九年级化学人教版下册常见的酸和碱(第2课时常见的碱)(课件27页)
文档属性
| 名称 | 九年级化学人教版下册常见的酸和碱(第2课时常见的碱)(课件27页) |  | |
| 格式 | pptx | ||
| 文件大小 | 32.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-06 11:32:40 | ||
图片预览






文档简介
(共27张PPT)
课题1 常见的碱
常见的酸和碱
第二课时
常见的碱
名称角度
从名称上来看一般叫 .
氢氧化某
组成角度
从组成上看都含 离子
氢氧根
性质角度
从性质上看碱溶液都呈 性
碱
氢氧化钙
氢氧化钠
氢氧化铝
氢氧化钾
KOH
(1)NaOH:有很强的腐蚀性,俗称烧碱、火碱、苛性钠
NaOH
(2)不慎将氢氧化钠溶液沾到皮肤上,立即用大量水冲洗,然后再涂上硼酸溶液。
一、常见的碱
1、氢氧化钠的性质
现象 分析
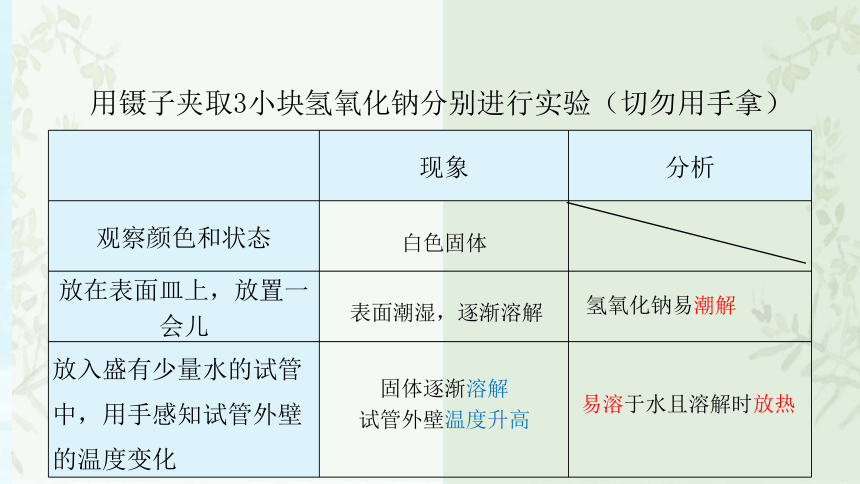
观察颜色和状态
放在表面皿上,放置一会儿
放入盛有少量水的试管中,用手感知试管外壁的温度变化
用镊子夹取3小块氢氧化钠分别进行实验(切勿用手拿)
白色固体
表面潮湿,逐渐溶解
氢氧化钠易潮解
固体逐渐溶解
试管外壁温度升高
易溶于水且溶解时放热
1、氢氧化钠的性质
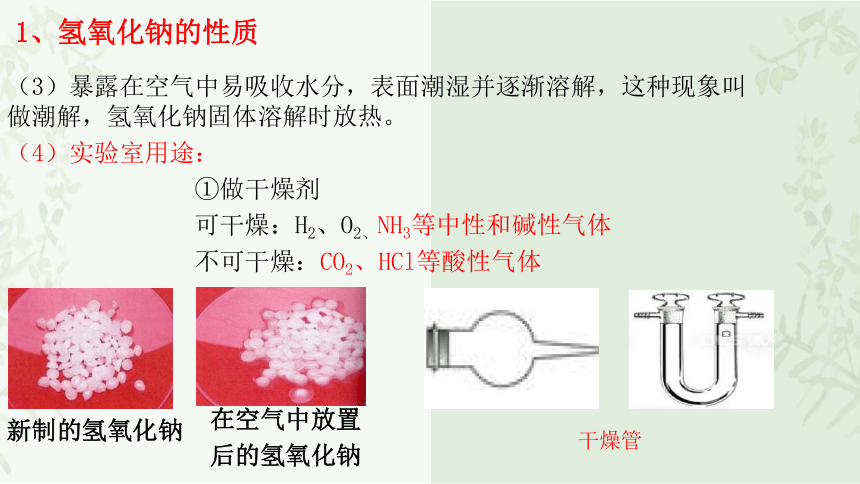
(3)暴露在空气中易吸收水分,表面潮湿并逐渐溶解,这种现象叫 做潮解,氢氧化钠固体溶解时放热。
在空气中放置
后的氢氧化钠
新制的氢氧化钠
(4)实验室用途:
①做干燥剂
可干燥:H2、O2、NH3等中性和碱性气体
不可干燥:CO2、HCl等酸性气体
干燥管
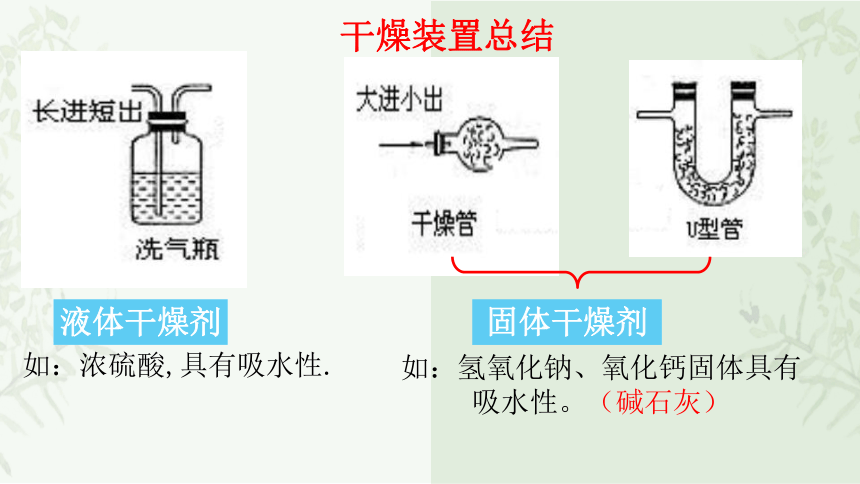
干燥装置总结
液体干燥剂
固体干燥剂
如:浓硫酸,具有吸水性.
如:氢氧化钠、氧化钙固体具有吸水性。(碱石灰)
(5)化工原料
肥皂
石油
印染
造纸
油污清洁
2. 氢氧化钙[ Ca(OH)2 ]
(3)制取:CaO + H2O = Ca(OH)2(CaO可做食品干燥剂的原因)
(4)用途: ①做建筑材料:砌砖、刷墙(石灰浆变硬是化学变化);
②保护树木,防止冻伤和害虫生卵;
③和硫酸铜混合配制农药波尔多液;
④改良酸性土壤;
⑤检验CO2
(2)物理性质:白色粉末,微溶于水,水溶液俗称石灰水。
当石灰水中有较多未溶解的氢氧化钙时,
称石灰乳或石灰浆。
(1)俗称:熟石灰或消石灰
俗称 苛性钠、火碱、烧碱 (强腐蚀性) 熟石灰、消石灰
(有腐蚀性)
颜色、状态 白色固体 白色粉末
溶解性 极易溶于水,放出大量热 微溶于水
(溶液俗称石灰水)
其他 易潮解 (作干燥剂) 可由生石灰加水制得(放热)
CaO+H2O=Ca(OH)2
用途 化工原料:广泛用于肥皂、石油、造纸、纺织、印染等工业。 砌砖、抹墙;制氢氧化钠、制漂白粉;降低土壤酸性;制波尔多液。
氢氧化钠和氢氧化钙的物理性质和用途
物质
性质
氢氧化钠
氢氧化钙
可溶性碱
氢氧化钾
KOH
氢氧化钠
NaOH
氨水
NH3.H2O
氢氧化钙
Ca(OH)2
氢氧化钡
Ba(OH)2
Cu(OH)2
氢氧化铜
Mg(OH)2
氢氧化镁
Fe(OH)3
氢氧化铁
Al(OH)3
氢氧化铝
难溶性碱
不能使指示剂变色
可溶性碱有五位
钾钠氨钙钡
碱的分类
蓝色 红褐色
二、可溶性碱的化学性质
1.碱溶液能使紫色的石蕊溶液变蓝色,使无色的酚酞溶液变红色。
回忆检验二氧化碳的方法,并写出化学方程式
Ca(OH)2 +CO2=CaCO3↓ +H2O
思考:氢氧化钠能否与二氧化碳反应?如何设计实验方案
2.碱溶液能与某些非金属氧化物(主要是CO2、SO2,不包含CO)反应
2NaOH + CO2 = Na2CO3 + H2O(吸收CO2)
Ca(OH)2+CO2=CaCO3↓+H2O(检验CO2)
氢氧化钠、氢氧化钙放置在空气中会发生变质,所以氢氧化钠必须密封保存。
碱 + 非金属氧化物 → 盐 + H2O
2NaOH + SO2 = Na2SO3 + H2O
Ca(OH)2+SO2=CaSO3+H2O
(1)碱溶液与CO2反应
(2)碱溶液与SO2反应
3、碱+酸→盐+水
练习:分别写出氢氧化铁、氢氧化钙和盐酸、硫酸的反应
Ca(OH)2 + 2HCl == CaCl2 + 2H2O
Fe(OH)3 + 3HCl == FeCl3 + 3H2O
2Fe(OH)3 + 3H2SO4 == Fe2(SO4)3 + 6H2O
如:NaOH + HCl == NaCl + H2O;
2NaOH + H2SO4 == Na2SO4 + 2H2O;
红褐色固体溶解,溶液变成黄色
红褐色固体溶解,溶液变成黄色
4、碱 + 盐→新碱 + 新盐
2NaOH+CuCl2=
3NaOH+FeCl3=
Cu(OH)2↓+2NaCl
Fe(OH)3↓+3NaCl
有蓝色沉淀出现
有红褐色沉淀出现
化 合 反 应 分 解 反 应 置 换 反 应
定 义
类 型
特 征
由两种或两种以上物质生成另一种物质的反应
由一种物质生成两种或两种以上其它物质的反应
由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应
A+B→AB
AB→A+B+ ….
AB + C→A +BC
反应物为多种而生成物只有一种,即“多变一”
反应物只有一种而生成物有多种,即“一变多”
反应物与生成物都是两种,且都是单质和化合物
化学基本反应类型
1、酸能与金属氧化物反应,盐和水。
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
2、酸能与碱反应,生成盐和水。
NaOH + HCl=== NaCl + H2O
Ca(OH)2 + 2HCl=== CaCl2 + 2H2O
3、酸能与某些盐反应。
CaCO3+2HCl === CaCl2+H2O+CO2↑
Na2CO3+2HCl=== 2NaCl+H2O+CO2↑
4、碱+盐→新碱+新盐
2NaOH+CuCl2=
3NaOH+FeCl3=
Cu(OH)2↓+2NaCl
Fe(OH)3↓+3NaCl
复分解反应
1.定义:在溶液中,由两种化合物相互交换成分,生成另外两种化合物的反应。
2.表达式:AB + CD →AD + CB
3.发生条件:生成物中有沉淀或有气体或有水生成。
特点:双交换、价不变、首尾连
(双选)下列反应中不属于复分解反应的是( )
CE
E.CO2+2NaOH====Na2CO3+H2O
无交换
硝酸盐,全可溶
盐酸盐,银不溶(AgCl白色沉淀)
硫酸盐,钡不溶(BaSO4白色沉淀)
碳酸盐,可溶只有钾、钠盐,不溶都是白沉淀。
Cu(OH)2
氢氧化铜
蓝色 红褐色
Fe(OH)3
氢氧化铁
Mg(OH)2
白色
氢氧化镁
氢氧化铝
Al((OH)3
白色
判断下列物质是否溶于水:
Na2CO3 AgCl BaCO3
MgSO4 BaSO4 Cu(OH)2
Fe(OH)3 Ba(OH)2 Mg(OH)2
AgNO3 NaNO3
不溶
溶
溶
溶
溶
不溶
不溶
不溶
不溶
溶
不溶
答案
练习:
(1)氢氧化钠和氯化铜的反应
(2)氢氧化钠和氯化铁的反应
(3)BaCl2+H2SO4
(4)BaCl2+ NaOH
(5)Na2CO3 + NaOH
复分解反应发生的条件:只有当两种化合物相互交换成分,
①生成水;②生成气体;③生成沉淀。(满足一条即可)
蒸馏水
乙醇
稀盐酸
稀硫酸
氢氧化钠溶液
氢氧化钙溶液
不导电
不导电
导电
导电
导电
导电
H+
Cl-
H2O
H2O
H2O
C2H6O
H+
SO42-
H2O
Na+
OH-
H2O
Ca2+
OH-
H2O
HCl → H+ + Cl-
H2SO4→2H+ + SO42-
NaOH → Na+ + OH-
Ca(OH)2→ Ca2+ + 2OH-
分子
不能自由移动的离子
1、在不同的酸溶液中都含有相同的H+,所以,酸有一些相似的性质。
2、在不同的碱溶液中都含有相同的OH-,所以碱也有一些相似的性质。
能自由移动的离子
三、酸碱具有通性的原因
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
课题1 常见的碱
常见的酸和碱
第二课时
常见的碱
名称角度
从名称上来看一般叫 .
氢氧化某
组成角度
从组成上看都含 离子
氢氧根
性质角度
从性质上看碱溶液都呈 性
碱
氢氧化钙
氢氧化钠
氢氧化铝
氢氧化钾
KOH
(1)NaOH:有很强的腐蚀性,俗称烧碱、火碱、苛性钠
NaOH
(2)不慎将氢氧化钠溶液沾到皮肤上,立即用大量水冲洗,然后再涂上硼酸溶液。
一、常见的碱
1、氢氧化钠的性质
现象 分析
观察颜色和状态
放在表面皿上,放置一会儿
放入盛有少量水的试管中,用手感知试管外壁的温度变化
用镊子夹取3小块氢氧化钠分别进行实验(切勿用手拿)
白色固体
表面潮湿,逐渐溶解
氢氧化钠易潮解
固体逐渐溶解
试管外壁温度升高
易溶于水且溶解时放热
1、氢氧化钠的性质
(3)暴露在空气中易吸收水分,表面潮湿并逐渐溶解,这种现象叫 做潮解,氢氧化钠固体溶解时放热。
在空气中放置
后的氢氧化钠
新制的氢氧化钠
(4)实验室用途:
①做干燥剂
可干燥:H2、O2、NH3等中性和碱性气体
不可干燥:CO2、HCl等酸性气体
干燥管
干燥装置总结
液体干燥剂
固体干燥剂
如:浓硫酸,具有吸水性.
如:氢氧化钠、氧化钙固体具有吸水性。(碱石灰)
(5)化工原料
肥皂
石油
印染
造纸
油污清洁
2. 氢氧化钙[ Ca(OH)2 ]
(3)制取:CaO + H2O = Ca(OH)2(CaO可做食品干燥剂的原因)
(4)用途: ①做建筑材料:砌砖、刷墙(石灰浆变硬是化学变化);
②保护树木,防止冻伤和害虫生卵;
③和硫酸铜混合配制农药波尔多液;
④改良酸性土壤;
⑤检验CO2
(2)物理性质:白色粉末,微溶于水,水溶液俗称石灰水。
当石灰水中有较多未溶解的氢氧化钙时,
称石灰乳或石灰浆。
(1)俗称:熟石灰或消石灰
俗称 苛性钠、火碱、烧碱 (强腐蚀性) 熟石灰、消石灰
(有腐蚀性)
颜色、状态 白色固体 白色粉末
溶解性 极易溶于水,放出大量热 微溶于水
(溶液俗称石灰水)
其他 易潮解 (作干燥剂) 可由生石灰加水制得(放热)
CaO+H2O=Ca(OH)2
用途 化工原料:广泛用于肥皂、石油、造纸、纺织、印染等工业。 砌砖、抹墙;制氢氧化钠、制漂白粉;降低土壤酸性;制波尔多液。
氢氧化钠和氢氧化钙的物理性质和用途
物质
性质
氢氧化钠
氢氧化钙
可溶性碱
氢氧化钾
KOH
氢氧化钠
NaOH
氨水
NH3.H2O
氢氧化钙
Ca(OH)2
氢氧化钡
Ba(OH)2
Cu(OH)2
氢氧化铜
Mg(OH)2
氢氧化镁
Fe(OH)3
氢氧化铁
Al(OH)3
氢氧化铝
难溶性碱
不能使指示剂变色
可溶性碱有五位
钾钠氨钙钡
碱的分类
蓝色 红褐色
二、可溶性碱的化学性质
1.碱溶液能使紫色的石蕊溶液变蓝色,使无色的酚酞溶液变红色。
回忆检验二氧化碳的方法,并写出化学方程式
Ca(OH)2 +CO2=CaCO3↓ +H2O
思考:氢氧化钠能否与二氧化碳反应?如何设计实验方案
2.碱溶液能与某些非金属氧化物(主要是CO2、SO2,不包含CO)反应
2NaOH + CO2 = Na2CO3 + H2O(吸收CO2)
Ca(OH)2+CO2=CaCO3↓+H2O(检验CO2)
氢氧化钠、氢氧化钙放置在空气中会发生变质,所以氢氧化钠必须密封保存。
碱 + 非金属氧化物 → 盐 + H2O
2NaOH + SO2 = Na2SO3 + H2O
Ca(OH)2+SO2=CaSO3+H2O
(1)碱溶液与CO2反应
(2)碱溶液与SO2反应
3、碱+酸→盐+水
练习:分别写出氢氧化铁、氢氧化钙和盐酸、硫酸的反应
Ca(OH)2 + 2HCl == CaCl2 + 2H2O
Fe(OH)3 + 3HCl == FeCl3 + 3H2O
2Fe(OH)3 + 3H2SO4 == Fe2(SO4)3 + 6H2O
如:NaOH + HCl == NaCl + H2O;
2NaOH + H2SO4 == Na2SO4 + 2H2O;
红褐色固体溶解,溶液变成黄色
红褐色固体溶解,溶液变成黄色
4、碱 + 盐→新碱 + 新盐
2NaOH+CuCl2=
3NaOH+FeCl3=
Cu(OH)2↓+2NaCl
Fe(OH)3↓+3NaCl
有蓝色沉淀出现
有红褐色沉淀出现
化 合 反 应 分 解 反 应 置 换 反 应
定 义
类 型
特 征
由两种或两种以上物质生成另一种物质的反应
由一种物质生成两种或两种以上其它物质的反应
由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应
A+B→AB
AB→A+B+ ….
AB + C→A +BC
反应物为多种而生成物只有一种,即“多变一”
反应物只有一种而生成物有多种,即“一变多”
反应物与生成物都是两种,且都是单质和化合物
化学基本反应类型
1、酸能与金属氧化物反应,盐和水。
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
2、酸能与碱反应,生成盐和水。
NaOH + HCl=== NaCl + H2O
Ca(OH)2 + 2HCl=== CaCl2 + 2H2O
3、酸能与某些盐反应。
CaCO3+2HCl === CaCl2+H2O+CO2↑
Na2CO3+2HCl=== 2NaCl+H2O+CO2↑
4、碱+盐→新碱+新盐
2NaOH+CuCl2=
3NaOH+FeCl3=
Cu(OH)2↓+2NaCl
Fe(OH)3↓+3NaCl
复分解反应
1.定义:在溶液中,由两种化合物相互交换成分,生成另外两种化合物的反应。
2.表达式:AB + CD →AD + CB
3.发生条件:生成物中有沉淀或有气体或有水生成。
特点:双交换、价不变、首尾连
(双选)下列反应中不属于复分解反应的是( )
CE
E.CO2+2NaOH====Na2CO3+H2O
无交换
硝酸盐,全可溶
盐酸盐,银不溶(AgCl白色沉淀)
硫酸盐,钡不溶(BaSO4白色沉淀)
碳酸盐,可溶只有钾、钠盐,不溶都是白沉淀。
Cu(OH)2
氢氧化铜
蓝色 红褐色
Fe(OH)3
氢氧化铁
Mg(OH)2
白色
氢氧化镁
氢氧化铝
Al((OH)3
白色
判断下列物质是否溶于水:
Na2CO3 AgCl BaCO3
MgSO4 BaSO4 Cu(OH)2
Fe(OH)3 Ba(OH)2 Mg(OH)2
AgNO3 NaNO3
不溶
溶
溶
溶
溶
不溶
不溶
不溶
不溶
溶
不溶
答案
练习:
(1)氢氧化钠和氯化铜的反应
(2)氢氧化钠和氯化铁的反应
(3)BaCl2+H2SO4
(4)BaCl2+ NaOH
(5)Na2CO3 + NaOH
复分解反应发生的条件:只有当两种化合物相互交换成分,
①生成水;②生成气体;③生成沉淀。(满足一条即可)
蒸馏水
乙醇
稀盐酸
稀硫酸
氢氧化钠溶液
氢氧化钙溶液
不导电
不导电
导电
导电
导电
导电
H+
Cl-
H2O
H2O
H2O
C2H6O
H+
SO42-
H2O
Na+
OH-
H2O
Ca2+
OH-
H2O
HCl → H+ + Cl-
H2SO4→2H+ + SO42-
NaOH → Na+ + OH-
Ca(OH)2→ Ca2+ + 2OH-
分子
不能自由移动的离子
1、在不同的酸溶液中都含有相同的H+,所以,酸有一些相似的性质。
2、在不同的碱溶液中都含有相同的OH-,所以碱也有一些相似的性质。
能自由移动的离子
三、酸碱具有通性的原因
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
