【精品推荐】2014届高考化学总复习 智能考点 归类总结(教材精讲+典型例题+跟踪训练):开发金属矿物和海水资源(含方法提示和解析)
文档属性
| 名称 | 【精品推荐】2014届高考化学总复习 智能考点 归类总结(教材精讲+典型例题+跟踪训练):开发金属矿物和海水资源(含方法提示和解析) |
|
|
| 格式 | zip | ||
| 文件大小 | 250.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-12-27 00:00:00 | ||
图片预览


文档简介
智能考点 开发金属矿物和海水资源
Ι.课标要求
1.知道根据金属的活动性不同,可分别采用加热、电解、还原剂还原等方法冶炼金属。并能从能量的角度选择金属的冶炼方法。能够书写相关的化学方程式。
2.知道海水淡化的几种方法;掌握海水蒸馏的原理。
3.知道从海水中提取溴、碘的原理。了解非金属置换反应。
4.能参照海水提取镁过程的化学原理写出有关的化学方程式。
(通过上述要求让学生体会、认识海水资源的广阔前景)
II.考纲要求
1.了解化学方法在金属矿物开发(主要是金属冶炼)及海水资源开发中的作用。
2.了解常见非金属元素单质及其重要化合物的,主要性质及应用。
III.教材精讲
本考点知识结构
1.常见金属的冶炼:
①加热分解法:如:2HgO == 2Hg + O2↑
②加热还原法:如: CuO+H2 == Cu + H2O
又如: Fe2O3+ 3CO == 2Fe + 3CO2
③电解法:如: 2NaCl == 2Na+Cl2 ↑
又如: 2Al2O3 == 2Al + 3O2 ↑
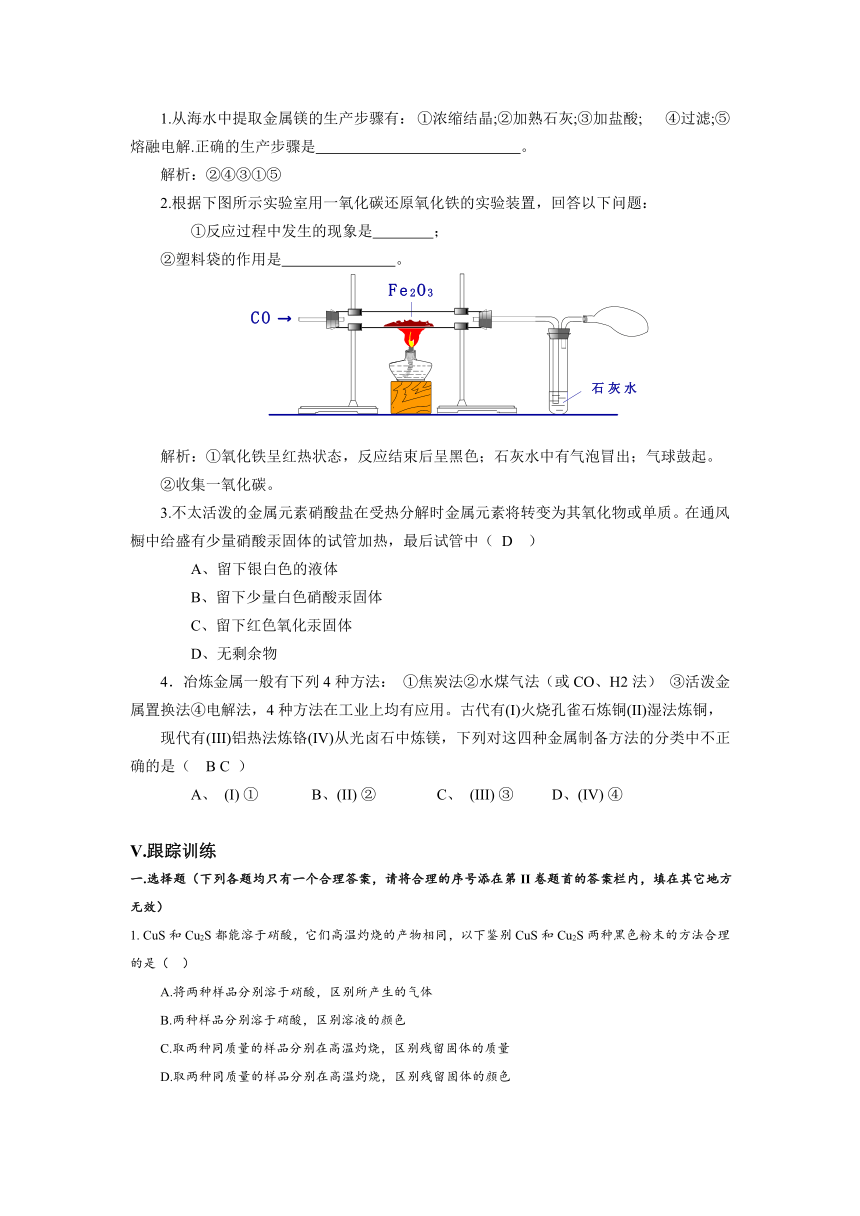
2.海水资源的开发利用:
IV.典型例题
1.从海水中提取金属镁的生产步骤有: ①浓缩结晶;②加熟石灰;③加盐酸; ④过滤;⑤熔融电解.正确的生产步骤是 。
解析:②④③①⑤
2.根据下图所示实验室用一氧化碳还原氧化铁的实验装置,回答以下问题:
①反应过程中发生的现象是 ;
②塑料袋的作用是 。
解析:①氧化铁呈红热状态,反应结束后呈黑色;石灰水中有气泡冒出;气球鼓起。
②收集一氧化碳。
3.不太活泼的金属元素硝酸盐在受热分解时金属元素将转变为其氧化物或单质。在通风橱中给盛有少量硝酸汞固体的试管加热,最后试管中( D )
A、留下银白色的液体
B、留下少量白色硝酸汞固体
C、留下红色氧化汞固体
D、无剩余物
4.冶炼金属一般有下列4种方法: ①焦炭法②水煤气法(或CO、H2法) ③活泼金属置换法④电解法,4种方法在工业上均有应用。古代有(I)火烧孔雀石炼铜(II)湿法炼铜,
现代有(III)铝热法炼铬(IV)从光卤石中炼镁,下列对这四种金属制备方法的分类中不正确的是( B C )
A、 (I) ① B、(II) ② C、 (III) ③ D、(IV) ④
V.跟踪训练
一.选择题(下列各题均只有一个合理答案,请将合理的序号添在第II卷题首的答案栏内,填在其它地方无效)
1. CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是( )
A.将两种样品分别溶于硝酸,区别所产生的气体
B.两种样品分别溶于硝酸,区别溶液的颜色
C.取两种同质量的样品分别在高温灼烧,区别残留固体的质量
D.取两种同质量的样品分别在高温灼烧,区别残留固体的颜色
2. 将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是()
A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
3. 右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是()
A a为负极、b为正极 B a为阳极、b为阴极
C 电解过程中,d电极质量增加 D 电解过程中,氯离子浓度不变
4. 在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铝和硫酸铁溶液,这种试剂是( )
A NaOH B NH3·H2O C AgNO3 D BaCl2
5. 下列有关纯铁的描述正确的是( )
A 熔点比生铁的低 B 与相同浓度的盐酸反应生成氢气的速率比生铁的快
C 在潮湿空气中比生铁容易被腐蚀 D 在冷的浓硫酸中可钝化
二.选择题(下列各题有一---二个合理答案,请将合理答案的序号填在第II卷题首的答案栏内,填在其它地方无效)
6.硝酸铜是制备Cu-Zn-Al系催化剂的重要原料。19.2g纯铜粉理论上可制得纯净硝酸铜晶体的质量为( )
A 28.2g B 56.4g C 64.2g D 72.6g
7.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是()
A 向CuSO4溶液中加入适量铁粉
B 等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液
C 等物质的量的NaHCO3与Na2O 2固体
D 在NaBr溶液中通入过量氯气
8.0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol。该混合气体的平均相对分子质量可能是( )
A 30 B 46 C 50 D 66
9.取pH值均等于2的盐酸和醒酸各100ml分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是( )
A 醋酸与锌反应放出氢气多 B 盐酸和醋酸分别与锌反应放出的氢气一样多
C 醋酸与锌反应速率大 D 盐酸和醋分别与锌反应的速度一样大
10.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是
(1/2)H2+NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述中正确的是()
A.电池放电时,电池负极周围溶液的OH不断增大 B.电池放电时,镍元素被氧化
C.电池充电时。氢元素被还原 D.电池放电时,H2是负极
11.下列离子方程式书写不正确的是( )
A FeCl2溶液中通入Cl2:Fe2++Cl2→Fe3++2Cl-
B 澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-→CaCO3↓+H2O
C FeS固体放人稀硝酸溶液中:FeS+2H+→Fe2++H2S↑
D AlCl3溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O
12.bg某金属与足量的稀硫酸反应,生成该金属的三价正盐和ag氢气。则该金属的相对原子质量不可能为( )
A.2b/a B.3b/2a C.3b/a D.a/3b
三.填空题(本题包括2小题)
13.海水的综合利用可以制备金属镁,其流和如下图所示:
若在空气中加热MgCl2 6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式
用电解法制取金属镁时,需要无水氧化镁。在干燥的HCl气流中加热MgCl2 6H2O时,能得到无水MgCl2,其原因是
Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
实验室时将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:
过滤时:
蒸发时:
14.实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg→Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显 价。
(2)以上反应中的氧化剂为 ,当有1molCuI参与反应时,转移电子 mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式。
Cu2++ I-→ CuI+ I3-
四.本题本题包括2小题
15.孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
xCuCO3 yCu(OH)2 (x、y为正整数且x≤2,y≤2)
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1。请推算它们的化学组成。
孔雀石: 石青:
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 3.36L(标准状况下);加热另一份样品使其完全分解,得到CuO 20g,试通过计算确定该混合物中孔雀石和石青的物质的量之比。
16.黄铜矿(主要成分CuFeS2)是提取制的主要原料
(1)取12.5g黄铜矿样品,经测定含3.60g硫(杂质不含硫),矿样中CuFeS2含量为_______________
800℃
(2)已知2CuFeS2+4O2——→Cu2S+3SO2+2FeO(炉渣)
产物Cu2S在1200℃高温下继续反应:
2Cu2S+3O2→2Cu2O+2SO2
2Cu2O+Cu2S→6Cu+SO2
假定各步反应都完全,完成下列计算:
①由6molCuFeS2生成6molCu,求消耗O2的物质的量
②6molCuFeS2和14.25molO2反应,理论上可得到多少摩尔铜
③6molCuFeS2和15.75molO2反应,理论上可得到多少摩尔铜。
“开发金属矿物和海水资源”参考答案
一.1.c 2.C 3.C 4.A. 5.D
二.6.BD 7.BD 8.BC 9BC .10.CD
11.B 12、C
四13. (1)MgCl2 6H2O Mg(OH)Cl + HCl↑ + 5H2O↑
MgCl2 6H2O MgO + 2HCl↑ + 5H2O↑
或 Mg(OH)Cl MgO + HCl↑
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2 6H2O受热产生的水气,故能得到无水MgCl2
(2)加入MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤
(3)搅拌,加速溶解
使待滤液体沿玻璃棒流入漏斗,防止外洒
搅拌,防止因局部过热液滴或晶体飞溅
14. .(1)+1 (2)CuI 0.5 (3)2 5 2 1
五.15. 解:(1)设孔雀石的化学式为xCuCO3 yCu(OH)2
则依题意 = =
孔雀石的化学式为 CuCO3 Cu(OH)2
又设石青的化学式为 xCuCO3 yCu(OH)2
则依题意 = =
石青的化学式为 2CuCO3 Cu(OH)2
(2)设该样品中孔雀石物质的量分数为x,则石青为 1- x
= =
孔雀石与石青物质的量之比为1:1
16. (1)82.8%
(2) ①CuFeS2Cu+FeO+2SO2 n(O2)=(+2)×6=15(mol)
②O2不足量 Cu2S+O2→2Cu+SO2 N(Cu)=6-2(15-14.25)=4.5(mol)
③O2过量 2Cu2S+3O2→2Cu2O+2SO2 n(Cu)=6(1-×2)=3(mol)
Ι.课标要求
1.知道根据金属的活动性不同,可分别采用加热、电解、还原剂还原等方法冶炼金属。并能从能量的角度选择金属的冶炼方法。能够书写相关的化学方程式。
2.知道海水淡化的几种方法;掌握海水蒸馏的原理。
3.知道从海水中提取溴、碘的原理。了解非金属置换反应。
4.能参照海水提取镁过程的化学原理写出有关的化学方程式。
(通过上述要求让学生体会、认识海水资源的广阔前景)
II.考纲要求
1.了解化学方法在金属矿物开发(主要是金属冶炼)及海水资源开发中的作用。
2.了解常见非金属元素单质及其重要化合物的,主要性质及应用。
III.教材精讲
本考点知识结构
1.常见金属的冶炼:
①加热分解法:如:2HgO == 2Hg + O2↑
②加热还原法:如: CuO+H2 == Cu + H2O
又如: Fe2O3+ 3CO == 2Fe + 3CO2
③电解法:如: 2NaCl == 2Na+Cl2 ↑
又如: 2Al2O3 == 2Al + 3O2 ↑
2.海水资源的开发利用:
IV.典型例题
1.从海水中提取金属镁的生产步骤有: ①浓缩结晶;②加熟石灰;③加盐酸; ④过滤;⑤熔融电解.正确的生产步骤是 。
解析:②④③①⑤
2.根据下图所示实验室用一氧化碳还原氧化铁的实验装置,回答以下问题:
①反应过程中发生的现象是 ;
②塑料袋的作用是 。
解析:①氧化铁呈红热状态,反应结束后呈黑色;石灰水中有气泡冒出;气球鼓起。
②收集一氧化碳。
3.不太活泼的金属元素硝酸盐在受热分解时金属元素将转变为其氧化物或单质。在通风橱中给盛有少量硝酸汞固体的试管加热,最后试管中( D )
A、留下银白色的液体
B、留下少量白色硝酸汞固体
C、留下红色氧化汞固体
D、无剩余物
4.冶炼金属一般有下列4种方法: ①焦炭法②水煤气法(或CO、H2法) ③活泼金属置换法④电解法,4种方法在工业上均有应用。古代有(I)火烧孔雀石炼铜(II)湿法炼铜,
现代有(III)铝热法炼铬(IV)从光卤石中炼镁,下列对这四种金属制备方法的分类中不正确的是( B C )
A、 (I) ① B、(II) ② C、 (III) ③ D、(IV) ④
V.跟踪训练
一.选择题(下列各题均只有一个合理答案,请将合理的序号添在第II卷题首的答案栏内,填在其它地方无效)
1. CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是( )
A.将两种样品分别溶于硝酸,区别所产生的气体
B.两种样品分别溶于硝酸,区别溶液的颜色
C.取两种同质量的样品分别在高温灼烧,区别残留固体的质量
D.取两种同质量的样品分别在高温灼烧,区别残留固体的颜色
2. 将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是()
A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
3. 右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是()
A a为负极、b为正极 B a为阳极、b为阴极
C 电解过程中,d电极质量增加 D 电解过程中,氯离子浓度不变
4. 在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铝和硫酸铁溶液,这种试剂是( )
A NaOH B NH3·H2O C AgNO3 D BaCl2
5. 下列有关纯铁的描述正确的是( )
A 熔点比生铁的低 B 与相同浓度的盐酸反应生成氢气的速率比生铁的快
C 在潮湿空气中比生铁容易被腐蚀 D 在冷的浓硫酸中可钝化
二.选择题(下列各题有一---二个合理答案,请将合理答案的序号填在第II卷题首的答案栏内,填在其它地方无效)
6.硝酸铜是制备Cu-Zn-Al系催化剂的重要原料。19.2g纯铜粉理论上可制得纯净硝酸铜晶体的质量为( )
A 28.2g B 56.4g C 64.2g D 72.6g
7.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是()
A 向CuSO4溶液中加入适量铁粉
B 等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液
C 等物质的量的NaHCO3与Na2O 2固体
D 在NaBr溶液中通入过量氯气
8.0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol。该混合气体的平均相对分子质量可能是( )
A 30 B 46 C 50 D 66
9.取pH值均等于2的盐酸和醒酸各100ml分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是( )
A 醋酸与锌反应放出氢气多 B 盐酸和醋酸分别与锌反应放出的氢气一样多
C 醋酸与锌反应速率大 D 盐酸和醋分别与锌反应的速度一样大
10.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是
(1/2)H2+NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述中正确的是()
A.电池放电时,电池负极周围溶液的OH不断增大 B.电池放电时,镍元素被氧化
C.电池充电时。氢元素被还原 D.电池放电时,H2是负极
11.下列离子方程式书写不正确的是( )
A FeCl2溶液中通入Cl2:Fe2++Cl2→Fe3++2Cl-
B 澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-→CaCO3↓+H2O
C FeS固体放人稀硝酸溶液中:FeS+2H+→Fe2++H2S↑
D AlCl3溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O
12.bg某金属与足量的稀硫酸反应,生成该金属的三价正盐和ag氢气。则该金属的相对原子质量不可能为( )
A.2b/a B.3b/2a C.3b/a D.a/3b
三.填空题(本题包括2小题)
13.海水的综合利用可以制备金属镁,其流和如下图所示:
若在空气中加热MgCl2 6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式
用电解法制取金属镁时,需要无水氧化镁。在干燥的HCl气流中加热MgCl2 6H2O时,能得到无水MgCl2,其原因是
Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
实验室时将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:
过滤时:
蒸发时:
14.实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg→Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显 价。
(2)以上反应中的氧化剂为 ,当有1molCuI参与反应时,转移电子 mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式。
Cu2++ I-→ CuI+ I3-
四.本题本题包括2小题
15.孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
xCuCO3 yCu(OH)2 (x、y为正整数且x≤2,y≤2)
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1。请推算它们的化学组成。
孔雀石: 石青:
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 3.36L(标准状况下);加热另一份样品使其完全分解,得到CuO 20g,试通过计算确定该混合物中孔雀石和石青的物质的量之比。
16.黄铜矿(主要成分CuFeS2)是提取制的主要原料
(1)取12.5g黄铜矿样品,经测定含3.60g硫(杂质不含硫),矿样中CuFeS2含量为_______________
800℃
(2)已知2CuFeS2+4O2——→Cu2S+3SO2+2FeO(炉渣)
产物Cu2S在1200℃高温下继续反应:
2Cu2S+3O2→2Cu2O+2SO2
2Cu2O+Cu2S→6Cu+SO2
假定各步反应都完全,完成下列计算:
①由6molCuFeS2生成6molCu,求消耗O2的物质的量
②6molCuFeS2和14.25molO2反应,理论上可得到多少摩尔铜
③6molCuFeS2和15.75molO2反应,理论上可得到多少摩尔铜。
“开发金属矿物和海水资源”参考答案
一.1.c 2.C 3.C 4.A. 5.D
二.6.BD 7.BD 8.BC 9BC .10.CD
11.B 12、C
四13. (1)MgCl2 6H2O Mg(OH)Cl + HCl↑ + 5H2O↑
MgCl2 6H2O MgO + 2HCl↑ + 5H2O↑
或 Mg(OH)Cl MgO + HCl↑
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2 6H2O受热产生的水气,故能得到无水MgCl2
(2)加入MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤
(3)搅拌,加速溶解
使待滤液体沿玻璃棒流入漏斗,防止外洒
搅拌,防止因局部过热液滴或晶体飞溅
14. .(1)+1 (2)CuI 0.5 (3)2 5 2 1
五.15. 解:(1)设孔雀石的化学式为xCuCO3 yCu(OH)2
则依题意 = =
孔雀石的化学式为 CuCO3 Cu(OH)2
又设石青的化学式为 xCuCO3 yCu(OH)2
则依题意 = =
石青的化学式为 2CuCO3 Cu(OH)2
(2)设该样品中孔雀石物质的量分数为x,则石青为 1- x
= =
孔雀石与石青物质的量之比为1:1
16. (1)82.8%
(2) ①CuFeS2Cu+FeO+2SO2 n(O2)=(+2)×6=15(mol)
②O2不足量 Cu2S+O2→2Cu+SO2 N(Cu)=6-2(15-14.25)=4.5(mol)
③O2过量 2Cu2S+3O2→2Cu2O+2SO2 n(Cu)=6(1-×2)=3(mol)
同课章节目录
