【精品推荐】2014届高考化学总复习 智能考点 归类总结(教材精讲+典型例题+跟踪训练):物质性质及反应规律的研究(含方法提示和解析)
文档属性
| 名称 | 【精品推荐】2014届高考化学总复习 智能考点 归类总结(教材精讲+典型例题+跟踪训练):物质性质及反应规律的研究(含方法提示和解析) |

|
|
| 格式 | zip | ||
| 文件大小 | 131.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-12-27 00:00:00 | ||
图片预览




文档简介
能考点 物质性质及反应规律的研究
Ⅰ.课标要求
1.认识化学实验在学习和研究化学中的作用。能发现学习、生产、生活中有意义的化学问题,并进行实验探究。
2.能对实验现象做出合理的解释,运用比较、归纳、分析、综合等方法初步揭示化学变化的规律。
Ⅱ.考纲要求
了解化学实验是科学探究过程中的一种重要方法。能根据实验试题要求.做到:
1.设计、评价或改进实验方案。
2.了解控制实验条件的方法。
3.分析或处理实验数据,得出合理结论。
4.绘制和识别典型的实验仪器装置图。
Ⅲ.教材精讲
一、研究物质性质的基本方法
研究物质性质的方法:观察、分类、预测、实验、验证、比较等。
1.锌及其化合物的性质:
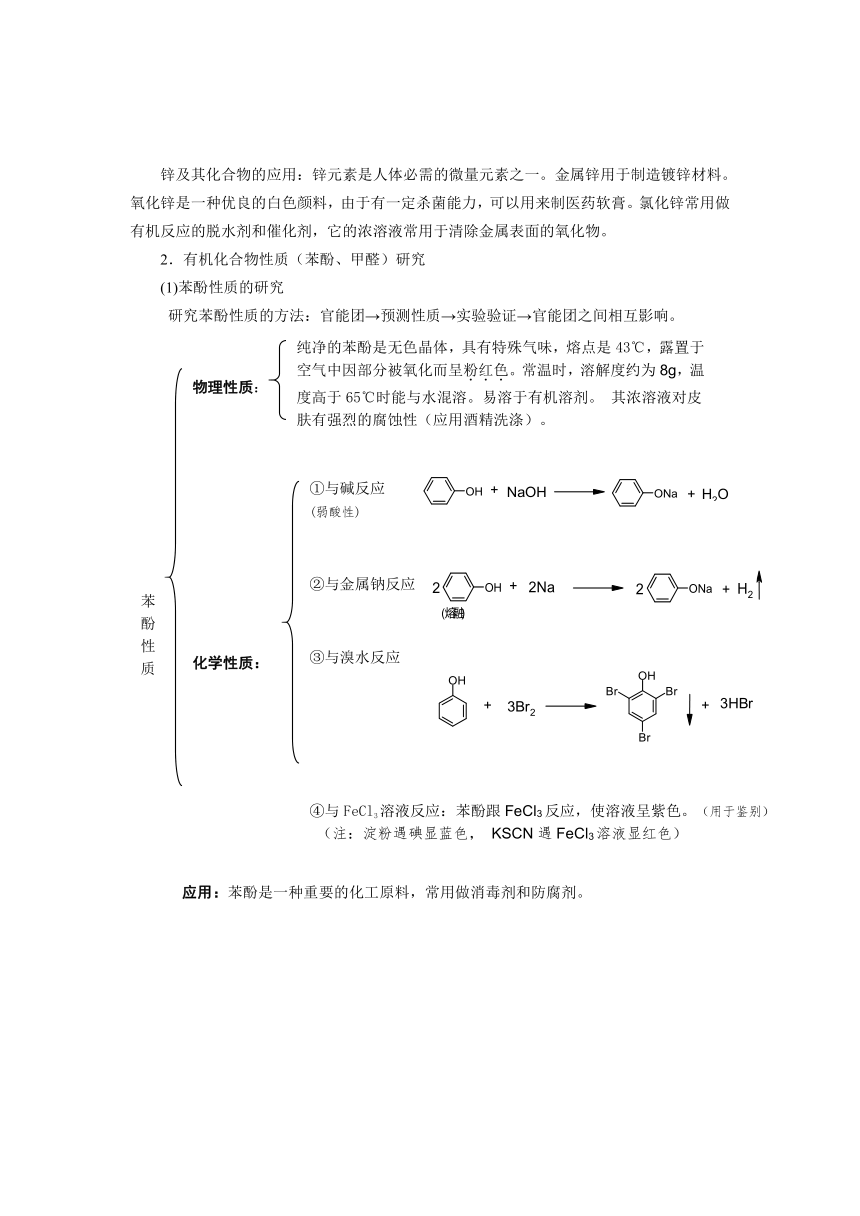
锌及其化合物的应用:锌元素是人体必需的微量元素之一。金属锌用于制造镀锌材料。氧化锌是一种优良的白色颜料,由于有一定杀菌能力,可以用来制医药软膏。氯化锌常用做有机反应的脱水剂和催化剂,它的浓溶液常用于清除金属表面的氧化物。
2.有机化合物性质(苯酚、甲醛)研究
(1)苯酚性质的研究
研究苯酚性质的方法:官能团→预测性质→实验验证→官能团之间相互影响。
(2)甲醛性质的研究
甲醛性质的研究方法:官能团→预测性质→实验验证。
二、认识发生在盐溶液中的化学反应
1.认识盐类的水解
盐类水解规律的研究思路:
盐溶液的酸碱性 →酸碱性的原因 盐类水解的本质 →盐类水解的规律
①测定盐溶液的酸碱性
盐的名称 碳酸钠 氯化锌 醋酸钠 硫酸铝 氯化钠 氯化铵 硝酸钾
化学式 Na2CO3 ZnCl2 CH3COONa Al2(SO4)3 NaCl NH4Cl KNO3
pH >7 <7 >7 <7 =7 <7 =7
酸碱性 碱性 酸性 碱性 酸性 中性 酸性 中性
②探讨盐溶液呈酸性或碱性的原因
在溶液中盐电离出来的离子与水电离出来的H+或OH—结合生成弱电解质的反应,叫做盐类的水解。水解程度一般较小,是一个可逆过程。
Al3++3H2OAl(OH)3+ 3H+
CO32—+H2OHCO3— +OH—
HCO3—+H2OH2CO3 + OH—
③盐类水解规律的初步探讨
双水解:硫酸铝属于强酸弱碱盐与碳酸钠属于强碱弱酸盐混合时,互相促进了水解。
2Al3++3CO32—+3H2O = 2Al(OH)3↓+3CO2↑
2.研究电解
①电解饱和食盐水
在直流电的作用下,电解质溶液(或熔融态电解质)在两个电极上分别发生氧化反应和还原反应的过程叫做电解。其中,发生氧化反应的电极称为阳极,发生还原反应的电极称为阴极。
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
②电解规律的初步探索
阳离子在阴极的放电顺序:
K+阴离子在阳极放电顺序:
SO42—三、反应条件对化学反应的影响
研究的方法:变量控制(只改变一种条件,观察实验结果,得出该条件对反应结果的影响)
1.浓度对化学平衡的影响
AgCl + 2NH32[Ag(NH3)2] ++ Cl—
FeCl3+3KSCN Fe(SCN)3 +3KCl
2.反应条件对化学反应速率的影响
2H2O2 = 2H2O + O2↑(浓度、溶液酸碱性、温度、催化剂对双氧水分解的影响)
3.反应介质、浓度对化学反应结果的影响
(1)KMnO4溶液与Na2SO3溶液在不同酸碱性条件下的反应。
2MnO4— + 6H+ + 5SO32— = 2Mn2+ + 5SO42—+ 3H2O
2MnO4— + H2O + 3SO32— = 2MnO2 ↓+ 3SO42—+ 2O H—
2MnO4— +2O H— + SO32— = 2MnO42— + SO42—+ H2O
(2)浓硫酸、稀硫酸性质的对比研究
C + 2H2SO4 (浓) CO2↑+ 2SO2↑+2H2O
Cu + 2H2SO4 (浓) CuSO4+ 2SO2↑+2H2O
Cu +4HNO3 (浓) Cu(NO3)2+ 2NO2↑+2H2O
3Cu +8HNO3 (稀) 3Cu(NO3)2+ 2NO↑+4H2O
四、现代实验技术在研究物质性质及反应规律中的应用
Ⅳ.典型例题
例1.某中学化学小组查阅资料发现金属氧化物A也能催化氯酸钾的分解,且A和二氧化锰的最佳催化温度均在500℃左右。于是对A和二氧化锰的催化性能进行了定量对照实验。实验时均以收满500mL氧气为准(其他可能影响实验的因素均已忽略)。
表一 用MnO2作催化剂
实验序号 KClO3质量(g) MnO2质量(g) 反应温度(℃) 待测数据
1 8.00 2.00 500
2 8.00 2.00 500
表二 用A作催化剂
实验序号 KClO3质量(g) A质量(g) 反应温度(℃) 待测数据
1 8.00 2.00 500
2 8.00 2.00 500
请回答:
上述实验中的待测数据应是 。
完成此研究后,他们准备发表一篇研究报告,请你替他们拟一个报告的题目:
。
【解析】根据题意,此实验的目的是为了对照MnO2和A的催化能力。而催化能力的高低可以用单位时间内产生的气体的量,或者用产生一定量气体需要的时间来表示。现在题目指明“以收集满500mL氧气为准”,因此在实验报告中应记录产生这些气体需要的时间。本次实验的主要目的在于比较,比较的又是催化剂的效果。在拟定实验报告标题的时候注意给出这两个要点就可以了。
答案:时间 催化效果的对照研究
【点评】本题研究问题的方法也是变量控制法,知道该实验的目的以及反应速率的表示方法便可作答。
例2.有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,
该反应的化学方程式是: 。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
上述方案是否合理 。请简要说明两点理由:
① ;② 。
【解析】若Na2O2与SO2发生反应:2Na2O2+2SO2=2Na2SO3+O2,则其生成物Na2SO3可与酸(盐酸或H2SO4)作用产生能使品红溶液褪色的SO2气体,故取白色固体,加入稀H2SO4,若产生使品红溶液褪色的气体,则白色固体中含Na2SO3。(3)由于稀HNO3具有强氧化性可将BaSO3氧化成为BaSO4,或反应后的固体仍有残留强氧化剂Na2O2时,溶于水后,它能将SO32—氧化成为SO42—,故所给方案不合理。
答:(1)2Na2O2+2SO2=2Na2SO3+O2
(2)取白色固体,加稀硫酸,产生能使品红溶液褪色的气体。
(3)不合理 稀硝酸能将亚硫酸钡氧化为硫酸钡
如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根
【点评】因SO2有还原性,Na2O2与SO2反应比Na2O2与CO2反应要复杂的多。本题从化学方程式、实验设计与评价、实验过程分析等方面对考生进行考查。
Ⅴ、跟踪训练
一、选择题(单选题)
1、室内装潢和家具挥发出来的甲醛是室内空气的主要污染物。甲醛易溶于水,常温下有强烈刺激性气味,当温度超过20℃时,挥发速度加快。根据甲醛的这些性质,下列做法错误的是 ( )
A入住前房间内保持一定湿度并通风
B.装修尽可能选择在温度较高的季节
C请环境监测部门检测室内甲醛含量低于国家标准后入住
D.紧闭门窗一段时间后入住
2、关于电解NaCl水溶液,下列叙述正确的是( )
A 若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
B 若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C 电解时在阳极得到氯气,在阴极得到金属钠
D 电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
3、浓硫酸和2mol/L的稀硫酸,在实验室中敞口放置。它们的质量和放置天数的关系如右图,分析a、b曲线变化的原因是( )
A、a升华、b冷凝 B、a挥发、b吸水
C、a蒸发、b潮解 D、a冷凝、b吸水
4、氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是( )
A、HI和HClO B、HCl和HIO C、HClO3和HIO D、HClO和HIO
5、向50mL 18 mol·L-1H2SO4溶液中加入足量的铜片并加热.充分反应后,被还原的H2SO4的物质的量( )
A小于0.45 mol B等于0.45 mol C在0.45 mol和0.90 mol之间 D大于0.90 mol
6、下列可检验阿司匹林( )样品中混有水杨酸( )的试剂是( )
A 三氯化铁溶液 B 碳酸氢钠溶液 C 石蕊试液 D 氢氧化钠溶液
7、用没食子酸( )制造墨水主要利用了( )类化合物的性质。
A、醇 B、酚 C、油脂 D、羧酸
二、选择题(12选项)
8、继科学家发现C3O2是金星大气成分之后,2004年,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质,已知硫化羰与二氧化碳的结构相似,但在氧气中会燃烧,下列有关C3O2与硫化羰的说法不正确的是( )
A C3O2与CO一样可以在氧气中燃烧生成CO2
B CO、C3O2、CO2都是碳的氧化物,它们互为同素异形体
C COS是由极性键构成的极性分子,分子中所有原子都满足8电子稳定结构
D 硫化羰在氧气中完全燃烧后的生成物是CO2 和SO3
9、在容积不变的密闭容器中存在如下反应:2SO2(g)十O2(g)2SO3(g);ΔH<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是 ( )
A.图I表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
D.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
10、下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是
A、纯Ni(s)和Ni(CO)4(g) B、纯Ni(s)和CO(g)
C、不纯Ni(s)和CO(g) D、不纯Ni(s)和Ni(CO)4(g)
11、碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
A 气瓶中产生的沉淀是碳酸钡
B Z导管出来的气体中无二氧化碳
C 气瓶中产生的沉淀是硫酸钡
D Z导管口有红棕色气体出现
12、金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A 阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B 电解过程中,阳极质量的减少与阴极质量的增加相等
C 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D 电解后,电解槽底部的阳极泥中只有Cu和Pt
13、在溶液导电性实验中,往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮变化是:明一暗一明,下列说法正确的是 ( )
A溶液的导电性与溶液中离子的浓度有关
B溶液的导电性与溶液中离子的数目多少有关
C灯泡最暗时溶液中无自由移动的离子
D往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同
14、有四位同学设计了下列四个方案确证溶液中含有SO42—,你认为合理的是 ( )
A.试液 白色沉淀 沉淀不溶解
B试液 无沉淀 白色沉淀
C试液 无沉淀 白色沉淀
D试液 无沉淀 白色沉淀
三、填空题
15、在二氧化锰催化氯酸钾分解的实验中,制得的氧气中常有氯气的气味,生成的氯化钾又略带紫红色,对这一客观事实的一种分析认为其反应过程如下:
①2KClO3+2MnO2=2A+B↑+O2↑
②2A D+MnO2+O2↑
③B+D=2KCl+MnO2+O2↑
根据上述分析请回答:
(1)A物质的化学式为 ·
(2)除去氧气中的B气体常有的试剂为: 。
(2)写出反应③的化学方程式: 。
16、磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,并放出X kJ热量。通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
17、.(1)1986年,化学上第一次用非电解法制得氟气,试配平该反应的化学方程式:
□K2MnF6 + □SbF5 —— □KSbF6 + □MnF3 + □F2
反应中 元素被还原。
(2) 氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素。如:+H2OHSCN+HSCNO。它们阴离子的还原性 强弱为:Cl—①(CN)2与KOH溶液反应的化学方程式:
。
②NaBr和KSCN的混合溶液中加入(CN)2,反应的离子方程式。
。
18、某化学反应2AB+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。
理由是 。
19、由金红石(TiO2)制取单质Ti,涉及到的步骤为:
反应TiCl4 +2Mg =2MgCl2 + Ti在Ar气氛中进行的理由是_______________________。
20、.(1)下表为相对分子质量相近的醇与烷烃的沸点比较数据:
名称 甲醇 乙烷 乙醇 丙烷 乙二醇 丙醇 丁烷
相对分子质量 32 30 46 44 62 60 58
沸点/℃ 64. 7 -88.6 78.5 -42.1 188 97.2 -0.5
根据表中数据, 总结有机物的沸点与相对分子质量、羟基官能团之间的关系:
。
(2)根据上述规律,下列有机物沸点最高的是 (填代号)。
A.丙烷 B.丁烯 C.1,2-丙二醇 D.甘油
(3)多元醇具有较大的酸性,所以Cu(OH)2能溶于乙二醇中,生成鲜蓝色的溶液,实验室常利用这个反应鉴别具有两个相邻羟基的多元醇:
工业上以石油裂解气丙烯为原料制备丁,其反应过程如下:
上述框图中;甲的结构简式为 ;属于取代反应的有 (填框图中的序号);属于加成反应的有 (填框图中的序号)。
写出反应③的化学方程式: 。
“物质性质及反应规律的研究”参考答案
一选择题
1、D 2、B 3、B 4、B 5、A 6、A 7、B
二选择题
8、B D 9、BD 10、B 解析:本题主要考查温度对化学平衡的影响规律。反应在左端开始发生如下反应随着反应的进行,Ni(CO)4(g)充满玻璃管,并达到平衡;Ni(CO)4在玻璃管右侧发生反应,这样两端的化学平衡体系都在不停向右移动,直到左端Ni粉完全反应,Ni(CO)4在右侧完全分解为止,故经过足够长时间后,右端的主要物质为Ni(s)和CO(g)。
11、CD 12、D 13、A 14、B
三填空题
15、(1) KMnO4 (2)NaOH (3)Cl2+ K2MnO4 = 2KCl+MnO2+O2↑
16、P2O3 P2O5 2.75 3.55
17、(1)2 4 4 2 1 (说明:错一个即不给分) Mn(或锰)
(2)(CN)2+2KOH=KCN+KCNO+H2O 2SCN—+(CN)2=2CN—+(SCN)2
18、(1)0.013
(2)1.0 催化剂
(3)吸热;由于吸热温度升高时,平衡向右移动
19、防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用
20、(1)①相对分子质量越大,烷烃(或一元醇)的沸点越高;
②相对分子质量相近的醇与烷烃,醇的沸点远高于烷烃;
③碳原子数相同的醇,羟基越多,沸点越高。
(2)D
(3)A的结构简式:CH2=CHCH2Cl 取代反应:①、②、④ 加成反应:③
反应③:
锌及其化合物的性质
金属锌
(4).既与酸又能与强碱反应:Zn +2HCl = ZnCl2 +H2↑
Zn+2NaOH+2H2O = Na2[Zn(OH)4]+ H2↑
(四羟基合锌酸钠)
(5).与盐溶液反应:Zn+CuSO4 = ZnSO4+Cu
(3).与X2反应:Zn +X2 ZnX2 (X2表示卤素单质)
(2).与O2反应:2Zn + O2 2ZnO
(1).“生锈”:4Zn+2O2+3H2O+CO2 = ZnCO3· 3Zn(OH)2
Zn2++2OH—=Zn(OH)2↓
氯化锌
Zn(OH)2 ZnO + H2O
氢氧化锌
(两性氢氧化物)
Zn(OH)2 +2H+ = Zn2+ +2H2O
Zn(OH)2+OH— = [Zn(OH)4]2—
氧化锌
(两性氧化物)
ZnO +2HCl = ZnCl2 +H2O
ZnO+2NaOH+H2O = Na2[Zn(OH)4]
纯净的苯酚是无色晶体,具有特殊气味,熔点是43℃,露置于空气中因部分被氧化而呈粉红色。常温时,溶解度约为8g,温度高于65℃时能与水混溶。易溶于有机溶剂。 其浓溶液对皮肤有强烈的腐蚀性(应用酒精洗涤)。
物理性质:
①与碱反应
(弱酸性)
②与金属钠反应
苯
酚
性
质
化学性质:
③与溴水反应
④与FeCl3溶液反应:苯酚跟FeCl3反应,使溶液呈紫色。(用于鉴别)
(注:淀粉遇碘显蓝色, KSCN遇FeCl3溶液显红色)
应用:苯酚是一种重要的化工原料,常用做消毒剂和防腐剂。
甲醛
(还原性)
①与酸性KMnO4溶液反应:KMnO4 / H+溶液褪色。
②与新制氢氧化铜反应:
物理性质:无色、有刺激性气味的气体,易溶于水,35%∽40%的甲醛水溶液叫福尔马林。
化学性质:
应用:工业上制人造板材所需脲醛树脂、酚醛树脂的原料,制染料,用于消毒。
③与银氨溶液反应:
④与氢气反应:
HCHO + 2Cu(OH)2 HCOOH +Cu2O+2H2O
HCHO +2[Ag(NH3)2]OH HCOONH4+2Ag↓+3NH3+H2O
HCHO +H2 CH3OH
电离理论
强酸强碱盐:中性(不水解)
强酸弱碱盐:酸性(水解)
强酸弱碱盐:碱性(水解)
熔点仪
密度仪
旋光仪
折光率
1.研究物质的性质
质谱分析仪
核磁共振技术
2.研究物质的组成、结构
闪光光谱仪
脉冲激光技术
飞秒光谱技术
扫描探针显微镜技术
3.研究化学反应过程
白色
沉淀
将B中反应后的固体溶解于水
BaCl2溶液
稀硝酸
仍有部分白色沉淀不溶解,证明有Na2SO4生成
足量盐酸
氯化钡溶液
足量盐酸
足量盐酸
氯化钡溶液
硝酸钡溶液
足量稀硝酸
足量稀硝酸
硝酸钡溶液
TiO2 → TiCl4
Ti
Mg
800℃,Ar
Ⅰ.课标要求
1.认识化学实验在学习和研究化学中的作用。能发现学习、生产、生活中有意义的化学问题,并进行实验探究。
2.能对实验现象做出合理的解释,运用比较、归纳、分析、综合等方法初步揭示化学变化的规律。
Ⅱ.考纲要求
了解化学实验是科学探究过程中的一种重要方法。能根据实验试题要求.做到:
1.设计、评价或改进实验方案。
2.了解控制实验条件的方法。
3.分析或处理实验数据,得出合理结论。
4.绘制和识别典型的实验仪器装置图。
Ⅲ.教材精讲
一、研究物质性质的基本方法
研究物质性质的方法:观察、分类、预测、实验、验证、比较等。
1.锌及其化合物的性质:
锌及其化合物的应用:锌元素是人体必需的微量元素之一。金属锌用于制造镀锌材料。氧化锌是一种优良的白色颜料,由于有一定杀菌能力,可以用来制医药软膏。氯化锌常用做有机反应的脱水剂和催化剂,它的浓溶液常用于清除金属表面的氧化物。
2.有机化合物性质(苯酚、甲醛)研究
(1)苯酚性质的研究
研究苯酚性质的方法:官能团→预测性质→实验验证→官能团之间相互影响。
(2)甲醛性质的研究
甲醛性质的研究方法:官能团→预测性质→实验验证。
二、认识发生在盐溶液中的化学反应
1.认识盐类的水解
盐类水解规律的研究思路:
盐溶液的酸碱性 →酸碱性的原因 盐类水解的本质 →盐类水解的规律
①测定盐溶液的酸碱性
盐的名称 碳酸钠 氯化锌 醋酸钠 硫酸铝 氯化钠 氯化铵 硝酸钾
化学式 Na2CO3 ZnCl2 CH3COONa Al2(SO4)3 NaCl NH4Cl KNO3
pH >7 <7 >7 <7 =7 <7 =7
酸碱性 碱性 酸性 碱性 酸性 中性 酸性 中性
②探讨盐溶液呈酸性或碱性的原因
在溶液中盐电离出来的离子与水电离出来的H+或OH—结合生成弱电解质的反应,叫做盐类的水解。水解程度一般较小,是一个可逆过程。
Al3++3H2OAl(OH)3+ 3H+
CO32—+H2OHCO3— +OH—
HCO3—+H2OH2CO3 + OH—
③盐类水解规律的初步探讨
双水解:硫酸铝属于强酸弱碱盐与碳酸钠属于强碱弱酸盐混合时,互相促进了水解。
2Al3++3CO32—+3H2O = 2Al(OH)3↓+3CO2↑
2.研究电解
①电解饱和食盐水
在直流电的作用下,电解质溶液(或熔融态电解质)在两个电极上分别发生氧化反应和还原反应的过程叫做电解。其中,发生氧化反应的电极称为阳极,发生还原反应的电极称为阴极。
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
②电解规律的初步探索
阳离子在阴极的放电顺序:
K+
SO42—
研究的方法:变量控制(只改变一种条件,观察实验结果,得出该条件对反应结果的影响)
1.浓度对化学平衡的影响
AgCl + 2NH32[Ag(NH3)2] ++ Cl—
FeCl3+3KSCN Fe(SCN)3 +3KCl
2.反应条件对化学反应速率的影响
2H2O2 = 2H2O + O2↑(浓度、溶液酸碱性、温度、催化剂对双氧水分解的影响)
3.反应介质、浓度对化学反应结果的影响
(1)KMnO4溶液与Na2SO3溶液在不同酸碱性条件下的反应。
2MnO4— + 6H+ + 5SO32— = 2Mn2+ + 5SO42—+ 3H2O
2MnO4— + H2O + 3SO32— = 2MnO2 ↓+ 3SO42—+ 2O H—
2MnO4— +2O H— + SO32— = 2MnO42— + SO42—+ H2O
(2)浓硫酸、稀硫酸性质的对比研究
C + 2H2SO4 (浓) CO2↑+ 2SO2↑+2H2O
Cu + 2H2SO4 (浓) CuSO4+ 2SO2↑+2H2O
Cu +4HNO3 (浓) Cu(NO3)2+ 2NO2↑+2H2O
3Cu +8HNO3 (稀) 3Cu(NO3)2+ 2NO↑+4H2O
四、现代实验技术在研究物质性质及反应规律中的应用
Ⅳ.典型例题
例1.某中学化学小组查阅资料发现金属氧化物A也能催化氯酸钾的分解,且A和二氧化锰的最佳催化温度均在500℃左右。于是对A和二氧化锰的催化性能进行了定量对照实验。实验时均以收满500mL氧气为准(其他可能影响实验的因素均已忽略)。
表一 用MnO2作催化剂
实验序号 KClO3质量(g) MnO2质量(g) 反应温度(℃) 待测数据
1 8.00 2.00 500
2 8.00 2.00 500
表二 用A作催化剂
实验序号 KClO3质量(g) A质量(g) 反应温度(℃) 待测数据
1 8.00 2.00 500
2 8.00 2.00 500
请回答:
上述实验中的待测数据应是 。
完成此研究后,他们准备发表一篇研究报告,请你替他们拟一个报告的题目:
。
【解析】根据题意,此实验的目的是为了对照MnO2和A的催化能力。而催化能力的高低可以用单位时间内产生的气体的量,或者用产生一定量气体需要的时间来表示。现在题目指明“以收集满500mL氧气为准”,因此在实验报告中应记录产生这些气体需要的时间。本次实验的主要目的在于比较,比较的又是催化剂的效果。在拟定实验报告标题的时候注意给出这两个要点就可以了。
答案:时间 催化效果的对照研究
【点评】本题研究问题的方法也是变量控制法,知道该实验的目的以及反应速率的表示方法便可作答。
例2.有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,
该反应的化学方程式是: 。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
上述方案是否合理 。请简要说明两点理由:
① ;② 。
【解析】若Na2O2与SO2发生反应:2Na2O2+2SO2=2Na2SO3+O2,则其生成物Na2SO3可与酸(盐酸或H2SO4)作用产生能使品红溶液褪色的SO2气体,故取白色固体,加入稀H2SO4,若产生使品红溶液褪色的气体,则白色固体中含Na2SO3。(3)由于稀HNO3具有强氧化性可将BaSO3氧化成为BaSO4,或反应后的固体仍有残留强氧化剂Na2O2时,溶于水后,它能将SO32—氧化成为SO42—,故所给方案不合理。
答:(1)2Na2O2+2SO2=2Na2SO3+O2
(2)取白色固体,加稀硫酸,产生能使品红溶液褪色的气体。
(3)不合理 稀硝酸能将亚硫酸钡氧化为硫酸钡
如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根
【点评】因SO2有还原性,Na2O2与SO2反应比Na2O2与CO2反应要复杂的多。本题从化学方程式、实验设计与评价、实验过程分析等方面对考生进行考查。
Ⅴ、跟踪训练
一、选择题(单选题)
1、室内装潢和家具挥发出来的甲醛是室内空气的主要污染物。甲醛易溶于水,常温下有强烈刺激性气味,当温度超过20℃时,挥发速度加快。根据甲醛的这些性质,下列做法错误的是 ( )
A入住前房间内保持一定湿度并通风
B.装修尽可能选择在温度较高的季节
C请环境监测部门检测室内甲醛含量低于国家标准后入住
D.紧闭门窗一段时间后入住
2、关于电解NaCl水溶液,下列叙述正确的是( )
A 若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
B 若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C 电解时在阳极得到氯气,在阴极得到金属钠
D 电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
3、浓硫酸和2mol/L的稀硫酸,在实验室中敞口放置。它们的质量和放置天数的关系如右图,分析a、b曲线变化的原因是( )
A、a升华、b冷凝 B、a挥发、b吸水
C、a蒸发、b潮解 D、a冷凝、b吸水
4、氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是( )
A、HI和HClO B、HCl和HIO C、HClO3和HIO D、HClO和HIO
5、向50mL 18 mol·L-1H2SO4溶液中加入足量的铜片并加热.充分反应后,被还原的H2SO4的物质的量( )
A小于0.45 mol B等于0.45 mol C在0.45 mol和0.90 mol之间 D大于0.90 mol
6、下列可检验阿司匹林( )样品中混有水杨酸( )的试剂是( )
A 三氯化铁溶液 B 碳酸氢钠溶液 C 石蕊试液 D 氢氧化钠溶液
7、用没食子酸( )制造墨水主要利用了( )类化合物的性质。
A、醇 B、酚 C、油脂 D、羧酸
二、选择题(12选项)
8、继科学家发现C3O2是金星大气成分之后,2004年,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质,已知硫化羰与二氧化碳的结构相似,但在氧气中会燃烧,下列有关C3O2与硫化羰的说法不正确的是( )
A C3O2与CO一样可以在氧气中燃烧生成CO2
B CO、C3O2、CO2都是碳的氧化物,它们互为同素异形体
C COS是由极性键构成的极性分子,分子中所有原子都满足8电子稳定结构
D 硫化羰在氧气中完全燃烧后的生成物是CO2 和SO3
9、在容积不变的密闭容器中存在如下反应:2SO2(g)十O2(g)2SO3(g);ΔH<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是 ( )
A.图I表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
D.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
10、下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是
A、纯Ni(s)和Ni(CO)4(g) B、纯Ni(s)和CO(g)
C、不纯Ni(s)和CO(g) D、不纯Ni(s)和Ni(CO)4(g)
11、碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
A 气瓶中产生的沉淀是碳酸钡
B Z导管出来的气体中无二氧化碳
C 气瓶中产生的沉淀是硫酸钡
D Z导管口有红棕色气体出现
12、金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A 阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B 电解过程中,阳极质量的减少与阴极质量的增加相等
C 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D 电解后,电解槽底部的阳极泥中只有Cu和Pt
13、在溶液导电性实验中,往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮变化是:明一暗一明,下列说法正确的是 ( )
A溶液的导电性与溶液中离子的浓度有关
B溶液的导电性与溶液中离子的数目多少有关
C灯泡最暗时溶液中无自由移动的离子
D往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同
14、有四位同学设计了下列四个方案确证溶液中含有SO42—,你认为合理的是 ( )
A.试液 白色沉淀 沉淀不溶解
B试液 无沉淀 白色沉淀
C试液 无沉淀 白色沉淀
D试液 无沉淀 白色沉淀
三、填空题
15、在二氧化锰催化氯酸钾分解的实验中,制得的氧气中常有氯气的气味,生成的氯化钾又略带紫红色,对这一客观事实的一种分析认为其反应过程如下:
①2KClO3+2MnO2=2A+B↑+O2↑
②2A D+MnO2+O2↑
③B+D=2KCl+MnO2+O2↑
根据上述分析请回答:
(1)A物质的化学式为 ·
(2)除去氧气中的B气体常有的试剂为: 。
(2)写出反应③的化学方程式: 。
16、磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,并放出X kJ热量。通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
17、.(1)1986年,化学上第一次用非电解法制得氟气,试配平该反应的化学方程式:
□K2MnF6 + □SbF5 —— □KSbF6 + □MnF3 + □F2
反应中 元素被还原。
(2) 氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素。如:+H2OHSCN+HSCNO。它们阴离子的还原性 强弱为:Cl—
。
②NaBr和KSCN的混合溶液中加入(CN)2,反应的离子方程式。
。
18、某化学反应2AB+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。
理由是 。
19、由金红石(TiO2)制取单质Ti,涉及到的步骤为:
反应TiCl4 +2Mg =2MgCl2 + Ti在Ar气氛中进行的理由是_______________________。
20、.(1)下表为相对分子质量相近的醇与烷烃的沸点比较数据:
名称 甲醇 乙烷 乙醇 丙烷 乙二醇 丙醇 丁烷
相对分子质量 32 30 46 44 62 60 58
沸点/℃ 64. 7 -88.6 78.5 -42.1 188 97.2 -0.5
根据表中数据, 总结有机物的沸点与相对分子质量、羟基官能团之间的关系:
。
(2)根据上述规律,下列有机物沸点最高的是 (填代号)。
A.丙烷 B.丁烯 C.1,2-丙二醇 D.甘油
(3)多元醇具有较大的酸性,所以Cu(OH)2能溶于乙二醇中,生成鲜蓝色的溶液,实验室常利用这个反应鉴别具有两个相邻羟基的多元醇:
工业上以石油裂解气丙烯为原料制备丁,其反应过程如下:
上述框图中;甲的结构简式为 ;属于取代反应的有 (填框图中的序号);属于加成反应的有 (填框图中的序号)。
写出反应③的化学方程式: 。
“物质性质及反应规律的研究”参考答案
一选择题
1、D 2、B 3、B 4、B 5、A 6、A 7、B
二选择题
8、B D 9、BD 10、B 解析:本题主要考查温度对化学平衡的影响规律。反应在左端开始发生如下反应随着反应的进行,Ni(CO)4(g)充满玻璃管,并达到平衡;Ni(CO)4在玻璃管右侧发生反应,这样两端的化学平衡体系都在不停向右移动,直到左端Ni粉完全反应,Ni(CO)4在右侧完全分解为止,故经过足够长时间后,右端的主要物质为Ni(s)和CO(g)。
11、CD 12、D 13、A 14、B
三填空题
15、(1) KMnO4 (2)NaOH (3)Cl2+ K2MnO4 = 2KCl+MnO2+O2↑
16、P2O3 P2O5 2.75 3.55
17、(1)2 4 4 2 1 (说明:错一个即不给分) Mn(或锰)
(2)(CN)2+2KOH=KCN+KCNO+H2O 2SCN—+(CN)2=2CN—+(SCN)2
18、(1)0.013
(2)1.0 催化剂
(3)吸热;由于吸热温度升高时,平衡向右移动
19、防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用
20、(1)①相对分子质量越大,烷烃(或一元醇)的沸点越高;
②相对分子质量相近的醇与烷烃,醇的沸点远高于烷烃;
③碳原子数相同的醇,羟基越多,沸点越高。
(2)D
(3)A的结构简式:CH2=CHCH2Cl 取代反应:①、②、④ 加成反应:③
反应③:
锌及其化合物的性质
金属锌
(4).既与酸又能与强碱反应:Zn +2HCl = ZnCl2 +H2↑
Zn+2NaOH+2H2O = Na2[Zn(OH)4]+ H2↑
(四羟基合锌酸钠)
(5).与盐溶液反应:Zn+CuSO4 = ZnSO4+Cu
(3).与X2反应:Zn +X2 ZnX2 (X2表示卤素单质)
(2).与O2反应:2Zn + O2 2ZnO
(1).“生锈”:4Zn+2O2+3H2O+CO2 = ZnCO3· 3Zn(OH)2
Zn2++2OH—=Zn(OH)2↓
氯化锌
Zn(OH)2 ZnO + H2O
氢氧化锌
(两性氢氧化物)
Zn(OH)2 +2H+ = Zn2+ +2H2O
Zn(OH)2+OH— = [Zn(OH)4]2—
氧化锌
(两性氧化物)
ZnO +2HCl = ZnCl2 +H2O
ZnO+2NaOH+H2O = Na2[Zn(OH)4]
纯净的苯酚是无色晶体,具有特殊气味,熔点是43℃,露置于空气中因部分被氧化而呈粉红色。常温时,溶解度约为8g,温度高于65℃时能与水混溶。易溶于有机溶剂。 其浓溶液对皮肤有强烈的腐蚀性(应用酒精洗涤)。
物理性质:
①与碱反应
(弱酸性)
②与金属钠反应
苯
酚
性
质
化学性质:
③与溴水反应
④与FeCl3溶液反应:苯酚跟FeCl3反应,使溶液呈紫色。(用于鉴别)
(注:淀粉遇碘显蓝色, KSCN遇FeCl3溶液显红色)
应用:苯酚是一种重要的化工原料,常用做消毒剂和防腐剂。
甲醛
(还原性)
①与酸性KMnO4溶液反应:KMnO4 / H+溶液褪色。
②与新制氢氧化铜反应:
物理性质:无色、有刺激性气味的气体,易溶于水,35%∽40%的甲醛水溶液叫福尔马林。
化学性质:
应用:工业上制人造板材所需脲醛树脂、酚醛树脂的原料,制染料,用于消毒。
③与银氨溶液反应:
④与氢气反应:
HCHO + 2Cu(OH)2 HCOOH +Cu2O+2H2O
HCHO +2[Ag(NH3)2]OH HCOONH4+2Ag↓+3NH3+H2O
HCHO +H2 CH3OH
电离理论
强酸强碱盐:中性(不水解)
强酸弱碱盐:酸性(水解)
强酸弱碱盐:碱性(水解)
熔点仪
密度仪
旋光仪
折光率
1.研究物质的性质
质谱分析仪
核磁共振技术
2.研究物质的组成、结构
闪光光谱仪
脉冲激光技术
飞秒光谱技术
扫描探针显微镜技术
3.研究化学反应过程
白色
沉淀
将B中反应后的固体溶解于水
BaCl2溶液
稀硝酸
仍有部分白色沉淀不溶解,证明有Na2SO4生成
足量盐酸
氯化钡溶液
足量盐酸
足量盐酸
氯化钡溶液
硝酸钡溶液
足量稀硝酸
足量稀硝酸
硝酸钡溶液
TiO2 → TiCl4
Ti
Mg
800℃,Ar
同课章节目录
