8-04++单元复习(PPT课件21页)-2022-2023学年九年级下册化学同步精品讲义(人教版)
文档属性
| 名称 | 8-04++单元复习(PPT课件21页)-2022-2023学年九年级下册化学同步精品讲义(人教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 21.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-06 11:36:01 | ||
图片预览







文档简介
(共21张PPT)
《金属和金属材料》单元复习
一、金属材料的发展和利用
2. 金属材料的发展
金属材料被广泛利用的顺序由早到晚依次是_____________。
3. 金属材料的应用
①应用最广泛的金属是铁
②世界上年产量居前三位的金属依次是_____________
③钛和钛合金被认为是21世纪重要的金属材料
Cu、Fe、Al
1. 金属材料包括_________和_________。
纯金属
合金
Fe、Al、Cu
二、金属的物理性质
1. 物理共性
常温下,大多数金属为银白色固态,有金属光泽,具有导电性、导热性、延展性,密度较大,熔点较高等。
2. 差异性
① 大多数金属都呈银白色,铜为紫红色,金呈黄色;
② 在常温下,大多数金属都是固体,汞是液体;
③ 金属在导电性、导热性、密度、熔点、硬度、延展性等方面均有较大差异。
二、金属的物理性质
3. 金属之最
① 熔点最高:钨W(3410℃);熔点最低:汞Hg(-39℃)。
② 延展性最好:金Au,可制成万分之一毫米的金箔,铝、锡都是常见的延展性很好的金属。
③ 导电导热性最好:银Ag,铜Cu,金Au,铝Al。
④ 地壳中含量最高的金属元素——铝
⑤ 人体中含量最高的金属元素——钙
⑥ 目前世界年产量最高的金属——铁
性质决定用途
价格
是否美观
资源
废料是否易于回收
物质的用途
物质的性质
对环境的影响
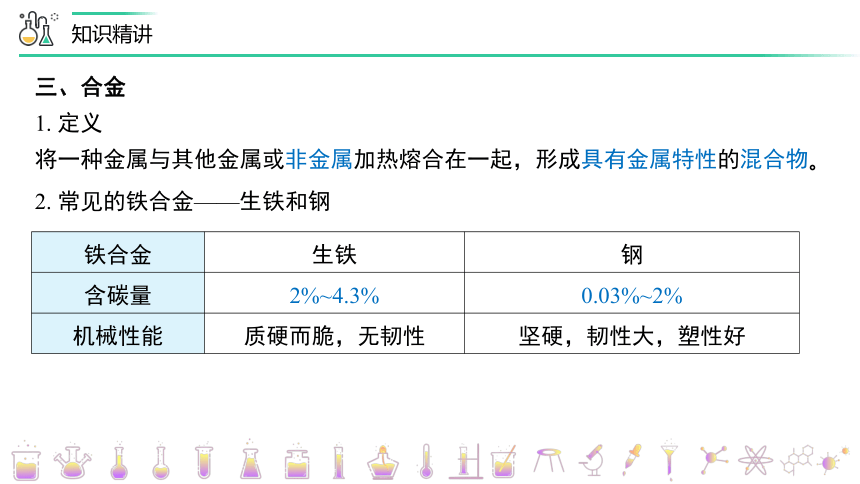
三、合金
1. 定义
将一种金属与其他金属或非金属加热熔合在一起,形成具有金属特性的混合物。
2. 常见的铁合金——生铁和钢
铁合金 生铁 钢
含碳量 2%~4.3% 0.03%~2%
机械性能 质硬而脆,无韧性 坚硬,韧性大,塑性好
三、合金
3. 合金的性质
一般来说,合金的硬度比它的各成分金属的硬度都大。
一般来说,合金的熔点比它的各成分金属的熔点都低。
一般来说,合金的抗腐蚀性比它的各成分金属都好。
四、金属与氧气反应
1. Al、Mg和氧气在常温下即可反应
氧化铝薄膜有很好的保护作用,因此铝具有很好的抗腐蚀性,能被广泛应用。
2. Fe、Cu和氧气在高温下反应
3.金即使在高温下,也不跟氧气反应。
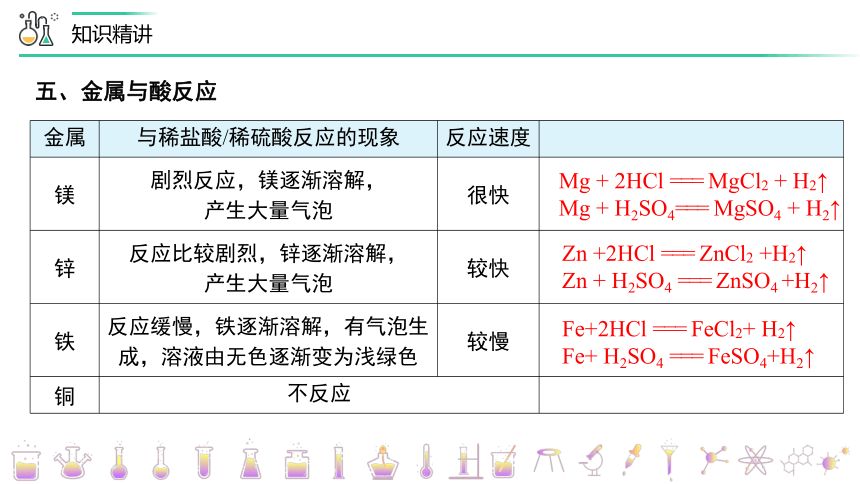
五、金属与酸反应
金属 与稀盐酸/稀硫酸反应的现象 反应速度
镁 剧烈反应,镁逐渐溶解, 产生大量气泡 很快
锌 反应比较剧烈,锌逐渐溶解, 产生大量气泡 较快
铁 反应缓慢,铁逐渐溶解,有气泡生成,溶液由无色逐渐变为浅绿色 较慢
铜 不反应
Zn +2HCl === ZnCl2 +H2↑
Zn + H2SO4 === ZnSO4 +H2↑
Fe+2HCl === FeCl2+ H2↑
Fe+ H2SO4 === FeSO4+H2↑
Mg + 2HCl === MgCl2 + H2↑
Mg + H2SO4=== MgSO4 + H2↑
六、置换反应
1. 定义
由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。
2. 通式
A + BC → AC + B
七、金属与金属化合物溶液的反应
实验操作 实验现象 化学方程式 活动性
铝丝浸入 硫酸铜溶液
铜丝浸入 硝酸银溶液
铜丝浸入 硫酸铝溶液
铝丝表面覆盖一层红色物质,溶液由蓝色变无色
铜丝表面覆盖一层银色物质,溶液由无色变蓝色
无明显现象
2Al + 3CuSO4==
Al2(SO4)3 + 3Cu
Al>Cu
Cu + 2AgNO3 ==
Cu(NO3)2 + 2Ag
Cu>Ag
Cu<Al
【实验结论】三种金属活动性顺序为:_________________。
Al>Cu>Ag
八、金属活动顺序
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
九、金属活动顺序的应用
金属活动性顺序在工农业生产和科学研究中有重要应用,它可以给你以下一些判断的依据:
1. 金属的位置越靠前,它的活动性就越强;
2. 位于氢前面的金属能置换出盐酸、稀硫酸中的氢;
3. 位于前面的金属能把位于后面的金属从它们的化合物溶液中置换出来。
根据金属活动顺序,位置越靠前,其金属活动性就越强
金属与氧气反应越剧烈,其金属活动性越强
金属与酸反应越剧烈,其金属活动性越强
活动性强的金属,可将活动性较弱的金属,从其化合物溶液中置换出来
十、金属活动顺序的比较
十一、金属资源概述
1. 少数很不活泼的金属以单质形式存在,如金、银等。
2. 绝大多数金属以化合物形式存在,如Fe、Cu、Al等。
3. 常见的金属矿石及其主要成分
赤铁矿
(Fe2O3)
磁铁矿
(Fe3O4)
菱铁矿
(FeCO3)
铝土矿
(Al2O3)
黄铜矿
(CuFeS2)
辉铜矿
(Cu2S)
十二、铁的冶炼
1. 实验室用CO还原氧化铁
实验现象
红棕色粉末逐渐变黑;澄清石灰水变浑浊;尾气燃烧产生蓝色火焰。
相关反应
3CO + Fe2O3 ==== 2Fe + 3CO2
CO2 + Ca(OH)2 ==== CaCO3↓+ H2O 2CO + O2 ==== 2CO2
高温
点燃
十二、铁的冶炼
2. 工业炼铁
C + O2 ==== CO2
CO2 + C ==== 2CO
3CO + Fe2O3 ==== 2Fe + 3CO2
相关反应
高温
高温
高温
实验操作 ① ②
③
实验现象
实验分析 实验结论 实验探究——铁钉锈蚀条件
生锈
(水面附近锈蚀更严重)
不生锈
不生锈
①② → 铁生锈与氧气有关;
①③ → 铁生锈与水有关。
铁生锈的条件:铁与__________同时接触
氧气、水
十三、金属锈蚀的防护措施
1. 防护原理
① 隔绝空气 ② 隔绝水
2. 具体方法
① 保持铁制品表面干燥和洁净;
② 在铁制品表面涂一层保护膜如刷油漆、涂油,镀上耐磨耐腐蚀的金属铬;
③ 制成合金,如不锈钢。
十四、金属资源的保护
1. 金属矿物的储量有限,且不能再生。
2. 保护保护金属资源的有效途径:
① 防止金属的腐蚀;
② 金属的回收利用;
③ 有计划、合理地开采金属矿物;
④ 努力寻找金属替代品。
《金属和金属材料》单元复习
一、金属材料的发展和利用
2. 金属材料的发展
金属材料被广泛利用的顺序由早到晚依次是_____________。
3. 金属材料的应用
①应用最广泛的金属是铁
②世界上年产量居前三位的金属依次是_____________
③钛和钛合金被认为是21世纪重要的金属材料
Cu、Fe、Al
1. 金属材料包括_________和_________。
纯金属
合金
Fe、Al、Cu
二、金属的物理性质
1. 物理共性
常温下,大多数金属为银白色固态,有金属光泽,具有导电性、导热性、延展性,密度较大,熔点较高等。
2. 差异性
① 大多数金属都呈银白色,铜为紫红色,金呈黄色;
② 在常温下,大多数金属都是固体,汞是液体;
③ 金属在导电性、导热性、密度、熔点、硬度、延展性等方面均有较大差异。
二、金属的物理性质
3. 金属之最
① 熔点最高:钨W(3410℃);熔点最低:汞Hg(-39℃)。
② 延展性最好:金Au,可制成万分之一毫米的金箔,铝、锡都是常见的延展性很好的金属。
③ 导电导热性最好:银Ag,铜Cu,金Au,铝Al。
④ 地壳中含量最高的金属元素——铝
⑤ 人体中含量最高的金属元素——钙
⑥ 目前世界年产量最高的金属——铁
性质决定用途
价格
是否美观
资源
废料是否易于回收
物质的用途
物质的性质
对环境的影响
三、合金
1. 定义
将一种金属与其他金属或非金属加热熔合在一起,形成具有金属特性的混合物。
2. 常见的铁合金——生铁和钢
铁合金 生铁 钢
含碳量 2%~4.3% 0.03%~2%
机械性能 质硬而脆,无韧性 坚硬,韧性大,塑性好
三、合金
3. 合金的性质
一般来说,合金的硬度比它的各成分金属的硬度都大。
一般来说,合金的熔点比它的各成分金属的熔点都低。
一般来说,合金的抗腐蚀性比它的各成分金属都好。
四、金属与氧气反应
1. Al、Mg和氧气在常温下即可反应
氧化铝薄膜有很好的保护作用,因此铝具有很好的抗腐蚀性,能被广泛应用。
2. Fe、Cu和氧气在高温下反应
3.金即使在高温下,也不跟氧气反应。
五、金属与酸反应
金属 与稀盐酸/稀硫酸反应的现象 反应速度
镁 剧烈反应,镁逐渐溶解, 产生大量气泡 很快
锌 反应比较剧烈,锌逐渐溶解, 产生大量气泡 较快
铁 反应缓慢,铁逐渐溶解,有气泡生成,溶液由无色逐渐变为浅绿色 较慢
铜 不反应
Zn +2HCl === ZnCl2 +H2↑
Zn + H2SO4 === ZnSO4 +H2↑
Fe+2HCl === FeCl2+ H2↑
Fe+ H2SO4 === FeSO4+H2↑
Mg + 2HCl === MgCl2 + H2↑
Mg + H2SO4=== MgSO4 + H2↑
六、置换反应
1. 定义
由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。
2. 通式
A + BC → AC + B
七、金属与金属化合物溶液的反应
实验操作 实验现象 化学方程式 活动性
铝丝浸入 硫酸铜溶液
铜丝浸入 硝酸银溶液
铜丝浸入 硫酸铝溶液
铝丝表面覆盖一层红色物质,溶液由蓝色变无色
铜丝表面覆盖一层银色物质,溶液由无色变蓝色
无明显现象
2Al + 3CuSO4==
Al2(SO4)3 + 3Cu
Al>Cu
Cu + 2AgNO3 ==
Cu(NO3)2 + 2Ag
Cu>Ag
Cu<Al
【实验结论】三种金属活动性顺序为:_________________。
Al>Cu>Ag
八、金属活动顺序
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
九、金属活动顺序的应用
金属活动性顺序在工农业生产和科学研究中有重要应用,它可以给你以下一些判断的依据:
1. 金属的位置越靠前,它的活动性就越强;
2. 位于氢前面的金属能置换出盐酸、稀硫酸中的氢;
3. 位于前面的金属能把位于后面的金属从它们的化合物溶液中置换出来。
根据金属活动顺序,位置越靠前,其金属活动性就越强
金属与氧气反应越剧烈,其金属活动性越强
金属与酸反应越剧烈,其金属活动性越强
活动性强的金属,可将活动性较弱的金属,从其化合物溶液中置换出来
十、金属活动顺序的比较
十一、金属资源概述
1. 少数很不活泼的金属以单质形式存在,如金、银等。
2. 绝大多数金属以化合物形式存在,如Fe、Cu、Al等。
3. 常见的金属矿石及其主要成分
赤铁矿
(Fe2O3)
磁铁矿
(Fe3O4)
菱铁矿
(FeCO3)
铝土矿
(Al2O3)
黄铜矿
(CuFeS2)
辉铜矿
(Cu2S)
十二、铁的冶炼
1. 实验室用CO还原氧化铁
实验现象
红棕色粉末逐渐变黑;澄清石灰水变浑浊;尾气燃烧产生蓝色火焰。
相关反应
3CO + Fe2O3 ==== 2Fe + 3CO2
CO2 + Ca(OH)2 ==== CaCO3↓+ H2O 2CO + O2 ==== 2CO2
高温
点燃
十二、铁的冶炼
2. 工业炼铁
C + O2 ==== CO2
CO2 + C ==== 2CO
3CO + Fe2O3 ==== 2Fe + 3CO2
相关反应
高温
高温
高温
实验操作 ① ②
③
实验现象
实验分析 实验结论 实验探究——铁钉锈蚀条件
生锈
(水面附近锈蚀更严重)
不生锈
不生锈
①② → 铁生锈与氧气有关;
①③ → 铁生锈与水有关。
铁生锈的条件:铁与__________同时接触
氧气、水
十三、金属锈蚀的防护措施
1. 防护原理
① 隔绝空气 ② 隔绝水
2. 具体方法
① 保持铁制品表面干燥和洁净;
② 在铁制品表面涂一层保护膜如刷油漆、涂油,镀上耐磨耐腐蚀的金属铬;
③ 制成合金,如不锈钢。
十四、金属资源的保护
1. 金属矿物的储量有限,且不能再生。
2. 保护保护金属资源的有效途径:
① 防止金属的腐蚀;
② 金属的回收利用;
③ 有计划、合理地开采金属矿物;
④ 努力寻找金属替代品。
同课章节目录
