4.3.1 金属的腐蚀与防护 课件 2022-2023学年高二化学人教版(2019)选择性必修1(18张ppt)
文档属性
| 名称 | 4.3.1 金属的腐蚀与防护 课件 2022-2023学年高二化学人教版(2019)选择性必修1(18张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 38.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-04 14:32:45 | ||
图片预览





文档简介
(共18张PPT)
1.通过讨论钢铁腐蚀的现象,认识金属腐蚀的本质,能用电化学腐蚀的原理解释金属腐蚀的现象。2.通过讨论日常生活中金属腐蚀的危害,能选择并设计防腐措施。
金属的腐蚀与防护
第一课时
我国每年因腐蚀而造成的经济损失占国民生产总值的5%左右。金属材料使用量的90% 以上是钢铁,由钢铁造成的损失约 7 000 亿美元,超过每年各项大灾(火灾、风灾及地震等)损失的总和。
——《中国腐蚀调查报告》
生活中常见的金属的腐蚀
钢铁生锈
主要成分:Fe2O3 · xH2O
铜器生锈
铜绿的主要成分:
Cu2(OH)2CO3
1、什么是金属的腐蚀?
2、金属腐蚀的实质是什么?
3、一般金属的腐蚀可分为几种?各有什么特点?
是指金属或合金跟接触的气体或液体发生氧化还原反应而腐蚀损耗的过程。
M-ne- =Mn+
化学腐蚀
电化学腐蚀
影响金属腐蚀的因素
内因:金属自身的性质
外因:
金属所处的环境
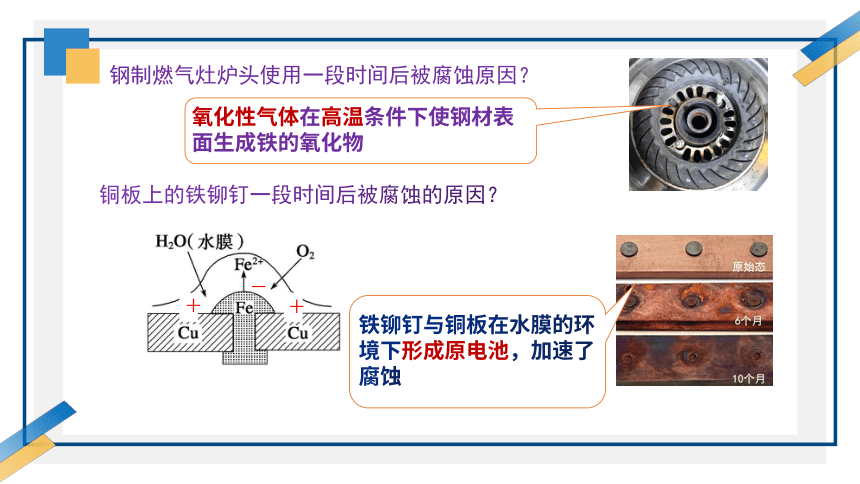
钢制燃气灶炉头使用一段时间后被腐蚀原因?
氧化性气体在高温条件下使钢材表面生成铁的氧化物
铜板上的铁铆钉一段时间后被腐蚀的原因?
铁铆钉与铜板在水膜的环境下形成原电池,加速了腐蚀
-
+
+
金属跟接触到的干燥气体(如O2、Cl2、SO2等)或非电解质液体(如石油)等直接发生化学反应而引起的腐蚀。
(1)化学腐蚀:
输送原油的钢管在无水、
无氧的情况下被腐蚀而漏油
Fe
Fe2O3·xH2O
0
+3
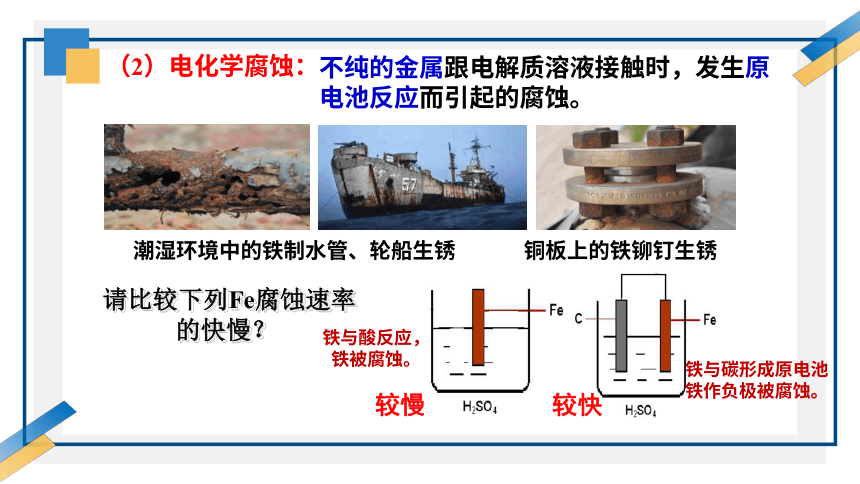
不纯的金属跟电解质溶液接触时,发生原电池反应而引起的腐蚀。
请比较下列Fe腐蚀速率的快慢?
铁与酸反应,
铁被腐蚀。
铁与碳形成原电池铁作负极被腐蚀。
较慢 较快
铜板上的铁铆钉生锈
潮湿环境中的铁制水管、轮船生锈
(2)电化学腐蚀:
化学腐蚀与电化学腐蚀的比较
化学腐蚀 电化学腐蚀
条件
特征
速率
结果
金属与氧化性物质直接接触
不纯金属与电解质溶液
及氧化剂接触
无电流产生
有微弱电流产生
金属被氧化
相对活泼的金属被氧化
小
大
通常情况下,两者同时存在,以电化学腐蚀为主
【探究1】潮湿环境中钢铁生锈原理探究
盐酸浸泡过的铁钉
装置中铁、碳和盐酸构成原电池,铁钉发生析氢腐蚀腐蚀
导管中有水柱上升,铁钉表面有铁锈生成
条件:水膜酸性较强
正极: 2H++ 2e- =H2 ↑
负极: Fe - 2e- = Fe2+
总反应:Fe + 2H+ =Fe2+ + H2 ↑
实验1:将酸洗除锈的铁钉,用饱和食盐水浸泡后,放入下图所示装置,几分钟后观察导管中水柱的变化。
消耗的一定是氧气吗?
导管中有水柱上升,铁钉表面有铁锈生成
实验2:
用传感器测量铁钉腐蚀过程中密闭装置内氧气含量的变化。
氧气含量
测定传感器
装置中铁、碳和饱和食盐水构成原电池,铁钉发生吸氧腐蚀腐蚀
电解质溶液
Fe2+
e-
e-
e-
e-
4Fe(OH)2 +O2 + 2H2O =4 Fe(OH)3
2Fe(OH)3=(3-x) H2O+Fe2O3·xH2O
吸氧腐蚀
+
-
负极:2Fe - 4e- = 2Fe2+
正极:O2+2H2O+4e- =4OH-
O2
OH-
条件:弱酸性或中性或碱性
电脑
数据采集器
一定pH的
醋酸溶液
铁和炭粉
【创新实验】不同pH下,试管中气体压强随时间变化情况
2H+ + 2e = H2↑
pH=2.0、3.0、3.5:
pH=4.0:
O2 + 4e + 4H+ = 2H2O
(析氢腐蚀)
(吸氧腐蚀)
写出pH=2.0~3.5和4.0时发生的主要正极反应。
钢铁的析氢腐蚀和吸氧腐蚀比较
小结
吸氧腐蚀 析氢腐蚀
条件
电极反应 负极(Fe)
正极(C)
总反应
水膜呈较强酸性
水膜酸性很弱或呈中性
2Fe-4e- 2Fe2+
Fe-2e- Fe2+
O2+4e-+2H2O 4OH-
2H++2e- H2
2Fe+O2+2H2O 2Fe(OH)2
Fe+2H+ Fe2++H2
Fe2O3˙xH2O
脱水
4Fe(OH)2+O2+2H2O 4Fe(OH)3
金属的腐蚀以电化学腐蚀为主,
电化学腐蚀又以吸氧腐蚀为主。
二者往往同时存在
练习
1、下列关于金属腐蚀的说法正确的是 ( )
A.合金都比纯金属易被腐蚀
B.金属化学腐蚀的实质是:M-ne-=Mn+,电子直接转移给氧化剂
C.金属的电化学腐蚀必须在酸性条件下进行
D.在潮湿的环境中,金属的电化学腐蚀一定是析氢腐蚀
E.镀锌铁皮的镀层损坏后,铁更容易被腐蚀
B
探究一:镀锌铁皮和镀锡铁皮哪个更易被腐蚀?为什么?
探究二:纯锌和粗锌哪个更易和酸反应?如果向溶液中再加入硫酸铜又会什么现象?
镀锡铁皮更易被腐蚀。铁比锡更活泼,当镀层破坏时,锡铁和空气及水分构成原电池,铁做负极发生反应而损耗。锌比铁更活泼,当镀层破坏时,锌铁和空气及水分构成原电池,锌做负极发生反应而损耗。
粗锌中有多种杂质如碳等,与酸一起构成原电池,反应加快。
加入硫酸铜,锌与铜离子反应生成铜附着在锌上构成原电池,反应速率加快,产生气泡速率加快。
2.某学生为研究金属腐蚀的条件,用金属丝把三根大小相同的铁钉分别固定在如图所示的三个装置中,放置一星期后观察现象,下列描述错误的是 ( )
A.装置Ⅰ的U形管铁钉一侧的液面一定会上升
B.装置Ⅱ中的铁钉腐蚀最严重
C.比较U形管铁钉一侧的液面:装置Ⅰ比装置Ⅱ的低
D.装置Ⅲ中的铁钉几乎没有被腐蚀
C
3、利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是 ( )
A.a管发生吸氧腐蚀,b管发生析氢腐蚀
B.一段时间后,a管液面高于b管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:
Fe-2e-=Fe2+
C
在酸性(较强)条件下:发生析氢腐蚀;
在中性(碱性或极弱的酸性)条件下发生吸氧腐蚀。
1.通过讨论钢铁腐蚀的现象,认识金属腐蚀的本质,能用电化学腐蚀的原理解释金属腐蚀的现象。2.通过讨论日常生活中金属腐蚀的危害,能选择并设计防腐措施。
金属的腐蚀与防护
第一课时
我国每年因腐蚀而造成的经济损失占国民生产总值的5%左右。金属材料使用量的90% 以上是钢铁,由钢铁造成的损失约 7 000 亿美元,超过每年各项大灾(火灾、风灾及地震等)损失的总和。
——《中国腐蚀调查报告》
生活中常见的金属的腐蚀
钢铁生锈
主要成分:Fe2O3 · xH2O
铜器生锈
铜绿的主要成分:
Cu2(OH)2CO3
1、什么是金属的腐蚀?
2、金属腐蚀的实质是什么?
3、一般金属的腐蚀可分为几种?各有什么特点?
是指金属或合金跟接触的气体或液体发生氧化还原反应而腐蚀损耗的过程。
M-ne- =Mn+
化学腐蚀
电化学腐蚀
影响金属腐蚀的因素
内因:金属自身的性质
外因:
金属所处的环境
钢制燃气灶炉头使用一段时间后被腐蚀原因?
氧化性气体在高温条件下使钢材表面生成铁的氧化物
铜板上的铁铆钉一段时间后被腐蚀的原因?
铁铆钉与铜板在水膜的环境下形成原电池,加速了腐蚀
-
+
+
金属跟接触到的干燥气体(如O2、Cl2、SO2等)或非电解质液体(如石油)等直接发生化学反应而引起的腐蚀。
(1)化学腐蚀:
输送原油的钢管在无水、
无氧的情况下被腐蚀而漏油
Fe
Fe2O3·xH2O
0
+3
不纯的金属跟电解质溶液接触时,发生原电池反应而引起的腐蚀。
请比较下列Fe腐蚀速率的快慢?
铁与酸反应,
铁被腐蚀。
铁与碳形成原电池铁作负极被腐蚀。
较慢 较快
铜板上的铁铆钉生锈
潮湿环境中的铁制水管、轮船生锈
(2)电化学腐蚀:
化学腐蚀与电化学腐蚀的比较
化学腐蚀 电化学腐蚀
条件
特征
速率
结果
金属与氧化性物质直接接触
不纯金属与电解质溶液
及氧化剂接触
无电流产生
有微弱电流产生
金属被氧化
相对活泼的金属被氧化
小
大
通常情况下,两者同时存在,以电化学腐蚀为主
【探究1】潮湿环境中钢铁生锈原理探究
盐酸浸泡过的铁钉
装置中铁、碳和盐酸构成原电池,铁钉发生析氢腐蚀腐蚀
导管中有水柱上升,铁钉表面有铁锈生成
条件:水膜酸性较强
正极: 2H++ 2e- =H2 ↑
负极: Fe - 2e- = Fe2+
总反应:Fe + 2H+ =Fe2+ + H2 ↑
实验1:将酸洗除锈的铁钉,用饱和食盐水浸泡后,放入下图所示装置,几分钟后观察导管中水柱的变化。
消耗的一定是氧气吗?
导管中有水柱上升,铁钉表面有铁锈生成
实验2:
用传感器测量铁钉腐蚀过程中密闭装置内氧气含量的变化。
氧气含量
测定传感器
装置中铁、碳和饱和食盐水构成原电池,铁钉发生吸氧腐蚀腐蚀
电解质溶液
Fe2+
e-
e-
e-
e-
4Fe(OH)2 +O2 + 2H2O =4 Fe(OH)3
2Fe(OH)3=(3-x) H2O+Fe2O3·xH2O
吸氧腐蚀
+
-
负极:2Fe - 4e- = 2Fe2+
正极:O2+2H2O+4e- =4OH-
O2
OH-
条件:弱酸性或中性或碱性
电脑
数据采集器
一定pH的
醋酸溶液
铁和炭粉
【创新实验】不同pH下,试管中气体压强随时间变化情况
2H+ + 2e = H2↑
pH=2.0、3.0、3.5:
pH=4.0:
O2 + 4e + 4H+ = 2H2O
(析氢腐蚀)
(吸氧腐蚀)
写出pH=2.0~3.5和4.0时发生的主要正极反应。
钢铁的析氢腐蚀和吸氧腐蚀比较
小结
吸氧腐蚀 析氢腐蚀
条件
电极反应 负极(Fe)
正极(C)
总反应
水膜呈较强酸性
水膜酸性很弱或呈中性
2Fe-4e- 2Fe2+
Fe-2e- Fe2+
O2+4e-+2H2O 4OH-
2H++2e- H2
2Fe+O2+2H2O 2Fe(OH)2
Fe+2H+ Fe2++H2
Fe2O3˙xH2O
脱水
4Fe(OH)2+O2+2H2O 4Fe(OH)3
金属的腐蚀以电化学腐蚀为主,
电化学腐蚀又以吸氧腐蚀为主。
二者往往同时存在
练习
1、下列关于金属腐蚀的说法正确的是 ( )
A.合金都比纯金属易被腐蚀
B.金属化学腐蚀的实质是:M-ne-=Mn+,电子直接转移给氧化剂
C.金属的电化学腐蚀必须在酸性条件下进行
D.在潮湿的环境中,金属的电化学腐蚀一定是析氢腐蚀
E.镀锌铁皮的镀层损坏后,铁更容易被腐蚀
B
探究一:镀锌铁皮和镀锡铁皮哪个更易被腐蚀?为什么?
探究二:纯锌和粗锌哪个更易和酸反应?如果向溶液中再加入硫酸铜又会什么现象?
镀锡铁皮更易被腐蚀。铁比锡更活泼,当镀层破坏时,锡铁和空气及水分构成原电池,铁做负极发生反应而损耗。锌比铁更活泼,当镀层破坏时,锌铁和空气及水分构成原电池,锌做负极发生反应而损耗。
粗锌中有多种杂质如碳等,与酸一起构成原电池,反应加快。
加入硫酸铜,锌与铜离子反应生成铜附着在锌上构成原电池,反应速率加快,产生气泡速率加快。
2.某学生为研究金属腐蚀的条件,用金属丝把三根大小相同的铁钉分别固定在如图所示的三个装置中,放置一星期后观察现象,下列描述错误的是 ( )
A.装置Ⅰ的U形管铁钉一侧的液面一定会上升
B.装置Ⅱ中的铁钉腐蚀最严重
C.比较U形管铁钉一侧的液面:装置Ⅰ比装置Ⅱ的低
D.装置Ⅲ中的铁钉几乎没有被腐蚀
C
3、利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是 ( )
A.a管发生吸氧腐蚀,b管发生析氢腐蚀
B.一段时间后,a管液面高于b管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:
Fe-2e-=Fe2+
C
在酸性(较强)条件下:发生析氢腐蚀;
在中性(碱性或极弱的酸性)条件下发生吸氧腐蚀。
