【志鸿原创课件】2013年高中化学选修一 化学与生活:主题1课题2 获取安全的饮用水(课件,鲁科版)
文档属性
| 名称 | 【志鸿原创课件】2013年高中化学选修一 化学与生活:主题1课题2 获取安全的饮用水(课件,鲁科版) |

|
|
| 格式 | zip | ||
| 文件大小 | 680.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-12-28 00:00:00 | ||
图片预览










文档简介
课件56张PPT。课题2 获取安全的饮用水学习目标
1.认识某些含氯化合物的杀菌消毒原理。
2.了解离子交换法、药剂法和加热法降低水硬度的原理。
3.了解污水治理的基本原理。
4.通过饮用水净化过程主要环节的化学知识,进一步掌握有关Mg2+、Ca2+、Al3+、Fe2+、Fe3+、Ca(HCO3)2和Mg(HCO3)2的性质等知识。
5.初步学习水处理中常用的沉降悬浮物,降低水的硬度等实验方法和操作技能。
6.通过学习本课题知识,增进学生保护水资源、防止水污染的意识,学会正确选择饮用水。 课堂互动讲练探究整合应用知能优化训练课题2
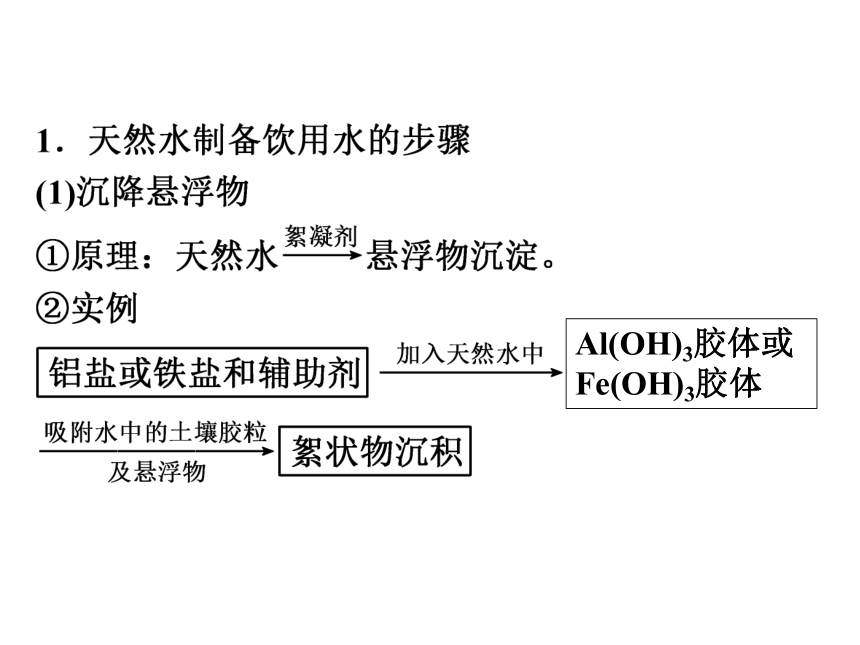
获取安全的饮用水课前自主学案课前自主学案一、天然水的净化
人类饮用的天然水中主要含有泥土、____________和__________等杂质,必须经过综合处理后才能达到饮用标准。可溶性物质致病细菌Al(OH)3胶体或
Fe(OH)3胶体常用絮凝剂还有________、镁盐和有机絮凝剂等。
(2)杀菌消毒
①实质:用_________或在______条件下使菌体蛋白质变性。
②常用杀菌消毒剂: ______、漂白粉、二氧化氯、高铁酸盐等。
2.城市自来水的获取
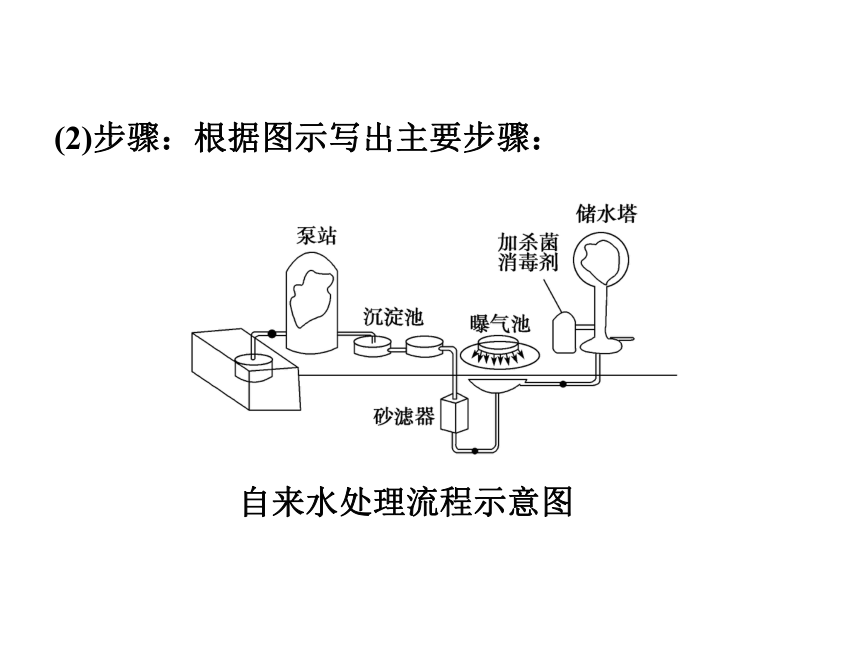
(1)策略:用便宜、有效的方法把天然水中的悬浮物、微生物及异味除去,但无须除去水中所有的矿物质。聚合铝强氧化剂高温氯气(2)步骤:根据图示写出主要步骤:自来水处理流程示意图思考感悟
1.明矾是如何净水的?
【提示】 明矾溶于水后电离出Al3+:KAl(SO4)2·12H2O===K++Al3++2SO+12H2O,水也能发生微弱电离,产生微量的OH-,H2O??H++OH-;Al3+能与水中的OH-结合成难电离的Al(OH)3,氢氧化铝在水中形成胶体,对水中细小的悬浮物有很强的吸附性,能沉降除去悬浮物,达到净水的目的。二、硬水的软化
1.水的硬度
(1)硬水:溶有较多Ca2+、Mg2+的水。
(2)软水:溶有少量或不含Ca2+、Mg2+的水。
(3)永久硬度:由钙和镁的硫酸盐或氯化物等引起的水的硬度。
(4)暂时硬度:由碳酸氢钙和碳酸氢镁引起的水的硬度。2.硬水的危害
(1)不能饮用——易引起肠胃不适、诱发疾病。
(2)不利于洗涤——浪费洗涤剂,引起衣物退色。
(3)不能用于锅炉——会使锅炉内壁结垢[主要成分CaCO3、Mg(OH)2],降低热效率,甚至引起爆炸。
3.硬水的软化
(1)硬水的软化:除去或减少天然水中Ca2+、Mg2+等的过程。(2)常用方法
①加热法
通过加热煮沸使暂时硬水所含钙、镁的酸式碳酸盐发生分解,主要化学反应原理是:
___________________________________;
___________________________________ ;
______________________________。②药剂法
通过加入适当化学药剂促使水中Ca2+、Mg2+以沉淀的形式从水中分离出来的方法。常用的化学药剂有_______、纯碱等,主要化学反应原理是:
Ca(HCO3)2+Ca(OH)2===2CaCO3↓+2H2O;
Mg(HCO3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2O;生石灰MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2;
CaCl2+Na2CO3===CaCO3↓+2NaCl。
③离子交换法
通过加入离子交换剂与水溶液交换同性电荷离子从而除去或减少不需要的离子,常用于工业锅炉用水的软化。
思考感悟
2.生活中鉴别硬水与软水常用的方法有哪些?
【提示】 方法1:取一杯热水,将肥皂切碎投入其中,肥皂能完全溶解,冷却后成为一种半透明液体,即为软水;若冷却后水面有一层未溶解的白色物质,则为硬水,且白色物质越多,硬度越大。
方法2:用烧杯盛水加热,若杯壁留下较多水垢,则为硬水。三、纯净水的制取方法
1.纯净水的制取方法
纯净水是以符合生活饮用水水质标准的水为原料,选用__________、 ____________、 __________、 ________等加工方法制得的。
2.纯净水的制取过程
电渗析法离子交换法反渗透法蒸馏法活性炭四、污水处理与环境保护
1.人为因素的水污染
主要是由工业废水、生活污水、农田排水以及降雨淋洗将大气中的污染物和堆积在地上的垃圾污染物冲入水中而引起的。2.活性污泥法二级处理工艺
(1)一级处理:在沉淀池中通过______除去污水中的固体沉淀物和悬浮物,再加入一定量的化学试剂中和污水中的______或______物质。
(2)二级处理:采用空气曝气活性污泥法,利用细菌等微生物除去废水中的有机污染物,使之变为______ 和________。
过滤酸性碱性CO2无机盐思考感悟
3.处理污水采取的方法和原理是什么?
【提示】
1.城市由天然水获取自来水的一般步骤为( )解析:选C。天然水变为自来水应先自然沉降和加絮凝剂沉降,使水中的固体杂质沉淀出,然后通过细砂、活性炭过滤,再曝气增加溶氧量,氧化、消除有机质,最后消毒成为自来水。2.下列方法不能用于对饮用水进行杀菌消毒的是
( )
A.加热煮沸 B.加入Ca(ClO)2
C.加入纯碱 D.加入ClO2
解析:选C。细菌主要由蛋白质构成,杀菌的实质是用强氧化剂或在高温条件下使菌体蛋白质变性,对少量水通常采用加热煮沸法来杀菌消毒,对大量水多采用氧化剂氧化法来杀菌消毒,故C项不正确。3.下列方法适宜软化永久硬水的是( )
A.离子交换法 B.加热煮沸
C.加入Na2SO4溶液 D.加入HCl溶液课堂互动讲练1.硬水软化的涵义
除去或减少天然水中的Ca2+、Mg2+等的过程,叫做硬水的软化。
2.硬水软化的方法
(1)加热法(详见课前自主学案)
(2)药剂法(详见课前自主学案)(3)离子交换法
①离子交换法软化硬水的涵义
离子交换法是采用离子交换剂软化水的一种方法。离子交换剂分阳离子交换剂和阴离子交换剂两类,它们在水溶液中能与具有同性电荷的离子进行交换,从而除去或减少不需要的离子。②用阳离子交换剂软化硬水的原理
工业上常用磺化煤等阳离子交换剂对锅炉用水进行软化。这些阳离子交换剂都具有复杂的结构,通常将它们的化学式简写为NaR。当硬水通过装有离子交换剂的装置时,发生如下的离子交换作用:
2NaR+Ca2+===CaR2+2Na+
2NaR+Mg2+===MgR2+2Na+
硬水中的Ca2+、Mg2+被离子交换剂吸附而除去,从装置中流出的水就成为软水。③离子交换剂的再生
离子交换剂因离子交换作用的不断进行而逐步丧失功能,因此需要在一定时间后进行再生。一般的再生方法是让高浓度的NaCl溶液通过离子交换剂,用Na+把离子交换剂吸附的Ca2+、Mg2+置换出来,从而恢复离子交换剂软化硬水的能力。离子交换剂再生的化学反应为:
CaR2+2Na+===2NaR+Ca2+
MgR2+2Na+===2NaR+Mg2+ 关于水的硬度,通常把由Ca2+、Mg2+的碳酸氢盐引起的硬度叫暂时硬度,而把Ca2+、Mg2+的硫酸盐或氯化物引起的硬度叫永久硬度。我国现行标准规定:1 L水含10 mg CaO(或相当于10 mg CaO)的硬度称为1度(以1°表示),硬度在8°以上的称为硬水,在8°以下的称为软水。经实验测定,某地的河水中含Ca(HCO3)2 2.500×10-3 mol/L、Mg(HCO3)2 3.000×10-3 mol/L。请回答下列问题:(1)该河水的硬度类型是________,硬度值是________。
(2)若将该河水直接做锅炉用水,主要危害是
____________________________。
(3)欲降低该河水的硬度,下列措施中有效的是(填写代号)________。
A.加热 B.加漂白粉
C.加高铁酸钾 D.加明矾【答案】 (1)暂时硬度 30.8°
(2)使锅炉结垢,降低热效率,浪费燃料,甚至引起锅炉爆炸 (3)A变式训练1 下列关于硬水及其软化的说法正确的是( )
A.所谓软水是不含Ca2+、Mg2+的水
B.石灰—纯碱法中石灰是指CaCO3
C.石灰—纯碱法软化硬水过程中,Mg2+引起的硬度转化成了Ca2+的硬度
D.离子交换剂不能再生解析:选C。软水是指不含或Ca2+、Mg2+含量较少的水;石灰——纯碱法中的“石灰”是指生石灰CaO,CaO加入水中与水反应生成Ca(OH)2,Ca(OH)2可以沉淀Mg2+;由Mg2++2OH-===Mg(OH)2↓知,Mg2+被除去的同时,溶液中又增加了等量的Ca2+,所以Mg2+的硬度转化成了Ca2+的硬度;将离子交换剂浸泡在饱和NaCl溶液中时,Na+把Ca2+、Mg2+交换下来,从而使离子交换剂恢复软化硬水的能力,故选C项。1.水体污染分类
(1)水体污染原因
引起水体污染的原因有两类:一类是自然因素造成的,如地下水流动把地层中某些矿物质溶解,使某些地区水中盐分、某些元素含量偏高或因动植物腐烂产生毒物而影响了当地的水质等;另一类是人为因素造成的,主要是工业排放的污水。此外,还包括生活污水、农田排水、降雨淋洗大气中的污染物以及堆积在大地上的垃圾经降雨淋洗流入水体中的污染物。(2)水体污染种类
重金属污染:主要来自化工、冶金、电子和电镀等行业排放的工业废水,它们能在体内积累,不宜排出体外。
植物营养物质污染:生活污水或者工业废水中含有大量的营养性元素,如K、N等。这些污水中物质在分解过程中会消耗水中溶解的氧,并释放出养分,使水中生物疯长,而引发“水华”“赤潮”现象。
其他污染:农药的广泛使用、石油外泄等对水体造成的污染。2.污水处理方法
污水处理方法一般可归纳为物理法、生物法和化学法。
(1)混凝法:混凝法就是通过加入混凝剂使难以自然沉降的悬浮物形成沉淀的污水处理方法。它属于物理方法,常见的混凝剂有:明矾、聚羟基氯化铝、聚丙烯酰胺等。
(2)中和法:对于酸性废水和碱性废水,可以采用中和法进行处理。一般用中和剂如熟石灰来中和钢铁厂、电镀厂等产生的酸性废水,用硫酸或者二氧化碳来中和碱性废水。其有关反应如下:Ca(OH)2+H2SO4===CaSO4↓+2H2O
H2SO4+2NaOH===Na2SO4+2H2O
2NaOH+CO2===Na2CO3+H2O
对于高浓度的酸、碱废水,应首先考虑回收利用,如采用浓缩的方法回收酸、碱等。
(3)沉淀法:沉淀法就是利用某些化学物质作为沉淀剂,与废水中的污染物(主要是重金属离子)发生化学反应,生成难溶于水的沉淀,从废水中分离出去。利用沉淀反应是除去水中重金属离子常用的方法。例如,向含有Hg2+的废水中加入Na2S可以使Hg2+转变为HgS沉淀而除去。用这种方法处理以后,污水中的Hg2+的浓度可以降低到几乎对人体无毒。(4)氧化还原法:利用氧化还原反应将废水中的有害物质转变为无毒物质、难溶性物质或易除去的物质,这是废水处理中的重要方法之一。
例如,氯氧化法处理含氰(CN-)废水是废水处理的一个典型实例。在碱性条件下,Cl2可将废水中的CN-氧化成无毒的N2和CO2等,使水质得到净化:2CN-+8OH-+5Cl2===2CO2↑+N2↑+10Cl-+4H2O。某化学变式训练2 如图是某市污水处理的工艺流程示意图:(1)常用的凝聚剂可以是________(任填一种凝聚剂的名称)。
(2)加入熟石灰的目的是
_____________________________,
写出相关的化学方程式
_____________________________。
(3)加入Na2S的作用是
_____________________________。解析:本题考查污水处理的工艺流程,解答本题要认真读懂题所给图示,结合本节知识来回答。格栅间是用来除去大块物体,然后加入凝聚剂沉降水中悬浮物,然后加入熟石灰以除去溶液中的H+从而进入沉淀池,加入Na2S是为了除去溶液中的Hg2+等重金属离子使之沉降下来,最后达标排放。
答案:(1)明矾(其他合理答案均可)
(2)中和酸性废水 Ca(OH)2+2HCl===CaCl2+2H2O
(3)除去Hg2+等重金属离子探究整合应用饮用水的获取实验探究
【举例】 我国规定饮用水质量标准必须符合下列要求:(1)源水中含Ca2+、Mg2+、HCO、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个反应的离子方程式
_______________________________。(2)①凝聚剂除去悬浮固体颗粒的过程________(填写编号,下同)。
A.只是物理过程 B.只是化学过程
C.是物理和化学过程
②下列物质可以起到除去悬浮固体颗粒作用的是______。
A.铝盐 B.烧碱
C.黏土 D.纯碱
③FeSO4·7H2O也常用做凝聚剂,它在水中最终生成________沉淀。(3)通入二氧化碳的目的是________________和________________。
(4)气体A的作用是________。这种作用是基于气体A和水反应的产物具有________性。
(5)下列物质中,________可以作为气体A的代用品。
A.Ca(ClO)2 B.NH3(液)
C.K2FeO4 D.SO2
1.认识某些含氯化合物的杀菌消毒原理。
2.了解离子交换法、药剂法和加热法降低水硬度的原理。
3.了解污水治理的基本原理。
4.通过饮用水净化过程主要环节的化学知识,进一步掌握有关Mg2+、Ca2+、Al3+、Fe2+、Fe3+、Ca(HCO3)2和Mg(HCO3)2的性质等知识。
5.初步学习水处理中常用的沉降悬浮物,降低水的硬度等实验方法和操作技能。
6.通过学习本课题知识,增进学生保护水资源、防止水污染的意识,学会正确选择饮用水。 课堂互动讲练探究整合应用知能优化训练课题2
获取安全的饮用水课前自主学案课前自主学案一、天然水的净化
人类饮用的天然水中主要含有泥土、____________和__________等杂质,必须经过综合处理后才能达到饮用标准。可溶性物质致病细菌Al(OH)3胶体或
Fe(OH)3胶体常用絮凝剂还有________、镁盐和有机絮凝剂等。
(2)杀菌消毒
①实质:用_________或在______条件下使菌体蛋白质变性。
②常用杀菌消毒剂: ______、漂白粉、二氧化氯、高铁酸盐等。
2.城市自来水的获取
(1)策略:用便宜、有效的方法把天然水中的悬浮物、微生物及异味除去,但无须除去水中所有的矿物质。聚合铝强氧化剂高温氯气(2)步骤:根据图示写出主要步骤:自来水处理流程示意图思考感悟
1.明矾是如何净水的?
【提示】 明矾溶于水后电离出Al3+:KAl(SO4)2·12H2O===K++Al3++2SO+12H2O,水也能发生微弱电离,产生微量的OH-,H2O??H++OH-;Al3+能与水中的OH-结合成难电离的Al(OH)3,氢氧化铝在水中形成胶体,对水中细小的悬浮物有很强的吸附性,能沉降除去悬浮物,达到净水的目的。二、硬水的软化
1.水的硬度
(1)硬水:溶有较多Ca2+、Mg2+的水。
(2)软水:溶有少量或不含Ca2+、Mg2+的水。
(3)永久硬度:由钙和镁的硫酸盐或氯化物等引起的水的硬度。
(4)暂时硬度:由碳酸氢钙和碳酸氢镁引起的水的硬度。2.硬水的危害
(1)不能饮用——易引起肠胃不适、诱发疾病。
(2)不利于洗涤——浪费洗涤剂,引起衣物退色。
(3)不能用于锅炉——会使锅炉内壁结垢[主要成分CaCO3、Mg(OH)2],降低热效率,甚至引起爆炸。
3.硬水的软化
(1)硬水的软化:除去或减少天然水中Ca2+、Mg2+等的过程。(2)常用方法
①加热法
通过加热煮沸使暂时硬水所含钙、镁的酸式碳酸盐发生分解,主要化学反应原理是:
___________________________________;
___________________________________ ;
______________________________。②药剂法
通过加入适当化学药剂促使水中Ca2+、Mg2+以沉淀的形式从水中分离出来的方法。常用的化学药剂有_______、纯碱等,主要化学反应原理是:
Ca(HCO3)2+Ca(OH)2===2CaCO3↓+2H2O;
Mg(HCO3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2O;生石灰MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2;
CaCl2+Na2CO3===CaCO3↓+2NaCl。
③离子交换法
通过加入离子交换剂与水溶液交换同性电荷离子从而除去或减少不需要的离子,常用于工业锅炉用水的软化。
思考感悟
2.生活中鉴别硬水与软水常用的方法有哪些?
【提示】 方法1:取一杯热水,将肥皂切碎投入其中,肥皂能完全溶解,冷却后成为一种半透明液体,即为软水;若冷却后水面有一层未溶解的白色物质,则为硬水,且白色物质越多,硬度越大。
方法2:用烧杯盛水加热,若杯壁留下较多水垢,则为硬水。三、纯净水的制取方法
1.纯净水的制取方法
纯净水是以符合生活饮用水水质标准的水为原料,选用__________、 ____________、 __________、 ________等加工方法制得的。
2.纯净水的制取过程
电渗析法离子交换法反渗透法蒸馏法活性炭四、污水处理与环境保护
1.人为因素的水污染
主要是由工业废水、生活污水、农田排水以及降雨淋洗将大气中的污染物和堆积在地上的垃圾污染物冲入水中而引起的。2.活性污泥法二级处理工艺
(1)一级处理:在沉淀池中通过______除去污水中的固体沉淀物和悬浮物,再加入一定量的化学试剂中和污水中的______或______物质。
(2)二级处理:采用空气曝气活性污泥法,利用细菌等微生物除去废水中的有机污染物,使之变为______ 和________。
过滤酸性碱性CO2无机盐思考感悟
3.处理污水采取的方法和原理是什么?
【提示】
1.城市由天然水获取自来水的一般步骤为( )解析:选C。天然水变为自来水应先自然沉降和加絮凝剂沉降,使水中的固体杂质沉淀出,然后通过细砂、活性炭过滤,再曝气增加溶氧量,氧化、消除有机质,最后消毒成为自来水。2.下列方法不能用于对饮用水进行杀菌消毒的是
( )
A.加热煮沸 B.加入Ca(ClO)2
C.加入纯碱 D.加入ClO2
解析:选C。细菌主要由蛋白质构成,杀菌的实质是用强氧化剂或在高温条件下使菌体蛋白质变性,对少量水通常采用加热煮沸法来杀菌消毒,对大量水多采用氧化剂氧化法来杀菌消毒,故C项不正确。3.下列方法适宜软化永久硬水的是( )
A.离子交换法 B.加热煮沸
C.加入Na2SO4溶液 D.加入HCl溶液课堂互动讲练1.硬水软化的涵义
除去或减少天然水中的Ca2+、Mg2+等的过程,叫做硬水的软化。
2.硬水软化的方法
(1)加热法(详见课前自主学案)
(2)药剂法(详见课前自主学案)(3)离子交换法
①离子交换法软化硬水的涵义
离子交换法是采用离子交换剂软化水的一种方法。离子交换剂分阳离子交换剂和阴离子交换剂两类,它们在水溶液中能与具有同性电荷的离子进行交换,从而除去或减少不需要的离子。②用阳离子交换剂软化硬水的原理
工业上常用磺化煤等阳离子交换剂对锅炉用水进行软化。这些阳离子交换剂都具有复杂的结构,通常将它们的化学式简写为NaR。当硬水通过装有离子交换剂的装置时,发生如下的离子交换作用:
2NaR+Ca2+===CaR2+2Na+
2NaR+Mg2+===MgR2+2Na+
硬水中的Ca2+、Mg2+被离子交换剂吸附而除去,从装置中流出的水就成为软水。③离子交换剂的再生
离子交换剂因离子交换作用的不断进行而逐步丧失功能,因此需要在一定时间后进行再生。一般的再生方法是让高浓度的NaCl溶液通过离子交换剂,用Na+把离子交换剂吸附的Ca2+、Mg2+置换出来,从而恢复离子交换剂软化硬水的能力。离子交换剂再生的化学反应为:
CaR2+2Na+===2NaR+Ca2+
MgR2+2Na+===2NaR+Mg2+ 关于水的硬度,通常把由Ca2+、Mg2+的碳酸氢盐引起的硬度叫暂时硬度,而把Ca2+、Mg2+的硫酸盐或氯化物引起的硬度叫永久硬度。我国现行标准规定:1 L水含10 mg CaO(或相当于10 mg CaO)的硬度称为1度(以1°表示),硬度在8°以上的称为硬水,在8°以下的称为软水。经实验测定,某地的河水中含Ca(HCO3)2 2.500×10-3 mol/L、Mg(HCO3)2 3.000×10-3 mol/L。请回答下列问题:(1)该河水的硬度类型是________,硬度值是________。
(2)若将该河水直接做锅炉用水,主要危害是
____________________________。
(3)欲降低该河水的硬度,下列措施中有效的是(填写代号)________。
A.加热 B.加漂白粉
C.加高铁酸钾 D.加明矾【答案】 (1)暂时硬度 30.8°
(2)使锅炉结垢,降低热效率,浪费燃料,甚至引起锅炉爆炸 (3)A变式训练1 下列关于硬水及其软化的说法正确的是( )
A.所谓软水是不含Ca2+、Mg2+的水
B.石灰—纯碱法中石灰是指CaCO3
C.石灰—纯碱法软化硬水过程中,Mg2+引起的硬度转化成了Ca2+的硬度
D.离子交换剂不能再生解析:选C。软水是指不含或Ca2+、Mg2+含量较少的水;石灰——纯碱法中的“石灰”是指生石灰CaO,CaO加入水中与水反应生成Ca(OH)2,Ca(OH)2可以沉淀Mg2+;由Mg2++2OH-===Mg(OH)2↓知,Mg2+被除去的同时,溶液中又增加了等量的Ca2+,所以Mg2+的硬度转化成了Ca2+的硬度;将离子交换剂浸泡在饱和NaCl溶液中时,Na+把Ca2+、Mg2+交换下来,从而使离子交换剂恢复软化硬水的能力,故选C项。1.水体污染分类
(1)水体污染原因
引起水体污染的原因有两类:一类是自然因素造成的,如地下水流动把地层中某些矿物质溶解,使某些地区水中盐分、某些元素含量偏高或因动植物腐烂产生毒物而影响了当地的水质等;另一类是人为因素造成的,主要是工业排放的污水。此外,还包括生活污水、农田排水、降雨淋洗大气中的污染物以及堆积在大地上的垃圾经降雨淋洗流入水体中的污染物。(2)水体污染种类
重金属污染:主要来自化工、冶金、电子和电镀等行业排放的工业废水,它们能在体内积累,不宜排出体外。
植物营养物质污染:生活污水或者工业废水中含有大量的营养性元素,如K、N等。这些污水中物质在分解过程中会消耗水中溶解的氧,并释放出养分,使水中生物疯长,而引发“水华”“赤潮”现象。
其他污染:农药的广泛使用、石油外泄等对水体造成的污染。2.污水处理方法
污水处理方法一般可归纳为物理法、生物法和化学法。
(1)混凝法:混凝法就是通过加入混凝剂使难以自然沉降的悬浮物形成沉淀的污水处理方法。它属于物理方法,常见的混凝剂有:明矾、聚羟基氯化铝、聚丙烯酰胺等。
(2)中和法:对于酸性废水和碱性废水,可以采用中和法进行处理。一般用中和剂如熟石灰来中和钢铁厂、电镀厂等产生的酸性废水,用硫酸或者二氧化碳来中和碱性废水。其有关反应如下:Ca(OH)2+H2SO4===CaSO4↓+2H2O
H2SO4+2NaOH===Na2SO4+2H2O
2NaOH+CO2===Na2CO3+H2O
对于高浓度的酸、碱废水,应首先考虑回收利用,如采用浓缩的方法回收酸、碱等。
(3)沉淀法:沉淀法就是利用某些化学物质作为沉淀剂,与废水中的污染物(主要是重金属离子)发生化学反应,生成难溶于水的沉淀,从废水中分离出去。利用沉淀反应是除去水中重金属离子常用的方法。例如,向含有Hg2+的废水中加入Na2S可以使Hg2+转变为HgS沉淀而除去。用这种方法处理以后,污水中的Hg2+的浓度可以降低到几乎对人体无毒。(4)氧化还原法:利用氧化还原反应将废水中的有害物质转变为无毒物质、难溶性物质或易除去的物质,这是废水处理中的重要方法之一。
例如,氯氧化法处理含氰(CN-)废水是废水处理的一个典型实例。在碱性条件下,Cl2可将废水中的CN-氧化成无毒的N2和CO2等,使水质得到净化:2CN-+8OH-+5Cl2===2CO2↑+N2↑+10Cl-+4H2O。某化学变式训练2 如图是某市污水处理的工艺流程示意图:(1)常用的凝聚剂可以是________(任填一种凝聚剂的名称)。
(2)加入熟石灰的目的是
_____________________________,
写出相关的化学方程式
_____________________________。
(3)加入Na2S的作用是
_____________________________。解析:本题考查污水处理的工艺流程,解答本题要认真读懂题所给图示,结合本节知识来回答。格栅间是用来除去大块物体,然后加入凝聚剂沉降水中悬浮物,然后加入熟石灰以除去溶液中的H+从而进入沉淀池,加入Na2S是为了除去溶液中的Hg2+等重金属离子使之沉降下来,最后达标排放。
答案:(1)明矾(其他合理答案均可)
(2)中和酸性废水 Ca(OH)2+2HCl===CaCl2+2H2O
(3)除去Hg2+等重金属离子探究整合应用饮用水的获取实验探究
【举例】 我国规定饮用水质量标准必须符合下列要求:(1)源水中含Ca2+、Mg2+、HCO、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个反应的离子方程式
_______________________________。(2)①凝聚剂除去悬浮固体颗粒的过程________(填写编号,下同)。
A.只是物理过程 B.只是化学过程
C.是物理和化学过程
②下列物质可以起到除去悬浮固体颗粒作用的是______。
A.铝盐 B.烧碱
C.黏土 D.纯碱
③FeSO4·7H2O也常用做凝聚剂,它在水中最终生成________沉淀。(3)通入二氧化碳的目的是________________和________________。
(4)气体A的作用是________。这种作用是基于气体A和水反应的产物具有________性。
(5)下列物质中,________可以作为气体A的代用品。
A.Ca(ClO)2 B.NH3(液)
C.K2FeO4 D.SO2
