【志鸿原创课件】2013年高中化学选修一 化学与生活:主题3课题1 电池探秘(课件,鲁科版)
文档属性
| 名称 | 【志鸿原创课件】2013年高中化学选修一 化学与生活:主题3课题1 电池探秘(课件,鲁科版) |

|
|
| 格式 | zip | ||
| 文件大小 | 359.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-12-28 19:32:23 | ||
图片预览







文档简介
课件42张PPT。课题1 电池探秘学习目标
1.理解电池的工作原理和构成条件。
2.了解生活中常用电池的种类、性能,知道根据需要合理选择电池。
3.认识常用电池中发生的氧化还原反应。
4.学会电极反应式的书写。 课堂互动讲练探究整合应用知能优化训练课题1
电池探秘课前自主学案课前自主学案一、电池是怎样工作的
1.原电池的定义
利用__________反应将化学能转化成电能的装置。
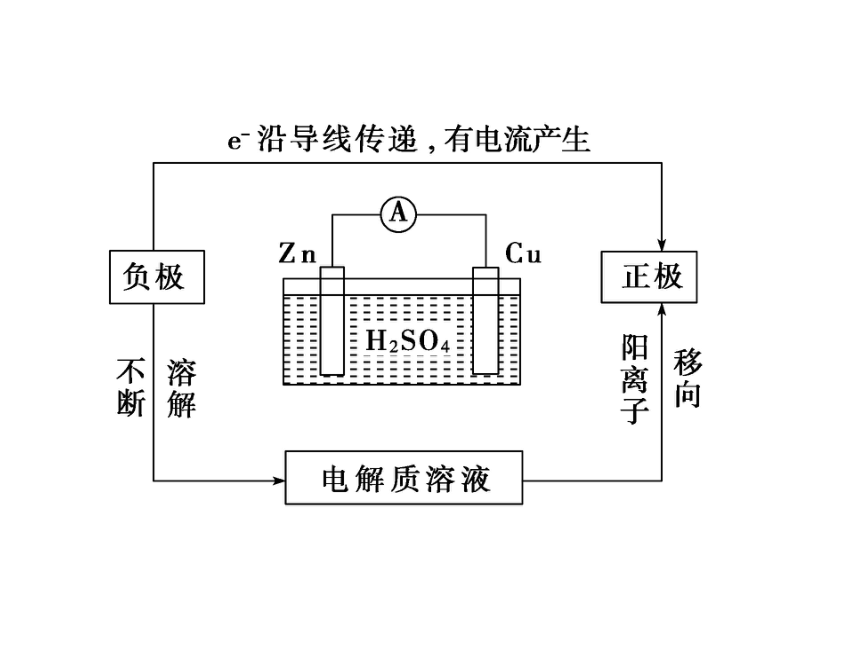
2.原电池的工作原理(以铜锌原电池为例)氧化还原(1)电子流向
___片失去电子,电子经导线流向___片,溶液中的H+从___片上得到电子被_____成氢原子,继而结合成氢分子进而聚集成氢气从___片上逸出。
(2)电极名称
负极:电子_____的电极,发生_____反应。
正极:电子_____的电极,发生______反应。锌铜铜还原铜流出氧化流入还原(3)电极反应式
负极:Zn→Zn2++2e-;
正极:2H++2e-→H2↑;
总反应式:Zn+2H+===Zn2++H2↑。
3.实质
(1)原电池产生电流的实质,是发生了自发的氧化还原反应。(2)电子由负极流向正极产生电流。
(3)原电池中有的电极材料直接参与反应,有的不参与反应, 只起_____作用。
4.实际应用
常见的纽扣电池以___做负极,以_______做正极,选用___________做电解质,发生的氧化还原反应为HgO+Zn+H2O===Zn(OH)2+Hg。导电锌氧化汞氢氧化钾思考感悟
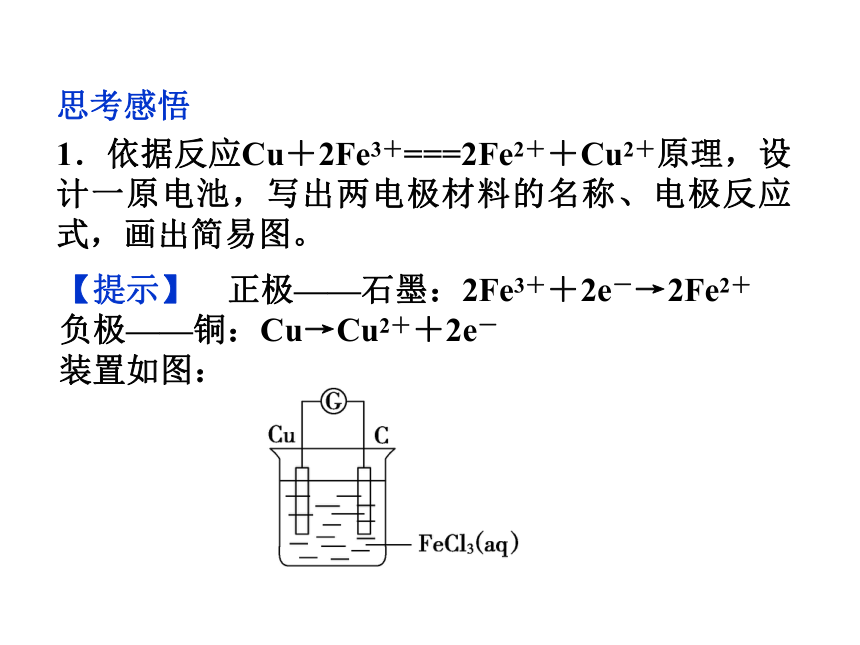
1.依据反应Cu+2Fe3+===2Fe2++Cu2+原理,设计一原电池,写出两电极材料的名称、电极反应式,画出简易图。【提示】 正极——石墨:2Fe3++2e-→2Fe2+
负极——铜:Cu→Cu2++2e-
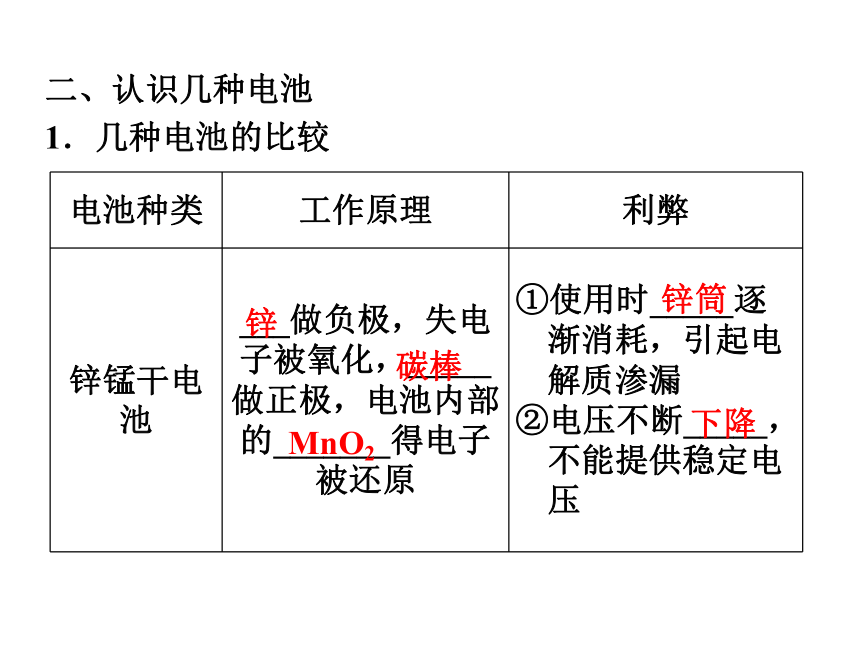
装置如图:二、认识几种电池
1.几种电池的比较碳棒MnO2锌筒下降锌Pb和PbO2浓度H2O2饮用水思考感悟
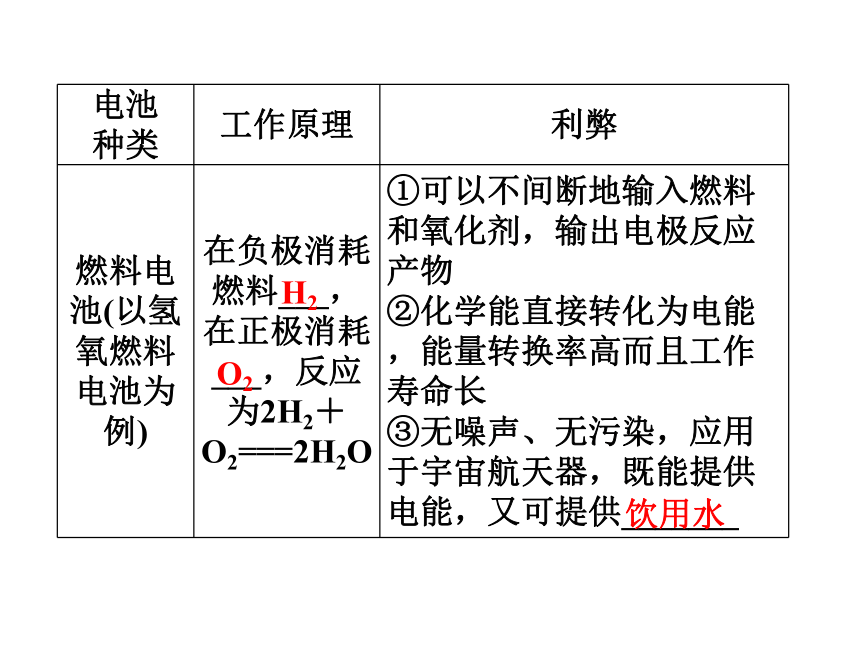
2.(1)氢氧燃料电池的主要优缺点是什么?
(2)对于氢氧燃料电池,当使用H2SO4做电解质或选用KOH做电解质时,所发生的电极反应与总反应一样吗?
【提示】 (1)①优点:能量转换率高,电池能长时间连续供电,污染小;②缺点:成本高,电池寿命较短。
(2)①选稀H2SO4做电解质溶液时:
正极:O2+4e-+4H+→2H2O;负极:2H2→4H++4e-;
电池反应:2H2+O2===2H2O。
②选KOH溶液做电解质溶液时:
正极:O2+2H2O+4e-→4OH-;
负极:2H2+4OH-→4H2O+4e-;
电池反应:2H2+O2===2H2O。
故选用不同电解质,电极反应不同而电池总反应相同。2.化学电池表示方法
(-)负极|电解质|正极(+)例如:
(1)铜锌原电池___________________
(2)锌锰干电池(-)Zn|NH4Cl,ZnCl2|MnO2,C(+)
(3)碱性锌锰电池(-)Zn|KOH|MnO2,C(+)
(4)锌汞纽扣电池(-)Zn|KOH|HgO,C(+)(-)Zn|H2SO4|Cu(+)(5)铅酸蓄电池(-)Pb|H2SO4|PbO2(+)
(6)________________ (-)Au,H2|KOH|O2,Au(+)
3.废旧电池污染的治理
(1)废旧电池必须_____。
(2)开发使用无污染或污染小的新型电池,如_____________。氢氧燃料电池回收太阳能电池1.下列装置能够组成原电池的是( )解析:选A。构成原电池要有四个基本条件:电解质溶液、两种活泼性不同的电极并插入电解质溶液中、构成闭合回路、可以自发进行氧化还原反应。四个条件相互联系,不能孤立。B项中电极均为Cu,D项中所用乙醇为非电解质,C项中所用蔗糖溶液是非电解质溶液,故B、C、D项都不能构成原电池。2.原电池的正极一定是( )
A.电子流出的一极
B.电子流入的一极
C.发生氧化反应的一极
D.电极自身参与反应的一极
解析:选B。电子流出的一极为负极;电子流入的一极为正极;发生氧化反应的一极为负极;有的原电池的正极自身不参与反应,如燃料电池、铜锌原电池等,有的原电池的正极自身参与反应,如铅酸蓄电池,故选B项。课堂互动讲练1.原电池正负极的判断方法
原电池有两个电极,一个是正极,一个是负极,判断正极和负极的方法是:
(1)由组成原电池两极的电极材料判断。一般是活泼性强的金属为负极,活泼性较弱的金属或能导电的非金属为正极。特别提醒:判断原电池正负极时,不要盲目根据活泼金属做负极去判断,必要时根据正负极上发生的反应进行判断。
(2)根据电流方向或电子流动方向判断。电流是由正极流向负极;电子流动方向是由负极流向正极。
(3)根据原电池里电解质溶液中离子的定向移动方向判断。在原电池的电解质溶液中,阳离子移向的极是正极,阴离子移向的极是负极。(4)根据原电池两极发生的变化来判断。原电池的负极总是失电子发生氧化反应,其正极总是得电子发生还原反应。
(5)依据现象判断。溶解的一极为负极,增重或者有气体放出的一极为正极。
2.原电池电极反应式的书写
原电池反应的实质是自发的氧化还原反应,因此书写时:(1)先判断出正负极。正极上发生还原反应,负极上发生氧化反应,根据氧化还原反应原理进行书写。但要注意介质环境。
(2)可以先写出总反应方程式。然后减去某一极的电极反应式就可以得到另一极的电极反应式。 如图是一种原电池。试回答下列问题(灯泡功率合适):
(1)电解质溶液为稀H2SO4时,灯泡__________(填“亮”或“不亮”)。若灯泡亮,则负极是________极,电极反应式是________________________________________________________________________;正极上的电极反应式是________________________________________________________________________。
(2)电解质溶液为NaOH溶液时,灯泡________(填“亮”或“不亮”)。若灯泡亮,则负极是________极,电极反应式是
________________________________________________________________________。【解析】 (1)、(2)两种情况都具备了形成原电池的条件:两电极金属的活动性不同,有电极与电解质溶液之间发生的氧化还原反应。当电解质溶液为酸溶液时,Mg比Al活泼,Mg做原电池的负极,失去电子变为Mg2+,Al做原电池的正极,电子由镁片流向铝片。正极上H+得电子变为H2。
当电解质溶液为碱溶液时,Al与碱反应:
2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑而Mg与碱不反应,所以Al做原电池的负极,负极上Al失去电子,失去的电子流向正极。Mg做正极,正极上H+得电子变成H2。
【答案】 (1)亮 Mg
Mg→Mg2++2e- 2H++2e-→H2↑
(2)亮 Al
Al→Al3++3e-;Al3++4OH-→[Al(OH)4]-【规律方法】 两种活动性不同的金属电极与电解质溶液形成原电池时,较活泼的金属不一定做负极,如本题(2)中做负极的是相对不活泼的铝。变式训练 如图所示,电流表 指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液。则A、B、C分别可以为( )A.A是Zn,B是Cu,C是稀硫酸
B.A是Cu,B是Zn,C是稀硫酸
C.A是Fe,B是Ag,C是稀AgNO3溶液
D.A是Ag,B是Fe,C是稀AgNO3溶液
解析:选D。探究整合应用常见几种化学电源的工作原理
【举例】 根据生产和生活的需要,人们研究和制造了多种电池,如锌锰干电池、铅蓄电池、氢氧燃料电池等。试回答:③当电池快用完时,需要及时将电池取出,原因是
________________________________________________________________________。
(2)铅蓄电池用途极广,可多次充、放电。铅蓄电池放电时发生的反应:Pb+PbO2+2H2SO4===2PbSO4+2H2O。
①放电一段时间后,电解质溶液的酸碱性变化是______________。②充电时铅蓄电池发生的反应________________________________________________________________________,
此时电池中硫酸浓度不断________(填“增大”或“减小”)。
③充电时电极的连接情况是:外接电源的正极接蓄电池的________,外接电源的负极接蓄电池的________。(3)氢氧燃料电池是新型电池,具有能量转换率高且工作寿命长的特点。其负极反应物是__________,正极反应物是________,电池反应是________________________________________________________________________。
应用在宇宙航天器中,既能提供电能,又能为宇航员提供________。当电池快用完时,锌筒由于被消耗容易导致电解质溶液渗漏而腐蚀所用仪器设备。
(2)铅蓄电池的充电反应与放电反应是相反的过程,发生的化学变化也是相反的,即2PbSO4+2H2O ===Pb+PbO2+2H2SO4,由充电反应可知硫酸浓度不断增大,而放电时由于H2SO4不断被消耗导致酸性减弱。蓄电池充电时,电极应相对应,即蓄电池的正极与负极分别与外接电源的正、负极相连。(3)氢氧燃料电池利用的是H2与O2发生的氧化还原反应即2H2+O2===2H2O,分析反应方程式H2失电子应做负极反应物,而O2应得电子发生还原反应,做正极反应物。由于反应生成水,氢氧燃料电池在把化学能转化为电能提供电能的同时,还能提供水。【答案】 (1)①Zn→Zn2++2e-
②产生的H2无法吸收,破坏了干电池,使其无法稳定工作
③锌筒由于被消耗容易导致电解质溶液渗漏而腐蚀仪器设备
(2)①酸性降低
②2PbSO4+2H2O===Pb+PbO2+2H2SO4 增大
③正极 负极
(3)H2 O2 2H2+O2===2H2O 饮用水
1.理解电池的工作原理和构成条件。
2.了解生活中常用电池的种类、性能,知道根据需要合理选择电池。
3.认识常用电池中发生的氧化还原反应。
4.学会电极反应式的书写。 课堂互动讲练探究整合应用知能优化训练课题1
电池探秘课前自主学案课前自主学案一、电池是怎样工作的
1.原电池的定义
利用__________反应将化学能转化成电能的装置。
2.原电池的工作原理(以铜锌原电池为例)氧化还原(1)电子流向
___片失去电子,电子经导线流向___片,溶液中的H+从___片上得到电子被_____成氢原子,继而结合成氢分子进而聚集成氢气从___片上逸出。
(2)电极名称
负极:电子_____的电极,发生_____反应。
正极:电子_____的电极,发生______反应。锌铜铜还原铜流出氧化流入还原(3)电极反应式
负极:Zn→Zn2++2e-;
正极:2H++2e-→H2↑;
总反应式:Zn+2H+===Zn2++H2↑。
3.实质
(1)原电池产生电流的实质,是发生了自发的氧化还原反应。(2)电子由负极流向正极产生电流。
(3)原电池中有的电极材料直接参与反应,有的不参与反应, 只起_____作用。
4.实际应用
常见的纽扣电池以___做负极,以_______做正极,选用___________做电解质,发生的氧化还原反应为HgO+Zn+H2O===Zn(OH)2+Hg。导电锌氧化汞氢氧化钾思考感悟
1.依据反应Cu+2Fe3+===2Fe2++Cu2+原理,设计一原电池,写出两电极材料的名称、电极反应式,画出简易图。【提示】 正极——石墨:2Fe3++2e-→2Fe2+
负极——铜:Cu→Cu2++2e-
装置如图:二、认识几种电池
1.几种电池的比较碳棒MnO2锌筒下降锌Pb和PbO2浓度H2O2饮用水思考感悟
2.(1)氢氧燃料电池的主要优缺点是什么?
(2)对于氢氧燃料电池,当使用H2SO4做电解质或选用KOH做电解质时,所发生的电极反应与总反应一样吗?
【提示】 (1)①优点:能量转换率高,电池能长时间连续供电,污染小;②缺点:成本高,电池寿命较短。
(2)①选稀H2SO4做电解质溶液时:
正极:O2+4e-+4H+→2H2O;负极:2H2→4H++4e-;
电池反应:2H2+O2===2H2O。
②选KOH溶液做电解质溶液时:
正极:O2+2H2O+4e-→4OH-;
负极:2H2+4OH-→4H2O+4e-;
电池反应:2H2+O2===2H2O。
故选用不同电解质,电极反应不同而电池总反应相同。2.化学电池表示方法
(-)负极|电解质|正极(+)例如:
(1)铜锌原电池___________________
(2)锌锰干电池(-)Zn|NH4Cl,ZnCl2|MnO2,C(+)
(3)碱性锌锰电池(-)Zn|KOH|MnO2,C(+)
(4)锌汞纽扣电池(-)Zn|KOH|HgO,C(+)(-)Zn|H2SO4|Cu(+)(5)铅酸蓄电池(-)Pb|H2SO4|PbO2(+)
(6)________________ (-)Au,H2|KOH|O2,Au(+)
3.废旧电池污染的治理
(1)废旧电池必须_____。
(2)开发使用无污染或污染小的新型电池,如_____________。氢氧燃料电池回收太阳能电池1.下列装置能够组成原电池的是( )解析:选A。构成原电池要有四个基本条件:电解质溶液、两种活泼性不同的电极并插入电解质溶液中、构成闭合回路、可以自发进行氧化还原反应。四个条件相互联系,不能孤立。B项中电极均为Cu,D项中所用乙醇为非电解质,C项中所用蔗糖溶液是非电解质溶液,故B、C、D项都不能构成原电池。2.原电池的正极一定是( )
A.电子流出的一极
B.电子流入的一极
C.发生氧化反应的一极
D.电极自身参与反应的一极
解析:选B。电子流出的一极为负极;电子流入的一极为正极;发生氧化反应的一极为负极;有的原电池的正极自身不参与反应,如燃料电池、铜锌原电池等,有的原电池的正极自身参与反应,如铅酸蓄电池,故选B项。课堂互动讲练1.原电池正负极的判断方法
原电池有两个电极,一个是正极,一个是负极,判断正极和负极的方法是:
(1)由组成原电池两极的电极材料判断。一般是活泼性强的金属为负极,活泼性较弱的金属或能导电的非金属为正极。特别提醒:判断原电池正负极时,不要盲目根据活泼金属做负极去判断,必要时根据正负极上发生的反应进行判断。
(2)根据电流方向或电子流动方向判断。电流是由正极流向负极;电子流动方向是由负极流向正极。
(3)根据原电池里电解质溶液中离子的定向移动方向判断。在原电池的电解质溶液中,阳离子移向的极是正极,阴离子移向的极是负极。(4)根据原电池两极发生的变化来判断。原电池的负极总是失电子发生氧化反应,其正极总是得电子发生还原反应。
(5)依据现象判断。溶解的一极为负极,增重或者有气体放出的一极为正极。
2.原电池电极反应式的书写
原电池反应的实质是自发的氧化还原反应,因此书写时:(1)先判断出正负极。正极上发生还原反应,负极上发生氧化反应,根据氧化还原反应原理进行书写。但要注意介质环境。
(2)可以先写出总反应方程式。然后减去某一极的电极反应式就可以得到另一极的电极反应式。 如图是一种原电池。试回答下列问题(灯泡功率合适):
(1)电解质溶液为稀H2SO4时,灯泡__________(填“亮”或“不亮”)。若灯泡亮,则负极是________极,电极反应式是________________________________________________________________________;正极上的电极反应式是________________________________________________________________________。
(2)电解质溶液为NaOH溶液时,灯泡________(填“亮”或“不亮”)。若灯泡亮,则负极是________极,电极反应式是
________________________________________________________________________。【解析】 (1)、(2)两种情况都具备了形成原电池的条件:两电极金属的活动性不同,有电极与电解质溶液之间发生的氧化还原反应。当电解质溶液为酸溶液时,Mg比Al活泼,Mg做原电池的负极,失去电子变为Mg2+,Al做原电池的正极,电子由镁片流向铝片。正极上H+得电子变为H2。
当电解质溶液为碱溶液时,Al与碱反应:
2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑而Mg与碱不反应,所以Al做原电池的负极,负极上Al失去电子,失去的电子流向正极。Mg做正极,正极上H+得电子变成H2。
【答案】 (1)亮 Mg
Mg→Mg2++2e- 2H++2e-→H2↑
(2)亮 Al
Al→Al3++3e-;Al3++4OH-→[Al(OH)4]-【规律方法】 两种活动性不同的金属电极与电解质溶液形成原电池时,较活泼的金属不一定做负极,如本题(2)中做负极的是相对不活泼的铝。变式训练 如图所示,电流表 指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液。则A、B、C分别可以为( )A.A是Zn,B是Cu,C是稀硫酸
B.A是Cu,B是Zn,C是稀硫酸
C.A是Fe,B是Ag,C是稀AgNO3溶液
D.A是Ag,B是Fe,C是稀AgNO3溶液
解析:选D。探究整合应用常见几种化学电源的工作原理
【举例】 根据生产和生活的需要,人们研究和制造了多种电池,如锌锰干电池、铅蓄电池、氢氧燃料电池等。试回答:③当电池快用完时,需要及时将电池取出,原因是
________________________________________________________________________。
(2)铅蓄电池用途极广,可多次充、放电。铅蓄电池放电时发生的反应:Pb+PbO2+2H2SO4===2PbSO4+2H2O。
①放电一段时间后,电解质溶液的酸碱性变化是______________。②充电时铅蓄电池发生的反应________________________________________________________________________,
此时电池中硫酸浓度不断________(填“增大”或“减小”)。
③充电时电极的连接情况是:外接电源的正极接蓄电池的________,外接电源的负极接蓄电池的________。(3)氢氧燃料电池是新型电池,具有能量转换率高且工作寿命长的特点。其负极反应物是__________,正极反应物是________,电池反应是________________________________________________________________________。
应用在宇宙航天器中,既能提供电能,又能为宇航员提供________。当电池快用完时,锌筒由于被消耗容易导致电解质溶液渗漏而腐蚀所用仪器设备。
(2)铅蓄电池的充电反应与放电反应是相反的过程,发生的化学变化也是相反的,即2PbSO4+2H2O ===Pb+PbO2+2H2SO4,由充电反应可知硫酸浓度不断增大,而放电时由于H2SO4不断被消耗导致酸性减弱。蓄电池充电时,电极应相对应,即蓄电池的正极与负极分别与外接电源的正、负极相连。(3)氢氧燃料电池利用的是H2与O2发生的氧化还原反应即2H2+O2===2H2O,分析反应方程式H2失电子应做负极反应物,而O2应得电子发生还原反应,做正极反应物。由于反应生成水,氢氧燃料电池在把化学能转化为电能提供电能的同时,还能提供水。【答案】 (1)①Zn→Zn2++2e-
②产生的H2无法吸收,破坏了干电池,使其无法稳定工作
③锌筒由于被消耗容易导致电解质溶液渗漏而腐蚀仪器设备
(2)①酸性降低
②2PbSO4+2H2O===Pb+PbO2+2H2SO4 增大
③正极 负极
(3)H2 O2 2H2+O2===2H2O 饮用水
