【志鸿原创课件】2013年高中化学选修一 化学与生活:主题4课题4 金属制品的防护(课件,鲁科版)
文档属性
| 名称 | 【志鸿原创课件】2013年高中化学选修一 化学与生活:主题4课题4 金属制品的防护(课件,鲁科版) |

|
|
| 格式 | zip | ||
| 文件大小 | 380.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-12-28 19:36:19 | ||
图片预览









文档简介
课件35张PPT。课题4 金属制品的防护学习目标
1.探究金属腐蚀的化学原理,知道金属防腐蚀的方法。
2.理解原电池的工作原理,加深对金属化学性质的理解。
3.从金属腐蚀原理到解决防腐蚀方法,培养学生分析并解决实际问题的能力。 课堂互动讲练探究整合应用知能优化训练课题4
金属制品的防护课前自主学案课前自主学案一、自行车金属部件为什么易被腐蚀
1.电化学腐蚀
(1)定义
金属在有______________存在的情况下通过_________反应发生的腐蚀。电解质溶液原电池(2)钢铁的电化学腐蚀(以吸氧腐蚀为例)
①电极反应式:
负极:2Fe→2Fe2++4e-;
正极:2H2O+O2+4e-→4OH-。
②电池反应:2Fe+2H2O+O2===2Fe(OH)2。
③铁锈的形成:(用化学方程式表示)
Fe(OH)2不稳定,在空气中进一步被氧化4Fe(OH)2+O2+2H2O===4Fe(OH)3。
氢氧化铁分解生成____色的______________,即铁锈的主要成分:
红三氧化二铁2.化学腐蚀
金属与__________直接接触而被腐蚀的过程。
3.金属腐蚀的本质
无论是电化学腐蚀,还是化学腐蚀,其本质都是金属原子____________变成金属阳离子,可用通式表示为:
___________________。氧化剂失去电子M→Mn++ne-思考感悟
1.影响金属腐蚀的因素有哪些?
【提示】 (1)金属的性质 金属越活泼,就越容易失去电子而被腐蚀,如果金属中能导电的杂质不如该金属活泼,则容易形成原电池而使金属发生电化学腐蚀。
(2)介质 活泼金属在强电解质溶液中腐蚀较快。
(3)氧化剂 氧化剂的氧化性越强,金属腐蚀的越快。
二、自行车金属部件的防腐蚀
1.给车架、挡泥板、车后座_______________;
2.给链条涂上_________,给轴承涂上_________;
3.将车把、车圈、车辐条进行________;
4.将车座弹簧用一层________保护。
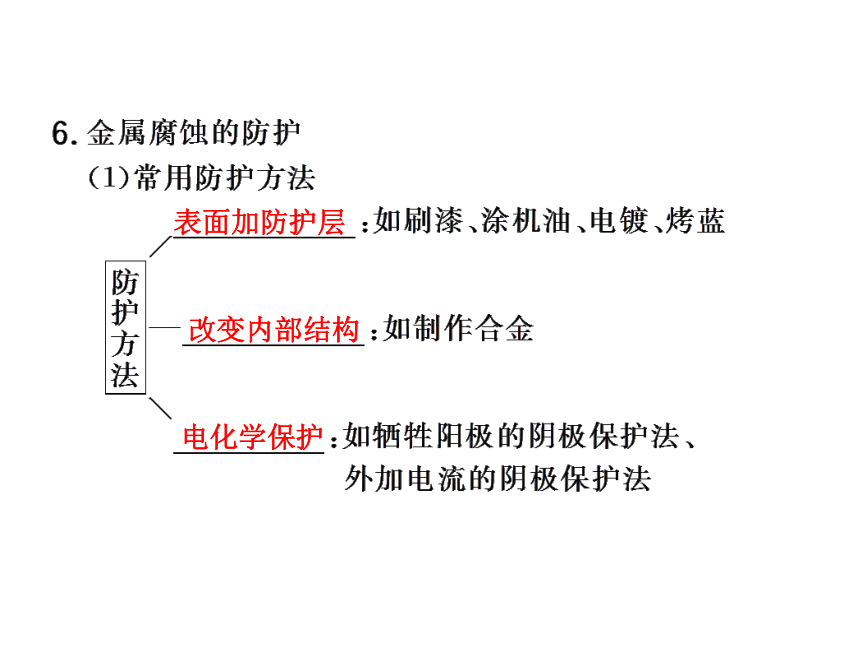
5.采用______做自行车的零部件。烤上一层漆机油凡士林电镀“烤蓝”合金表面加防护层改变内部结构电化学保护(2)电化学保护
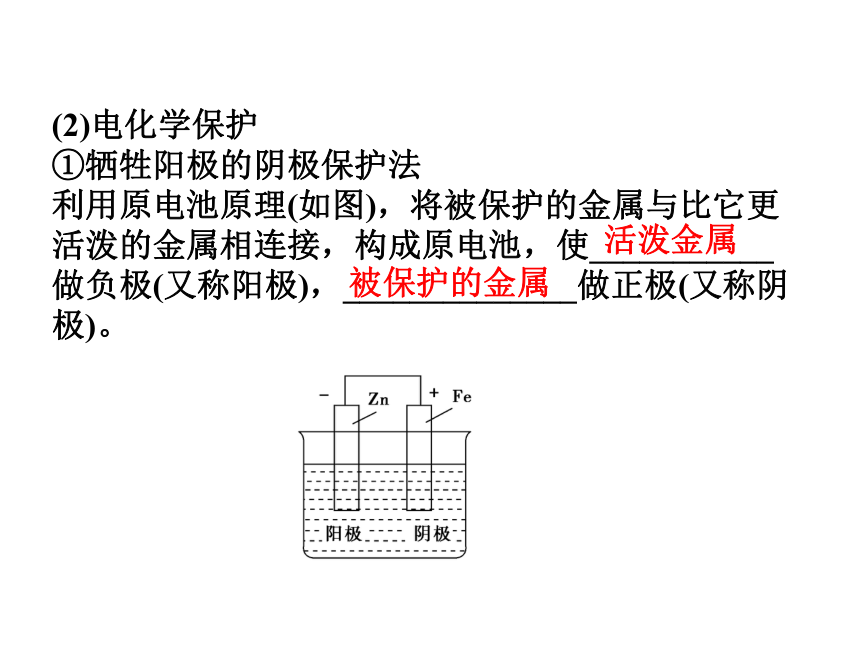
①牺牲阳极的阴极保护法
利用原电池原理(如图),将被保护的金属与比它更活泼的金属相连接,构成原电池,使___________做负极(又称阳极),______________做正极(又称阴极)。活泼金属被保护的金属②外加电流的阴极保护法
将被保护的金属与外加直流电源_______相连做阴极,用能导电的惰性材料与电源_______相连做阳极,以防止被保护金属氧化。负极正极思考感悟
2.何谓“烤蓝”?有何作用?
【提示】 “烤蓝”又称“发蓝”,也是一种常见的铁器表面处理方法。它可以使铁器表面生成一层致密的Fe3O4薄膜,增强铁器件的抗腐蚀能力。铁器件“烤蓝”要使用发蓝液。其方法是:将铁放入50 g NaOH、10 g NaNO3、3 g NaNO2及100 mL 水所得到的溶液中,加热煮沸20 min,用水洗净,即看到有Fe3O4保护层生成。其原理是利用Fe在碱性溶液中更容易被一些并不强的氧化剂氧化生成钝化膜。三、自行车中的合金材料
1.定义:合金是由金属与其他金属或非金属熔合而成的具有金属特性的物质。通过调节合金中元素的种类和含量,可以使合金具有特殊的性质。例如,常用的钢铁材料是铁的合金,黄铜是铜锌合金,青铜是铜锡合金。
2.自行车使用最多的是钢车架(铁合金),高强度的铁合金可以做成较薄的管材,使得整体车架变轻。但是铁合金具有笨重、易腐蚀的缺点。3.自行车的车圈、车把、车架等受力构件选用铝合金,铝合金质轻,而且成本低、易加工、机械性高,应用范围相当广范。此外,铝合金具有高度的散热性,可用做散热材料,还可以用铝合金制成各种装饰品。
4.钛合金是广泛运用于航空航天技术领域的高性能材料。重量轻、强度高、韧性好、耐腐蚀是钛合金最显著的特点。可用钛合金制造自行车车架。
5.镁合金被称作21世纪的绿色工程材料。镁合金具有质轻的突出优点,在增强交通工具的架构强度、减轻重量、增强安全性、节约能源、抗冲击与振动等方面也具有优势,镁合金材料已大量应用于自行车前叉、踏板零组件的制造,在自行车车架、轮圈、齿轮盘、刹车零组件等的制造方面镁合金材料也有所应用。1.以下现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗解析:选D。选项中的黄铜是铜锌合金,可以构成原电池,但铜没有锌活泼,被腐蚀的是锌而不是铜,所以不易产生铜绿;选项B中生铁是铁碳合金,可以构成原电池而使铁腐蚀生锈,软铁芯几乎是纯铁,不构成原电池;选项C中铁与铜接触构成原电池,铁比铜活泼,铁腐蚀成铁锈;选项D中银质奖章是由较纯的银制成的,不构成原电池,久置后变暗是跟空气中的多种物质起反应造成的。2.相同材质的铁在下列情形下最不易被腐蚀的是( )解析:选C。A、B、D项都因原电池原理而被腐蚀,A、D项是析氢腐蚀,B项是吸氧腐蚀,C项中铁球被Cu保护,不易腐蚀。3.下列各种方法中:①金属表面涂抹油漆 ②改变金属内部结构 ③保持金属表面清洁干燥 ④在金属表面进行电镀 ⑤使金属表面形成致密的氧化物薄膜,能对金属起到防护或减缓腐蚀作用的是( )
A.①②③④ B.①③④⑤
C.①②④⑤ D.全部
解析:选D。金属腐蚀的防护方法有加保护层,如①④⑤。改变内部结构,加入某种金属制成合金,如②。由于化学腐蚀比电化学腐蚀慢,保持表面清洁干燥可防止电化学腐蚀的发生,如③。课堂互动讲练金属腐蚀绝大多数属于电化学腐蚀,电化学腐蚀通常有析氢腐蚀和吸氧腐蚀两种,这两种腐蚀主要差异体现在正极反应上。特别提醒:由于金属表面一般不会遇到酸性较强的溶液,故吸氧腐蚀是金属腐蚀的主要形式,但在某些地方由于酸雨的形成,金属腐蚀以析氢腐蚀为主。
只有在金属活动性顺序中位于氢前面的金属才可能发生析氢腐蚀,而位于氢以后的金属腐蚀时,只能是吸氧腐蚀,如铁锈的形成,铜绿的形成就属于吸氧腐蚀。其中铜绿形成原理为: 下列有关钢铁腐蚀与防护的说法正确的是( )
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-===Fe3+【解析】 钢管与电源正极连接,作电解池的阳极,被氧化而腐蚀,A项错;铁在冷浓硝酸中表面生成一层致密的氧化物保护膜,从而保护内部不被腐蚀,B项正确,钢管与铜管堆放一起时,构成原电池,钢管作负极而易被腐蚀,C项错;钢铁发生析氢腐蚀时,负极反应:Fe-2e-===Fe2+,D项错。【答案】B
【规律方法】 本题主要考查金属腐蚀及防护的知识,尤其是电化学腐蚀知识,体现了化学与日常生活密切相关的特点。变式训练 下列说法正确的是(双选)( )
A.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
B.原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀
C.钢铁电化学腐蚀的两种类型主要区别在于水膜的pH不同,引起的正极反应相同
D.无论哪种类型的腐蚀,其实质都是金属被氧化解析:选CD。本题考查金属的腐蚀实质和类型。金属的腐蚀就是金属失电子而被氧化的过程。依据电化学腐蚀中析氢腐蚀和吸氧腐蚀的原理可知,吸氧腐蚀正极反应为O2+2H2O+4e-→4OH-,析氢腐蚀中正极反应式为2H++2e-→H2↑。原电池反应既可以加快金属的腐蚀,也可用以防止金属的腐蚀,例如镀锌铁等。 探究整合应用金属腐蚀的影响因素实验探究
【举例】 全世界每年因生锈损失的钢铁约占世界钢铁年产量的1/4。某学生想探究铁生锈的条件,他将干净的铁钉分别同时放入A、B、C三支试管中进行研究。(1)请你帮助该学生完成下列实验设计的内容:(2)一周后,编号为________的试管中的铁钉最易生锈。
(3)用相同材料制作,经过相同时间防锈处理的铁栏杆,安装在南方比安装在北方更易生锈,其原因是_____________________________。(4)在焊接铁管时,为了使接口更加牢固,常用稀盐酸清洗接口处的铁锈,该反应的化学方程式为________________________。下列物质的用途,利用氧化还原反应原理解释的是________。
A.用明矾净水
B.用稀盐酸除去热水瓶胆壁上的水垢
C.水厂用氯气消毒自来水
D.用酵母蒸馒头某铁合金与铁的物理性质的比较如下表所示:
又知该铁合金耐腐蚀,强度大,从以上性能看,该铁合金不适合用做________。
A.导线 B.门窗框
C.炉具 D.飞机外壳【解析】 通过对比实验,探究铁生锈的条件,(1)与空气接触(2)与电解质溶液接触。南方空气湿度大且雨水多,故钢铁比干燥的北方更易生锈。用盐酸清洗铁锈是Fe2O3与盐酸的反应。自来水消毒过程是Cl2与水反应生成的HClO具有强氧化性可消毒,杀菌。结合表中数据,该铁合金导电性较差,不易导电不可用做导线。
【答案】 (1)把铁钉放入干燥环境中 探究铁钉在有水无空气时的生锈情况 放入铁钉,注入少量蒸馏水(2)C (3)南方多雨,潮湿空气里铁更易生锈(4)Fe2O3+6HCl===2FeCl3+3H2O C A
1.探究金属腐蚀的化学原理,知道金属防腐蚀的方法。
2.理解原电池的工作原理,加深对金属化学性质的理解。
3.从金属腐蚀原理到解决防腐蚀方法,培养学生分析并解决实际问题的能力。 课堂互动讲练探究整合应用知能优化训练课题4
金属制品的防护课前自主学案课前自主学案一、自行车金属部件为什么易被腐蚀
1.电化学腐蚀
(1)定义
金属在有______________存在的情况下通过_________反应发生的腐蚀。电解质溶液原电池(2)钢铁的电化学腐蚀(以吸氧腐蚀为例)
①电极反应式:
负极:2Fe→2Fe2++4e-;
正极:2H2O+O2+4e-→4OH-。
②电池反应:2Fe+2H2O+O2===2Fe(OH)2。
③铁锈的形成:(用化学方程式表示)
Fe(OH)2不稳定,在空气中进一步被氧化4Fe(OH)2+O2+2H2O===4Fe(OH)3。
氢氧化铁分解生成____色的______________,即铁锈的主要成分:
红三氧化二铁2.化学腐蚀
金属与__________直接接触而被腐蚀的过程。
3.金属腐蚀的本质
无论是电化学腐蚀,还是化学腐蚀,其本质都是金属原子____________变成金属阳离子,可用通式表示为:
___________________。氧化剂失去电子M→Mn++ne-思考感悟
1.影响金属腐蚀的因素有哪些?
【提示】 (1)金属的性质 金属越活泼,就越容易失去电子而被腐蚀,如果金属中能导电的杂质不如该金属活泼,则容易形成原电池而使金属发生电化学腐蚀。
(2)介质 活泼金属在强电解质溶液中腐蚀较快。
(3)氧化剂 氧化剂的氧化性越强,金属腐蚀的越快。
二、自行车金属部件的防腐蚀
1.给车架、挡泥板、车后座_______________;
2.给链条涂上_________,给轴承涂上_________;
3.将车把、车圈、车辐条进行________;
4.将车座弹簧用一层________保护。
5.采用______做自行车的零部件。烤上一层漆机油凡士林电镀“烤蓝”合金表面加防护层改变内部结构电化学保护(2)电化学保护
①牺牲阳极的阴极保护法
利用原电池原理(如图),将被保护的金属与比它更活泼的金属相连接,构成原电池,使___________做负极(又称阳极),______________做正极(又称阴极)。活泼金属被保护的金属②外加电流的阴极保护法
将被保护的金属与外加直流电源_______相连做阴极,用能导电的惰性材料与电源_______相连做阳极,以防止被保护金属氧化。负极正极思考感悟
2.何谓“烤蓝”?有何作用?
【提示】 “烤蓝”又称“发蓝”,也是一种常见的铁器表面处理方法。它可以使铁器表面生成一层致密的Fe3O4薄膜,增强铁器件的抗腐蚀能力。铁器件“烤蓝”要使用发蓝液。其方法是:将铁放入50 g NaOH、10 g NaNO3、3 g NaNO2及100 mL 水所得到的溶液中,加热煮沸20 min,用水洗净,即看到有Fe3O4保护层生成。其原理是利用Fe在碱性溶液中更容易被一些并不强的氧化剂氧化生成钝化膜。三、自行车中的合金材料
1.定义:合金是由金属与其他金属或非金属熔合而成的具有金属特性的物质。通过调节合金中元素的种类和含量,可以使合金具有特殊的性质。例如,常用的钢铁材料是铁的合金,黄铜是铜锌合金,青铜是铜锡合金。
2.自行车使用最多的是钢车架(铁合金),高强度的铁合金可以做成较薄的管材,使得整体车架变轻。但是铁合金具有笨重、易腐蚀的缺点。3.自行车的车圈、车把、车架等受力构件选用铝合金,铝合金质轻,而且成本低、易加工、机械性高,应用范围相当广范。此外,铝合金具有高度的散热性,可用做散热材料,还可以用铝合金制成各种装饰品。
4.钛合金是广泛运用于航空航天技术领域的高性能材料。重量轻、强度高、韧性好、耐腐蚀是钛合金最显著的特点。可用钛合金制造自行车车架。
5.镁合金被称作21世纪的绿色工程材料。镁合金具有质轻的突出优点,在增强交通工具的架构强度、减轻重量、增强安全性、节约能源、抗冲击与振动等方面也具有优势,镁合金材料已大量应用于自行车前叉、踏板零组件的制造,在自行车车架、轮圈、齿轮盘、刹车零组件等的制造方面镁合金材料也有所应用。1.以下现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗解析:选D。选项中的黄铜是铜锌合金,可以构成原电池,但铜没有锌活泼,被腐蚀的是锌而不是铜,所以不易产生铜绿;选项B中生铁是铁碳合金,可以构成原电池而使铁腐蚀生锈,软铁芯几乎是纯铁,不构成原电池;选项C中铁与铜接触构成原电池,铁比铜活泼,铁腐蚀成铁锈;选项D中银质奖章是由较纯的银制成的,不构成原电池,久置后变暗是跟空气中的多种物质起反应造成的。2.相同材质的铁在下列情形下最不易被腐蚀的是( )解析:选C。A、B、D项都因原电池原理而被腐蚀,A、D项是析氢腐蚀,B项是吸氧腐蚀,C项中铁球被Cu保护,不易腐蚀。3.下列各种方法中:①金属表面涂抹油漆 ②改变金属内部结构 ③保持金属表面清洁干燥 ④在金属表面进行电镀 ⑤使金属表面形成致密的氧化物薄膜,能对金属起到防护或减缓腐蚀作用的是( )
A.①②③④ B.①③④⑤
C.①②④⑤ D.全部
解析:选D。金属腐蚀的防护方法有加保护层,如①④⑤。改变内部结构,加入某种金属制成合金,如②。由于化学腐蚀比电化学腐蚀慢,保持表面清洁干燥可防止电化学腐蚀的发生,如③。课堂互动讲练金属腐蚀绝大多数属于电化学腐蚀,电化学腐蚀通常有析氢腐蚀和吸氧腐蚀两种,这两种腐蚀主要差异体现在正极反应上。特别提醒:由于金属表面一般不会遇到酸性较强的溶液,故吸氧腐蚀是金属腐蚀的主要形式,但在某些地方由于酸雨的形成,金属腐蚀以析氢腐蚀为主。
只有在金属活动性顺序中位于氢前面的金属才可能发生析氢腐蚀,而位于氢以后的金属腐蚀时,只能是吸氧腐蚀,如铁锈的形成,铜绿的形成就属于吸氧腐蚀。其中铜绿形成原理为: 下列有关钢铁腐蚀与防护的说法正确的是( )
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-===Fe3+【解析】 钢管与电源正极连接,作电解池的阳极,被氧化而腐蚀,A项错;铁在冷浓硝酸中表面生成一层致密的氧化物保护膜,从而保护内部不被腐蚀,B项正确,钢管与铜管堆放一起时,构成原电池,钢管作负极而易被腐蚀,C项错;钢铁发生析氢腐蚀时,负极反应:Fe-2e-===Fe2+,D项错。【答案】B
【规律方法】 本题主要考查金属腐蚀及防护的知识,尤其是电化学腐蚀知识,体现了化学与日常生活密切相关的特点。变式训练 下列说法正确的是(双选)( )
A.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
B.原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀
C.钢铁电化学腐蚀的两种类型主要区别在于水膜的pH不同,引起的正极反应相同
D.无论哪种类型的腐蚀,其实质都是金属被氧化解析:选CD。本题考查金属的腐蚀实质和类型。金属的腐蚀就是金属失电子而被氧化的过程。依据电化学腐蚀中析氢腐蚀和吸氧腐蚀的原理可知,吸氧腐蚀正极反应为O2+2H2O+4e-→4OH-,析氢腐蚀中正极反应式为2H++2e-→H2↑。原电池反应既可以加快金属的腐蚀,也可用以防止金属的腐蚀,例如镀锌铁等。 探究整合应用金属腐蚀的影响因素实验探究
【举例】 全世界每年因生锈损失的钢铁约占世界钢铁年产量的1/4。某学生想探究铁生锈的条件,他将干净的铁钉分别同时放入A、B、C三支试管中进行研究。(1)请你帮助该学生完成下列实验设计的内容:(2)一周后,编号为________的试管中的铁钉最易生锈。
(3)用相同材料制作,经过相同时间防锈处理的铁栏杆,安装在南方比安装在北方更易生锈,其原因是_____________________________。(4)在焊接铁管时,为了使接口更加牢固,常用稀盐酸清洗接口处的铁锈,该反应的化学方程式为________________________。下列物质的用途,利用氧化还原反应原理解释的是________。
A.用明矾净水
B.用稀盐酸除去热水瓶胆壁上的水垢
C.水厂用氯气消毒自来水
D.用酵母蒸馒头某铁合金与铁的物理性质的比较如下表所示:
又知该铁合金耐腐蚀,强度大,从以上性能看,该铁合金不适合用做________。
A.导线 B.门窗框
C.炉具 D.飞机外壳【解析】 通过对比实验,探究铁生锈的条件,(1)与空气接触(2)与电解质溶液接触。南方空气湿度大且雨水多,故钢铁比干燥的北方更易生锈。用盐酸清洗铁锈是Fe2O3与盐酸的反应。自来水消毒过程是Cl2与水反应生成的HClO具有强氧化性可消毒,杀菌。结合表中数据,该铁合金导电性较差,不易导电不可用做导线。
【答案】 (1)把铁钉放入干燥环境中 探究铁钉在有水无空气时的生锈情况 放入铁钉,注入少量蒸馏水(2)C (3)南方多雨,潮湿空气里铁更易生锈(4)Fe2O3+6HCl===2FeCl3+3H2O C A
