纯碱的性质(第二课时)
图片预览







文档简介
课件26张PPT。海水“制碱”Na2CO3 纯碱或苏打第二课时1.食盐不仅是必不可少的生活用品,也是重要的化工原料。碳酸钠就是以食盐、___为原料,以______为媒介,采用氨碱法制的。
2.试用化学方程式表示海水制碱的原理
知识回顾氨碱法制纯碱所得到的最终产物是_________________二氧化碳氨3.被称为我国制碱工业先驱的科学家是( )
A 张青莲 B 钱学森 C 侯德榜 D 道尔顿
4.试用 ①NaHCO3 ②Na2CO3 ③NaCl 填写下列空白
(1)用作调味品的是_ __
(2)是发酵粉的主要成分,医疗上可用于胃酸过多的是______
(3)用于生产玻璃的是_ __
(4)用作洗涤剂的是_ __
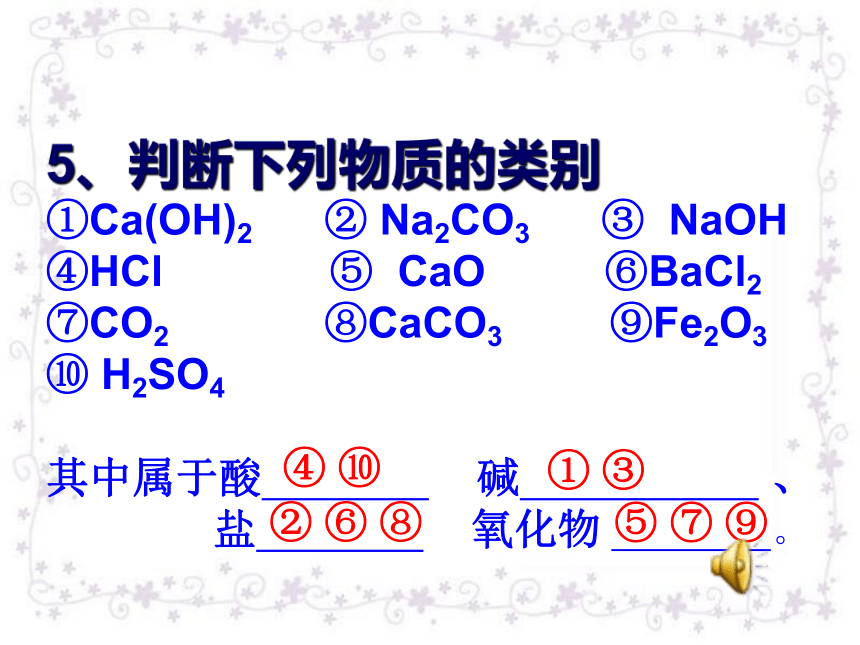
(5)俗名是苏打的是___,俗名是小苏打的是__③①②②②①C5、判断下列物质的类别
①Ca(OH)2 ② Na2CO3 ③ NaOH?
④HCl ⑤ CaO ⑥BaCl2 ⑦CO2 ⑧CaCO3 ⑨Fe2O3
⑩ H2SO4
其中属于酸 碱 、
盐 氧化物 。④ ⑩ ① ③② ⑥ ⑧⑤ ⑦ ⑨碳酸钠的用途肥皂与洗涤剂纯碱的性质刁镇中学 张燕玲配料:食用纯碱 (碳酸钠)纯碱的物理性质:
颜色
状态
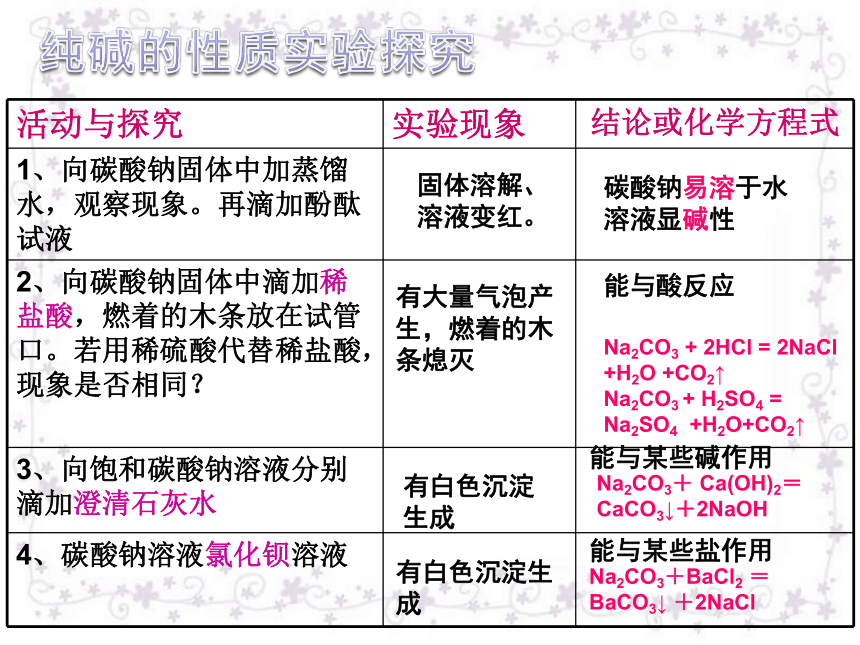
溶解性白色固态易溶于水纯碱的性质实验探究固体溶解、溶液变红。碳酸钠易溶于水 溶液显碱性有大量气泡产生,燃着的木条熄灭有白色沉淀生成有白色沉淀生成
能与酸反应能与某些碱作用能与某些盐作用纯碱的性质 (1)水溶液显碱性
(2)能与大多数酸反应
(3)能与氢氧化钙反应
(4)能与氯化钡反应盐的化学性质 (1)盐+酸 → 新盐+新酸
(2)盐+碱 → 新碱+新盐
(3)盐+盐 → 新盐+新盐 复分解反应发生的条件是什么?根据复分解反应的条件,下列反应是否能够发
生。探究复分解反应的实质1、NaOH+HCl =
2、AgNO3+ HCl =
3、Na2CO3 +2HCl=
4、KNO3 + NaCl =A+C=BABDCD+酸、碱、盐、氧化物由两种化合物互相交换成分生成另外两种化合物的反应叫做复分解反应。
︸H+、SO42-Na+、CO3 2 -Na+、SO42-反应前反应后溶液中离子种类发生改变 H2SO4+Na2CO3——Na2SO4+ + H2O——√溶液中反应的离子变化Ca2+、OH- Na+、CO3 2 -Na+、OH-反应前反应后溶液中离子种类发生改变 Ca(OH)2+ Na2CO3—— 2NaOH+——CaCO3↓√溶液中反应的离子变化KCl + NaNO3×Na+、Cl- K+、NO3-K+、Cl-反应前反应后溶液中离子种类没有改变 NaCl + KNO3 ——Na+、NO3-溶液中反应的离子变化碱只溶五位,钾钠铵钡钙酸均溶于水硝酸盐均易溶氯化物不溶氯化银硫酸盐不溶硫酸钡碳酸盐只溶钾钠铵部分酸碱盐溶解性口诀:钾钠铵盐皆可溶,
硝酸盐入水无影踪;
盐酸不溶银;
硫酸不溶钡;
碳酸盐,
只溶钾钠铵;
可溶碱五位,钾钠铵钙钡 判断下列物质是否溶于水
Na2CO3 AgCl BaCO3
MgSO4 BaSO 4 Cu(OH)2
Ba(OH)2 Mg(OH)2 AgNO3 试试你记住了吗 是酸碱盐溶液中解离出的离子两种离相互结合生成沉淀、气体、或水时,反应就能发生。
复分解反应的实质1、纯碱:白色固体,易溶于水,水溶液显碱性
2、纯碱的化学性质:
①与酸碱指示剂反应
②盐 + 酸→ 新盐 + 新盐 ③盐(可溶) + 碱(可溶)→ 新盐 + 新碱 ④盐(可溶)+ 盐(可溶)→ 两种新盐
3、复分解反应的实质:是酸碱盐解离出的离子相互结合,生成沉淀、气体、或水时,反应就能发生。谈本节收获在线测试1 钡餐透视检查胃肠疾病时,病人需口服硫酸钡,若误服碳酸钡(BaCO3)就会中毒,原因是碳酸钡会与胃中的盐酸反应,生成对人体有害的可溶性钡盐。请写出此反应的化学方程式。BaCO3+2HCl=BaCl2+H2O+CO2↑
2下列各组物质,在溶液中能共存(即不发生反应)的一组是( )
A 、HCl NaCl NaOH.
B 、NaCl.CuSO4.Ba(OH)2
C、Na2CO3.NaOH.CaCl2
D 、NaNO3.HCl.CaCl2再试一次D3 碳酸根离子或碳酸氢根离子的检验:药品:稀盐酸 澄清石灰水
方法:取样品少许放入试管中,加
入稀盐酸,有气泡产生,将
生成的气体通入澄清石灰水
中,石灰水变浑浊
牛刀小试学习检测36,37页课后作业谢谢大家 再见
2.试用化学方程式表示海水制碱的原理
知识回顾氨碱法制纯碱所得到的最终产物是_________________二氧化碳氨3.被称为我国制碱工业先驱的科学家是( )
A 张青莲 B 钱学森 C 侯德榜 D 道尔顿
4.试用 ①NaHCO3 ②Na2CO3 ③NaCl 填写下列空白
(1)用作调味品的是_ __
(2)是发酵粉的主要成分,医疗上可用于胃酸过多的是______
(3)用于生产玻璃的是_ __
(4)用作洗涤剂的是_ __
(5)俗名是苏打的是___,俗名是小苏打的是__③①②②②①C5、判断下列物质的类别
①Ca(OH)2 ② Na2CO3 ③ NaOH?
④HCl ⑤ CaO ⑥BaCl2 ⑦CO2 ⑧CaCO3 ⑨Fe2O3
⑩ H2SO4
其中属于酸 碱 、
盐 氧化物 。④ ⑩ ① ③② ⑥ ⑧⑤ ⑦ ⑨碳酸钠的用途肥皂与洗涤剂纯碱的性质刁镇中学 张燕玲配料:食用纯碱 (碳酸钠)纯碱的物理性质:
颜色
状态
溶解性白色固态易溶于水纯碱的性质实验探究固体溶解、溶液变红。碳酸钠易溶于水 溶液显碱性有大量气泡产生,燃着的木条熄灭有白色沉淀生成有白色沉淀生成
能与酸反应能与某些碱作用能与某些盐作用纯碱的性质 (1)水溶液显碱性
(2)能与大多数酸反应
(3)能与氢氧化钙反应
(4)能与氯化钡反应盐的化学性质 (1)盐+酸 → 新盐+新酸
(2)盐+碱 → 新碱+新盐
(3)盐+盐 → 新盐+新盐 复分解反应发生的条件是什么?根据复分解反应的条件,下列反应是否能够发
生。探究复分解反应的实质1、NaOH+HCl =
2、AgNO3+ HCl =
3、Na2CO3 +2HCl=
4、KNO3 + NaCl =A+C=BABDCD+酸、碱、盐、氧化物由两种化合物互相交换成分生成另外两种化合物的反应叫做复分解反应。
︸H+、SO42-Na+、CO3 2 -Na+、SO42-反应前反应后溶液中离子种类发生改变 H2SO4+Na2CO3——Na2SO4+ + H2O——√溶液中反应的离子变化Ca2+、OH- Na+、CO3 2 -Na+、OH-反应前反应后溶液中离子种类发生改变 Ca(OH)2+ Na2CO3—— 2NaOH+——CaCO3↓√溶液中反应的离子变化KCl + NaNO3×Na+、Cl- K+、NO3-K+、Cl-反应前反应后溶液中离子种类没有改变 NaCl + KNO3 ——Na+、NO3-溶液中反应的离子变化碱只溶五位,钾钠铵钡钙酸均溶于水硝酸盐均易溶氯化物不溶氯化银硫酸盐不溶硫酸钡碳酸盐只溶钾钠铵部分酸碱盐溶解性口诀:钾钠铵盐皆可溶,
硝酸盐入水无影踪;
盐酸不溶银;
硫酸不溶钡;
碳酸盐,
只溶钾钠铵;
可溶碱五位,钾钠铵钙钡 判断下列物质是否溶于水
Na2CO3 AgCl BaCO3
MgSO4 BaSO 4 Cu(OH)2
Ba(OH)2 Mg(OH)2 AgNO3 试试你记住了吗 是酸碱盐溶液中解离出的离子两种离相互结合生成沉淀、气体、或水时,反应就能发生。
复分解反应的实质1、纯碱:白色固体,易溶于水,水溶液显碱性
2、纯碱的化学性质:
①与酸碱指示剂反应
②盐 + 酸→ 新盐 + 新盐 ③盐(可溶) + 碱(可溶)→ 新盐 + 新碱 ④盐(可溶)+ 盐(可溶)→ 两种新盐
3、复分解反应的实质:是酸碱盐解离出的离子相互结合,生成沉淀、气体、或水时,反应就能发生。谈本节收获在线测试1 钡餐透视检查胃肠疾病时,病人需口服硫酸钡,若误服碳酸钡(BaCO3)就会中毒,原因是碳酸钡会与胃中的盐酸反应,生成对人体有害的可溶性钡盐。请写出此反应的化学方程式。BaCO3+2HCl=BaCl2+H2O+CO2↑
2下列各组物质,在溶液中能共存(即不发生反应)的一组是( )
A 、HCl NaCl NaOH.
B 、NaCl.CuSO4.Ba(OH)2
C、Na2CO3.NaOH.CaCl2
D 、NaNO3.HCl.CaCl2再试一次D3 碳酸根离子或碳酸氢根离子的检验:药品:稀盐酸 澄清石灰水
方法:取样品少许放入试管中,加
入稀盐酸,有气泡产生,将
生成的气体通入澄清石灰水
中,石灰水变浑浊
牛刀小试学习检测36,37页课后作业谢谢大家 再见
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
