2022-2023学年人教版九年级化学下册 8.2 金属的化学性质(第1课时)同步测试(有解析)
文档属性
| 名称 | 2022-2023学年人教版九年级化学下册 8.2 金属的化学性质(第1课时)同步测试(有解析) |  | |
| 格式 | zip | ||
| 文件大小 | 205.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-05 11:08:50 | ||
图片预览



文档简介
8.2 金属的化学性质(第1课时)同步测试
1.从《中国成语大会》到《中国诗词大会》,中国诗词文化大放异彩,很多成语、诗词中蕴含着丰富的科学道理,下列说法错误的是( )
A.“火要虚”是说氧气浓度越高,可燃物燃烧越旺
B.“满架蔷薇一院香”是因为分子在不断地运动
C.“真金不怕火炼”说明黄金的化学性质非常稳定
D.“松叶堪为酒,春来酿几多?”指清香的美酒来自于粮食缓慢氧化
2.实验小组将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,结果如图1,图2所示。下列说法正确的是( )
A.0~50s,装置里没有发生反应
B.50s时,溶液中溶质为AlCl3
C.100s时,密闭容器中的反应已结束
D.反应过程中气压增大,仅因为有氢气生成
3.将一根洁净的铜片放入稀硫酸中,下列叙述正确的是( )
①铜片表面产生气泡
②液体由无色变成蓝色
③溶液的质量增加
④无明显现象
A.③④ B.④ C.①②③ D.①②③④
4.质量相同质量分数相同的稀H2SO4与足量Mg、Al、Zn、Fe充分反应,生成氢气质量与金属质量的关系如图所示,分析图象信息,得出结论正确的是( )
A.四种金属都能与酸反应生成H2
B.四种金属的活动性顺序:Al>Mg>Fe>Zn
C.相同质量的四种金属与稀H2SO4反应,消耗酸的质量相等
D.相同质量的四种金属与足量稀H2SO4反应氢气质量:Zn>Fe>Mg>Al
5.某种金属混合物样品由Mg、Al、Fe、Zn四种金属中的两种组成,取5.6g样品跟足量稀硫酸反应,得到0.2g氢气,则此混合物中一定含有的金属是( )
A.Zn B.Al C.Mg D.Fe
6.在如图甲、乙两支完全相同的试管中,装有足量质量相等且同样的稀盐酸。在两只试管上方各罩一个完全相同的气球,两个气球中分别装有质量相同的金属A和B.现同时提起两只气球,使其中的金属迅速与稀盐酸接触反应。实验发现:开始时,甲气球迅速鼓起,而乙气球鼓起较慢;反应结束时,甲气球鼓起比的体积比乙气球的大。根据以上事实,下列推论错误的是( )
A.金属A比金属B活泼 B.A可能是锌,B可能是铁
C.A可能是铝,B可能是锌 D.A可能是镁,B可能是铁
7.为了探究金属与酸反应的规律,兴趣小组进行了如下实验:取等质量且表面积相同的Fe片、Mg片、Zn片,分别与等体积、等浓度的稀HCl反应,用温度传感器测得反应温度随时间变化曲线如图所示。下列说法正确的是( )
A.等质量的三种金属与足量稀HCl完全反应生成等质量的H2
B.Mg比Zn、Fe更适合与酸反应以获得平稳的H2流
C.Zn片与稀HCl反应至50s时,溶液中的溶质为ZnCl2
D.相同条件下,金属越活泼,与酸反应放出的热量越多
8.向两份完全相同的稀盐酸中分别加入过量Zn粉、Fe粉,随着反应的进行,金属质量和生成氢气的质量变化如图所示。请读取图象信息,并根据图象信息判断下列说法正确的是( )
A.Fe与Zn的活动性顺序:Zn>Fe
B.同质量的Zn粉和Fe粉与足量稀盐酸反应生成H2质量:Fe>Zn
C.同质量的Zn粉和Fe粉与足量稀盐酸反应生成H2质量:Fe=Zn
D.同质量同质量分数的稀盐酸分别与Zn粉和Fe粉反应生成H2质量:Fe=Zn
9.生铁和足量的硫酸充分反应后,总会有少量残渣剩余,残渣的成分主要是( )
A.铁 B.硫酸铁
C.硫酸亚铁 D.碳和一些杂质
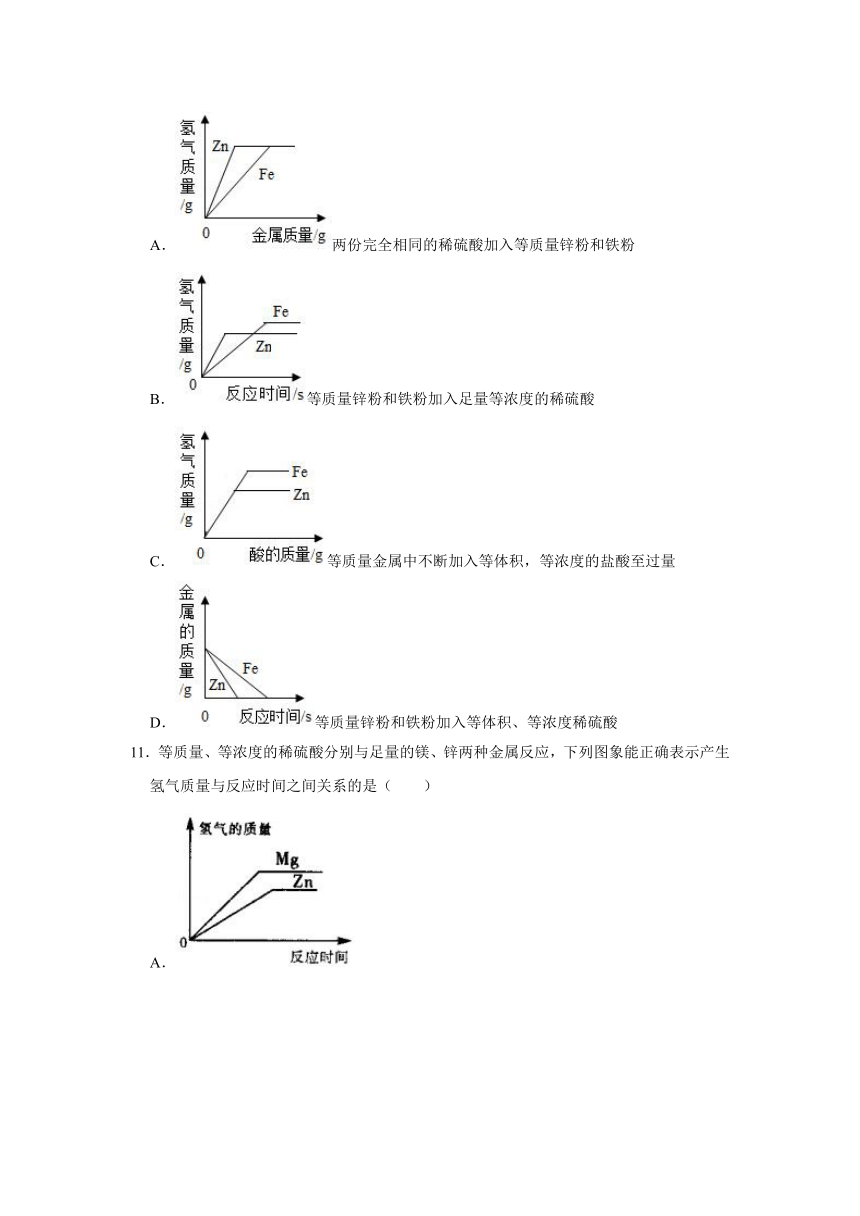
10.下面是同学们梳理复习金属与酸反应时得到的一组图象,下列图象不能正确反映对应变化关系的是( )
A.两份完全相同的稀硫酸加入等质量锌粉和铁粉
B.等质量锌粉和铁粉加入足量等浓度的稀硫酸
C.等质量金属中不断加入等体积,等浓度的盐酸至过量
D.等质量锌粉和铁粉加入等体积、等浓度稀硫酸
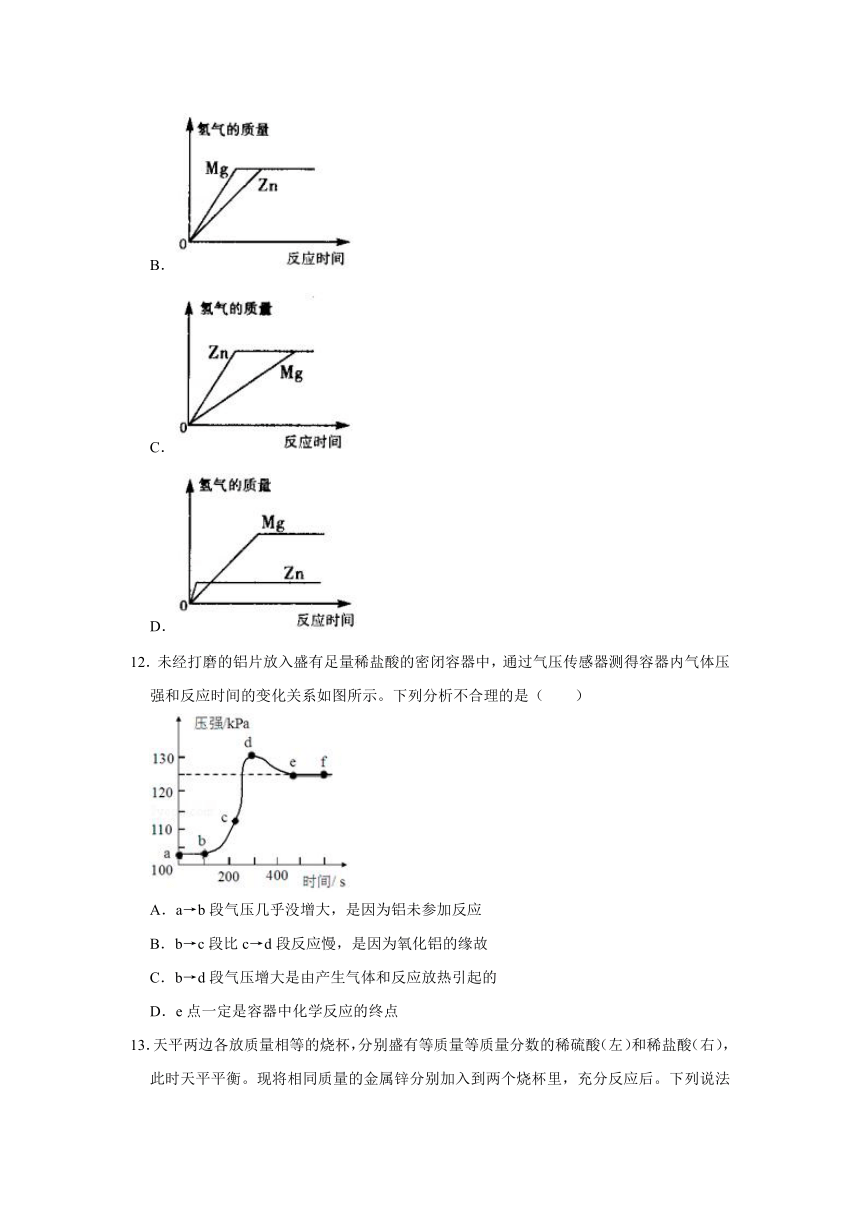
11.等质量、等浓度的稀硫酸分别与足量的镁、锌两种金属反应,下列图象能正确表示产生氢气质量与反应时间之间关系的是( )
A.
B.
C.
D.
12.未经打磨的铝片放入盛有足量稀盐酸的密闭容器中,通过气压传感器测得容器内气体压强和反应时间的变化关系如图所示。下列分析不合理的是( )
A.a→b段气压几乎没增大,是因为铝未参加反应
B.b→c段比c→d段反应慢,是因为氧化铝的缘故
C.b→d段气压增大是由产生气体和反应放热引起的
D.e点一定是容器中化学反应的终点
13.天平两边各放质量相等的烧杯,分别盛有等质量等质量分数的稀硫酸(左)和稀盐酸(右),此时天平平衡。现将相同质量的金属锌分别加入到两个烧杯里,充分反应后。下列说法正确的是( )
A.若天平平衡,两烧杯中的酸一定都反应完了
B.若天平不平衡,左边的锌一定有剩余
C.若天平不平衡,指针一定偏向稀盐酸的一边
D.若天平平衡,两烧杯中的酸一定都有剩余
二.填空题(共1小题)
14.铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得。今天,铝已经进入了我们生活的每一个角落。
(1)金属铝具有很好的抗腐蚀性的原因: 。
(2)铝是一种既可以和酸,又可以和强碱溶液反应的金属,请写出铝和氢氧化钾溶液生成偏铝酸钾[KAlO2]和一种可燃性气体单质的化学反应方程式: 。
(3)铝热法是一种利用铝的还原性获得高熔点金属单质的方法,可简单认为是铝与某些金属氧化物在高温条件下发生的置换反应。请写出铝与四氧化三铁反应的化学方程式: 。
三.实验探究题(共1小题)
15.运用手持技术探究金属与酸的反应。
向250mL的烧瓶内注入25mL溶质质量分数8.8%的稀盐酸,分别剪取长约4cm、宽约0.4cm的镁、铝、锌、铁、铜金属条,打磨后投入烧瓶中,迅速塞紧带有压强传感器的橡皮塞(见图1),点击采集,得到如图2所示的气压变化曲线。回答下列问题:
(1)曲线a对应的金属是 。
(2)曲线b对应的金属是铁,反应的化学方程式为 。
(3)曲线c在18s左右达到最高点后又略微下降的原因是 。
(4)下列说法错误的是 。
A.d对应的反应速率适中,适合实验室制取气体
B.如延长反应时间,可得到d的图象是一条直线
C.从0~100s图象可推测e对应的金属打磨不彻底
D.从250﹣450s图象推测e反应时盐酸浓度在变大
答案与解析
1.从《中国成语大会》到《中国诗词大会》,中国诗词文化大放异彩,很多成语、诗词中蕴含着丰富的科学道理,下列说法错误的是( )
A.“火要虚”是说氧气浓度越高,可燃物燃烧越旺
B.“满架蔷薇一院香”是因为分子在不断地运动
C.“真金不怕火炼”说明黄金的化学性质非常稳定
D.“松叶堪为酒,春来酿几多?”指清香的美酒来自于粮食缓慢氧化
【答案】A
【解析】A、“火要虚”,增大了燃料与氧气的接触面积,能使燃料充分燃烧,故选项说法错误。
B、“满架蔷薇一院香”,是因为蔷薇花香中含有的分子是在不断的运动的,向四周扩散,使人们闻到蔷薇花香,故选项说法正确。
C、“真金不怕火炼”意思是金即使在高温时也不与氧气反应,说明金的化学性质不活泼,故选项说法正确。
D、“松叶堪为酒,春来酿几多?”,美酒中的酒精是用粮食发酵制得的,属于缓慢氧化,故选项说法正确。
故选:A。
2.实验小组将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,结果如图1,图2所示。下列说法正确的是( )
A.0~50s,装置里没有发生反应
B.50s时,溶液中溶质为AlCl3
C.100s时,密闭容器中的反应已结束
D.反应过程中气压增大,仅因为有氢气生成
【答案】C
【解析】A、根据铝的表面有一层致密的氧化铝薄膜,0~50s,装置里发生了氧化铝与稀盐酸的反应,故选项说法错误。
B、50s时,铝与稀盐酸的反应开始发生,稀盐酸有剩余,溶液中溶质为AlCl3和HCl,故选项说法错误。
C、100s时,压强开始减小,密闭容器中的反应已结束,故选项说法正确。
D、反应过程中气压增大,不是仅因为有氢气生成,还因为铝和稀盐酸反应生成气体并放热,故选项说法错误。故选:C。
3.将一根洁净的铜片放入稀硫酸中,下列叙述正确的是( )
①铜片表面产生气泡
②液体由无色变成蓝色
③溶液的质量增加
④无明显现象
A.③④ B.④ C.①②③ D.①②③④
【答案】B
【解析】在金属活动性顺序中,铜的位置排在氢的后面,不能与稀硫酸反应,铜片表面无明显现象,没有气泡产生,液体颜色不变,溶液的质量不变。故选:B。
4.质量相同质量分数相同的稀H2SO4与足量Mg、Al、Zn、Fe充分反应,生成氢气质量与金属质量的关系如图所示,分析图象信息,得出结论正确的是( )
A.四种金属都能与酸反应生成H2
B.四种金属的活动性顺序:Al>Mg>Fe>Zn
C.相同质量的四种金属与稀H2SO4反应,消耗酸的质量相等
D.相同质量的四种金属与足量稀H2SO4反应氢气质量:Zn>Fe>Mg>Al
【答案】A
【解析】A、四种金属都能与酸反应生成氢气,该选项说法正确;
B、四种金属的活动性顺序:Mg>Al>Zn>Fe,该选项说法不正确;
C、相同质量的四种金属与稀H2SO4反应,消耗酸的质量关系:Al>Mg>Fe>Zn,该选项说法不正确;
D、相同质量的四种金属与足量稀H2SO4反应氢气质量:Al>Mg>Fe>Zn,该选项说法不正确。故选:A。
5.某种金属混合物样品由Mg、Al、Fe、Zn四种金属中的两种组成,取5.6g样品跟足量稀硫酸反应,得到0.2g氢气,则此混合物中一定含有的金属是( )
A.Zn B.Al C.Mg D.Fe
【答案】A
【解析】Mg、Al、Fe、Zn四种金属和稀硫酸反应的化学方程式及其质量关系:
Mg+H2SO4═MgSO4+H2↑,
24 2
2.4g 0.2g
2Al+3H2SO4═Al2(SO4)3+3H2↑,
54 6
1.8g 0.2g
Zn+H2SO4═ZnSO4+H2↑,
65 2
6.5g 0.2g
Fe+H2SO4═FeSO4+H2↑,
56 2
5.6g 0.2g
由以上质量关系可知,5.6g镁和铝完全反应生成氢气质量大于0.2g,5.6g镁和铁完全反应生成氢气质量大于0.2g,5.6g镁和锌完全反应生成氢气质量可能是0.2g,5.6g铝和铁完全反应生成氢气质量大于0.2g,5.6g铝和锌完全反应生成氢气质量可能是0.2g,5.6g铁和锌完全反应生成氢气质量小于0.2g,因此此混合物中一定含有的金属是锌。故选:A。
6.在如图甲、乙两支完全相同的试管中,装有足量质量相等且同样的稀盐酸。在两只试管上方各罩一个完全相同的气球,两个气球中分别装有质量相同的金属A和B.现同时提起两只气球,使其中的金属迅速与稀盐酸接触反应。实验发现:开始时,甲气球迅速鼓起,而乙气球鼓起较慢;反应结束时,甲气球鼓起比的体积比乙气球的大。根据以上事实,下列推论错误的是( )
A.金属A比金属B活泼 B.A可能是锌,B可能是铁
C.A可能是铝,B可能是锌 D.A可能是镁,B可能是铁
【答案】B
【解析】A、开始时,甲气球迅速鼓起,而乙气球鼓起较慢,说明A与酸反应的速率快,其金属活动性比B强,故选项说法正确。
B、A最终生成氢气的体积比B多,等质量的锌和铁,与足量的稀盐酸反应,铁产生的氢气多,故选项说法错误。
C、A与酸反应的速率快,其金属活动性比B强,等质量的铝和锌,与足量的稀盐酸反应,铝产生的氢气多,A可能是铝,B可能是锌,故选项说法正确。
D、A与酸反应的速率快,其金属活动性比B强,等质量的镁和铁,与足量的稀盐酸反应,镁产生的氢气多,A可能是镁,B可能是铁,故选项说法正确。
故选:B。
7.为了探究金属与酸反应的规律,兴趣小组进行了如下实验:取等质量且表面积相同的Fe片、Mg片、Zn片,分别与等体积、等浓度的稀HCl反应,用温度传感器测得反应温度随时间变化曲线如图所示。下列说法正确的是( )
A.等质量的三种金属与足量稀HCl完全反应生成等质量的H2
B.Mg比Zn、Fe更适合与酸反应以获得平稳的H2流
C.Zn片与稀HCl反应至50s时,溶液中的溶质为ZnCl2
D.相同条件下,金属越活泼,与酸反应放出的热量越多
【答案】D
【解析】A、等质量的三种金属与足量稀HCl完全反应生成氢气质量不相等,镁反应生成氢气最多,锌反应生成氢气最少,该选项说法不正确;
B、单位时间内镁反应放热最多,说明镁和稀盐酸反应最剧烈,因此镁和稀盐酸反应时不能获得平稳的H2流,该选项说法不正确;
C、Zn片与稀HCl反应至50s时,稀盐酸过量,溶液中的溶质为氯化锌和氯化氢,该选项说法不正确;
D、镁在三种金属中最活泼,由图中信息可知,相同条件下,金属越活泼,与酸反应放出的热量越多,该选项说法正确。
故选:D。
8.向两份完全相同的稀盐酸中分别加入过量Zn粉、Fe粉,随着反应的进行,金属质量和生成氢气的质量变化如图所示。请读取图象信息,并根据图象信息判断下列说法正确的是( )
A.Fe与Zn的活动性顺序:Zn>Fe
B.同质量的Zn粉和Fe粉与足量稀盐酸反应生成H2质量:Fe>Zn
C.同质量的Zn粉和Fe粉与足量稀盐酸反应生成H2质量:Fe=Zn
D.同质量同质量分数的稀盐酸分别与Zn粉和Fe粉反应生成H2质量:Fe=Zn
【答案】B
【解析】A、根据图中信息不能判断两种物质的活动性顺序,该选项说法不正确;
B、由图中数据可知,同质量的Zn粉和Fe粉与足量稀盐酸反应生成H2质量:Fe>Zn,该选项说法正确;
C、同质量的Zn粉和Fe粉与足量稀盐酸反应生成H2质量:Fe≠Zn,该选项说法不正确;
D、同质量同质量分数的稀盐酸分别与Zn粉和Fe粉反应生成H2质量不一定相等,例如稀盐酸过量时,生成氢气质量不相等,该选项说法不正确。
故选:B。
9.生铁和足量的硫酸充分反应后,总会有少量残渣剩余,残渣的成分主要是( )
A.铁 B.硫酸铁
C.硫酸亚铁 D.碳和一些杂质
【答案】D
【解析】生铁是含碳量约为2%﹣4.3%的铁合金。将生铁放入足量的硫酸中,铁能与硫酸反应生成硫酸亚铁和氢气,碳不与硫酸反应,充分反应后过滤,剩余的残渣是既不溶于水,又不和酸反应的碳和一些杂质。
故选:D。
10.下面是同学们梳理复习金属与酸反应时得到的一组图象,下列图象不能正确反映对应变化关系的是( )
A.两份完全相同的稀硫酸加入等质量锌粉和铁粉
B.等质量锌粉和铁粉加入足量等浓度的稀硫酸
C.等质量金属中不断加入等体积,等浓度的盐酸至过量
D.等质量锌粉和铁粉加入等体积、等浓度稀硫酸
【答案】A
【解析】A、金属与酸反应时氢气来源于酸中的氢元素,因为酸的量相同,金属过量,故生成的氢气应该相等;生成等质量的氢气,消耗的锌的质量多,故选项图象错误。
B、锌的活动性比铁强,反应速率快,至完全反应,反应时间短;等质量锌粉和铁粉加入足量等浓度的稀硫酸,铁生成氢气的质量比锌多,故选项图象正确。
C、若消耗盐酸相同,则生成氢气质量相同,故开始两斜线重合,后因盐酸过量,铁消耗盐酸多,拐点高些,故选项图象正确。
D、等质量锌粉和铁粉加入等体积、等浓度稀硫酸,锌的活动性比铁强,反应速率快,至完全反应,反应时间短,锌先完全反应,质量先减少至0,故选项图象正确。
故选:A。
11.等质量、等浓度的稀硫酸分别与足量的镁、锌两种金属反应,下列图象能正确表示产生氢气质量与反应时间之间关系的是( )
A.
B.
C.
D.
【答案】B
【解析】在金属活动性顺序中,Mg>Zn,则镁的反应速率最快,锌的反应速率慢,等质量的硫酸与足量的镁、锌反应,则酸全部参加反应,生成氢气的质量相同;
A、此图象中生成氢气的质量不同,故A错误;
B、此图象中生成氢气的质量相同,且镁的斜线最陡,表明镁反应的速率快,锌的斜线最平缓,表明锌的反应速率慢,故B正确;
C、此图中锌的斜线比镁的斜线陡,表明是锌比镁反应的速率快,故C错误;
D、此图中反应生成的氢气质量不同,故D错误;
故选:B。
12.未经打磨的铝片放入盛有足量稀盐酸的密闭容器中,通过气压传感器测得容器内气体压强和反应时间的变化关系如图所示。下列分析不合理的是( )
A.a→b段气压几乎没增大,是因为铝未参加反应
B.b→c段比c→d段反应慢,是因为氧化铝的缘故
C.b→d段气压增大是由产生气体和反应放热引起的
D.e点一定是容器中化学反应的终点
【答案】D
【解析】A、a→b段气压几乎没增大,是因为盐酸和氧化铝反应生成氯化铝和水,铝未参加反应,该选项说法正确;
B、b→c段比c→d段反应慢,是因为氧化铝的缘故,该选项说法正确;
C、b→d段气压增大是由产生气体和反应放热引起的,该选项说法正确;
D、由图象可知,d点压强最大,一定是容器中化学反应的结束点,该选项说法不正确。
故选:D。
13.天平两边各放质量相等的烧杯,分别盛有等质量等质量分数的稀硫酸(左)和稀盐酸(右),此时天平平衡。现将相同质量的金属锌分别加入到两个烧杯里,充分反应后。下列说法正确的是( )
A.若天平平衡,两烧杯中的酸一定都反应完了
B.若天平不平衡,左边的锌一定有剩余
C.若天平不平衡,指针一定偏向稀盐酸的一边
D.若天平平衡,两烧杯中的酸一定都有剩余
【答案】B
【解析】锌与稀硫酸和稀盐酸反应的质量比分别是:
Zn+H2SO4═ZnSO4+H2↑
65 98 2
Zn+2HCl═ZnCl2+H2↑
65 73 2
A、若天平平衡,说明反应生成氢气质量相等,若两烧杯中的酸都反应完了,生成氢气的质量不相同,该选项说法不正确;
B、若天平不平衡,两边产生氢气的质量不同,盐酸产生的氢气质量大于硫酸,产生的氢气质量越大,消耗锌的质量也越大,所以左边消耗锌的质量小于右边,锌一定有剩余,该选项说法正确;
C、若天平不平衡,说明反应生成氢气质量不相等,由方程式可知,盐酸反应放出的氢气多,指针一定偏向稀硫酸的一边,该选项说法不正确;
D、若天平平衡,说明反应生成氢气质量相等,生成氢气质量相等时,反应锌的质量相同,可能两烧杯中的酸都有剩余,也可能稀硫酸完全反应了,稀盐酸有剩余,该选项说法不正确。
故选:B。
二.填空题(共1小题)
14.铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得。今天,铝已经进入了我们生活的每一个角落。
(1)金属铝具有很好的抗腐蚀性的原因: 。
(2)铝是一种既可以和酸,又可以和强碱溶液反应的金属,请写出铝和氢氧化钾溶液生成偏铝酸钾[KAlO2]和一种可燃性气体单质的化学反应方程式: 。
(3)铝热法是一种利用铝的还原性获得高熔点金属单质的方法,可简单认为是铝与某些金属氧化物在高温条件下发生的置换反应。请写出铝与四氧化三铁反应的化学方程式: 。
【答案】(1)铝在空气中能与氧气反应,其表面生成一层致密的氧化铝薄膜,防止内部的铝进一步被氧化;
(2)2Al+2KOH+2H2O=2KAlO2+3H2↑;
(3)8Al+3Fe3O49Fe+4Al2O3。
【解析】(1)铝在空气中能与氧气反应,其表面生成一层致密的氧化铝薄膜,防止内部的铝进一步被氧化,因此铝制品抗腐蚀性强。
(2)铝和氢氧化钾溶液生成偏铝酸钾[KAlO2]和一种可燃性气体单质,由质量守恒定律,可燃性气体单质是氢气,反应的化学方程式为2Al+2KOH+2H2O=2KAlO2+3H2↑。
(3)铝与某些金属氧化物在高温条件下发生的置换反应,铝与四氧化三铁反应生成铁和氧化铝,反应的化学方程式为8Al+3Fe3O49Fe+4Al2O3。
故答案为:
(1)铝在空气中能与氧气反应,其表面生成一层致密的氧化铝薄膜,防止内部的铝进一步被氧化;
(2)2Al+2KOH+2H2O=2KAlO2+3H2↑;
(3)8Al+3Fe3O49Fe+4Al2O3。
三.实验探究题(共1小题)
15.运用手持技术探究金属与酸的反应。
向250mL的烧瓶内注入25mL溶质质量分数8.8%的稀盐酸,分别剪取长约4cm、宽约0.4cm的镁、铝、锌、铁、铜金属条,打磨后投入烧瓶中,迅速塞紧带有压强传感器的橡皮塞(见图1),点击采集,得到如图2所示的气压变化曲线。回答下列问题:
(1)曲线a对应的金属是 。
(2)曲线b对应的金属是铁,反应的化学方程式为 。
(3)曲线c在18s左右达到最高点后又略微下降的原因是 。
(4)下列说法错误的是 。
A.d对应的反应速率适中,适合实验室制取气体
B.如延长反应时间,可得到d的图象是一条直线
C.从0~100s图象可推测e对应的金属打磨不彻底
D.从250﹣450s图象推测e反应时盐酸浓度在变大
【答案】(1)铜。
(2)Fe+2HCl=FeCl2+H2↑。
(3)镁与稀盐酸反应放热,在18s反应结束,温度降低。
(4)BD。
【解析】由金属活动性顺序表可知,金属的活动性强弱是:镁>锌>铁>铜。
(1)曲线a不变,也就是压强不变,没有气体放出,铜与稀盐酸不反应,对应的金属是铜。
(2)曲线b变化较慢,也就是反应进行的速率较为缓慢,铁与稀盐酸反应比较缓慢,对应的金属是铁,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑。
(3)曲线c是压强变化最快的,镁与稀盐酸反应比较剧烈,对应的金属应是镁,在18s左右达到最高点后又略微下降的原因是:镁与稀盐酸反应放热,在18s反应结束,温度降低。
(4)A.d对应的反应速率适中,应是锌,适合实验室制取气体,故A说法正确;
B.反应停止后不再产生氢气,压强不变,不再是一条直线,故B说法不正确;
C、从0~100s图象可推测e对应的金属打磨不彻底,酸与金属氧化物反应不放出氢气,压强不变,故C说法正确;
D.随着反应的进行,盐酸浓度在变小,故D说法不正确。
1.从《中国成语大会》到《中国诗词大会》,中国诗词文化大放异彩,很多成语、诗词中蕴含着丰富的科学道理,下列说法错误的是( )
A.“火要虚”是说氧气浓度越高,可燃物燃烧越旺
B.“满架蔷薇一院香”是因为分子在不断地运动
C.“真金不怕火炼”说明黄金的化学性质非常稳定
D.“松叶堪为酒,春来酿几多?”指清香的美酒来自于粮食缓慢氧化
2.实验小组将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,结果如图1,图2所示。下列说法正确的是( )
A.0~50s,装置里没有发生反应
B.50s时,溶液中溶质为AlCl3
C.100s时,密闭容器中的反应已结束
D.反应过程中气压增大,仅因为有氢气生成
3.将一根洁净的铜片放入稀硫酸中,下列叙述正确的是( )
①铜片表面产生气泡
②液体由无色变成蓝色
③溶液的质量增加
④无明显现象
A.③④ B.④ C.①②③ D.①②③④
4.质量相同质量分数相同的稀H2SO4与足量Mg、Al、Zn、Fe充分反应,生成氢气质量与金属质量的关系如图所示,分析图象信息,得出结论正确的是( )
A.四种金属都能与酸反应生成H2
B.四种金属的活动性顺序:Al>Mg>Fe>Zn
C.相同质量的四种金属与稀H2SO4反应,消耗酸的质量相等
D.相同质量的四种金属与足量稀H2SO4反应氢气质量:Zn>Fe>Mg>Al
5.某种金属混合物样品由Mg、Al、Fe、Zn四种金属中的两种组成,取5.6g样品跟足量稀硫酸反应,得到0.2g氢气,则此混合物中一定含有的金属是( )
A.Zn B.Al C.Mg D.Fe
6.在如图甲、乙两支完全相同的试管中,装有足量质量相等且同样的稀盐酸。在两只试管上方各罩一个完全相同的气球,两个气球中分别装有质量相同的金属A和B.现同时提起两只气球,使其中的金属迅速与稀盐酸接触反应。实验发现:开始时,甲气球迅速鼓起,而乙气球鼓起较慢;反应结束时,甲气球鼓起比的体积比乙气球的大。根据以上事实,下列推论错误的是( )
A.金属A比金属B活泼 B.A可能是锌,B可能是铁
C.A可能是铝,B可能是锌 D.A可能是镁,B可能是铁
7.为了探究金属与酸反应的规律,兴趣小组进行了如下实验:取等质量且表面积相同的Fe片、Mg片、Zn片,分别与等体积、等浓度的稀HCl反应,用温度传感器测得反应温度随时间变化曲线如图所示。下列说法正确的是( )
A.等质量的三种金属与足量稀HCl完全反应生成等质量的H2
B.Mg比Zn、Fe更适合与酸反应以获得平稳的H2流
C.Zn片与稀HCl反应至50s时,溶液中的溶质为ZnCl2
D.相同条件下,金属越活泼,与酸反应放出的热量越多
8.向两份完全相同的稀盐酸中分别加入过量Zn粉、Fe粉,随着反应的进行,金属质量和生成氢气的质量变化如图所示。请读取图象信息,并根据图象信息判断下列说法正确的是( )
A.Fe与Zn的活动性顺序:Zn>Fe
B.同质量的Zn粉和Fe粉与足量稀盐酸反应生成H2质量:Fe>Zn
C.同质量的Zn粉和Fe粉与足量稀盐酸反应生成H2质量:Fe=Zn
D.同质量同质量分数的稀盐酸分别与Zn粉和Fe粉反应生成H2质量:Fe=Zn
9.生铁和足量的硫酸充分反应后,总会有少量残渣剩余,残渣的成分主要是( )
A.铁 B.硫酸铁
C.硫酸亚铁 D.碳和一些杂质
10.下面是同学们梳理复习金属与酸反应时得到的一组图象,下列图象不能正确反映对应变化关系的是( )
A.两份完全相同的稀硫酸加入等质量锌粉和铁粉
B.等质量锌粉和铁粉加入足量等浓度的稀硫酸
C.等质量金属中不断加入等体积,等浓度的盐酸至过量
D.等质量锌粉和铁粉加入等体积、等浓度稀硫酸
11.等质量、等浓度的稀硫酸分别与足量的镁、锌两种金属反应,下列图象能正确表示产生氢气质量与反应时间之间关系的是( )
A.
B.
C.
D.
12.未经打磨的铝片放入盛有足量稀盐酸的密闭容器中,通过气压传感器测得容器内气体压强和反应时间的变化关系如图所示。下列分析不合理的是( )
A.a→b段气压几乎没增大,是因为铝未参加反应
B.b→c段比c→d段反应慢,是因为氧化铝的缘故
C.b→d段气压增大是由产生气体和反应放热引起的
D.e点一定是容器中化学反应的终点
13.天平两边各放质量相等的烧杯,分别盛有等质量等质量分数的稀硫酸(左)和稀盐酸(右),此时天平平衡。现将相同质量的金属锌分别加入到两个烧杯里,充分反应后。下列说法正确的是( )
A.若天平平衡,两烧杯中的酸一定都反应完了
B.若天平不平衡,左边的锌一定有剩余
C.若天平不平衡,指针一定偏向稀盐酸的一边
D.若天平平衡,两烧杯中的酸一定都有剩余
二.填空题(共1小题)
14.铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得。今天,铝已经进入了我们生活的每一个角落。
(1)金属铝具有很好的抗腐蚀性的原因: 。
(2)铝是一种既可以和酸,又可以和强碱溶液反应的金属,请写出铝和氢氧化钾溶液生成偏铝酸钾[KAlO2]和一种可燃性气体单质的化学反应方程式: 。
(3)铝热法是一种利用铝的还原性获得高熔点金属单质的方法,可简单认为是铝与某些金属氧化物在高温条件下发生的置换反应。请写出铝与四氧化三铁反应的化学方程式: 。
三.实验探究题(共1小题)
15.运用手持技术探究金属与酸的反应。
向250mL的烧瓶内注入25mL溶质质量分数8.8%的稀盐酸,分别剪取长约4cm、宽约0.4cm的镁、铝、锌、铁、铜金属条,打磨后投入烧瓶中,迅速塞紧带有压强传感器的橡皮塞(见图1),点击采集,得到如图2所示的气压变化曲线。回答下列问题:
(1)曲线a对应的金属是 。
(2)曲线b对应的金属是铁,反应的化学方程式为 。
(3)曲线c在18s左右达到最高点后又略微下降的原因是 。
(4)下列说法错误的是 。
A.d对应的反应速率适中,适合实验室制取气体
B.如延长反应时间,可得到d的图象是一条直线
C.从0~100s图象可推测e对应的金属打磨不彻底
D.从250﹣450s图象推测e反应时盐酸浓度在变大
答案与解析
1.从《中国成语大会》到《中国诗词大会》,中国诗词文化大放异彩,很多成语、诗词中蕴含着丰富的科学道理,下列说法错误的是( )
A.“火要虚”是说氧气浓度越高,可燃物燃烧越旺
B.“满架蔷薇一院香”是因为分子在不断地运动
C.“真金不怕火炼”说明黄金的化学性质非常稳定
D.“松叶堪为酒,春来酿几多?”指清香的美酒来自于粮食缓慢氧化
【答案】A
【解析】A、“火要虚”,增大了燃料与氧气的接触面积,能使燃料充分燃烧,故选项说法错误。
B、“满架蔷薇一院香”,是因为蔷薇花香中含有的分子是在不断的运动的,向四周扩散,使人们闻到蔷薇花香,故选项说法正确。
C、“真金不怕火炼”意思是金即使在高温时也不与氧气反应,说明金的化学性质不活泼,故选项说法正确。
D、“松叶堪为酒,春来酿几多?”,美酒中的酒精是用粮食发酵制得的,属于缓慢氧化,故选项说法正确。
故选:A。
2.实验小组将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,结果如图1,图2所示。下列说法正确的是( )
A.0~50s,装置里没有发生反应
B.50s时,溶液中溶质为AlCl3
C.100s时,密闭容器中的反应已结束
D.反应过程中气压增大,仅因为有氢气生成
【答案】C
【解析】A、根据铝的表面有一层致密的氧化铝薄膜,0~50s,装置里发生了氧化铝与稀盐酸的反应,故选项说法错误。
B、50s时,铝与稀盐酸的反应开始发生,稀盐酸有剩余,溶液中溶质为AlCl3和HCl,故选项说法错误。
C、100s时,压强开始减小,密闭容器中的反应已结束,故选项说法正确。
D、反应过程中气压增大,不是仅因为有氢气生成,还因为铝和稀盐酸反应生成气体并放热,故选项说法错误。故选:C。
3.将一根洁净的铜片放入稀硫酸中,下列叙述正确的是( )
①铜片表面产生气泡
②液体由无色变成蓝色
③溶液的质量增加
④无明显现象
A.③④ B.④ C.①②③ D.①②③④
【答案】B
【解析】在金属活动性顺序中,铜的位置排在氢的后面,不能与稀硫酸反应,铜片表面无明显现象,没有气泡产生,液体颜色不变,溶液的质量不变。故选:B。
4.质量相同质量分数相同的稀H2SO4与足量Mg、Al、Zn、Fe充分反应,生成氢气质量与金属质量的关系如图所示,分析图象信息,得出结论正确的是( )
A.四种金属都能与酸反应生成H2
B.四种金属的活动性顺序:Al>Mg>Fe>Zn
C.相同质量的四种金属与稀H2SO4反应,消耗酸的质量相等
D.相同质量的四种金属与足量稀H2SO4反应氢气质量:Zn>Fe>Mg>Al
【答案】A
【解析】A、四种金属都能与酸反应生成氢气,该选项说法正确;
B、四种金属的活动性顺序:Mg>Al>Zn>Fe,该选项说法不正确;
C、相同质量的四种金属与稀H2SO4反应,消耗酸的质量关系:Al>Mg>Fe>Zn,该选项说法不正确;
D、相同质量的四种金属与足量稀H2SO4反应氢气质量:Al>Mg>Fe>Zn,该选项说法不正确。故选:A。
5.某种金属混合物样品由Mg、Al、Fe、Zn四种金属中的两种组成,取5.6g样品跟足量稀硫酸反应,得到0.2g氢气,则此混合物中一定含有的金属是( )
A.Zn B.Al C.Mg D.Fe
【答案】A
【解析】Mg、Al、Fe、Zn四种金属和稀硫酸反应的化学方程式及其质量关系:
Mg+H2SO4═MgSO4+H2↑,
24 2
2.4g 0.2g
2Al+3H2SO4═Al2(SO4)3+3H2↑,
54 6
1.8g 0.2g
Zn+H2SO4═ZnSO4+H2↑,
65 2
6.5g 0.2g
Fe+H2SO4═FeSO4+H2↑,
56 2
5.6g 0.2g
由以上质量关系可知,5.6g镁和铝完全反应生成氢气质量大于0.2g,5.6g镁和铁完全反应生成氢气质量大于0.2g,5.6g镁和锌完全反应生成氢气质量可能是0.2g,5.6g铝和铁完全反应生成氢气质量大于0.2g,5.6g铝和锌完全反应生成氢气质量可能是0.2g,5.6g铁和锌完全反应生成氢气质量小于0.2g,因此此混合物中一定含有的金属是锌。故选:A。
6.在如图甲、乙两支完全相同的试管中,装有足量质量相等且同样的稀盐酸。在两只试管上方各罩一个完全相同的气球,两个气球中分别装有质量相同的金属A和B.现同时提起两只气球,使其中的金属迅速与稀盐酸接触反应。实验发现:开始时,甲气球迅速鼓起,而乙气球鼓起较慢;反应结束时,甲气球鼓起比的体积比乙气球的大。根据以上事实,下列推论错误的是( )
A.金属A比金属B活泼 B.A可能是锌,B可能是铁
C.A可能是铝,B可能是锌 D.A可能是镁,B可能是铁
【答案】B
【解析】A、开始时,甲气球迅速鼓起,而乙气球鼓起较慢,说明A与酸反应的速率快,其金属活动性比B强,故选项说法正确。
B、A最终生成氢气的体积比B多,等质量的锌和铁,与足量的稀盐酸反应,铁产生的氢气多,故选项说法错误。
C、A与酸反应的速率快,其金属活动性比B强,等质量的铝和锌,与足量的稀盐酸反应,铝产生的氢气多,A可能是铝,B可能是锌,故选项说法正确。
D、A与酸反应的速率快,其金属活动性比B强,等质量的镁和铁,与足量的稀盐酸反应,镁产生的氢气多,A可能是镁,B可能是铁,故选项说法正确。
故选:B。
7.为了探究金属与酸反应的规律,兴趣小组进行了如下实验:取等质量且表面积相同的Fe片、Mg片、Zn片,分别与等体积、等浓度的稀HCl反应,用温度传感器测得反应温度随时间变化曲线如图所示。下列说法正确的是( )
A.等质量的三种金属与足量稀HCl完全反应生成等质量的H2
B.Mg比Zn、Fe更适合与酸反应以获得平稳的H2流
C.Zn片与稀HCl反应至50s时,溶液中的溶质为ZnCl2
D.相同条件下,金属越活泼,与酸反应放出的热量越多
【答案】D
【解析】A、等质量的三种金属与足量稀HCl完全反应生成氢气质量不相等,镁反应生成氢气最多,锌反应生成氢气最少,该选项说法不正确;
B、单位时间内镁反应放热最多,说明镁和稀盐酸反应最剧烈,因此镁和稀盐酸反应时不能获得平稳的H2流,该选项说法不正确;
C、Zn片与稀HCl反应至50s时,稀盐酸过量,溶液中的溶质为氯化锌和氯化氢,该选项说法不正确;
D、镁在三种金属中最活泼,由图中信息可知,相同条件下,金属越活泼,与酸反应放出的热量越多,该选项说法正确。
故选:D。
8.向两份完全相同的稀盐酸中分别加入过量Zn粉、Fe粉,随着反应的进行,金属质量和生成氢气的质量变化如图所示。请读取图象信息,并根据图象信息判断下列说法正确的是( )
A.Fe与Zn的活动性顺序:Zn>Fe
B.同质量的Zn粉和Fe粉与足量稀盐酸反应生成H2质量:Fe>Zn
C.同质量的Zn粉和Fe粉与足量稀盐酸反应生成H2质量:Fe=Zn
D.同质量同质量分数的稀盐酸分别与Zn粉和Fe粉反应生成H2质量:Fe=Zn
【答案】B
【解析】A、根据图中信息不能判断两种物质的活动性顺序,该选项说法不正确;
B、由图中数据可知,同质量的Zn粉和Fe粉与足量稀盐酸反应生成H2质量:Fe>Zn,该选项说法正确;
C、同质量的Zn粉和Fe粉与足量稀盐酸反应生成H2质量:Fe≠Zn,该选项说法不正确;
D、同质量同质量分数的稀盐酸分别与Zn粉和Fe粉反应生成H2质量不一定相等,例如稀盐酸过量时,生成氢气质量不相等,该选项说法不正确。
故选:B。
9.生铁和足量的硫酸充分反应后,总会有少量残渣剩余,残渣的成分主要是( )
A.铁 B.硫酸铁
C.硫酸亚铁 D.碳和一些杂质
【答案】D
【解析】生铁是含碳量约为2%﹣4.3%的铁合金。将生铁放入足量的硫酸中,铁能与硫酸反应生成硫酸亚铁和氢气,碳不与硫酸反应,充分反应后过滤,剩余的残渣是既不溶于水,又不和酸反应的碳和一些杂质。
故选:D。
10.下面是同学们梳理复习金属与酸反应时得到的一组图象,下列图象不能正确反映对应变化关系的是( )
A.两份完全相同的稀硫酸加入等质量锌粉和铁粉
B.等质量锌粉和铁粉加入足量等浓度的稀硫酸
C.等质量金属中不断加入等体积,等浓度的盐酸至过量
D.等质量锌粉和铁粉加入等体积、等浓度稀硫酸
【答案】A
【解析】A、金属与酸反应时氢气来源于酸中的氢元素,因为酸的量相同,金属过量,故生成的氢气应该相等;生成等质量的氢气,消耗的锌的质量多,故选项图象错误。
B、锌的活动性比铁强,反应速率快,至完全反应,反应时间短;等质量锌粉和铁粉加入足量等浓度的稀硫酸,铁生成氢气的质量比锌多,故选项图象正确。
C、若消耗盐酸相同,则生成氢气质量相同,故开始两斜线重合,后因盐酸过量,铁消耗盐酸多,拐点高些,故选项图象正确。
D、等质量锌粉和铁粉加入等体积、等浓度稀硫酸,锌的活动性比铁强,反应速率快,至完全反应,反应时间短,锌先完全反应,质量先减少至0,故选项图象正确。
故选:A。
11.等质量、等浓度的稀硫酸分别与足量的镁、锌两种金属反应,下列图象能正确表示产生氢气质量与反应时间之间关系的是( )
A.
B.
C.
D.
【答案】B
【解析】在金属活动性顺序中,Mg>Zn,则镁的反应速率最快,锌的反应速率慢,等质量的硫酸与足量的镁、锌反应,则酸全部参加反应,生成氢气的质量相同;
A、此图象中生成氢气的质量不同,故A错误;
B、此图象中生成氢气的质量相同,且镁的斜线最陡,表明镁反应的速率快,锌的斜线最平缓,表明锌的反应速率慢,故B正确;
C、此图中锌的斜线比镁的斜线陡,表明是锌比镁反应的速率快,故C错误;
D、此图中反应生成的氢气质量不同,故D错误;
故选:B。
12.未经打磨的铝片放入盛有足量稀盐酸的密闭容器中,通过气压传感器测得容器内气体压强和反应时间的变化关系如图所示。下列分析不合理的是( )
A.a→b段气压几乎没增大,是因为铝未参加反应
B.b→c段比c→d段反应慢,是因为氧化铝的缘故
C.b→d段气压增大是由产生气体和反应放热引起的
D.e点一定是容器中化学反应的终点
【答案】D
【解析】A、a→b段气压几乎没增大,是因为盐酸和氧化铝反应生成氯化铝和水,铝未参加反应,该选项说法正确;
B、b→c段比c→d段反应慢,是因为氧化铝的缘故,该选项说法正确;
C、b→d段气压增大是由产生气体和反应放热引起的,该选项说法正确;
D、由图象可知,d点压强最大,一定是容器中化学反应的结束点,该选项说法不正确。
故选:D。
13.天平两边各放质量相等的烧杯,分别盛有等质量等质量分数的稀硫酸(左)和稀盐酸(右),此时天平平衡。现将相同质量的金属锌分别加入到两个烧杯里,充分反应后。下列说法正确的是( )
A.若天平平衡,两烧杯中的酸一定都反应完了
B.若天平不平衡,左边的锌一定有剩余
C.若天平不平衡,指针一定偏向稀盐酸的一边
D.若天平平衡,两烧杯中的酸一定都有剩余
【答案】B
【解析】锌与稀硫酸和稀盐酸反应的质量比分别是:
Zn+H2SO4═ZnSO4+H2↑
65 98 2
Zn+2HCl═ZnCl2+H2↑
65 73 2
A、若天平平衡,说明反应生成氢气质量相等,若两烧杯中的酸都反应完了,生成氢气的质量不相同,该选项说法不正确;
B、若天平不平衡,两边产生氢气的质量不同,盐酸产生的氢气质量大于硫酸,产生的氢气质量越大,消耗锌的质量也越大,所以左边消耗锌的质量小于右边,锌一定有剩余,该选项说法正确;
C、若天平不平衡,说明反应生成氢气质量不相等,由方程式可知,盐酸反应放出的氢气多,指针一定偏向稀硫酸的一边,该选项说法不正确;
D、若天平平衡,说明反应生成氢气质量相等,生成氢气质量相等时,反应锌的质量相同,可能两烧杯中的酸都有剩余,也可能稀硫酸完全反应了,稀盐酸有剩余,该选项说法不正确。
故选:B。
二.填空题(共1小题)
14.铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得。今天,铝已经进入了我们生活的每一个角落。
(1)金属铝具有很好的抗腐蚀性的原因: 。
(2)铝是一种既可以和酸,又可以和强碱溶液反应的金属,请写出铝和氢氧化钾溶液生成偏铝酸钾[KAlO2]和一种可燃性气体单质的化学反应方程式: 。
(3)铝热法是一种利用铝的还原性获得高熔点金属单质的方法,可简单认为是铝与某些金属氧化物在高温条件下发生的置换反应。请写出铝与四氧化三铁反应的化学方程式: 。
【答案】(1)铝在空气中能与氧气反应,其表面生成一层致密的氧化铝薄膜,防止内部的铝进一步被氧化;
(2)2Al+2KOH+2H2O=2KAlO2+3H2↑;
(3)8Al+3Fe3O49Fe+4Al2O3。
【解析】(1)铝在空气中能与氧气反应,其表面生成一层致密的氧化铝薄膜,防止内部的铝进一步被氧化,因此铝制品抗腐蚀性强。
(2)铝和氢氧化钾溶液生成偏铝酸钾[KAlO2]和一种可燃性气体单质,由质量守恒定律,可燃性气体单质是氢气,反应的化学方程式为2Al+2KOH+2H2O=2KAlO2+3H2↑。
(3)铝与某些金属氧化物在高温条件下发生的置换反应,铝与四氧化三铁反应生成铁和氧化铝,反应的化学方程式为8Al+3Fe3O49Fe+4Al2O3。
故答案为:
(1)铝在空气中能与氧气反应,其表面生成一层致密的氧化铝薄膜,防止内部的铝进一步被氧化;
(2)2Al+2KOH+2H2O=2KAlO2+3H2↑;
(3)8Al+3Fe3O49Fe+4Al2O3。
三.实验探究题(共1小题)
15.运用手持技术探究金属与酸的反应。
向250mL的烧瓶内注入25mL溶质质量分数8.8%的稀盐酸,分别剪取长约4cm、宽约0.4cm的镁、铝、锌、铁、铜金属条,打磨后投入烧瓶中,迅速塞紧带有压强传感器的橡皮塞(见图1),点击采集,得到如图2所示的气压变化曲线。回答下列问题:
(1)曲线a对应的金属是 。
(2)曲线b对应的金属是铁,反应的化学方程式为 。
(3)曲线c在18s左右达到最高点后又略微下降的原因是 。
(4)下列说法错误的是 。
A.d对应的反应速率适中,适合实验室制取气体
B.如延长反应时间,可得到d的图象是一条直线
C.从0~100s图象可推测e对应的金属打磨不彻底
D.从250﹣450s图象推测e反应时盐酸浓度在变大
【答案】(1)铜。
(2)Fe+2HCl=FeCl2+H2↑。
(3)镁与稀盐酸反应放热,在18s反应结束,温度降低。
(4)BD。
【解析】由金属活动性顺序表可知,金属的活动性强弱是:镁>锌>铁>铜。
(1)曲线a不变,也就是压强不变,没有气体放出,铜与稀盐酸不反应,对应的金属是铜。
(2)曲线b变化较慢,也就是反应进行的速率较为缓慢,铁与稀盐酸反应比较缓慢,对应的金属是铁,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑。
(3)曲线c是压强变化最快的,镁与稀盐酸反应比较剧烈,对应的金属应是镁,在18s左右达到最高点后又略微下降的原因是:镁与稀盐酸反应放热,在18s反应结束,温度降低。
(4)A.d对应的反应速率适中,应是锌,适合实验室制取气体,故A说法正确;
B.反应停止后不再产生氢气,压强不变,不再是一条直线,故B说法不正确;
C、从0~100s图象可推测e对应的金属打磨不彻底,酸与金属氧化物反应不放出氢气,压强不变,故C说法正确;
D.随着反应的进行,盐酸浓度在变小,故D说法不正确。
同课章节目录
