2.2.1 分子的空间构型 课件 2022-2023学年高二化学人教版(2019)选择性必修2(29张ppt)
文档属性
| 名称 | 2.2.1 分子的空间构型 课件 2022-2023学年高二化学人教版(2019)选择性必修2(29张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 16:39:20 | ||
图片预览





文档简介
(共29张PPT)
化学
第二节 分子的空间构型
价层电子对互斥理论
温故知新
共价键
σ 键:
π 键:
成键方式 “头碰头”,呈轴对称
成键方式 “肩并肩”,呈镜像对称
键参数
键能
键长
键角
衡量化学键的稳定性
决定分子的立体构型的重要因素
分子的立体构型:
在多原子分子中,由于原子间排列的空间顺序不一样,使得分子有不同的结构,这就是所谓的分子的立体构型。
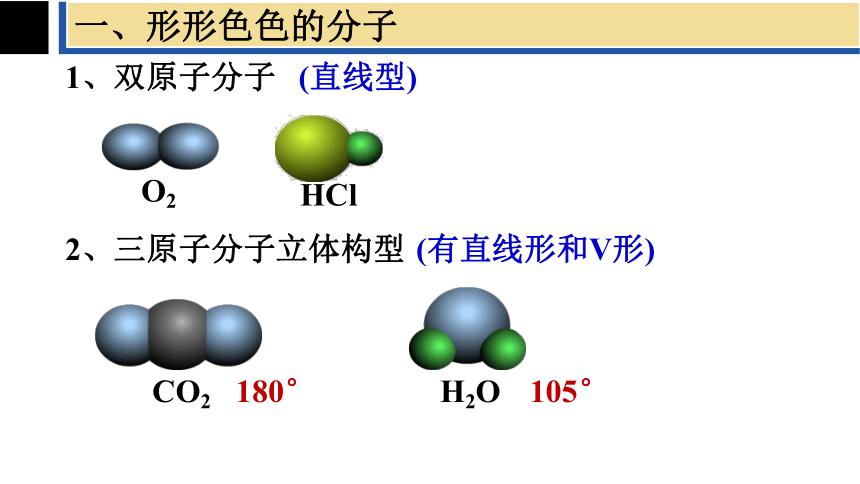
一、形形色色的分子
1、双原子分子
(直线型)
O2
HCl
2、三原子分子立体构型
(有直线形和V形)
CO2
H2O
180°
105°
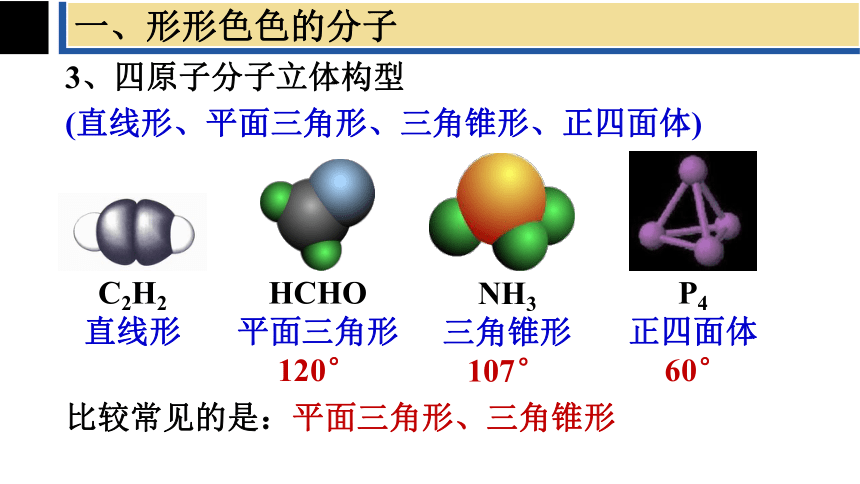
一、形形色色的分子
3、四原子分子立体构型
(直线形、平面三角形、三角锥形、正四面体)
比较常见的是:平面三角形、三角锥形
NH3
三角锥形107°
HCHO
平面三角形
120°
C2H2
直线形
P4
正四面体
60°
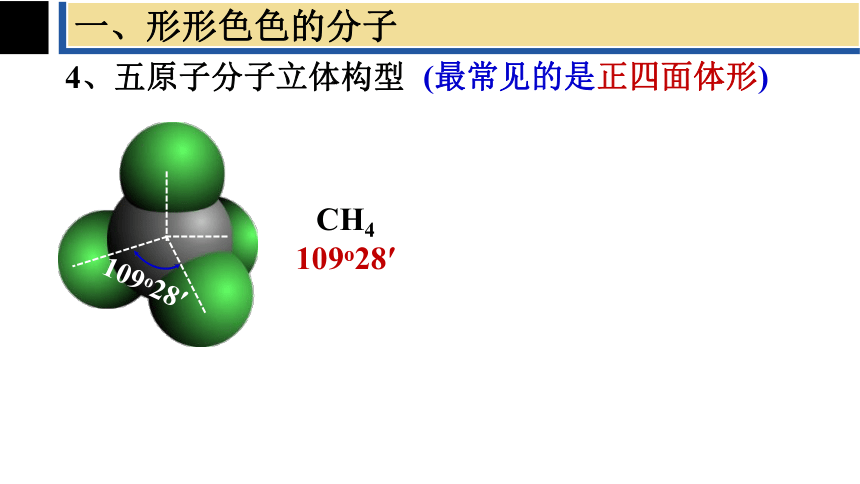
一、形形色色的分子
4、五原子分子立体构型
(最常见的是正四面体形)
109o28′
CH4
109o28′
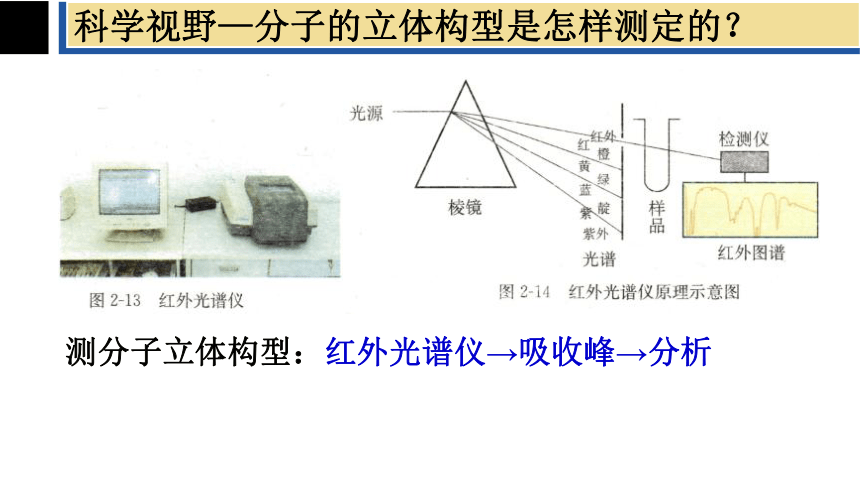
资料卡片:形形色色的分子
科学家已经创造出了许许多多测定分子结构的现代仪器,红外光谱就是其中的一种。
分子中的原子不是固定不动的,而是不断地振动着的。所谓的分子立体构型其实只是分子中的原子处于平衡位置时的模型。
当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现出吸收峰。通过计算机放入模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式来引起的,综合这些信息,可以分析出分子的立体构型。
科学视野—分子的立体构型是怎样测定的?
测分子立体构型:红外光谱仪→吸收峰→分析
科学视野—分子的立体构型是怎样测定的?
思考:为何会有不同的立体构型?
问题一:同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?
问题二:同为四原子分子,HCHO与 NH3 分子的空间结构也不同,什么原因?
路易斯(G.N.Lewis)结构式
路易斯结构式:用短线表示键合电子,小黑点表示未键合的孤电子对的结构式
例:HCl
H:Cl:
: :
H—Cl:
: :
写出下列分子的电子式、Lewis结构式及立体构型
分子 CO2 H2O NH3 CH2O
电子式
Lewis结构式
中心原子有 无孤对电子
空间结构
O C O
:
:
:
:
:
:
:
:
H O H
: :
.
.
.
.
H N H
:
.
.
.
.
.
.
H
H C H
:
.
.
.
.
O
:
: :
:
:
:
O═C═O
:
H O H
: :
H N H
:
H
: :
H C H
O
无
有
有
无
直线形
V 形
三角锥形
平面三角形
归纳总结
同为三原子或四原子分子,其分子空间构型不同,是由于分子中的成键电子对和中心原子上的孤电子对相互排斥,结果趋向尽可能彼此远离,在空间均匀分布,达到斥力最小。
吹气球游戏:如果将每个气球吹成一样大小,将其中的两个通过吹气口系在一起,你将会发现这两个气球自然成一直线,再向其中加入一个气球并通过吹气口系在一起,你会发现这三个气球均匀地分开成正三角形分布。依次再向其中加入一个气球并通过吹气口系在一起,你会有什么预期?
生活中的一个游戏现象:搭建气球模型
结果:两个大小相同的气球成直线分布;
三个大小相同的气球成正三角形分布;
四个大小相同的气球成正四面体分布;
五个大小相同的气球成三角双锥分布;
六个大小相同的气球成正八面体分布。
二、价层电子对互斥(VSEPR)理论
分子的立体构型是“价层电子对”相互排斥的结果
价层电子对:
指分子中的中心原子上的电子对
包括 σ 键电子对和孤电子对
注意:不包括成键的π电子对 !
价层电子对互斥理论要点
二、价层电子对互斥(VSEPR)理论
分子 H2O CO2
中心原子
中心原子的价电子数
与中心原子结合的原子数
与中心原子结合的原子 最多能接受的电子数
孤电子对数
σ 键电子对数
中心原子的价层电子对数
O C O
:
:
:
:
:
:
:
:
H O H
: :
.
.
.
.
C
4
2
2
O
6
2
1
6
- 2
×1
2
═
2
4
- 2
×2
2
═
0
中心原子的价电子数
与中心原子结合的原子数
与中心原子结合的原子最多能接受的电子数
-
×
2
=
二、价层电子对互斥(VSEPR)理论
分子 H2O CO2
中心原子
中心原子的价电子数
与中心原子结合的原子数
与中心原子结合的原子 最多能接受的电子数
孤电子对数
σ 键电子对数
中心原子的价层电子对数
O C O
:
:
:
:
:
:
:
:
H O H
: :
.
.
.
.
C
4
2
2
O
6
2
1
2
2
6
- 2
×1
2
═
2
4
- 2
×2
2
═
0
4
2
与中心原子结合的原子个数
a
x
b
孤电子对数 = (a-xb)
1
2
二、价层电子对互斥(VSEPR)理论
1、内容
对ABn型的分子或离子,中心原子A价层电子对(包括成键σ键电子对和未成键的孤电子对)之间由于存在排斥力,将使分子的几何构型总是采取电子对相互排斥最小的那种构型,以使彼此之间斥力最小,分子体系能量最低,最稳定。
二、价层电子对互斥(VSEPR)理论
2、中心原子价层电子对数计算
①确定中心原子价层电子对数目
价层电子对数
═ 配位原子数+孤电子对数
═ σ键电子对数+孤电子对数
═ (中心原子价电子数+结合原子数)/2
中心原子上的孤电子对数 ═ 价层电子对数-结合原子数
中心原子上的孤电子对数 ═ (a-xb)
1
2
二、价层电子对互斥(VSEPR)理论
中心原子上的孤电子对数 ═ (a-xb)
1
2
阴离子: 为中心原子 的价电子数加上离子的电荷数。
a:
x:
b:
原子: 为中心原子的价电子数;
阳离子: 为中心原子的价电子数减去离子的电荷数;
为与中心原子结合的原子数
为与中心原子结合的原子最多能接受的电子数
(H为1,其他原子为“8-该原子的最外层电子数)
分子或离子 a x b 中心原子上的 孤电子对数 σ键电子对数 价层电子对数
NH3
CH4
SO2
HCN
PCl5
SF6
NH4+
CO32-
SO42-
5
3
4
3
1
1
4
4
4
4
0
1
6
6
3
2
1
6
4
1+1
2
2
0
1+3
5
5
5
5
0
1
6
6
6
6
0
1
5-1
4
4
4
0
1
4+2
3
3
3
0
2
6+2
4
4
4
0
2
二、价层电子对互斥(VSEPR)理论
二、价层电子对互斥(VSEPR)理论
②确定中心原子价层电子对模型
价层电子对数目 2 3 4 5 6
价层电子对模型
直线形
平面
三角形
正四
面体形
三角
双锥
正八
面体
注意:孤电子对的存在会改变成键电子对的分布方向,从而改变化合物的键角。
不同价层电子对之间排斥作用的顺序为:
孤电子对—孤电子对>孤电子对—成键电子对>成键电子对—成键电子对
二、价层电子对互斥(VSEPR)理论
3、确定分子或离子的立体构型
中心原子价层电子对数
VSEPR
模型
略去孤电子对
分子(或离子)的立体构型
二、价层电子对互斥(VSEPR)理论
分子 H2O CO2
孤电子对数
价层电子对数
VSEPR 模型及名称
分子的立体 构型及名称
4
2
2
0
正四
面体形
直线形
V形
直线形
无孤电子对的VSEPR模型与分子的立体构型相同;
有孤电子对的VSEPR模型与分子的立体构型不同。
二、价层电子对互斥(VSEPR)理论
SO2
NH4+
3
1
孤电子对数
价层电子对数
NH3
4
1
CH4
4
0
CO32-
4
0
3
0
分子或离子
VSEPR模型名称
分子或离子立体构型名称
VSEPR模型
分子或离子立体构型
三角锥形
四面体形
正四面体形
正四面体形
平面三角形
V 形
正四面体形
正四面体形
平面三角形
平面三角形
小结:ABn 型分子的VSEPR模型和立体结构
价层电子对 VSER 模型 成键电子对数 孤电子对数 分子类型 电子对的排布模型 分子构型 实例
4
正四面体
AB4
4 0
3 1 AB3
2 2 AB2
正四
面体形
三角锥形
V 形
NH4+
SO42-
CH4/CCl4
SO32-
H3O+
NH3/PCl3
H2O
H2S
小结:ABn 型分子的VSEPR模型和立体结构
价层电子对 VSER 模型 成键电子对数 孤电子对数 分子类型 电子对的排布模型 分子构型 实例
2
3
2 0 AB2
直线形
直线形
CO2
BeCl2
平面
三角形
3 0 AB3
2 1 AB2
平面
三角形
V 形
BF3
SO3
SO2
当堂反馈
1、下列分子立体构型中属正八面体型分子的是( )
A.H3O+ B.CO32—
C.PCl5 D.SF6
2、下列分子①BCl3、②CCl4、③H2S、④CS2中,
其键角由小到大的顺序为_________
D
分析:①BCl3:平面三角形 60
②CCl4:正四面体
③H2S:V 形
④CS2:直线形 180
分析:CCl4、NH3、H2S的VSEPR模型均为正四面体形,但中心原子的孤电子对依次0、1、2对,根据价层电子对互斥理论,斥力为孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对,孤电子对数增多,对成键电子的斥力增大,故三者键角依次减小。
当堂反馈
当堂反馈
1、下列分子立体构型中属正八面体型分子的是( )
A.H3O+ B.CO32—
C.PCl5 D.SF6
2、下列分子①BCl3、②CCl4、③H2S、④CS2中,
其键角由小到大的顺序为_________
D
分析:①BCl3:平面三角形 60
②CCl4:正四面体
③H2S:V 形
④CS2:直线形 180
①<③<②<④
化学
第二节 分子的空间构型
价层电子对互斥理论
温故知新
共价键
σ 键:
π 键:
成键方式 “头碰头”,呈轴对称
成键方式 “肩并肩”,呈镜像对称
键参数
键能
键长
键角
衡量化学键的稳定性
决定分子的立体构型的重要因素
分子的立体构型:
在多原子分子中,由于原子间排列的空间顺序不一样,使得分子有不同的结构,这就是所谓的分子的立体构型。
一、形形色色的分子
1、双原子分子
(直线型)
O2
HCl
2、三原子分子立体构型
(有直线形和V形)
CO2
H2O
180°
105°
一、形形色色的分子
3、四原子分子立体构型
(直线形、平面三角形、三角锥形、正四面体)
比较常见的是:平面三角形、三角锥形
NH3
三角锥形107°
HCHO
平面三角形
120°
C2H2
直线形
P4
正四面体
60°
一、形形色色的分子
4、五原子分子立体构型
(最常见的是正四面体形)
109o28′
CH4
109o28′
资料卡片:形形色色的分子
科学家已经创造出了许许多多测定分子结构的现代仪器,红外光谱就是其中的一种。
分子中的原子不是固定不动的,而是不断地振动着的。所谓的分子立体构型其实只是分子中的原子处于平衡位置时的模型。
当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现出吸收峰。通过计算机放入模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式来引起的,综合这些信息,可以分析出分子的立体构型。
科学视野—分子的立体构型是怎样测定的?
测分子立体构型:红外光谱仪→吸收峰→分析
科学视野—分子的立体构型是怎样测定的?
思考:为何会有不同的立体构型?
问题一:同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?
问题二:同为四原子分子,HCHO与 NH3 分子的空间结构也不同,什么原因?
路易斯(G.N.Lewis)结构式
路易斯结构式:用短线表示键合电子,小黑点表示未键合的孤电子对的结构式
例:HCl
H:Cl:
: :
H—Cl:
: :
写出下列分子的电子式、Lewis结构式及立体构型
分子 CO2 H2O NH3 CH2O
电子式
Lewis结构式
中心原子有 无孤对电子
空间结构
O C O
:
:
:
:
:
:
:
:
H O H
: :
.
.
.
.
H N H
:
.
.
.
.
.
.
H
H C H
:
.
.
.
.
O
:
: :
:
:
:
O═C═O
:
H O H
: :
H N H
:
H
: :
H C H
O
无
有
有
无
直线形
V 形
三角锥形
平面三角形
归纳总结
同为三原子或四原子分子,其分子空间构型不同,是由于分子中的成键电子对和中心原子上的孤电子对相互排斥,结果趋向尽可能彼此远离,在空间均匀分布,达到斥力最小。
吹气球游戏:如果将每个气球吹成一样大小,将其中的两个通过吹气口系在一起,你将会发现这两个气球自然成一直线,再向其中加入一个气球并通过吹气口系在一起,你会发现这三个气球均匀地分开成正三角形分布。依次再向其中加入一个气球并通过吹气口系在一起,你会有什么预期?
生活中的一个游戏现象:搭建气球模型
结果:两个大小相同的气球成直线分布;
三个大小相同的气球成正三角形分布;
四个大小相同的气球成正四面体分布;
五个大小相同的气球成三角双锥分布;
六个大小相同的气球成正八面体分布。
二、价层电子对互斥(VSEPR)理论
分子的立体构型是“价层电子对”相互排斥的结果
价层电子对:
指分子中的中心原子上的电子对
包括 σ 键电子对和孤电子对
注意:不包括成键的π电子对 !
价层电子对互斥理论要点
二、价层电子对互斥(VSEPR)理论
分子 H2O CO2
中心原子
中心原子的价电子数
与中心原子结合的原子数
与中心原子结合的原子 最多能接受的电子数
孤电子对数
σ 键电子对数
中心原子的价层电子对数
O C O
:
:
:
:
:
:
:
:
H O H
: :
.
.
.
.
C
4
2
2
O
6
2
1
6
- 2
×1
2
═
2
4
- 2
×2
2
═
0
中心原子的价电子数
与中心原子结合的原子数
与中心原子结合的原子最多能接受的电子数
-
×
2
=
二、价层电子对互斥(VSEPR)理论
分子 H2O CO2
中心原子
中心原子的价电子数
与中心原子结合的原子数
与中心原子结合的原子 最多能接受的电子数
孤电子对数
σ 键电子对数
中心原子的价层电子对数
O C O
:
:
:
:
:
:
:
:
H O H
: :
.
.
.
.
C
4
2
2
O
6
2
1
2
2
6
- 2
×1
2
═
2
4
- 2
×2
2
═
0
4
2
与中心原子结合的原子个数
a
x
b
孤电子对数 = (a-xb)
1
2
二、价层电子对互斥(VSEPR)理论
1、内容
对ABn型的分子或离子,中心原子A价层电子对(包括成键σ键电子对和未成键的孤电子对)之间由于存在排斥力,将使分子的几何构型总是采取电子对相互排斥最小的那种构型,以使彼此之间斥力最小,分子体系能量最低,最稳定。
二、价层电子对互斥(VSEPR)理论
2、中心原子价层电子对数计算
①确定中心原子价层电子对数目
价层电子对数
═ 配位原子数+孤电子对数
═ σ键电子对数+孤电子对数
═ (中心原子价电子数+结合原子数)/2
中心原子上的孤电子对数 ═ 价层电子对数-结合原子数
中心原子上的孤电子对数 ═ (a-xb)
1
2
二、价层电子对互斥(VSEPR)理论
中心原子上的孤电子对数 ═ (a-xb)
1
2
阴离子: 为中心原子 的价电子数加上离子的电荷数。
a:
x:
b:
原子: 为中心原子的价电子数;
阳离子: 为中心原子的价电子数减去离子的电荷数;
为与中心原子结合的原子数
为与中心原子结合的原子最多能接受的电子数
(H为1,其他原子为“8-该原子的最外层电子数)
分子或离子 a x b 中心原子上的 孤电子对数 σ键电子对数 价层电子对数
NH3
CH4
SO2
HCN
PCl5
SF6
NH4+
CO32-
SO42-
5
3
4
3
1
1
4
4
4
4
0
1
6
6
3
2
1
6
4
1+1
2
2
0
1+3
5
5
5
5
0
1
6
6
6
6
0
1
5-1
4
4
4
0
1
4+2
3
3
3
0
2
6+2
4
4
4
0
2
二、价层电子对互斥(VSEPR)理论
二、价层电子对互斥(VSEPR)理论
②确定中心原子价层电子对模型
价层电子对数目 2 3 4 5 6
价层电子对模型
直线形
平面
三角形
正四
面体形
三角
双锥
正八
面体
注意:孤电子对的存在会改变成键电子对的分布方向,从而改变化合物的键角。
不同价层电子对之间排斥作用的顺序为:
孤电子对—孤电子对>孤电子对—成键电子对>成键电子对—成键电子对
二、价层电子对互斥(VSEPR)理论
3、确定分子或离子的立体构型
中心原子价层电子对数
VSEPR
模型
略去孤电子对
分子(或离子)的立体构型
二、价层电子对互斥(VSEPR)理论
分子 H2O CO2
孤电子对数
价层电子对数
VSEPR 模型及名称
分子的立体 构型及名称
4
2
2
0
正四
面体形
直线形
V形
直线形
无孤电子对的VSEPR模型与分子的立体构型相同;
有孤电子对的VSEPR模型与分子的立体构型不同。
二、价层电子对互斥(VSEPR)理论
SO2
NH4+
3
1
孤电子对数
价层电子对数
NH3
4
1
CH4
4
0
CO32-
4
0
3
0
分子或离子
VSEPR模型名称
分子或离子立体构型名称
VSEPR模型
分子或离子立体构型
三角锥形
四面体形
正四面体形
正四面体形
平面三角形
V 形
正四面体形
正四面体形
平面三角形
平面三角形
小结:ABn 型分子的VSEPR模型和立体结构
价层电子对 VSER 模型 成键电子对数 孤电子对数 分子类型 电子对的排布模型 分子构型 实例
4
正四面体
AB4
4 0
3 1 AB3
2 2 AB2
正四
面体形
三角锥形
V 形
NH4+
SO42-
CH4/CCl4
SO32-
H3O+
NH3/PCl3
H2O
H2S
小结:ABn 型分子的VSEPR模型和立体结构
价层电子对 VSER 模型 成键电子对数 孤电子对数 分子类型 电子对的排布模型 分子构型 实例
2
3
2 0 AB2
直线形
直线形
CO2
BeCl2
平面
三角形
3 0 AB3
2 1 AB2
平面
三角形
V 形
BF3
SO3
SO2
当堂反馈
1、下列分子立体构型中属正八面体型分子的是( )
A.H3O+ B.CO32—
C.PCl5 D.SF6
2、下列分子①BCl3、②CCl4、③H2S、④CS2中,
其键角由小到大的顺序为_________
D
分析:①BCl3:平面三角形 60
②CCl4:正四面体
③H2S:V 形
④CS2:直线形 180
分析:CCl4、NH3、H2S的VSEPR模型均为正四面体形,但中心原子的孤电子对依次0、1、2对,根据价层电子对互斥理论,斥力为孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对,孤电子对数增多,对成键电子的斥力增大,故三者键角依次减小。
当堂反馈
当堂反馈
1、下列分子立体构型中属正八面体型分子的是( )
A.H3O+ B.CO32—
C.PCl5 D.SF6
2、下列分子①BCl3、②CCl4、③H2S、④CS2中,
其键角由小到大的顺序为_________
D
分析:①BCl3:平面三角形 60
②CCl4:正四面体
③H2S:V 形
④CS2:直线形 180
①<③<②<④
