2.2.2 分子的空间构型 课件 2022-2023学年高二化学人教版(2019)选择性必修2(30张ppt)
文档属性
| 名称 | 2.2.2 分子的空间构型 课件 2022-2023学年高二化学人教版(2019)选择性必修2(30张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 00:00:00 | ||
图片预览



文档简介
(共30张PPT)
化学
第二节 分子的空间构型
杂化轨道理论
温故知新
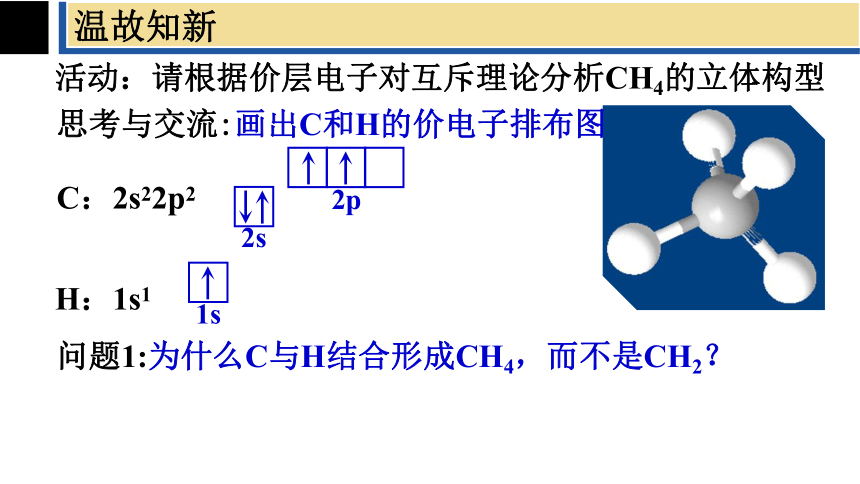
活动:请根据价层电子对互斥理论分析CH4的立体构型
思考与交流:画出C和H的价电子排布图
C:2s22p2
H:1s1
2s
2p
1s
问题1:为什么C与H结合形成CH4,而不是CH2?
温故知新
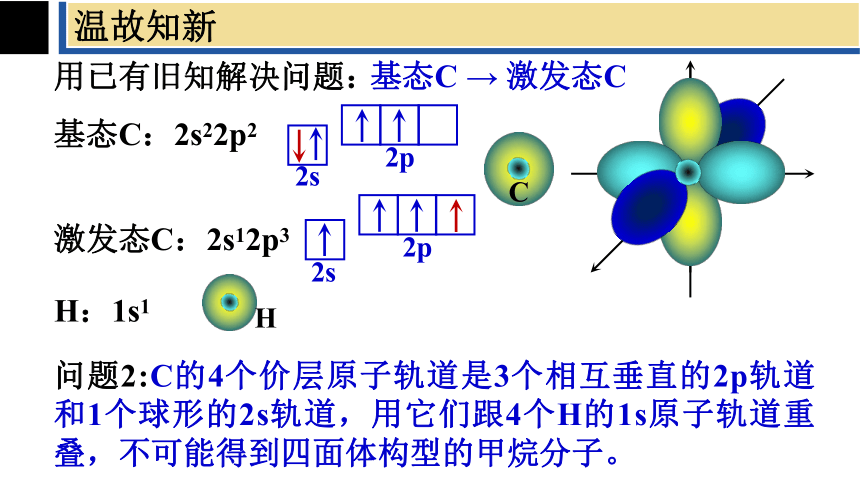
用已有旧知解决问题:
基态C:2s22p2
2s
2p
基态C → 激发态C
激发态C:2s12p3
2s
2p
H:1s1
C
H
问题2:C的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它们跟4个H的1s原子轨道重叠,不可能得到四面体构型的甲烷分子。
三、杂化轨道理论
杂化轨道理论: 解释分子
立体构型的一种价键理论
值得注意的是价层电子对互斥模型只能解释化合物分子的立体构型,却无法解释许多深层次的问题
为了解决这一矛盾鲍林提出杂化轨道理论
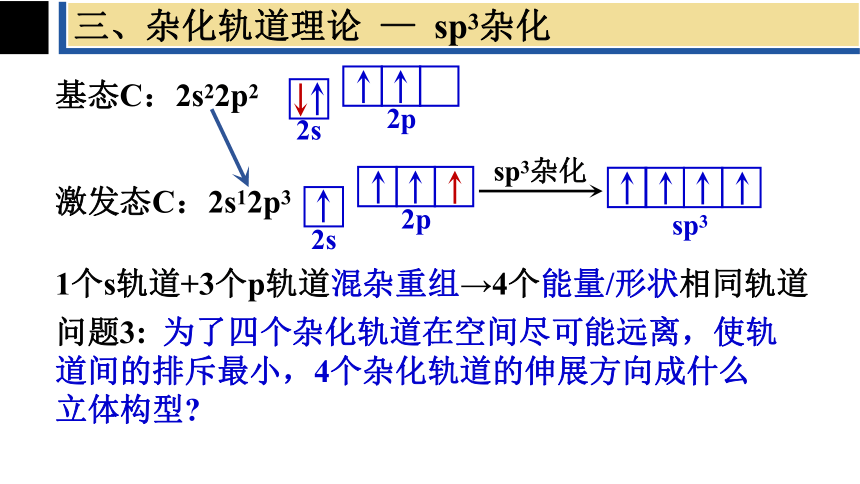
三、杂化轨道理论 — sp3杂化
基态C:2s22p2
2s
2p
激发态C:2s12p3
2s
2p
1个s轨道+3个p轨道混杂重组→4个能量/形状相同轨道
sp3杂化
sp3
问题3: 为了四个杂化轨道在空间尽可能远离,使轨道间的排斥最小,4个杂化轨道的伸展方向成什么立体构型
三、杂化轨道理论 — sp3杂化
三、杂化轨道理论
1、概念:
在形成分子时,在外界条件影响下若干不同类型能量相近的原子轨道混合起来,重新组合成一组新轨道的过程叫做原子轨道的杂化,所形成的新轨道就称为杂化轨道。
理论要点:
(1) 一定是中心原子发生轨道杂化;
(2) 参与杂化的各原子轨道能量相近;
同能级组:ns、np
相近能级组:ns、 np、(n-1)d
sp3、sp2、sp
sp3d、sp2d2、sp3d3
杂化轨道理论 — 理论要点
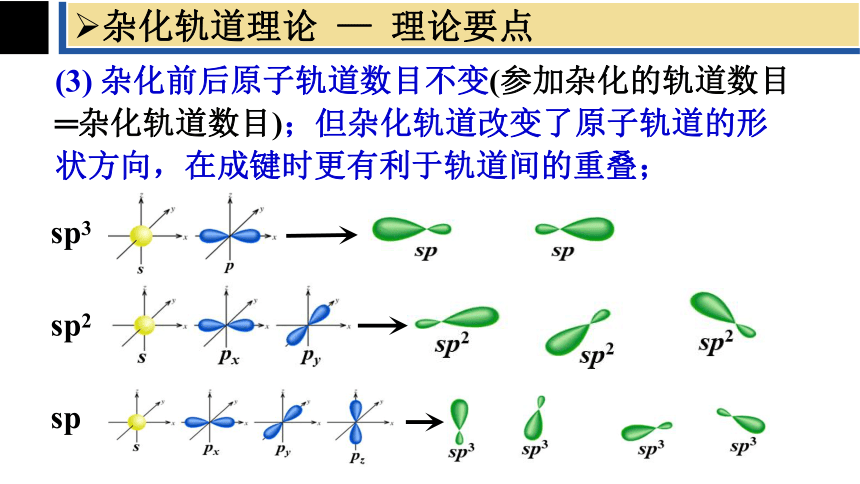
(3) 杂化前后原子轨道数目不变(参加杂化的轨道数目 ═杂化轨道数目);但杂化轨道改变了原子轨道的形状方向,在成键时更有利于轨道间的重叠;
sp3
sp2
sp
杂化轨道理论 — 理论要点
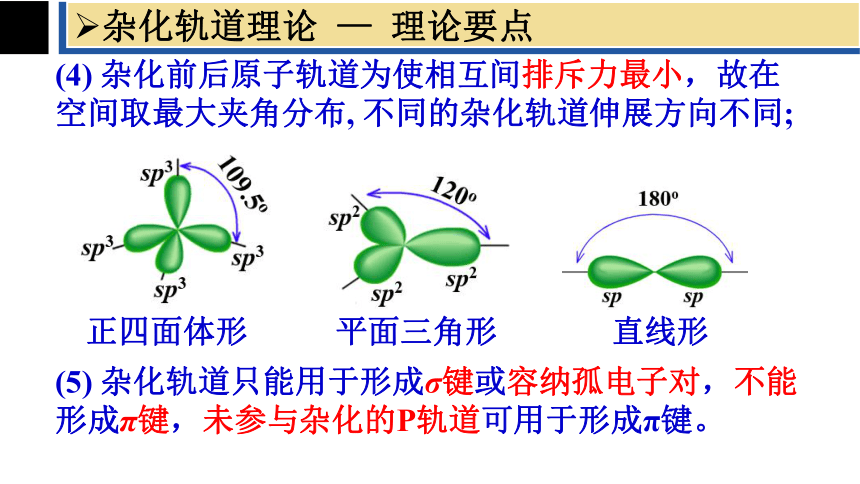
(4) 杂化前后原子轨道为使相互间排斥力最小,故在空间取最大夹角分布, 不同的杂化轨道伸展方向不同;
正四面体形
平面三角形
直线形
(5) 杂化轨道只能用于形成σ键或容纳孤电子对,不能形成π键,未参与杂化的P轨道可用于形成π键。
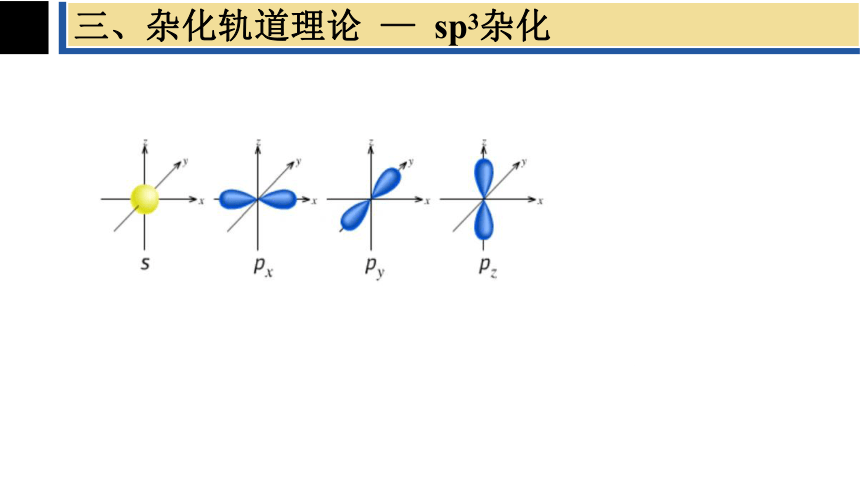
三、杂化轨道的类型 — sp3杂化
x
y
z
x
y
z
x
y
z
x
y
z
x
y
z
2、杂化轨道的类型
杂化轨道的类型 — sp3杂化
x
y
z
x
y
z
109°28′
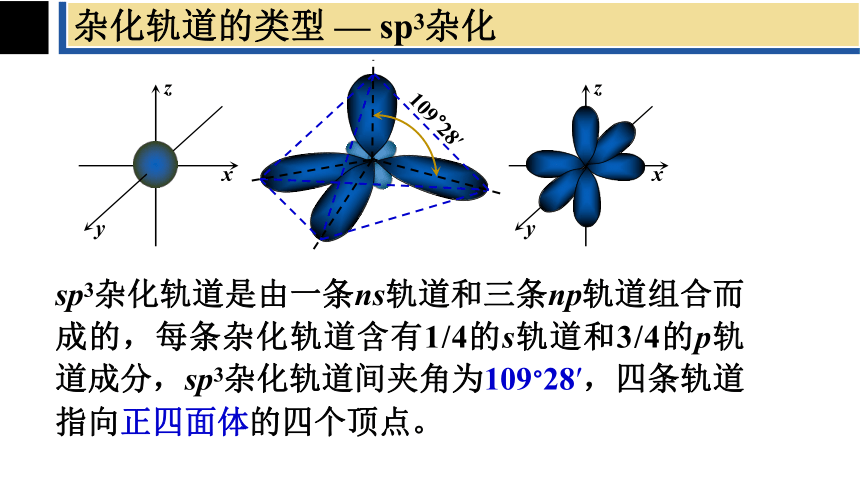
sp3杂化轨道是由一条ns轨道和三条np轨道组合而成的,每条杂化轨道含有1/4的s轨道和3/4的p轨道成分,sp3杂化轨道间夹角为109°28′,四条轨道指向正四面体的四个顶点。
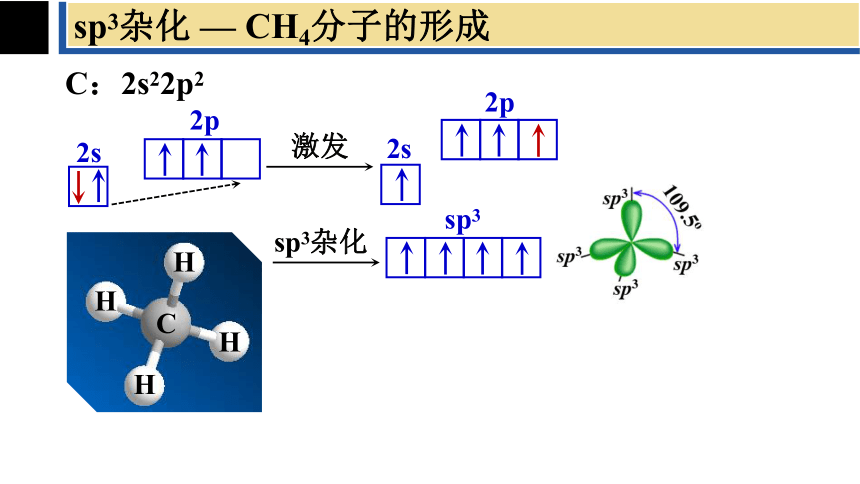
sp3杂化 — CH4分子的形成
C:2s22p2
2s
2p
2s
2p
激发
sp3杂化
sp3
C
H
H
H
H
杂化轨道的类型 — sp2杂化
x
y
z
x
y
z
x
y
z
x
y
z
杂化轨道的类型 — sp2杂化
x
y
z
x
y
z
x
y
z
120°
sp2杂化轨道是由一条ns轨道和两条np轨道组合而成的,每条杂化轨道含有1/3的s轨道和2/3的p轨道成分,sp3杂化轨道间夹角为120°,三条轨道指向平面三角形的三个顶点。
sp2杂化 — BF3分子的形成
B:2s22p1
2s
2p
2s
2p
激发
sp2杂化
sp2
B
F
F
F
杂化轨道的类型 — sp杂化
x
y
z
x
y
z
x
y
z
x
y
z
180°
sp杂化轨道是由一条ns轨道和一条np轨道组合而成的,每条杂化轨道含有1/2的s轨道和1/2的p轨道成分,两条杂化轨道在空间的伸展方向呈直线形,夹角为180°。
sp杂化 — BeCl2分子的形成
Be:2s2
2s
2p
2s
2p
激发
sp杂化
sp
Be
Cl
Cl
三、杂化轨道的类型 —杂化类型判断
3、杂化类型判断
因杂化轨道只能用于形成σ键或容纳孤电子对
杂化轨道数 ═ 中心原子价层电子对数
═ 中心原子孤电子对数+中心原子结合的原子数
杂化类型的判断方法: 先确定分子或离子的VSEPR模型,后确定中心原子的杂化轨道类型。
三、杂化轨道的类型 —杂化类型判断
对于ABn型分子或离子(杂化轨道数 ═ 价电子对数)
A的价电子对数 2 3 4
A的杂化轨道数
A的杂化类型
A的价电子对立体构型
A的杂化轨道立体构型
ABn型分子或离子 立体构型
2 3 4
sp sp2 sp3
直线型
平面三角形
正四面体
直线型
平面三角形
正四面体
直线型
平面三角形
或V形
正四面体
三角锥形或V形
三、杂化轨道的类型 —杂化类型判断
例1、计算下列分子或离子中的价电子对数,并填写下表
物质 价电 子对数 中心原子杂化轨道类型 VSEPR 模型名称 轨道 夹角 分子空 间构型 键角
CO2
SO2
CH2O
NH4+
CH4
NH3
H2O
2
3
3
4
4
4
4
sp
sp2
sp3
直线形
平面
三角形
正四面体
180°
120°
109°28′
直线形
V形
平面三角形
正四
面体
三角锥形
V 形
180°
109.5°
120°
109°28′
107°
104°
三、杂化轨道的类型 —杂化轨道分类
讨论:为什么CH4、NH3、H2O的中心原子均为sp3杂化,而键角却分别为109°28′、 107°和104°?
C:2s22p2
2s
2p
sp3杂化
sp3
等性杂化
等性杂化:各条轨道的成分相等,杂化轨道的能量相等
三、杂化轨道的类型 —杂化轨道分类
sp3杂化
不等性杂化
不等性杂化:各条轨道的成分不相等,杂化轨道的能量不相等
N:2s22p3
2s
2p
sp3
孤电子对
sp3杂化
O:2s22p4
2s
2p
sp3
孤电子对
排斥力:孤—孤>孤—成>成—成
三、杂化轨道的类型 —杂化轨道分类
讨论:为什么CH4、NH3、H2O的中心原子均为sp3杂化,而键角却分别为109°28′、 107°和104°?
交流与讨论
试用杂化轨道理论分析乙烯的杂化类型及立体构型?
C:2s22p2
2s
2p
sp2杂化
C
C
H
H
H
H
C
C
H
H
H
H
π键
三个相同的sp2杂化轨道指向三角形的三个顶点未杂化 p 形成π键;杂化轨道间夹角为120°
sp2
2p
杂化轨道只能用于形成σ键或容纳孤电子对,不能形成π键,未参与杂化的P轨道可用于形成π键。
交流与讨论
试用杂化轨道理论分析乙炔的杂化类型及立体构型?
C
C
H
H
C:2s22p2
2s
2p
sp杂化
sp
2p
两个相同的sp杂化轨道指向线段的两端;
未杂化p形成π键;杂化轨道间夹角为180°
C
C
H
H
π键
π键
交流与讨论
试用杂化轨道理论分析苯的杂化类型及立体构型?
sp2杂化
(1)相邻碳原子sp2杂化轨道成键,以及碳的sp2杂化轨道和H的1s轨道成键,六个碳原子、六个氢原子在同一平面上
(2)六个碳原子的2pz杂化轨道侧面重叠形成大π 键
小结:有机物 C 杂化类型
如:C2H2等
饱和C:
连接双键C:
连接三键C:
sp3杂化
sp2杂化
sp杂化
如:CH4、CH3CH3等饱和烷烃
如:C2H4、HCHO、苯等
当堂反馈
练1、原子轨道的杂化不但出现在分子中,原子团中同样存在原子轨道的杂化。在SO42-中S原子的杂化方式为( )
A.sp B.sp2
C.sp3 D.无法判断
解析:在SO42-中S原子的孤电子对数为0,与其相连的原子数为4,所以根据杂化轨道理论可推知中心原子S的杂化方式为sp3杂化,立体构型为正四面体形,类似于CH4。
C
当堂反馈
练2、在SO2分子中,分子的立体构型为V形,S原子采用sp2杂化,那么SO2的键角( )
A.等于120° B.大于120°
C.小于120° D.等于180°
解析: 由于SO2分子的VSEPR模型为平面三角形,从理论上讲其键角应为120°,但是由于SO2分子中的S原子有一对孤电子对,对其他的两个化学键存在排斥作用,因此分子中的键角要小于120°。
C
当堂反馈
练3、碳原子有4个价电子,在有机化合物中价电子均参与成键,但杂化方式不一定相同。在乙烷、乙烯、乙炔、苯、甲醛分子中,碳原子
采取sp杂化的分子是(写结构简式)_________;
采取sp2杂化的分子是______________________;
采取sp3杂化的分子是_________。
CH≡CH
CH3CH3
CH2= CH2、 、
HCHO
化学
第二节 分子的空间构型
杂化轨道理论
温故知新
活动:请根据价层电子对互斥理论分析CH4的立体构型
思考与交流:画出C和H的价电子排布图
C:2s22p2
H:1s1
2s
2p
1s
问题1:为什么C与H结合形成CH4,而不是CH2?
温故知新
用已有旧知解决问题:
基态C:2s22p2
2s
2p
基态C → 激发态C
激发态C:2s12p3
2s
2p
H:1s1
C
H
问题2:C的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它们跟4个H的1s原子轨道重叠,不可能得到四面体构型的甲烷分子。
三、杂化轨道理论
杂化轨道理论: 解释分子
立体构型的一种价键理论
值得注意的是价层电子对互斥模型只能解释化合物分子的立体构型,却无法解释许多深层次的问题
为了解决这一矛盾鲍林提出杂化轨道理论
三、杂化轨道理论 — sp3杂化
基态C:2s22p2
2s
2p
激发态C:2s12p3
2s
2p
1个s轨道+3个p轨道混杂重组→4个能量/形状相同轨道
sp3杂化
sp3
问题3: 为了四个杂化轨道在空间尽可能远离,使轨道间的排斥最小,4个杂化轨道的伸展方向成什么立体构型
三、杂化轨道理论 — sp3杂化
三、杂化轨道理论
1、概念:
在形成分子时,在外界条件影响下若干不同类型能量相近的原子轨道混合起来,重新组合成一组新轨道的过程叫做原子轨道的杂化,所形成的新轨道就称为杂化轨道。
理论要点:
(1) 一定是中心原子发生轨道杂化;
(2) 参与杂化的各原子轨道能量相近;
同能级组:ns、np
相近能级组:ns、 np、(n-1)d
sp3、sp2、sp
sp3d、sp2d2、sp3d3
杂化轨道理论 — 理论要点
(3) 杂化前后原子轨道数目不变(参加杂化的轨道数目 ═杂化轨道数目);但杂化轨道改变了原子轨道的形状方向,在成键时更有利于轨道间的重叠;
sp3
sp2
sp
杂化轨道理论 — 理论要点
(4) 杂化前后原子轨道为使相互间排斥力最小,故在空间取最大夹角分布, 不同的杂化轨道伸展方向不同;
正四面体形
平面三角形
直线形
(5) 杂化轨道只能用于形成σ键或容纳孤电子对,不能形成π键,未参与杂化的P轨道可用于形成π键。
三、杂化轨道的类型 — sp3杂化
x
y
z
x
y
z
x
y
z
x
y
z
x
y
z
2、杂化轨道的类型
杂化轨道的类型 — sp3杂化
x
y
z
x
y
z
109°28′
sp3杂化轨道是由一条ns轨道和三条np轨道组合而成的,每条杂化轨道含有1/4的s轨道和3/4的p轨道成分,sp3杂化轨道间夹角为109°28′,四条轨道指向正四面体的四个顶点。
sp3杂化 — CH4分子的形成
C:2s22p2
2s
2p
2s
2p
激发
sp3杂化
sp3
C
H
H
H
H
杂化轨道的类型 — sp2杂化
x
y
z
x
y
z
x
y
z
x
y
z
杂化轨道的类型 — sp2杂化
x
y
z
x
y
z
x
y
z
120°
sp2杂化轨道是由一条ns轨道和两条np轨道组合而成的,每条杂化轨道含有1/3的s轨道和2/3的p轨道成分,sp3杂化轨道间夹角为120°,三条轨道指向平面三角形的三个顶点。
sp2杂化 — BF3分子的形成
B:2s22p1
2s
2p
2s
2p
激发
sp2杂化
sp2
B
F
F
F
杂化轨道的类型 — sp杂化
x
y
z
x
y
z
x
y
z
x
y
z
180°
sp杂化轨道是由一条ns轨道和一条np轨道组合而成的,每条杂化轨道含有1/2的s轨道和1/2的p轨道成分,两条杂化轨道在空间的伸展方向呈直线形,夹角为180°。
sp杂化 — BeCl2分子的形成
Be:2s2
2s
2p
2s
2p
激发
sp杂化
sp
Be
Cl
Cl
三、杂化轨道的类型 —杂化类型判断
3、杂化类型判断
因杂化轨道只能用于形成σ键或容纳孤电子对
杂化轨道数 ═ 中心原子价层电子对数
═ 中心原子孤电子对数+中心原子结合的原子数
杂化类型的判断方法: 先确定分子或离子的VSEPR模型,后确定中心原子的杂化轨道类型。
三、杂化轨道的类型 —杂化类型判断
对于ABn型分子或离子(杂化轨道数 ═ 价电子对数)
A的价电子对数 2 3 4
A的杂化轨道数
A的杂化类型
A的价电子对立体构型
A的杂化轨道立体构型
ABn型分子或离子 立体构型
2 3 4
sp sp2 sp3
直线型
平面三角形
正四面体
直线型
平面三角形
正四面体
直线型
平面三角形
或V形
正四面体
三角锥形或V形
三、杂化轨道的类型 —杂化类型判断
例1、计算下列分子或离子中的价电子对数,并填写下表
物质 价电 子对数 中心原子杂化轨道类型 VSEPR 模型名称 轨道 夹角 分子空 间构型 键角
CO2
SO2
CH2O
NH4+
CH4
NH3
H2O
2
3
3
4
4
4
4
sp
sp2
sp3
直线形
平面
三角形
正四面体
180°
120°
109°28′
直线形
V形
平面三角形
正四
面体
三角锥形
V 形
180°
109.5°
120°
109°28′
107°
104°
三、杂化轨道的类型 —杂化轨道分类
讨论:为什么CH4、NH3、H2O的中心原子均为sp3杂化,而键角却分别为109°28′、 107°和104°?
C:2s22p2
2s
2p
sp3杂化
sp3
等性杂化
等性杂化:各条轨道的成分相等,杂化轨道的能量相等
三、杂化轨道的类型 —杂化轨道分类
sp3杂化
不等性杂化
不等性杂化:各条轨道的成分不相等,杂化轨道的能量不相等
N:2s22p3
2s
2p
sp3
孤电子对
sp3杂化
O:2s22p4
2s
2p
sp3
孤电子对
排斥力:孤—孤>孤—成>成—成
三、杂化轨道的类型 —杂化轨道分类
讨论:为什么CH4、NH3、H2O的中心原子均为sp3杂化,而键角却分别为109°28′、 107°和104°?
交流与讨论
试用杂化轨道理论分析乙烯的杂化类型及立体构型?
C:2s22p2
2s
2p
sp2杂化
C
C
H
H
H
H
C
C
H
H
H
H
π键
三个相同的sp2杂化轨道指向三角形的三个顶点未杂化 p 形成π键;杂化轨道间夹角为120°
sp2
2p
杂化轨道只能用于形成σ键或容纳孤电子对,不能形成π键,未参与杂化的P轨道可用于形成π键。
交流与讨论
试用杂化轨道理论分析乙炔的杂化类型及立体构型?
C
C
H
H
C:2s22p2
2s
2p
sp杂化
sp
2p
两个相同的sp杂化轨道指向线段的两端;
未杂化p形成π键;杂化轨道间夹角为180°
C
C
H
H
π键
π键
交流与讨论
试用杂化轨道理论分析苯的杂化类型及立体构型?
sp2杂化
(1)相邻碳原子sp2杂化轨道成键,以及碳的sp2杂化轨道和H的1s轨道成键,六个碳原子、六个氢原子在同一平面上
(2)六个碳原子的2pz杂化轨道侧面重叠形成大π 键
小结:有机物 C 杂化类型
如:C2H2等
饱和C:
连接双键C:
连接三键C:
sp3杂化
sp2杂化
sp杂化
如:CH4、CH3CH3等饱和烷烃
如:C2H4、HCHO、苯等
当堂反馈
练1、原子轨道的杂化不但出现在分子中,原子团中同样存在原子轨道的杂化。在SO42-中S原子的杂化方式为( )
A.sp B.sp2
C.sp3 D.无法判断
解析:在SO42-中S原子的孤电子对数为0,与其相连的原子数为4,所以根据杂化轨道理论可推知中心原子S的杂化方式为sp3杂化,立体构型为正四面体形,类似于CH4。
C
当堂反馈
练2、在SO2分子中,分子的立体构型为V形,S原子采用sp2杂化,那么SO2的键角( )
A.等于120° B.大于120°
C.小于120° D.等于180°
解析: 由于SO2分子的VSEPR模型为平面三角形,从理论上讲其键角应为120°,但是由于SO2分子中的S原子有一对孤电子对,对其他的两个化学键存在排斥作用,因此分子中的键角要小于120°。
C
当堂反馈
练3、碳原子有4个价电子,在有机化合物中价电子均参与成键,但杂化方式不一定相同。在乙烷、乙烯、乙炔、苯、甲醛分子中,碳原子
采取sp杂化的分子是(写结构简式)_________;
采取sp2杂化的分子是______________________;
采取sp3杂化的分子是_________。
CH≡CH
CH3CH3
CH2= CH2、 、
HCHO
