2.3 分子的性质与物质的性质 课件 2022-2023学年高二化学人教版(2019)选择性必修2(56张ppt)
文档属性
| 名称 | 2.3 分子的性质与物质的性质 课件 2022-2023学年高二化学人教版(2019)选择性必修2(56张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 17:01:30 | ||
图片预览








文档简介
(共56张PPT)
第三节 分子的性质与物质的性质
温故知新
复习思考2: 共用电子对在两原子周围出现的机会是否相同,即共用电子对是否偏移?如果发生偏移,电子对偏向什么原子?为什么?
复习思考1: 写出Cl2、O2、N2、HCl、CO2、H2O的电子式和结构式。
一、键的极性和分子的极性
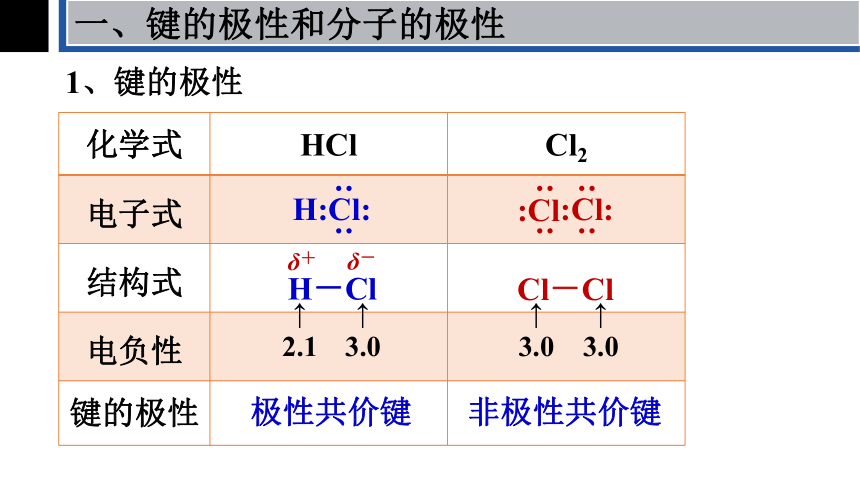
1、键的极性
化学式 HCl Cl2
电子式
结构式
电负性
键的极性
H:Cl:
: :
:Cl:
: :
:Cl
: :
H-Cl
Cl-Cl
↑
2.1
↑
3.0
↑
3.0
↑
3.0
δ+
δ-
极性共价键
非极性共价键
1、键的极性
思考1: 键的极性的判断依据是什么?
共用电子对是否有偏移
②共用电子对有偏移
①共用电子对无偏移
(电荷分布均匀)
(电荷分布不均匀)
非极性键
极性键
一、键的极性和分子的极性
1、键的极性
思考1: 键的极性的判断依据是什么?
思考2: 共用电子对是否偏移是什么因素引起的?
原子对共用电子对的吸引力不同
(元素的电负性)
思考3: 如何判断共价键的极性?
②不同种元素的原子间形成的共价键是极性键
①同种元素的原子间形成的共价键是非极性键
一、键的极性和分子的极性
1、键的极性
思考1: 键的极性的判断依据是什么?
思考2: 共用电子对是否偏移是什么因素引起的?
思考3: 如何判断共价键的极性?
一、键的极性和分子的极性
思考4: 共价键有极性和非极性,那么由共价键构成
的分子是否也有极性和非极性呢?
一、键的极性和分子的极性
探究实验一:用毛皮摩擦过的橡胶棒分别靠近水流与CCl4流,观察实验现象。
现象:
思考:为什么会出现这种现象?
水流方向有变化,而CCl4流的方向没有变化。
一、键的极性和分子的极性
2、分子的极性
(1)概念
极性分子:
非极性分子:
正电中心和负电中心不重合的分子
正电中心和负电中心重合的分子
(2)判断方法:
看正电中心和负电中心是否重合
①看键的极性 + 分子的立体构型
②化学键的极性的向量和是否等于零
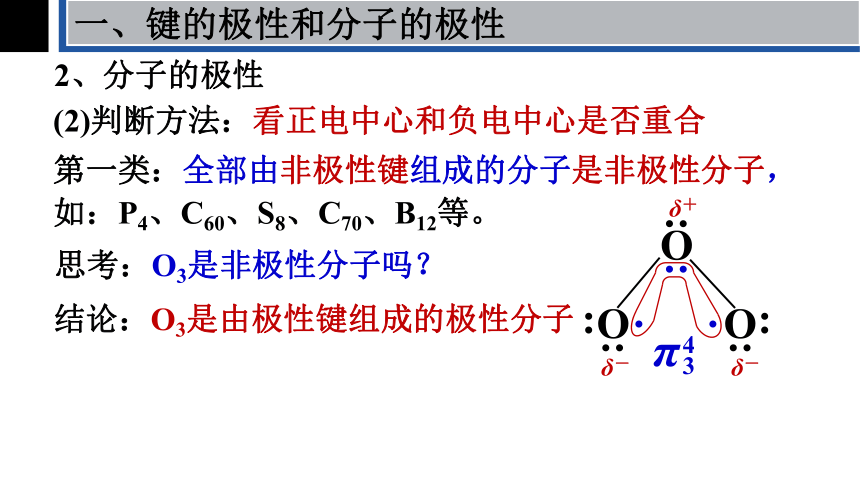
第一类:全部由非极性键组成的分子是非极性分子,如:P4、C60、S8、C70、B12等。
一、键的极性和分子的极性
2、分子的极性
(2)判断方法:看正电中心和负电中心是否重合
思考:O3是非极性分子吗?
O
O
O
:
:
:
:
:
:
.
.
4
3
π
δ+
δ-
δ-
结论:O3是由极性键组成的极性分子
第二类:对于ABn型分子极性判别方法
一、键的极性和分子的极性
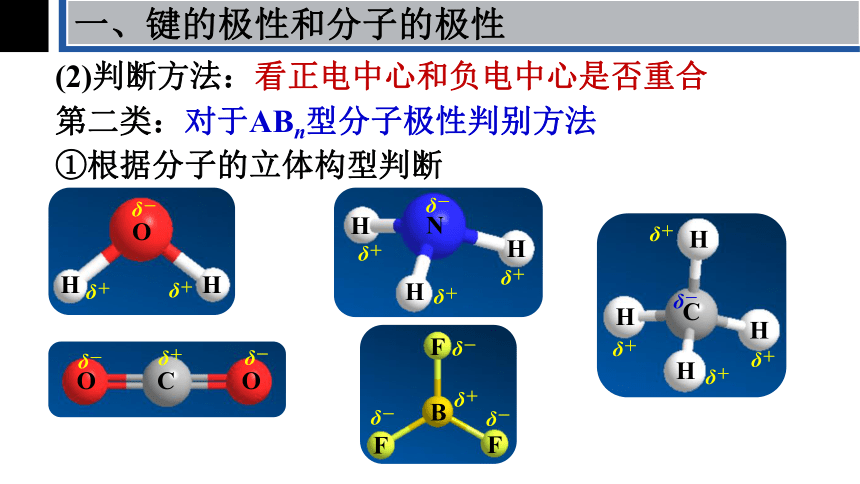
(2)判断方法:看正电中心和负电中心是否重合
①根据分子的立体构型判断
O
H
H
O
O
C
H
H
H
N
B
F
F
F
C
H
H
H
H
δ+
δ-
δ+
δ-
δ+
δ+
δ+
δ-
δ+
δ-
δ-
δ-
δ+
δ+
δ+
δ+
δ-
δ-
δ+
第二类:对于ABn型分子极性判别方法
一、键的极性和分子的极性
(2)判断方法:看正电中心和负电中心是否重合
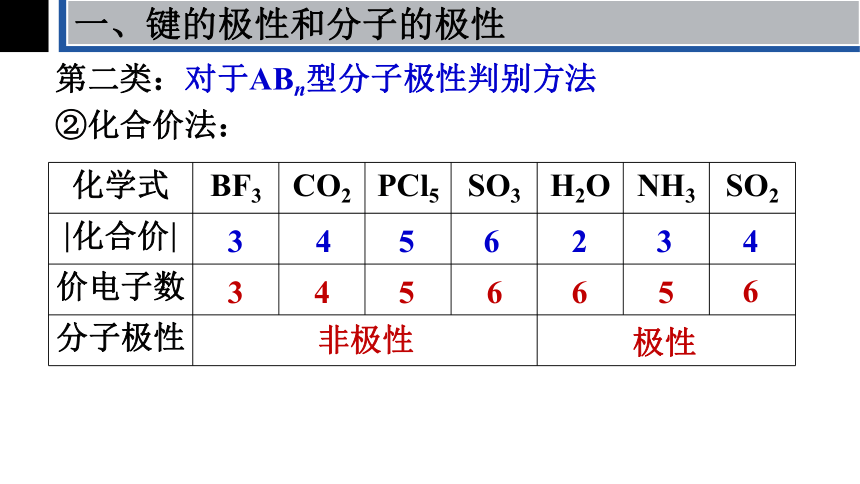
②化合价法:
若中心原子的化合价的绝对值 ═ 该元素的价电子数(无孤电子对)时,该分子为非极性分子,此时分子的立体构型对称;
若中心原子的化合价的绝对值≠其价电子数(有孤电子对),则分子的立体构型不对称,其分子为极性分子。
第二类:对于ABn型分子极性判别方法
一、键的极性和分子的极性
②化合价法:
化学式 BF3 CO2 PCl5 SO3 H2O NH3 SO2
化合价
价电子数
分子极性
3
4
5
6
2
3
4
3
4
5
6
6
5
6
非极性
极性
③物理模型法:从力学的角度分析
第二类:对于ABn型分子极性判别方法
一、键的极性和分子的极性
在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,若F合=0,为非极性分子(极性抵消),F合≠ 0,为极性分子(极性不抵消)。
②化合价法:
①根据分子的立体构型判断
③物理模型法:从力学的角度分析
一、键的极性和分子的极性
BF3
NH3
F1
F2
F3
F合2、3
+F1 ═ 0
F合
≠ 0
小结:常见分子的构型及分子的极性
常见分子 键的极性 键角 分子构型 分子类型
双原子 H2、Cl2
HCl
三原子 CO2
H2O
四原子 NH3
BF3
五原子 CH4
异核多原子 HCN
非极性
正四面体形
109 28′
极 性
非极性
平面三角形
120
极 性
107 18′
极 性
三角锥形
极 性
极 性
V形
104.5
极 性
非极性
极 性
非极性
直线形
直线形
直线形
180
极 性
极 性
非极性
无
无
极 性
180
直线形
极 性
温故知新
极性键
非极
性键
共
价
键
非极性
分子
空间
不对称
空间
对称
双原子分子:HCl、NO、IBr
V形分子:H2O、H2S、SO2
三角锥形分子:NH3、PH3
非正四面体:CHCl3
单质分子:Cl2、N2、P4、O2
直线形分子:CO2、CS2、C2H2
正四面体:CH4、CCl4、
极性
分子
问题探究
思考1:冰山融化现象是物理变化还是化学变化?
思考2:冰山融化过程中有没有破坏其中的化学键?
思考3:为什么冰山融化过程要吸收能量呢?
— 分子间作用力
二、范德华力及其对物质性质的影响
1、范德华力的定义
把分子聚集在一起的这类分子间作用力又称范德华力
分析下表的数据(单位:kJ/mol):
分 子 HCl HBr HI CO Ar
范德华力 21.14 23.11 26.00 8.75 8.50
共价键键能 431.8 366 298.7 745 无
2、范德华力的特点
范德华力很弱,约比化学键能小1~2个数量级。只能在很小的范围内存在,不属于化学键。
二、范德华力及其对物质性质的影响
3、影响范德华力大小的因素
分析下表中的数据:
分子 HCl HBr HI
相对分子质量 36.5 81 128
范德华力(kJ/mol) 21.14 23.11 26.00
熔点/℃ -114.8 -98.5 -50.8
沸点/℃ -84.9 -67 -35.4
(1)结构相似的分子,相对分子质量越大,范德华力
越大,熔、沸越高。
X2 Mr 熔点/℃ 沸点/℃ CX4 Mr 熔点/℃ 沸点/℃
F2 38 -219.6 -188.1 CF4 88 -184 -128
Cl2 71 -101.0 -34.6 CCl4 154 -22.9 76.5
Br2 160 -7.2 -58.8 CBr4 332 90.1 189.5
I2 254 113.5 184.4 CI4 520 - -
二、范德华力及其对物质性质的影响
3、影响范德华力大小的因素
(1)结构相似的分子,相对分子质量越大,范德华力
越大,熔、沸越高。
二、范德华力及其对物质性质的影响
3、影响范德华力大小的因素
分析下表中的数据:
(2)相对分子质量相同或接近时,分子的极性越大,
范德华力越大,熔、沸越高。
分子 Mr 分子的极性 熔点/℃ 沸点/℃
CO 28 极 性 -205.05 -191.49
N2 28 非极性 -210.00 -195.81
小结:化学键与范德华力的比较
化学键 范德华力
概念
存在范围
作用力强弱
影响的性质
使原子相结合的相互作用
分子内、原子间
较 强
主要影响化学性质
把分子聚集在一起的作用力
分子之间
与化学键相比弱的多
主要影响物理性质(如:熔沸点)
问题探究 — 一些氢化物的沸点
一些氢化物的沸点(单位: ℃)
CH4 -160
SiH4 -112
GeH4 -88
SnH4 -52
NH3 -33
PH3 -88
AsH3 -55
SbH3 -18
H2O 100
H2S -61
H2Se -44
H2Te -2
HF 20
HCl -85
HBr -67
HI -36
碳 族 氮 族 氧 族 卤 族
思考:非金属元素的氢化物在固态时是分子晶体,其熔沸点与其相对分子质量有关;对于同一主族非金属元素而言,从上到下,Mr逐渐增大,熔沸点应逐渐升高,而HF、H2O、NH3却出现反常,为什么?
问题探究 — 一些氢化物的沸点
一些氢化物的沸点(单位: ℃)
CH4 -160
SiH4 -112
GeH4 -88
SnH4 -52
NH3 -33
PH3 -88
AsH3 -55
SbH3 -18
H2O 100
H2S -61
H2Se -44
H2Te -2
HF 20
HCl -85
HBr -67
HI -36
碳 族 氮 族 氧 族 卤 族
说明在HF、H2O、NH3分子间还存在除范德华力之外的其他作用,这种作用就是氢键。
三、氢键及其对物质性质的影响
1、氢键概念
氢键是一种特殊的分子间作用力,它是由已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力。
如:HF中F的电负性相当大,电子对强烈地偏向F,而H几乎成了质子(H+),这种H与另一个HF分子中电负性相当大、半径小的F相互接近时,产生一种特殊的分子间作用力——氢键。氢键可以表示为···,
如:F-H···F-H。
本质:一种静电作用
三、氢键及其对物质性质的影响
1、氢键概念
氢键是一种特殊的分子间作用力,它是由已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力。
2、氢键形成的两个条件
(1)与电负性大且半径小的原子(F、O、N)相连的H
(2)在附近有电负性大,半径小且有孤电子对的原子
(F、O、N)
三、氢键及其对物质性质的影响
3、氢键的存在
(1)分子间氢键
研究证明: 氢键普遍存在于已经与N、O、F等电负性大的原子形成共价键的氢原子与另外的N、O、F等电负性大的原子之间。如:HF、H2O、NH3相互之间,C2H5OH、CH3COOH、H2O相互之间。
实验还证实,氢键不仅存在于分子之间,有时也存在于分子内。
三、氢键及其对物质性质的影响
3、氢键的存在
(1)分子间氢键
(2)分子内氢键
邻羟基苯甲醛
对羟基苯甲醛
如:硝酸、亚硝酸
三、氢键及其对物质性质的影响
4、氢键键能大小范围
F-H···F O-H···O N-H···N
氢键键能(kJ/mol) 28.1 18.8 17.9
范德华力(kJ/mol) 13.4 16.4 12.1
共价键键能(kJ/mol) 568 462.8 390.8
氢键的键能一般小于40 kJ/mol,介于范德华力和化学键之间,是一种较弱的作用力。
思考:影响氢键强弱的因素有哪些?
三、氢键及其对物质性质的影响
4、氢键键能大小范围
思考:影响氢键强弱的因素有哪些?
X-H···Y
与X和Y的电负性、原子半径有关,
即:它们的吸引电子能力越强,则氢键越强。
如:F-H···O>O-H···O>O-H···N>N-H···N,
C原子吸引电子能力较弱,一般不形成氢键。
三、氢键及其对物质性质的影响
名称 尿素 醋酸 硝酸
化学式 CO(NH2) CH3COOH HNO3
Mr 60 60 63
熔点(℃) 132.7 16.6 -41.6
沸点(℃) 160分解 117.9 83
思考:三种物质的Mr相近,熔点和沸点相差比较大。
分析它们可能含有的氢键,画出示意图。
三、氢键及其对物质性质的影响
O N
H O
O
102
130
…………
C CH3
H O
H3C C
O
O
O H
O
C
═
N
H
H
N
H
H
N
H
H
C
═
O
N
H
H
N
H
H
O C
═
N
H
H
N
C O
H
H
═
N
H
H
(1)分子间氢键使物质熔沸点升高
三、氢键及其对物质性质的影响
5、氢键对物质物理性质的影响
思考1:NH3为什么极易溶于水?NH3溶于水是形成N-H···O还是形成O-H···N?
(2)分子内氢键使物质熔沸点降低
三、氢键及其对物质性质的影响
5、氢键对物质物理性质的影响
思考:NH3为什么极易溶于水?NH3溶于水是形成N-H···O还是形成O-H···N?
提示: NH3溶于水溶液呈碱性(现象)
H N
H
H
H O
H
H N
H
H
H
H
O
√
本质: N原子的一对孤电子对更易形成氢键
(1)分子间氢键使物质熔沸点升高
三、氢键及其对物质性质的影响
5、氢键对物质物理性质的影响
(2)分子内氢键使物质熔沸点降低
(3)影响物质的溶解性
一般与溶剂形成分子间氢键可使溶解度升高
三、氢键及其对物质性质的影响
6、氢键的应用
(1)水的特殊物理性质
熔点/℃ 沸点/℃ ρ(0℃) ρ(4℃) ρ(20℃) ρ(100℃)
0.00 100.00 0.999841 1.000000 0.998203 0.958354
①为什么水的熔沸点比较高?
②为什么水结冰后体积膨胀、为什么冰能浮在水面?
③为什么水在4℃时密度最大?
④为什么雪花会呈现六边形结构?
氢键的应用 — 水的特殊物理性质
6、氢键的应用
(1)水的特殊物理性质
①为什么水的熔沸点比较高?
②为什么水结冰后体积膨胀、为什么冰能浮在水面?
冰中1个水分子
周围有4个水分子
冰的结构
冰融化,
分子的空隙减小
氢键的应用 — 水的特殊物理性质
②为什么水结冰后体积膨胀、为什么冰能浮在水面?
解析:在水蒸气中,水以单个的H2O分子形式存在;在液态水中,经常是几个水分子通过氢键结合起来,形成(H2O)n;在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
氢键的应用 — 水的特殊物理性质
③为什么水在4℃时密度最大?
在冰的晶体中,每个水分子周围只与处于四面体顶角方向的4个相邻的水分子连接。这种排列使冰中水分子的空间利用路不高,留有相当大的空隙。当冰刚刚融化为液体水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大,超过4℃时,由于热运动加剧,分子间距离加大,密度逐渐减小。
氢键的应用 — 水的特殊物理性质
④为什么雪花会呈现六边形结构?
冰霜、雪花中的水的氢键结构
H
O
三、氢键及其对物质性质的影响
6、氢键的应用
(1)水的特殊物理性质
(2)低级醇易溶于水、比含相同C的烃熔沸点高
(3)生物大分子中的氢键——蛋白质、DNA (P49)
四、溶解性
1、“相似相溶”规律
内容:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
①若存在氢键,溶质和溶剂之间的氢键作用力越大,溶解性越好。
②“相似相溶”还适用于分子结构的相似性。
③若溶质遇水能反应将增加其在水中的溶解度。
四、溶解性
思考与交流 P51
1、比较NH3和CH4在水中的溶解度。怎样用相似相溶
规律理解它们的溶解度不同?
分析: NH3是极性分子,CH4为非极性分子,而水是极性分子,根据“相似相溶”规律,NH3易溶于水,而CH4不易溶于水。NH3与水分子之间还可以形成氢键,使得NH3更易溶于水。
四、溶解性
思考与交流 P51
2、为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解
油漆而不用水?(油漆的主要成分是非极性或极性非常
小的有机分子)
分析:油漆是非极性分子,有机溶剂如(乙酸乙酯)也
是非极性溶剂,而水为极性溶剂,根据“相似相溶”
规律,应用有机溶剂溶解油漆而不能用水溶解油漆。
四、溶解性
思考与交流 P51
3、碘在纯水中还是在四氯化碳中溶解性较好?
分析:实验表明碘在四氯化碳溶液中的溶解性较好。
这是因为碘和四氯化碳都是非极性分子,非极性溶
质一般能溶于非极性溶剂,而水是极性分子。
五、手性
这两个分子的结构完全一样吗?
左右手互为镜像不能重叠
五、手性
1、手性:
2、手性异构体:
具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。
3、手性分子:
4、手性碳原子:
镜像对称,在三维空间里不能重叠。
有手性异构体的分子叫做手性分子
当碳原子结合的四个原子或原子团各不相同时,该碳原子是手性碳原子
A-C-B
- -
D
E
*
五、手性
5、判断分子是否手性的依据
(1)凡具有对称面、对称中心的分子都是非手性分子;
(2)有无对称轴,对分子是否有手性无决定作用。
一般:
※ 当分子中只有一个C*,分子一定有手性。
※ 当分子中有多个C*时,要借助对称因素,无对称面,又无对称中心的分子,必是手性分子。
H
H
H
Cl
Cl
H
H
H
Cl
Cl
H
H
手性分子
非手性分子
*
*
*
*
手性分子在生命科学和生产手性药物方面有广泛的应用
如图所示的分子是由一家德国制药厂在 1957 年 10月1日
上市的高效镇静剂,中文药名为“反应停”,它能使失
眠者美美地睡个好觉,能迅速止痛并能够减轻孕妇的妊
娠反应。然而,不久就发现世界各地相继出现了一些畸
形儿,后被科学家证实,是孕妇服用了这种药物导致的
随后的药物化学研究证实,在这种药物中,只有图左边的分子才有这种毒副作用,而右边的分子却没有这种毒副作用。人类从这一药物史上的悲剧中吸取教训,不久各国纷纷规定,今后凡生产手性药物,必须把手性异构体分离开,只出售能治病的那种手性异构体的药物。
五、手性 — “反应停”事件
六、无机含氧酸分子的酸性
1、知识回顾与归纳
(1) 在同一周期中,处于最高价态的元素,其含氧酸的酸性随原子序数的增加依次增强。
如:H3PO4高氯酸是非金属含氧酸中酸性最强的无机酸
六、无机含氧酸分子的酸性
1、知识回顾与归纳
(2) 在同一主族中,处于相同价态的不同元素,其含氧酸的酸性随成酸元素的原子序数递增依次减弱。
例如:
HClO>HBrO>HIO
HClO2>HBrO2>HIO2
HClO3>HBrO3>HIO3
HClO4>HBrO4>HIO4
六、无机含氧酸分子的酸性
1、知识回顾与归纳
(3) 同一元素若能形成几种不同价态的含氧酸,其酸性依化合价的递增而递增。
如:HClO六、无机含氧酸分子的酸性
2、无机含氧酸酸性规律
(HO)mROn,如果成酸元素R相同,则n值越大, R的正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强。
两种常见含氧酸的结构式:
H-O-N
O
O
HO-S-OH
O
O
如:H2SO3和H2SO4;HNO2和HNO3;
HClO、HClO2、HClO3、HClO4。
六、无机含氧酸分子的酸性
2、无机含氧酸酸性规律
(2) (HO)mROn,如果成酸元素R不同时,则非羟基氧原子数n值越大,酸性越强。
n=0,弱酸,如硼酸(H3BO3)
n=1,中强酸,如亚硫酸(H2SO3)
n=2,强酸,如硫酸(H2SO4)、硝酸(HNO3)
n=3,极强酸,如高氯酸(HClO4)
已知:硼酸(H3BO3)是弱酸,而亚磷酸(H3PO3)是中强酸
(1)写出这两种酸的结构式:________、________。
(2)写出亚磷酸和过量的NaOH溶液反应的化学方程式:
六、无机含氧酸分子的酸性
H-O-B-O-H
O
H
H-O-P-O-H
H
O
2NaOH + H3PO3 ═ Na2PO3 + 2H2O
小结:无机含氧酸分子的酸性
②当中心原子的电负性大、原子半径小、氧化数高时,使O-H键减弱,酸性增强。
①无机含氧酸的强度取决于中心原子的电负性、原子半径、氧化数。
第三节 分子的性质与物质的性质
温故知新
复习思考2: 共用电子对在两原子周围出现的机会是否相同,即共用电子对是否偏移?如果发生偏移,电子对偏向什么原子?为什么?
复习思考1: 写出Cl2、O2、N2、HCl、CO2、H2O的电子式和结构式。
一、键的极性和分子的极性
1、键的极性
化学式 HCl Cl2
电子式
结构式
电负性
键的极性
H:Cl:
: :
:Cl:
: :
:Cl
: :
H-Cl
Cl-Cl
↑
2.1
↑
3.0
↑
3.0
↑
3.0
δ+
δ-
极性共价键
非极性共价键
1、键的极性
思考1: 键的极性的判断依据是什么?
共用电子对是否有偏移
②共用电子对有偏移
①共用电子对无偏移
(电荷分布均匀)
(电荷分布不均匀)
非极性键
极性键
一、键的极性和分子的极性
1、键的极性
思考1: 键的极性的判断依据是什么?
思考2: 共用电子对是否偏移是什么因素引起的?
原子对共用电子对的吸引力不同
(元素的电负性)
思考3: 如何判断共价键的极性?
②不同种元素的原子间形成的共价键是极性键
①同种元素的原子间形成的共价键是非极性键
一、键的极性和分子的极性
1、键的极性
思考1: 键的极性的判断依据是什么?
思考2: 共用电子对是否偏移是什么因素引起的?
思考3: 如何判断共价键的极性?
一、键的极性和分子的极性
思考4: 共价键有极性和非极性,那么由共价键构成
的分子是否也有极性和非极性呢?
一、键的极性和分子的极性
探究实验一:用毛皮摩擦过的橡胶棒分别靠近水流与CCl4流,观察实验现象。
现象:
思考:为什么会出现这种现象?
水流方向有变化,而CCl4流的方向没有变化。
一、键的极性和分子的极性
2、分子的极性
(1)概念
极性分子:
非极性分子:
正电中心和负电中心不重合的分子
正电中心和负电中心重合的分子
(2)判断方法:
看正电中心和负电中心是否重合
①看键的极性 + 分子的立体构型
②化学键的极性的向量和是否等于零
第一类:全部由非极性键组成的分子是非极性分子,如:P4、C60、S8、C70、B12等。
一、键的极性和分子的极性
2、分子的极性
(2)判断方法:看正电中心和负电中心是否重合
思考:O3是非极性分子吗?
O
O
O
:
:
:
:
:
:
.
.
4
3
π
δ+
δ-
δ-
结论:O3是由极性键组成的极性分子
第二类:对于ABn型分子极性判别方法
一、键的极性和分子的极性
(2)判断方法:看正电中心和负电中心是否重合
①根据分子的立体构型判断
O
H
H
O
O
C
H
H
H
N
B
F
F
F
C
H
H
H
H
δ+
δ-
δ+
δ-
δ+
δ+
δ+
δ-
δ+
δ-
δ-
δ-
δ+
δ+
δ+
δ+
δ-
δ-
δ+
第二类:对于ABn型分子极性判别方法
一、键的极性和分子的极性
(2)判断方法:看正电中心和负电中心是否重合
②化合价法:
若中心原子的化合价的绝对值 ═ 该元素的价电子数(无孤电子对)时,该分子为非极性分子,此时分子的立体构型对称;
若中心原子的化合价的绝对值≠其价电子数(有孤电子对),则分子的立体构型不对称,其分子为极性分子。
第二类:对于ABn型分子极性判别方法
一、键的极性和分子的极性
②化合价法:
化学式 BF3 CO2 PCl5 SO3 H2O NH3 SO2
化合价
价电子数
分子极性
3
4
5
6
2
3
4
3
4
5
6
6
5
6
非极性
极性
③物理模型法:从力学的角度分析
第二类:对于ABn型分子极性判别方法
一、键的极性和分子的极性
在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,若F合=0,为非极性分子(极性抵消),F合≠ 0,为极性分子(极性不抵消)。
②化合价法:
①根据分子的立体构型判断
③物理模型法:从力学的角度分析
一、键的极性和分子的极性
BF3
NH3
F1
F2
F3
F合2、3
+F1 ═ 0
F合
≠ 0
小结:常见分子的构型及分子的极性
常见分子 键的极性 键角 分子构型 分子类型
双原子 H2、Cl2
HCl
三原子 CO2
H2O
四原子 NH3
BF3
五原子 CH4
异核多原子 HCN
非极性
正四面体形
109 28′
极 性
非极性
平面三角形
120
极 性
107 18′
极 性
三角锥形
极 性
极 性
V形
104.5
极 性
非极性
极 性
非极性
直线形
直线形
直线形
180
极 性
极 性
非极性
无
无
极 性
180
直线形
极 性
温故知新
极性键
非极
性键
共
价
键
非极性
分子
空间
不对称
空间
对称
双原子分子:HCl、NO、IBr
V形分子:H2O、H2S、SO2
三角锥形分子:NH3、PH3
非正四面体:CHCl3
单质分子:Cl2、N2、P4、O2
直线形分子:CO2、CS2、C2H2
正四面体:CH4、CCl4、
极性
分子
问题探究
思考1:冰山融化现象是物理变化还是化学变化?
思考2:冰山融化过程中有没有破坏其中的化学键?
思考3:为什么冰山融化过程要吸收能量呢?
— 分子间作用力
二、范德华力及其对物质性质的影响
1、范德华力的定义
把分子聚集在一起的这类分子间作用力又称范德华力
分析下表的数据(单位:kJ/mol):
分 子 HCl HBr HI CO Ar
范德华力 21.14 23.11 26.00 8.75 8.50
共价键键能 431.8 366 298.7 745 无
2、范德华力的特点
范德华力很弱,约比化学键能小1~2个数量级。只能在很小的范围内存在,不属于化学键。
二、范德华力及其对物质性质的影响
3、影响范德华力大小的因素
分析下表中的数据:
分子 HCl HBr HI
相对分子质量 36.5 81 128
范德华力(kJ/mol) 21.14 23.11 26.00
熔点/℃ -114.8 -98.5 -50.8
沸点/℃ -84.9 -67 -35.4
(1)结构相似的分子,相对分子质量越大,范德华力
越大,熔、沸越高。
X2 Mr 熔点/℃ 沸点/℃ CX4 Mr 熔点/℃ 沸点/℃
F2 38 -219.6 -188.1 CF4 88 -184 -128
Cl2 71 -101.0 -34.6 CCl4 154 -22.9 76.5
Br2 160 -7.2 -58.8 CBr4 332 90.1 189.5
I2 254 113.5 184.4 CI4 520 - -
二、范德华力及其对物质性质的影响
3、影响范德华力大小的因素
(1)结构相似的分子,相对分子质量越大,范德华力
越大,熔、沸越高。
二、范德华力及其对物质性质的影响
3、影响范德华力大小的因素
分析下表中的数据:
(2)相对分子质量相同或接近时,分子的极性越大,
范德华力越大,熔、沸越高。
分子 Mr 分子的极性 熔点/℃ 沸点/℃
CO 28 极 性 -205.05 -191.49
N2 28 非极性 -210.00 -195.81
小结:化学键与范德华力的比较
化学键 范德华力
概念
存在范围
作用力强弱
影响的性质
使原子相结合的相互作用
分子内、原子间
较 强
主要影响化学性质
把分子聚集在一起的作用力
分子之间
与化学键相比弱的多
主要影响物理性质(如:熔沸点)
问题探究 — 一些氢化物的沸点
一些氢化物的沸点(单位: ℃)
CH4 -160
SiH4 -112
GeH4 -88
SnH4 -52
NH3 -33
PH3 -88
AsH3 -55
SbH3 -18
H2O 100
H2S -61
H2Se -44
H2Te -2
HF 20
HCl -85
HBr -67
HI -36
碳 族 氮 族 氧 族 卤 族
思考:非金属元素的氢化物在固态时是分子晶体,其熔沸点与其相对分子质量有关;对于同一主族非金属元素而言,从上到下,Mr逐渐增大,熔沸点应逐渐升高,而HF、H2O、NH3却出现反常,为什么?
问题探究 — 一些氢化物的沸点
一些氢化物的沸点(单位: ℃)
CH4 -160
SiH4 -112
GeH4 -88
SnH4 -52
NH3 -33
PH3 -88
AsH3 -55
SbH3 -18
H2O 100
H2S -61
H2Se -44
H2Te -2
HF 20
HCl -85
HBr -67
HI -36
碳 族 氮 族 氧 族 卤 族
说明在HF、H2O、NH3分子间还存在除范德华力之外的其他作用,这种作用就是氢键。
三、氢键及其对物质性质的影响
1、氢键概念
氢键是一种特殊的分子间作用力,它是由已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力。
如:HF中F的电负性相当大,电子对强烈地偏向F,而H几乎成了质子(H+),这种H与另一个HF分子中电负性相当大、半径小的F相互接近时,产生一种特殊的分子间作用力——氢键。氢键可以表示为···,
如:F-H···F-H。
本质:一种静电作用
三、氢键及其对物质性质的影响
1、氢键概念
氢键是一种特殊的分子间作用力,它是由已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力。
2、氢键形成的两个条件
(1)与电负性大且半径小的原子(F、O、N)相连的H
(2)在附近有电负性大,半径小且有孤电子对的原子
(F、O、N)
三、氢键及其对物质性质的影响
3、氢键的存在
(1)分子间氢键
研究证明: 氢键普遍存在于已经与N、O、F等电负性大的原子形成共价键的氢原子与另外的N、O、F等电负性大的原子之间。如:HF、H2O、NH3相互之间,C2H5OH、CH3COOH、H2O相互之间。
实验还证实,氢键不仅存在于分子之间,有时也存在于分子内。
三、氢键及其对物质性质的影响
3、氢键的存在
(1)分子间氢键
(2)分子内氢键
邻羟基苯甲醛
对羟基苯甲醛
如:硝酸、亚硝酸
三、氢键及其对物质性质的影响
4、氢键键能大小范围
F-H···F O-H···O N-H···N
氢键键能(kJ/mol) 28.1 18.8 17.9
范德华力(kJ/mol) 13.4 16.4 12.1
共价键键能(kJ/mol) 568 462.8 390.8
氢键的键能一般小于40 kJ/mol,介于范德华力和化学键之间,是一种较弱的作用力。
思考:影响氢键强弱的因素有哪些?
三、氢键及其对物质性质的影响
4、氢键键能大小范围
思考:影响氢键强弱的因素有哪些?
X-H···Y
与X和Y的电负性、原子半径有关,
即:它们的吸引电子能力越强,则氢键越强。
如:F-H···O>O-H···O>O-H···N>N-H···N,
C原子吸引电子能力较弱,一般不形成氢键。
三、氢键及其对物质性质的影响
名称 尿素 醋酸 硝酸
化学式 CO(NH2) CH3COOH HNO3
Mr 60 60 63
熔点(℃) 132.7 16.6 -41.6
沸点(℃) 160分解 117.9 83
思考:三种物质的Mr相近,熔点和沸点相差比较大。
分析它们可能含有的氢键,画出示意图。
三、氢键及其对物质性质的影响
O N
H O
O
102
130
…………
C CH3
H O
H3C C
O
O
O H
O
C
═
N
H
H
N
H
H
N
H
H
C
═
O
N
H
H
N
H
H
O C
═
N
H
H
N
C O
H
H
═
N
H
H
(1)分子间氢键使物质熔沸点升高
三、氢键及其对物质性质的影响
5、氢键对物质物理性质的影响
思考1:NH3为什么极易溶于水?NH3溶于水是形成N-H···O还是形成O-H···N?
(2)分子内氢键使物质熔沸点降低
三、氢键及其对物质性质的影响
5、氢键对物质物理性质的影响
思考:NH3为什么极易溶于水?NH3溶于水是形成N-H···O还是形成O-H···N?
提示: NH3溶于水溶液呈碱性(现象)
H N
H
H
H O
H
H N
H
H
H
H
O
√
本质: N原子的一对孤电子对更易形成氢键
(1)分子间氢键使物质熔沸点升高
三、氢键及其对物质性质的影响
5、氢键对物质物理性质的影响
(2)分子内氢键使物质熔沸点降低
(3)影响物质的溶解性
一般与溶剂形成分子间氢键可使溶解度升高
三、氢键及其对物质性质的影响
6、氢键的应用
(1)水的特殊物理性质
熔点/℃ 沸点/℃ ρ(0℃) ρ(4℃) ρ(20℃) ρ(100℃)
0.00 100.00 0.999841 1.000000 0.998203 0.958354
①为什么水的熔沸点比较高?
②为什么水结冰后体积膨胀、为什么冰能浮在水面?
③为什么水在4℃时密度最大?
④为什么雪花会呈现六边形结构?
氢键的应用 — 水的特殊物理性质
6、氢键的应用
(1)水的特殊物理性质
①为什么水的熔沸点比较高?
②为什么水结冰后体积膨胀、为什么冰能浮在水面?
冰中1个水分子
周围有4个水分子
冰的结构
冰融化,
分子的空隙减小
氢键的应用 — 水的特殊物理性质
②为什么水结冰后体积膨胀、为什么冰能浮在水面?
解析:在水蒸气中,水以单个的H2O分子形式存在;在液态水中,经常是几个水分子通过氢键结合起来,形成(H2O)n;在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
氢键的应用 — 水的特殊物理性质
③为什么水在4℃时密度最大?
在冰的晶体中,每个水分子周围只与处于四面体顶角方向的4个相邻的水分子连接。这种排列使冰中水分子的空间利用路不高,留有相当大的空隙。当冰刚刚融化为液体水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大,超过4℃时,由于热运动加剧,分子间距离加大,密度逐渐减小。
氢键的应用 — 水的特殊物理性质
④为什么雪花会呈现六边形结构?
冰霜、雪花中的水的氢键结构
H
O
三、氢键及其对物质性质的影响
6、氢键的应用
(1)水的特殊物理性质
(2)低级醇易溶于水、比含相同C的烃熔沸点高
(3)生物大分子中的氢键——蛋白质、DNA (P49)
四、溶解性
1、“相似相溶”规律
内容:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
①若存在氢键,溶质和溶剂之间的氢键作用力越大,溶解性越好。
②“相似相溶”还适用于分子结构的相似性。
③若溶质遇水能反应将增加其在水中的溶解度。
四、溶解性
思考与交流 P51
1、比较NH3和CH4在水中的溶解度。怎样用相似相溶
规律理解它们的溶解度不同?
分析: NH3是极性分子,CH4为非极性分子,而水是极性分子,根据“相似相溶”规律,NH3易溶于水,而CH4不易溶于水。NH3与水分子之间还可以形成氢键,使得NH3更易溶于水。
四、溶解性
思考与交流 P51
2、为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解
油漆而不用水?(油漆的主要成分是非极性或极性非常
小的有机分子)
分析:油漆是非极性分子,有机溶剂如(乙酸乙酯)也
是非极性溶剂,而水为极性溶剂,根据“相似相溶”
规律,应用有机溶剂溶解油漆而不能用水溶解油漆。
四、溶解性
思考与交流 P51
3、碘在纯水中还是在四氯化碳中溶解性较好?
分析:实验表明碘在四氯化碳溶液中的溶解性较好。
这是因为碘和四氯化碳都是非极性分子,非极性溶
质一般能溶于非极性溶剂,而水是极性分子。
五、手性
这两个分子的结构完全一样吗?
左右手互为镜像不能重叠
五、手性
1、手性:
2、手性异构体:
具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。
3、手性分子:
4、手性碳原子:
镜像对称,在三维空间里不能重叠。
有手性异构体的分子叫做手性分子
当碳原子结合的四个原子或原子团各不相同时,该碳原子是手性碳原子
A-C-B
- -
D
E
*
五、手性
5、判断分子是否手性的依据
(1)凡具有对称面、对称中心的分子都是非手性分子;
(2)有无对称轴,对分子是否有手性无决定作用。
一般:
※ 当分子中只有一个C*,分子一定有手性。
※ 当分子中有多个C*时,要借助对称因素,无对称面,又无对称中心的分子,必是手性分子。
H
H
H
Cl
Cl
H
H
H
Cl
Cl
H
H
手性分子
非手性分子
*
*
*
*
手性分子在生命科学和生产手性药物方面有广泛的应用
如图所示的分子是由一家德国制药厂在 1957 年 10月1日
上市的高效镇静剂,中文药名为“反应停”,它能使失
眠者美美地睡个好觉,能迅速止痛并能够减轻孕妇的妊
娠反应。然而,不久就发现世界各地相继出现了一些畸
形儿,后被科学家证实,是孕妇服用了这种药物导致的
随后的药物化学研究证实,在这种药物中,只有图左边的分子才有这种毒副作用,而右边的分子却没有这种毒副作用。人类从这一药物史上的悲剧中吸取教训,不久各国纷纷规定,今后凡生产手性药物,必须把手性异构体分离开,只出售能治病的那种手性异构体的药物。
五、手性 — “反应停”事件
六、无机含氧酸分子的酸性
1、知识回顾与归纳
(1) 在同一周期中,处于最高价态的元素,其含氧酸的酸性随原子序数的增加依次增强。
如:H3PO4
六、无机含氧酸分子的酸性
1、知识回顾与归纳
(2) 在同一主族中,处于相同价态的不同元素,其含氧酸的酸性随成酸元素的原子序数递增依次减弱。
例如:
HClO>HBrO>HIO
HClO2>HBrO2>HIO2
HClO3>HBrO3>HIO3
HClO4>HBrO4>HIO4
六、无机含氧酸分子的酸性
1、知识回顾与归纳
(3) 同一元素若能形成几种不同价态的含氧酸,其酸性依化合价的递增而递增。
如:HClO
2、无机含氧酸酸性规律
(HO)mROn,如果成酸元素R相同,则n值越大, R的正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强。
两种常见含氧酸的结构式:
H-O-N
O
O
HO-S-OH
O
O
如:H2SO3和H2SO4;HNO2和HNO3;
HClO、HClO2、HClO3、HClO4。
六、无机含氧酸分子的酸性
2、无机含氧酸酸性规律
(2) (HO)mROn,如果成酸元素R不同时,则非羟基氧原子数n值越大,酸性越强。
n=0,弱酸,如硼酸(H3BO3)
n=1,中强酸,如亚硫酸(H2SO3)
n=2,强酸,如硫酸(H2SO4)、硝酸(HNO3)
n=3,极强酸,如高氯酸(HClO4)
已知:硼酸(H3BO3)是弱酸,而亚磷酸(H3PO3)是中强酸
(1)写出这两种酸的结构式:________、________。
(2)写出亚磷酸和过量的NaOH溶液反应的化学方程式:
六、无机含氧酸分子的酸性
H-O-B-O-H
O
H
H-O-P-O-H
H
O
2NaOH + H3PO3 ═ Na2PO3 + 2H2O
小结:无机含氧酸分子的酸性
②当中心原子的电负性大、原子半径小、氧化数高时,使O-H键减弱,酸性增强。
①无机含氧酸的强度取决于中心原子的电负性、原子半径、氧化数。
