高中化学人教版(2019)选择性必修2 3.3.2离子晶体(共57张ppt)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修2 3.3.2离子晶体(共57张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 32.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-06 00:00:00 | ||
图片预览


文档简介
(共57张PPT)
第三节 金属晶体与离子晶体
第一课时 离子晶体
1、概念:
带相反电荷的离子(阴、阳离子)之间
强烈的静电作用
阴、阳离子
阴、阳离子之间的静电作用
一般是活泼金属与活泼非金属之间
温故知新——离子键
2、成键微粒:
4、形成条件:
3、成键本质:
问题导学
晶体 氯化钠 干冰 金刚石
熔 点/℃ 801 -56.2 3550
思考:为什么氯化钠的性质与干冰、
金刚石的不同?
材料:
一、离子晶体
2、构成微粒:
阴、阳离子
3、微粒间的作用力:
离子键
4、常见的离子晶体:
强碱、活泼金属氧化物、大多数盐
1、定义:
由阴、阳离子通过离子键结合而成的晶体
5、物理性质:
一、离子晶体
5、物理性质:
熔沸点较高,难挥发,硬而脆
固体不导电,水溶液或者熔融状态下一般均导电
大多易溶于极性溶剂H2O,难溶于非极性溶剂(汽油、
苯、CCl4等)
注:判断离子晶体,可根据其熔融状态能否导电进行
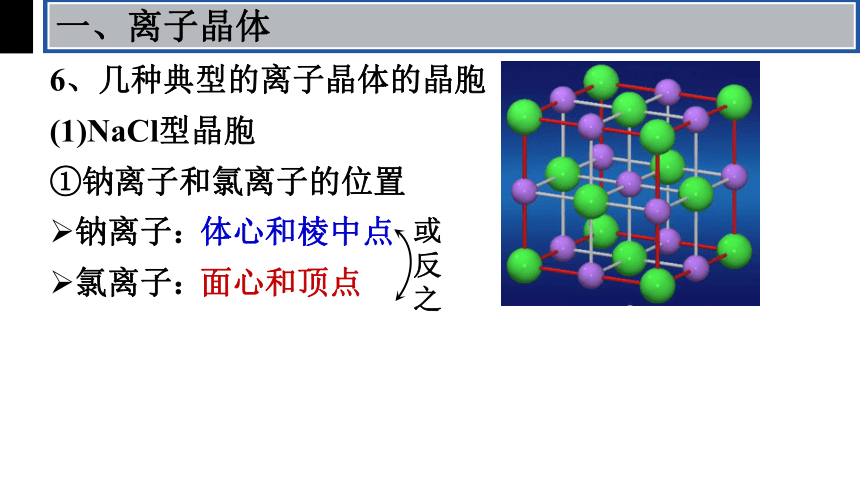
6、几种典型的离子晶体的晶胞
一、离子晶体
(1)NaCl型晶胞
①钠离子和氯离子的位置
钠离子:
氯离子:
体心和棱中点
面心和顶点
或反之
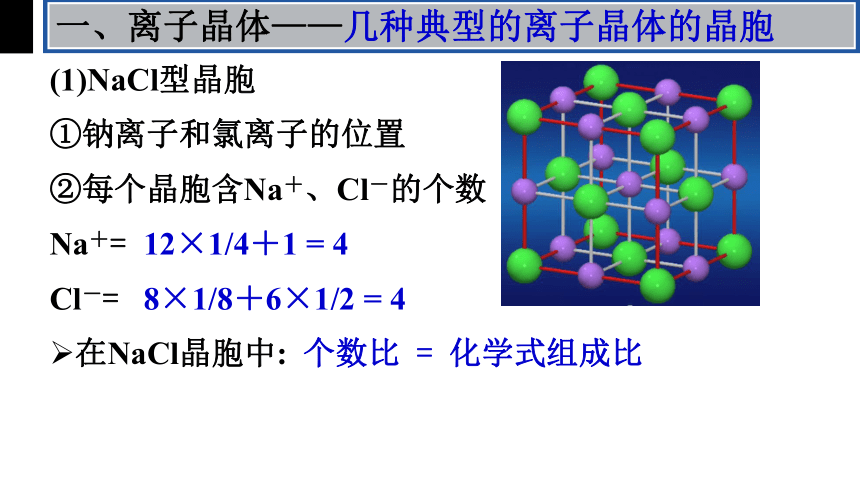
一、离子晶体——几种典型的离子晶体的晶胞
(1)NaCl型晶胞
②每个晶胞含Na+、Cl-的个数
Na+=
Cl-=
①钠离子和氯离子的位置
12×1/4+1 = 4
8×1/8+6×1/2 = 4
在NaCl晶胞中: 个数比 = 化学式组成比
一、离子晶体——几种典型的离子晶体的晶胞
(1)NaCl型晶胞
②每个晶胞含Na+、Cl-的个数
①钠离子和氯离子的位置
③与Na+等距离且最近的Na+个数
______个
12
与Cl-等距离且最近的Cl-个数也是12个
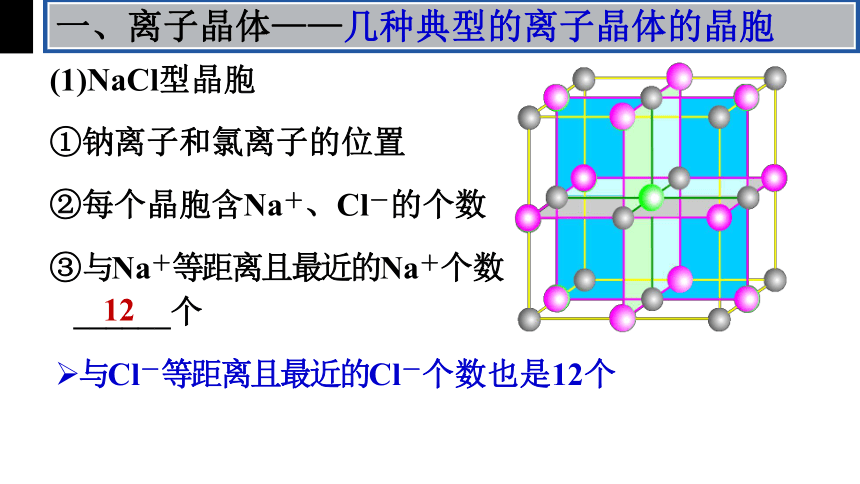
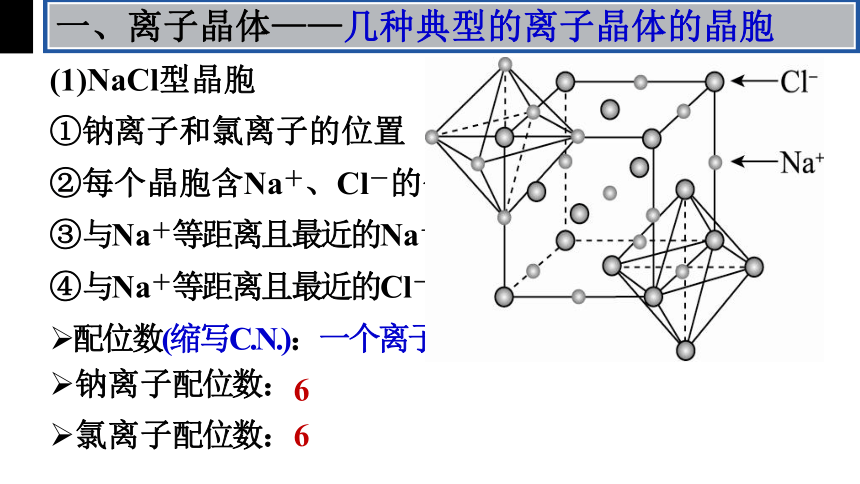
一、离子晶体——几种典型的离子晶体的晶胞
(1)NaCl型晶胞
②每个晶胞含Na+、Cl-的个数
①钠离子和氯离子的位置
③与Na+等距离且最近的Na+有12个
④与Na+等距离且最近的Cl-个数
配位数(缩写C.N.):一个离子周围最临近的异电性离子数目
钠离子配位数:
氯离子配位数:
6
6
一、离子晶体——几种典型的离子晶体的晶胞
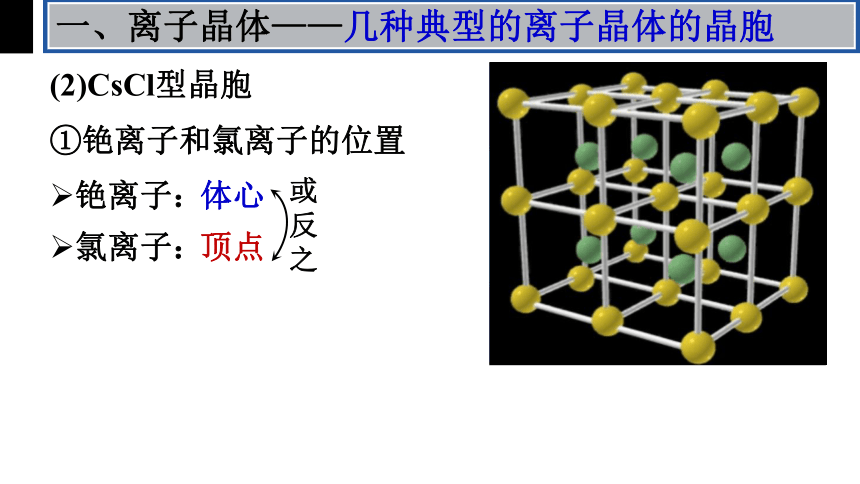
(2)CsCl型晶胞
①铯离子和氯离子的位置
铯离子:
氯离子:
体心
顶点
或反之
(2)CsCl型晶胞
①铯离子和氯离子的位置
②每个晶胞含______个Cs+、
含______个Cl-的个数;
Cl-
Cs+
一、离子晶体——几种典型的离子晶体的晶胞
1
1
③与Cs+等距离且最近的Cs+的个数为______;
与Cs+等距离且最近的Cl-的个数为______;
6个
8个
④Cs+配位数为____,Cl -配位数为______。
8
8
(3)萤石(CaF2)型晶胞
Ca2+: 面心立方最密堆积
F-: 填充在整个四面体空隙中
Ca2+
F-
一、离子晶体——几种典型的离子晶体的晶胞
(3)萤石(CaF2)型晶胞
①钙离子和氟离子的位置
Ca2+: _____________
F-: ____________________
②每个晶胞含Ca2+____个,含F-_____个;
③ Ca2+配位数为____,F-配位数为_____;
④每个F-周围最近且等距离的F-有____个;
每个Ca2+周围最近且等距离的Ca2+有_____个。
顶点和面心
Ca2+形成的四面体空隙
4
8
8
4
6
12
一、离子晶体——几种典型的离子晶体的晶胞
一、离子晶体——几种典型的离子晶体的晶胞
(4)立方ZnS型晶胞
Zn2+
Zn2+:面心立方最密堆积
S2-:填充在部分四面体空隙中
(4)立方ZnS型晶胞
①锌离子和硫离子的位置
Zn2+: _____________
S2-: ________________________
②每个晶胞含Zn2+____个,含S2-_____个;
③ Zn2+配位数为____, S2-配位数为______;
④每个Zn2+周围最近且等距离的Zn2+有____个;
每个S2-周围最近且等距离的S2-有_____个。
顶点和面心
Zn2+形成的部分四面体空隙
4
4
4
4
12
12
一、离子晶体——几种典型的离子晶体的晶胞
Zn2+
小结:几种典型的离子晶体晶胞的比较
晶体 类型 晶胞 类型 晶胞结构示意图 每个晶胞含 有离子数 配位数 实例
AB NaCl型 Na+ Na+ KBr、AgCl、MgO、CaS、BaSe
Cl- Cl-
CsCl型 Cs+ Cs+ CsCl、CsBr、
CsI、TlCl
Cl- Cl-
ZnS型 Zn2+ Zn2+
ZnS、AgI、BeO
S2- S2-
AB2 CaF2型 Ca2+ Ca2+ 碱土金属卤化物
碱金属氧化物
F- F-
4
4
6
6
1
1
8
8
4
4
4
4
4
8
4
8
拓展一:等径圆球堆积所形成的空隙类型
简单立方堆积模型中只形成一种空隙——
立方体空隙
假设阴离子作简单立方堆积,8个大球两两相切,晶胞的棱长a恰好为大球半径的二倍(即2r-)。假设在立方体空隙中放入一个半径为r+的阳离子小球,该小球恰好同时与8个阴离子大球在晶胞的体对角线方向上两两相切,则体对角线的长度为大小球半径之和的二倍[即2(r-+ r+)]
a = 2r-
√3a = 2(r++ r-)
-
拓展一:等径圆球堆积所形成的空隙类型
简单立方堆积模型中只形成一种空隙——立方体空隙
√3a = 2(r++ r-)
-
a = 2r-
a = 2r-
√3a = 2(r++ r-)
-
(√3-1)r- = r+
-
r+
r-
= √3-1 ≈ 0.732
-
拓展一:等径圆球堆积所形成的空隙类型
最密堆积模型中形成两种空隙——
四面体空隙和八面体空隙
1
2
3
4
5
6
7
8
说明:左图中红色的1、2、3、4小球和蓝色的5、6、7、8小球分别是密堆积结构中两层密置层的一部分
红1、2、3与蓝5这四个小球围成一个四面体空隙,
同样红4和蓝6、7、8也围成一个四面体空隙
拓展一:等径圆球堆积所形成的空隙类型
最密堆积模型中形成两种空隙——
四面体空隙和八面体空隙
1
2
3
4
5
6
7
8
红2、3、4与蓝5、6、7这六个小球围成了一个八面体空隙
拓展一:等径圆球堆积所形成的空隙类型
四面体空隙的填隙临界条件
假设阴离子作最密堆积,四面体空隙结构中4个大球两两相切,正四面体的边长l恰好为大球半径的二倍(即2r-)。假设在正四面体空隙中放入一个半径为r+的阳离子小球,该小球恰好同时与4个阴离子大球相切。
l = 2r-
拓展一:等径圆球堆积所形成的空隙类型
四面体空隙的填隙临界条件
将正四面体放入立方体中观察
l = 2r-
存在关系:四面体的边长为立方体的面对角线,大小球半径之和为立方体对角线的一半
a
√2 a = l = 2r-
√3
2
a = r++ r-
≈ 0.225
√ 3-√ 2
√ 2
r+
r-
=
拓展一:等径圆球堆积所形成的空隙类型
八面体空隙的填隙临界条件
2(r++ r-) = √ 2 (2r-)
r+
r-
= √ 2-1 ≈ 0.414
假设阴离子作最密堆积,八面体空隙结构中6个大球两两相切,正八面体的边长l恰好为大球半径的二倍(即2r-)。假设在正八面体空隙中放入一个半径为r+的阳离子小球,该小球恰好同时与6个阴离子大球相切。
拓展二:三种空隙大小的比较
三种空隙大小的比较
四面体空隙
八面体空隙
立方体空隙
临界条件:
r+
r-
≈ 0.225
r+
r-
≈ 0.414
r+
r-
≈ 0.732
容纳阳离子体积:
小 大
填隙模型的核心内容:“阴离子建房,阳离子住”
但“房子的大小”与阳离子的相对大小有关
拓展二:三种空隙大小的比较
三种空隙大小的比较
需要注意的是,临界模型中阳离子与阴离子之间、阴离子彼此之间都是紧密接触的。但在实际的离子晶体中,阴阳离子不一定都处于紧密接触状态。
以四面体模型为例,有时阳离子半径稍微相对大一点,正负粒子半径比就会大于0.225,此时四个阴离子被阳离子稍稍撑开,阳离子和四个阴离子仍然紧密接触,但四个阴离子之间就不会再保持紧密接触状态,不过这样的情况下只要半径比不接近0.414,阳离子在晶体中还可以保持四配位状态。
拓展二:三种空隙大小的比较
离子晶体中金属离子的配位数的大致半径比范围
配位数 半径比(r+/r-)范围
3 ﹤0.225
4 0.225 ~ 0.414
6 0.414 ~ 0.732
8 0.732 ~ 1.000
拓展二:三种空隙大小的比较
NaCl和CsCl都属于AB型离子晶体,因正负离子的半径比不同、配位数不同(比值越大,配位数越高),因此它们的晶体结构也不同。
离子 Na+ Cs+ Cl-
离子半径/pm 95 169 181
NaCl CsCl
r+/r- = r+/r- =
C.N. = C.N. =
0.524
0.934
6
8
影响离子晶体结构的因素:
几何因素
一、离子晶体——影响离子晶体结构的因素
影响离子晶体结构的因素:
几何因素:
晶体中正负离子的半径比数值越大,
离子的配位数越高
一、离子晶体——影响离子晶体结构的因素
影响离子晶体结构的因素:
离子晶体 阴离子的配位数 阳离子的配位数
NaCl 6 6
CaF2 4 8
在NaCl晶体中阳、阴离子的配位数相同是由于阳、阴离子所带电荷数相同,若阳、阴离子所带电荷数不同,则阳、阴离子的个数不同,阳、阴离子的配位数必然会不同,且离子所带电荷越多,配位数越多。
一、离子晶体——影响离子晶体结构的因素
影响离子晶体结构的因素:
(1)几何因素:
晶体中正负离子的半径比 (比值越大,
离子的配位数越高)
(2)电荷因素:
晶体中正负离子的电荷比 (离子所带
电荷越多,配位数越多)
(3)键性因素:
离子键的纯粹程度 (纯粹因素)
一、离子晶体——影响离子晶体结构的因素
科学视野
碳酸盐 MgCO3 CaCO3 SrCO3 BaCO3
热分解温度/℃ 402 900 1 172 1 360
阳离子半径/pm 66 99 112 135
M2+
CO32-
2+
2+
2-
+
MO CO2
碳酸盐的热分解示意图
结论: 金属阳离子的半径越小,碳酸盐的热稳定性越差
拓展三: 密堆积中的四面体、八面体空隙
1
2
3
4
5
6
7
8
左图中是最密堆积结构中的两层密置层,其中包含2个四面体空隙(1235和4678)还有1个八面体空隙(234567)。
图中两层密置层的8个小球构成一个三维的平行六面体,因此每个小球对图中贡献为1/8,图中结构含有小球个数为1个。
由此可以得出,最密堆积结构中:
小球 : 四面体空隙 : 八面体空隙 = 1 : 2 : 1
拓展三: 密堆积中的四面体、八面体空隙
八面体空隙在面心立方最密堆积晶胞中的分布
面心立方堆积晶胞中,
小球个数为: 8×1/8+6×1/2 = 4
依据比列可知,八面体空隙数目
为4个,它们分布在:
体心:1×1 = 4
棱心:12×1/4 = 3
立方最密堆积
中的八面体空隙
拓展三: 密堆积中的四面体、八面体空隙
八面体空隙在面心立方最密堆积晶胞中的分布
立方最密堆积
中的八面体空隙
拓展三: 密堆积中的四面体、八面体空隙
八面体空隙在面心立方最密堆积晶胞中的分布
若用分数坐标表示八面体空隙
的位置,分别是:
体心:
棱心:
1
2
1
2
1
2
, ,
1
2
, ,
0 0
1
2
, ,
0 0
1
2
, ,
0 0
立方最密堆积
中的四面体空隙
拓展三: 密堆积中的四面体、八面体空隙
四面体空隙在面心立方最密堆积晶胞中的分布
面心立方堆积晶胞中,小球个数为4个;根据比例可知四面体空隙的数目为8个。
它们分布在由晶胞体心向顶点所发出的8条线段的中点位置,也可以看作是将晶胞分割为8个小立方体后,每一个小立方体的体心位置。
注意:8个四面体空隙有2种空间取向,间隔有序分布在晶胞内,图中用 和 两种符号加以区分。
拓展三: 密堆积中的四面体、八面体空隙
四面体空隙在面心立方最密堆积晶胞中的分布
拓展三: 密堆积中的四面体、八面体空隙
若用分数坐标表示四面体空隙的位置,分别是:
立方最密堆积中的四面体空隙
1
4
1
4
1
4
, ,
3
4
1
4
3
4
, ,
3
4
3
4
3
4
, ,
1
4
3
4
1
4
, ,
3
4
3
4
1
4
, ,
1
4
3
4
3
4
, ,
1
4
1
4
3
4
, ,
3
4
1
4
1
4
, ,
拓展三: 密堆积中的四面体、八面体空隙
四面体空隙在六最密堆积晶胞中的分布
六方最密堆积中的四面体空隙
六方密堆积晶胞中,小球个数为2个;根据比例可知四面体空隙的数目为4个。
体内:2×1 = 2
Z棱上:8×1/4 = 2
注意:4个四面体空隙有2种空间取向,用 和 两种符号加以区分。
拓展三: 密堆积中的四面体、八面体空隙
四面体空隙在六最密堆积晶胞中的分布
拓展三: 密堆积中的四面体、八面体空隙
八面体空隙在六方最密堆积晶胞中的分布
六方密堆积晶胞中,小球个数为2个;根据比例可知八面体空隙的数目为2个。它们均分布在晶胞体内。
六方最密堆积中的八面体空隙
拓展三: 密堆积中的四面体、八面体空隙
八面体空隙在六方最密堆积晶胞中的分布
体心立方堆积中的变形四面体空隙
拓展三: 密堆积中的四面体、八面体空隙
体心立方堆积中的两类空隙——
变形四面体空隙和变形八面体空隙
变形四面体空隙由晶胞棱上的2个球与共面2个晶胞的体心上的2个球围成。该变形四面体6条棱中有2条棱长即为晶胞棱长,另外4条棱长为晶胞体对角线的一半。
晶胞中变形四面体空隙有12个,
(6×4×1/2 = 12)
拓展三: 密堆积中的四面体、八面体空隙
体心立方堆积中的两类空隙——
变形四面体空隙和变形八面体空隙
晶胞中变形八面体空隙有6个,
(6×1/2+12×1/4 = 12)
体心立方堆积中的变形八面体空隙
变形八面体空隙位于体心立方晶胞的面心和棱心。该变形八面体12条棱中有4条棱长为晶胞棱长,另外8条棱长为晶胞体对角线的一半
拓展三: 密堆积中的四面体、八面体空隙
体心立方堆积中的两类空隙——
变形四面体空隙和变形八面体空隙
晶胞中变形八面体空隙有6个,
(6×1/2+12×1/4 = 12)
体心立方堆积中,小球与两种空隙的个数必为:
小球 : 变形四面体空隙 : 变形八面体空隙 = 1 : 6 : 3
晶胞中变形四面体空隙有12个,
(6×4×1/2 = 12)
第3节 离子晶体
第二课时 晶格能
二、晶格能
阅读下表,分析(1)影响晶格能大小的因素有哪些?(2)晶格能与离子晶体性质的关系?
1、定义:
气态离子形成1摩离子晶体释放的能量
二、晶格能
阅读下表,分析(1)影响晶格能大小的因素有哪些?
(2)晶格能与离子晶体性质的关系?
AB型离子晶体 离子电荷(Z) 晶格能(KJ·mol-1) 熔点/℃ 摩尔硬度
NaF 1 923 993 3.2
NaCl 1 786 801 2.5
NaBr 1 747 747 ﹤2.5
NaI 1 707 661 ﹤2.5
MgO 2 3791 2852 5.5
CaO 2 3401 2614 4.5
SrO 2 3223 2430 3.5
BaO 2 3054 1918 3.3
结论一:离子的半径越小,晶格能越大
结论二:离子所带的电荷数越多,晶格能越大
即:晶格能∝
q1·q2
r
二、晶格能
1、定义:
气态离子形成1摩离子晶体释放的能量
2、影响晶格能大小的因素:
阴、阳离子的电荷数越多,离子半径越小,晶格能越大
二、晶格能
阅读下表,分析(1)影响晶格能大小的因素有哪些?
(2)晶格能与离子晶体性质的关系?
AB型离子晶体 离子电荷(Z) 晶格能(KJ·mol-1) 熔点/℃ 摩尔硬度
NaF 1 923 993 3.2
NaCl 1 786 801 2.5
NaBr 1 747 747 ﹤2.5
NaI 1 707 661 ﹤2.5
MgO 2 3791 2852 5.5
CaO 2 3401 2614 4.5
SrO 2 3223 2430 3.5
BaO 2 3054 1918 3.3
二、晶格能
1、定义:
气态离子形成1摩离子晶体释放的能量
2、影响晶格能大小的因素:
阴、阳离子的电荷数越多,离子半径越小,晶格能越大
3、晶格能与离子晶体性质的关系:
晶格能越大,形成的离子晶体越稳定,而且熔点越高,
硬度越大。
总结:几种晶体的比较
晶体类型 金属晶体 离子晶体 分子晶体 原子晶体
构成微粒 金属阳离子、自由电子 阴、阳离子 分子 原子
物质类别 金属单质、合金 离子化合物 多数的非金属单质和共价化合物 金刚石、SiC、 Si、SiO2等少数的非金属单质和共价化合物
物理性质 硬度和密度较大,熔沸点较高,有延展性,有金属光泽 硬度和密度较大,熔沸点较高 硬度和密度较小,熔沸点较低, 硬度和密度大,熔沸点较
决定熔沸点高低的因素 金属键强弱 离子键(晶格能)强弱 范德华力(或氢键)强弱 共价键强弱
导电性 固态、熔融均导电 熔融或溶于水能导电 某些溶于水能导电 不导电(硅、锗是半导体)
总结:几种晶体的比较
晶体类型 金属晶体 离子晶体 分子晶体 原子晶体
构成微粒 金属阳离子、自由电子 阴、阳离子 分子 原子
物质类别 金属单质、合金 离子化合物 多数的非金属单质和共价化合物 金刚石、SiC、 Si、SiO2等少数的非金属单质和共价化合物
物理性质 硬度和密度较大,熔沸点较高,有延展性,有金属光泽 硬度和密度较大,熔沸点较高 硬度和密度较小,熔沸点较低, 硬度和密度大,熔沸点较
决定熔沸点高低的因素 金属键强弱 离子键(晶格能)强弱 范德华力(或氢键)强弱 共价键强弱
导电性 固态、熔融均导电 熔融或溶于水能导电 某些溶于水能导电 不导电(硅、锗是半导体)
三、晶体熔、沸点的比较
金属晶体熔、沸点有的很高,有的很低如Hg。
但也有些离子晶体的熔、沸点比原子晶体高,
如MgO的熔、沸点比SiO2的高。
1、不同类型晶体熔、沸点的比较
一般各种晶体熔、沸点高低顺序为:
原子晶体 > 离子晶体 > 分子晶体
三、晶体熔、沸点的比较
2、同种类型晶体熔、沸点的比较
(1)原子晶体: (比较_________)
共价键
结构相似,半径越小,键长越短,键能越大熔、沸点越高
如熔点:金刚石____碳化硅____晶体硅
>
>
(2)离子晶体: (比较离子键强弱或晶格能大小)
离子所带电荷越多,半径越小,离子键越强,熔、沸点越高
如熔点:MgO____MgCl2____NaCl____CsCl
>
>
>
(3)金属晶体: 金属离子半径越小,离子电荷数越多,
其金属键越强,金属熔、沸点就越高。
三、晶体熔、沸点的比较
2、同种类型晶体熔、沸点的比较
(4)分子晶体:(比较分子间作用力)
①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常。
如:H2O____H2Te____H2Se____H2S
>
>
>
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
如:SnH4____GeH4____SiH4____CH4
>
>
>
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。
如:CO>N2,CH3OH>CH3CH3
④同分异构体,支链越多,熔、沸点越低
三、晶体熔、沸点的比较
2、同种类型晶体熔、沸点的比较
第三节 金属晶体与离子晶体
第一课时 离子晶体
1、概念:
带相反电荷的离子(阴、阳离子)之间
强烈的静电作用
阴、阳离子
阴、阳离子之间的静电作用
一般是活泼金属与活泼非金属之间
温故知新——离子键
2、成键微粒:
4、形成条件:
3、成键本质:
问题导学
晶体 氯化钠 干冰 金刚石
熔 点/℃ 801 -56.2 3550
思考:为什么氯化钠的性质与干冰、
金刚石的不同?
材料:
一、离子晶体
2、构成微粒:
阴、阳离子
3、微粒间的作用力:
离子键
4、常见的离子晶体:
强碱、活泼金属氧化物、大多数盐
1、定义:
由阴、阳离子通过离子键结合而成的晶体
5、物理性质:
一、离子晶体
5、物理性质:
熔沸点较高,难挥发,硬而脆
固体不导电,水溶液或者熔融状态下一般均导电
大多易溶于极性溶剂H2O,难溶于非极性溶剂(汽油、
苯、CCl4等)
注:判断离子晶体,可根据其熔融状态能否导电进行
6、几种典型的离子晶体的晶胞
一、离子晶体
(1)NaCl型晶胞
①钠离子和氯离子的位置
钠离子:
氯离子:
体心和棱中点
面心和顶点
或反之
一、离子晶体——几种典型的离子晶体的晶胞
(1)NaCl型晶胞
②每个晶胞含Na+、Cl-的个数
Na+=
Cl-=
①钠离子和氯离子的位置
12×1/4+1 = 4
8×1/8+6×1/2 = 4
在NaCl晶胞中: 个数比 = 化学式组成比
一、离子晶体——几种典型的离子晶体的晶胞
(1)NaCl型晶胞
②每个晶胞含Na+、Cl-的个数
①钠离子和氯离子的位置
③与Na+等距离且最近的Na+个数
______个
12
与Cl-等距离且最近的Cl-个数也是12个
一、离子晶体——几种典型的离子晶体的晶胞
(1)NaCl型晶胞
②每个晶胞含Na+、Cl-的个数
①钠离子和氯离子的位置
③与Na+等距离且最近的Na+有12个
④与Na+等距离且最近的Cl-个数
配位数(缩写C.N.):一个离子周围最临近的异电性离子数目
钠离子配位数:
氯离子配位数:
6
6
一、离子晶体——几种典型的离子晶体的晶胞
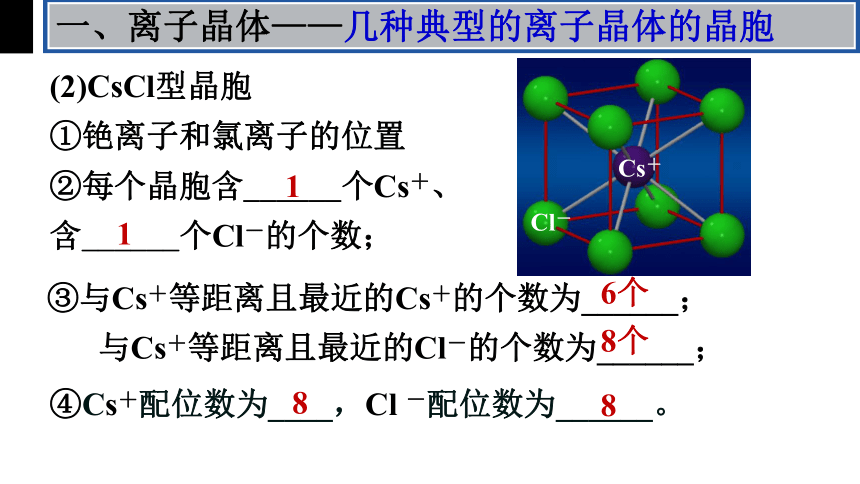
(2)CsCl型晶胞
①铯离子和氯离子的位置
铯离子:
氯离子:
体心
顶点
或反之
(2)CsCl型晶胞
①铯离子和氯离子的位置
②每个晶胞含______个Cs+、
含______个Cl-的个数;
Cl-
Cs+
一、离子晶体——几种典型的离子晶体的晶胞
1
1
③与Cs+等距离且最近的Cs+的个数为______;
与Cs+等距离且最近的Cl-的个数为______;
6个
8个
④Cs+配位数为____,Cl -配位数为______。
8
8
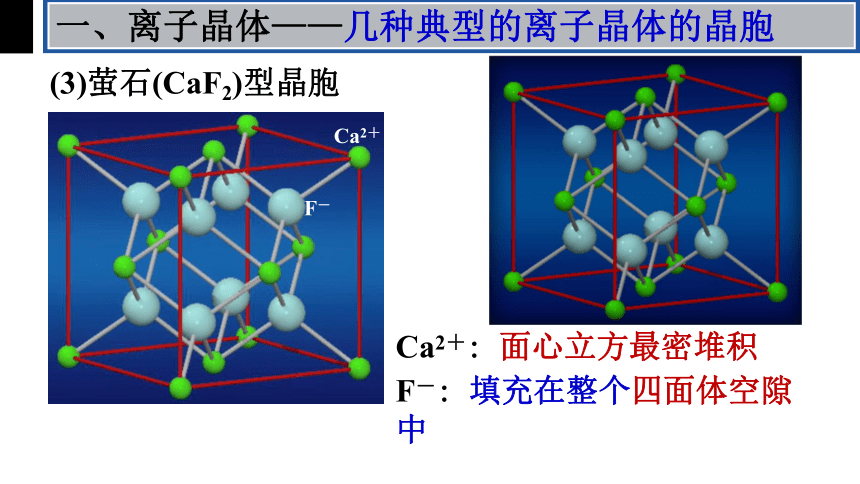
(3)萤石(CaF2)型晶胞
Ca2+: 面心立方最密堆积
F-: 填充在整个四面体空隙中
Ca2+
F-
一、离子晶体——几种典型的离子晶体的晶胞
(3)萤石(CaF2)型晶胞
①钙离子和氟离子的位置
Ca2+: _____________
F-: ____________________
②每个晶胞含Ca2+____个,含F-_____个;
③ Ca2+配位数为____,F-配位数为_____;
④每个F-周围最近且等距离的F-有____个;
每个Ca2+周围最近且等距离的Ca2+有_____个。
顶点和面心
Ca2+形成的四面体空隙
4
8
8
4
6
12
一、离子晶体——几种典型的离子晶体的晶胞
一、离子晶体——几种典型的离子晶体的晶胞
(4)立方ZnS型晶胞
Zn2+
Zn2+:面心立方最密堆积
S2-:填充在部分四面体空隙中
(4)立方ZnS型晶胞
①锌离子和硫离子的位置
Zn2+: _____________
S2-: ________________________
②每个晶胞含Zn2+____个,含S2-_____个;
③ Zn2+配位数为____, S2-配位数为______;
④每个Zn2+周围最近且等距离的Zn2+有____个;
每个S2-周围最近且等距离的S2-有_____个。
顶点和面心
Zn2+形成的部分四面体空隙
4
4
4
4
12
12
一、离子晶体——几种典型的离子晶体的晶胞
Zn2+
小结:几种典型的离子晶体晶胞的比较
晶体 类型 晶胞 类型 晶胞结构示意图 每个晶胞含 有离子数 配位数 实例
AB NaCl型 Na+ Na+ KBr、AgCl、MgO、CaS、BaSe
Cl- Cl-
CsCl型 Cs+ Cs+ CsCl、CsBr、
CsI、TlCl
Cl- Cl-
ZnS型 Zn2+ Zn2+
ZnS、AgI、BeO
S2- S2-
AB2 CaF2型 Ca2+ Ca2+ 碱土金属卤化物
碱金属氧化物
F- F-
4
4
6
6
1
1
8
8
4
4
4
4
4
8
4
8
拓展一:等径圆球堆积所形成的空隙类型
简单立方堆积模型中只形成一种空隙——
立方体空隙
假设阴离子作简单立方堆积,8个大球两两相切,晶胞的棱长a恰好为大球半径的二倍(即2r-)。假设在立方体空隙中放入一个半径为r+的阳离子小球,该小球恰好同时与8个阴离子大球在晶胞的体对角线方向上两两相切,则体对角线的长度为大小球半径之和的二倍[即2(r-+ r+)]
a = 2r-
√3a = 2(r++ r-)
-
拓展一:等径圆球堆积所形成的空隙类型
简单立方堆积模型中只形成一种空隙——立方体空隙
√3a = 2(r++ r-)
-
a = 2r-
a = 2r-
√3a = 2(r++ r-)
-
(√3-1)r- = r+
-
r+
r-
= √3-1 ≈ 0.732
-
拓展一:等径圆球堆积所形成的空隙类型
最密堆积模型中形成两种空隙——
四面体空隙和八面体空隙
1
2
3
4
5
6
7
8
说明:左图中红色的1、2、3、4小球和蓝色的5、6、7、8小球分别是密堆积结构中两层密置层的一部分
红1、2、3与蓝5这四个小球围成一个四面体空隙,
同样红4和蓝6、7、8也围成一个四面体空隙
拓展一:等径圆球堆积所形成的空隙类型
最密堆积模型中形成两种空隙——
四面体空隙和八面体空隙
1
2
3
4
5
6
7
8
红2、3、4与蓝5、6、7这六个小球围成了一个八面体空隙
拓展一:等径圆球堆积所形成的空隙类型
四面体空隙的填隙临界条件
假设阴离子作最密堆积,四面体空隙结构中4个大球两两相切,正四面体的边长l恰好为大球半径的二倍(即2r-)。假设在正四面体空隙中放入一个半径为r+的阳离子小球,该小球恰好同时与4个阴离子大球相切。
l = 2r-
拓展一:等径圆球堆积所形成的空隙类型
四面体空隙的填隙临界条件
将正四面体放入立方体中观察
l = 2r-
存在关系:四面体的边长为立方体的面对角线,大小球半径之和为立方体对角线的一半
a
√2 a = l = 2r-
√3
2
a = r++ r-
≈ 0.225
√ 3-√ 2
√ 2
r+
r-
=
拓展一:等径圆球堆积所形成的空隙类型
八面体空隙的填隙临界条件
2(r++ r-) = √ 2 (2r-)
r+
r-
= √ 2-1 ≈ 0.414
假设阴离子作最密堆积,八面体空隙结构中6个大球两两相切,正八面体的边长l恰好为大球半径的二倍(即2r-)。假设在正八面体空隙中放入一个半径为r+的阳离子小球,该小球恰好同时与6个阴离子大球相切。
拓展二:三种空隙大小的比较
三种空隙大小的比较
四面体空隙
八面体空隙
立方体空隙
临界条件:
r+
r-
≈ 0.225
r+
r-
≈ 0.414
r+
r-
≈ 0.732
容纳阳离子体积:
小 大
填隙模型的核心内容:“阴离子建房,阳离子住”
但“房子的大小”与阳离子的相对大小有关
拓展二:三种空隙大小的比较
三种空隙大小的比较
需要注意的是,临界模型中阳离子与阴离子之间、阴离子彼此之间都是紧密接触的。但在实际的离子晶体中,阴阳离子不一定都处于紧密接触状态。
以四面体模型为例,有时阳离子半径稍微相对大一点,正负粒子半径比就会大于0.225,此时四个阴离子被阳离子稍稍撑开,阳离子和四个阴离子仍然紧密接触,但四个阴离子之间就不会再保持紧密接触状态,不过这样的情况下只要半径比不接近0.414,阳离子在晶体中还可以保持四配位状态。
拓展二:三种空隙大小的比较
离子晶体中金属离子的配位数的大致半径比范围
配位数 半径比(r+/r-)范围
3 ﹤0.225
4 0.225 ~ 0.414
6 0.414 ~ 0.732
8 0.732 ~ 1.000
拓展二:三种空隙大小的比较
NaCl和CsCl都属于AB型离子晶体,因正负离子的半径比不同、配位数不同(比值越大,配位数越高),因此它们的晶体结构也不同。
离子 Na+ Cs+ Cl-
离子半径/pm 95 169 181
NaCl CsCl
r+/r- = r+/r- =
C.N. = C.N. =
0.524
0.934
6
8
影响离子晶体结构的因素:
几何因素
一、离子晶体——影响离子晶体结构的因素
影响离子晶体结构的因素:
几何因素:
晶体中正负离子的半径比数值越大,
离子的配位数越高
一、离子晶体——影响离子晶体结构的因素
影响离子晶体结构的因素:
离子晶体 阴离子的配位数 阳离子的配位数
NaCl 6 6
CaF2 4 8
在NaCl晶体中阳、阴离子的配位数相同是由于阳、阴离子所带电荷数相同,若阳、阴离子所带电荷数不同,则阳、阴离子的个数不同,阳、阴离子的配位数必然会不同,且离子所带电荷越多,配位数越多。
一、离子晶体——影响离子晶体结构的因素
影响离子晶体结构的因素:
(1)几何因素:
晶体中正负离子的半径比 (比值越大,
离子的配位数越高)
(2)电荷因素:
晶体中正负离子的电荷比 (离子所带
电荷越多,配位数越多)
(3)键性因素:
离子键的纯粹程度 (纯粹因素)
一、离子晶体——影响离子晶体结构的因素
科学视野
碳酸盐 MgCO3 CaCO3 SrCO3 BaCO3
热分解温度/℃ 402 900 1 172 1 360
阳离子半径/pm 66 99 112 135
M2+
CO32-
2+
2+
2-
+
MO CO2
碳酸盐的热分解示意图
结论: 金属阳离子的半径越小,碳酸盐的热稳定性越差
拓展三: 密堆积中的四面体、八面体空隙
1
2
3
4
5
6
7
8
左图中是最密堆积结构中的两层密置层,其中包含2个四面体空隙(1235和4678)还有1个八面体空隙(234567)。
图中两层密置层的8个小球构成一个三维的平行六面体,因此每个小球对图中贡献为1/8,图中结构含有小球个数为1个。
由此可以得出,最密堆积结构中:
小球 : 四面体空隙 : 八面体空隙 = 1 : 2 : 1
拓展三: 密堆积中的四面体、八面体空隙
八面体空隙在面心立方最密堆积晶胞中的分布
面心立方堆积晶胞中,
小球个数为: 8×1/8+6×1/2 = 4
依据比列可知,八面体空隙数目
为4个,它们分布在:
体心:1×1 = 4
棱心:12×1/4 = 3
立方最密堆积
中的八面体空隙
拓展三: 密堆积中的四面体、八面体空隙
八面体空隙在面心立方最密堆积晶胞中的分布
立方最密堆积
中的八面体空隙
拓展三: 密堆积中的四面体、八面体空隙
八面体空隙在面心立方最密堆积晶胞中的分布
若用分数坐标表示八面体空隙
的位置,分别是:
体心:
棱心:
1
2
1
2
1
2
, ,
1
2
, ,
0 0
1
2
, ,
0 0
1
2
, ,
0 0
立方最密堆积
中的四面体空隙
拓展三: 密堆积中的四面体、八面体空隙
四面体空隙在面心立方最密堆积晶胞中的分布
面心立方堆积晶胞中,小球个数为4个;根据比例可知四面体空隙的数目为8个。
它们分布在由晶胞体心向顶点所发出的8条线段的中点位置,也可以看作是将晶胞分割为8个小立方体后,每一个小立方体的体心位置。
注意:8个四面体空隙有2种空间取向,间隔有序分布在晶胞内,图中用 和 两种符号加以区分。
拓展三: 密堆积中的四面体、八面体空隙
四面体空隙在面心立方最密堆积晶胞中的分布
拓展三: 密堆积中的四面体、八面体空隙
若用分数坐标表示四面体空隙的位置,分别是:
立方最密堆积中的四面体空隙
1
4
1
4
1
4
, ,
3
4
1
4
3
4
, ,
3
4
3
4
3
4
, ,
1
4
3
4
1
4
, ,
3
4
3
4
1
4
, ,
1
4
3
4
3
4
, ,
1
4
1
4
3
4
, ,
3
4
1
4
1
4
, ,
拓展三: 密堆积中的四面体、八面体空隙
四面体空隙在六最密堆积晶胞中的分布
六方最密堆积中的四面体空隙
六方密堆积晶胞中,小球个数为2个;根据比例可知四面体空隙的数目为4个。
体内:2×1 = 2
Z棱上:8×1/4 = 2
注意:4个四面体空隙有2种空间取向,用 和 两种符号加以区分。
拓展三: 密堆积中的四面体、八面体空隙
四面体空隙在六最密堆积晶胞中的分布
拓展三: 密堆积中的四面体、八面体空隙
八面体空隙在六方最密堆积晶胞中的分布
六方密堆积晶胞中,小球个数为2个;根据比例可知八面体空隙的数目为2个。它们均分布在晶胞体内。
六方最密堆积中的八面体空隙
拓展三: 密堆积中的四面体、八面体空隙
八面体空隙在六方最密堆积晶胞中的分布
体心立方堆积中的变形四面体空隙
拓展三: 密堆积中的四面体、八面体空隙
体心立方堆积中的两类空隙——
变形四面体空隙和变形八面体空隙
变形四面体空隙由晶胞棱上的2个球与共面2个晶胞的体心上的2个球围成。该变形四面体6条棱中有2条棱长即为晶胞棱长,另外4条棱长为晶胞体对角线的一半。
晶胞中变形四面体空隙有12个,
(6×4×1/2 = 12)
拓展三: 密堆积中的四面体、八面体空隙
体心立方堆积中的两类空隙——
变形四面体空隙和变形八面体空隙
晶胞中变形八面体空隙有6个,
(6×1/2+12×1/4 = 12)
体心立方堆积中的变形八面体空隙
变形八面体空隙位于体心立方晶胞的面心和棱心。该变形八面体12条棱中有4条棱长为晶胞棱长,另外8条棱长为晶胞体对角线的一半
拓展三: 密堆积中的四面体、八面体空隙
体心立方堆积中的两类空隙——
变形四面体空隙和变形八面体空隙
晶胞中变形八面体空隙有6个,
(6×1/2+12×1/4 = 12)
体心立方堆积中,小球与两种空隙的个数必为:
小球 : 变形四面体空隙 : 变形八面体空隙 = 1 : 6 : 3
晶胞中变形四面体空隙有12个,
(6×4×1/2 = 12)
第3节 离子晶体
第二课时 晶格能
二、晶格能
阅读下表,分析(1)影响晶格能大小的因素有哪些?(2)晶格能与离子晶体性质的关系?
1、定义:
气态离子形成1摩离子晶体释放的能量
二、晶格能
阅读下表,分析(1)影响晶格能大小的因素有哪些?
(2)晶格能与离子晶体性质的关系?
AB型离子晶体 离子电荷(Z) 晶格能(KJ·mol-1) 熔点/℃ 摩尔硬度
NaF 1 923 993 3.2
NaCl 1 786 801 2.5
NaBr 1 747 747 ﹤2.5
NaI 1 707 661 ﹤2.5
MgO 2 3791 2852 5.5
CaO 2 3401 2614 4.5
SrO 2 3223 2430 3.5
BaO 2 3054 1918 3.3
结论一:离子的半径越小,晶格能越大
结论二:离子所带的电荷数越多,晶格能越大
即:晶格能∝
q1·q2
r
二、晶格能
1、定义:
气态离子形成1摩离子晶体释放的能量
2、影响晶格能大小的因素:
阴、阳离子的电荷数越多,离子半径越小,晶格能越大
二、晶格能
阅读下表,分析(1)影响晶格能大小的因素有哪些?
(2)晶格能与离子晶体性质的关系?
AB型离子晶体 离子电荷(Z) 晶格能(KJ·mol-1) 熔点/℃ 摩尔硬度
NaF 1 923 993 3.2
NaCl 1 786 801 2.5
NaBr 1 747 747 ﹤2.5
NaI 1 707 661 ﹤2.5
MgO 2 3791 2852 5.5
CaO 2 3401 2614 4.5
SrO 2 3223 2430 3.5
BaO 2 3054 1918 3.3
二、晶格能
1、定义:
气态离子形成1摩离子晶体释放的能量
2、影响晶格能大小的因素:
阴、阳离子的电荷数越多,离子半径越小,晶格能越大
3、晶格能与离子晶体性质的关系:
晶格能越大,形成的离子晶体越稳定,而且熔点越高,
硬度越大。
总结:几种晶体的比较
晶体类型 金属晶体 离子晶体 分子晶体 原子晶体
构成微粒 金属阳离子、自由电子 阴、阳离子 分子 原子
物质类别 金属单质、合金 离子化合物 多数的非金属单质和共价化合物 金刚石、SiC、 Si、SiO2等少数的非金属单质和共价化合物
物理性质 硬度和密度较大,熔沸点较高,有延展性,有金属光泽 硬度和密度较大,熔沸点较高 硬度和密度较小,熔沸点较低, 硬度和密度大,熔沸点较
决定熔沸点高低的因素 金属键强弱 离子键(晶格能)强弱 范德华力(或氢键)强弱 共价键强弱
导电性 固态、熔融均导电 熔融或溶于水能导电 某些溶于水能导电 不导电(硅、锗是半导体)
总结:几种晶体的比较
晶体类型 金属晶体 离子晶体 分子晶体 原子晶体
构成微粒 金属阳离子、自由电子 阴、阳离子 分子 原子
物质类别 金属单质、合金 离子化合物 多数的非金属单质和共价化合物 金刚石、SiC、 Si、SiO2等少数的非金属单质和共价化合物
物理性质 硬度和密度较大,熔沸点较高,有延展性,有金属光泽 硬度和密度较大,熔沸点较高 硬度和密度较小,熔沸点较低, 硬度和密度大,熔沸点较
决定熔沸点高低的因素 金属键强弱 离子键(晶格能)强弱 范德华力(或氢键)强弱 共价键强弱
导电性 固态、熔融均导电 熔融或溶于水能导电 某些溶于水能导电 不导电(硅、锗是半导体)
三、晶体熔、沸点的比较
金属晶体熔、沸点有的很高,有的很低如Hg。
但也有些离子晶体的熔、沸点比原子晶体高,
如MgO的熔、沸点比SiO2的高。
1、不同类型晶体熔、沸点的比较
一般各种晶体熔、沸点高低顺序为:
原子晶体 > 离子晶体 > 分子晶体
三、晶体熔、沸点的比较
2、同种类型晶体熔、沸点的比较
(1)原子晶体: (比较_________)
共价键
结构相似,半径越小,键长越短,键能越大熔、沸点越高
如熔点:金刚石____碳化硅____晶体硅
>
>
(2)离子晶体: (比较离子键强弱或晶格能大小)
离子所带电荷越多,半径越小,离子键越强,熔、沸点越高
如熔点:MgO____MgCl2____NaCl____CsCl
>
>
>
(3)金属晶体: 金属离子半径越小,离子电荷数越多,
其金属键越强,金属熔、沸点就越高。
三、晶体熔、沸点的比较
2、同种类型晶体熔、沸点的比较
(4)分子晶体:(比较分子间作用力)
①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常。
如:H2O____H2Te____H2Se____H2S
>
>
>
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
如:SnH4____GeH4____SiH4____CH4
>
>
>
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。
如:CO>N2,CH3OH>CH3CH3
④同分异构体,支链越多,熔、沸点越低
三、晶体熔、沸点的比较
2、同种类型晶体熔、沸点的比较
