10.2+酸和碱的中和反应(教学课件)-2022-2023学年九年级化学下册(同步教学课件29页+课时练)(人教版)
文档属性
| 名称 | 10.2+酸和碱的中和反应(教学课件)-2022-2023学年九年级化学下册(同步教学课件29页+课时练)(人教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 18.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-06 15:35:36 | ||
图片预览







文档简介
(共29张PPT)
2022-2023学年九年级化学下册 (人教版)
第十单元 酸和碱 Acids and bases
课题2 酸和碱的中和反应
- Learning objectives -
第
1
课
时
1.
知道中和反应的概念
2.
了解中和反应的实质
3.
了解中和反应的应用
本课件内嵌1个视频,即点即播,使用方便(此页可删除)。
Video1:在氢氧化钠溶液中滴加稀盐酸
说明:本课件使用WPS制作,使用WPS体验更佳效果。
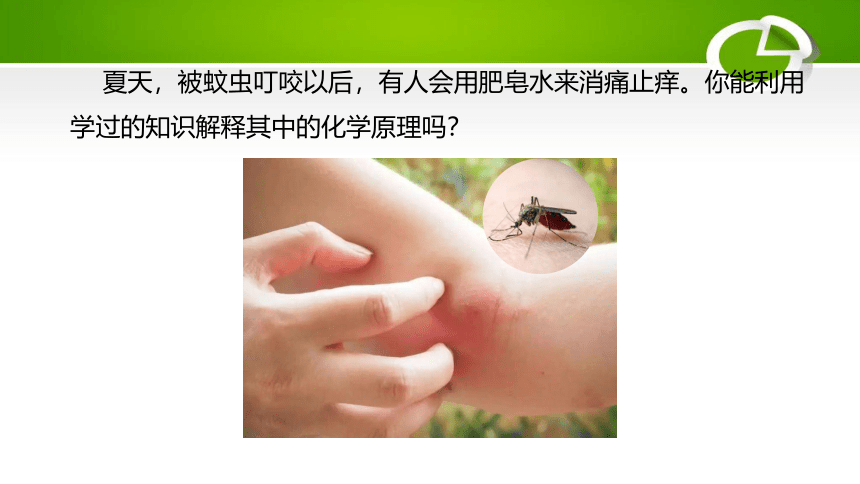
夏天,被蚊虫叮咬以后,有人会用肥皂水来消痛止痒。你能利用学过的知识解释其中的化学原理吗?
视频:在氢氧化钠溶液中滴加稀盐酸
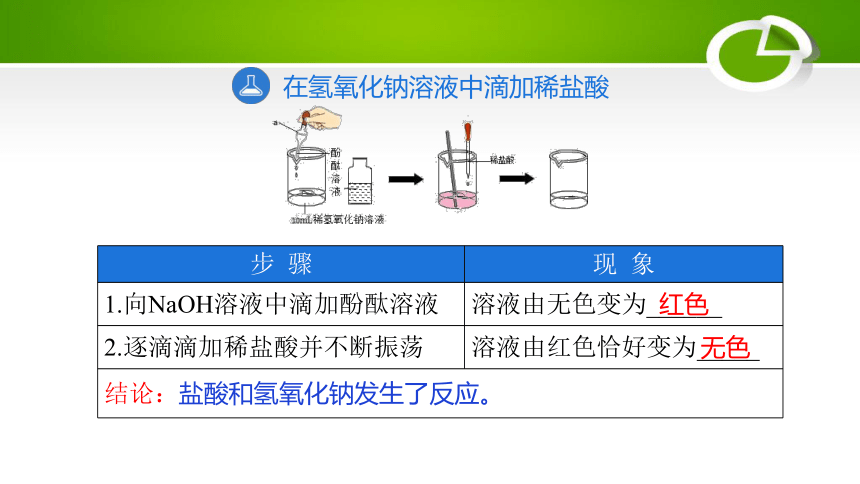
在氢氧化钠溶液中滴加稀盐酸
步 骤 现 象
1.向NaOH溶液中滴加酚酞溶液 溶液由无色变为______
2.逐滴滴加稀盐酸并不断振荡 溶液由红色恰好变为_____
结论: 红色
无色
盐酸和氢氧化钠发生了反应。
1.加入酚酞原因:_____________________酚酞起_____作用。
2.逐滴滴入稀盐酸目的:防止_______过量。
3.当溶液由___色恰好变为___色时中和反应恰好完成。
指示
无
稀盐酸
红
两者反应现象不明显
1.某同学向氢氧化钠溶液中加入稀盐酸后,发现忘记加入酚酞,他赶紧向反应后的溶液中加入酚酞试液,溶液呈无色,他认为二者恰好完全反应,溶液呈中性,他的说法是否正确?说明原因。
不正确;酚酞试液不变色,可能是二者恰好反应,溶液呈中性,也可能稀盐酸过量;溶液呈酸性。
2.能否把酸和碱的先后顺序调换?
不可以,因为盐酸中滴加酚酞时不变色,滴加氢氧化钠溶液溶液变红色时,氢氧化钠溶液已经过量,不能指示出恰好完全反应的时刻。
中和反应操作顺序:先加酚酞再滴盐酸
3. 能否把无色酚酞换成紫色石蕊?那个效果更好?
答:可以,NaOH溶液中滴加石蕊变蓝色,再加入盐酸,恰好由蓝色变为紫色时,即恰好完全反应;
用酚酞溶液效果更好,红色变无色更明显。
4.如何判断稀盐酸是否过量?(利用酸的化学性质)
方 案 现 象
①滴加_________试剂 溶液变红色
②加入H前金属,如_____ 有气泡产生
③加_____盐:CaCO3、Na2CO3 ④滴加一滴__________溶液 溶液仍为无色
氢氧化钠
锌粒
紫色石蕊
碳酸
一、中和反应
HCl + NaOH = NaCl + H2O
1.定义:___和___反应生成_______。
酸
盐和水
碱
金属离子
酸根离子
NaCl、CuSO4 、CaCO3 、Na2CO3、FeSO4
注意:不是所有的盐都含有金属离子(如铵盐—NH4NO3)
盐
H2SO4 + 2NaOH = Na2SO4 + 2 H2O
2HCl + Ca(OH)2 = CaCl2 + 2 H2O
+
(2)中和反应的实质是酸中 的和碱中的 结合生成水。用离子方程式表示为 。
(2019.河南改编)如图是氢氧化钠与盐酸反应示意图。
Na+、Cl-
H++OH-=H2O
(1)反应前后没有发生变化的离子有 。
H+
OH-
生成盐和水的反应,不一定都是中和反应。
如: 1.酸+金属氧化物→盐+水
2.碱+非金属氧化物→盐+水
CO2+2NaOH=Na2CO3+H2O
强调:中和反应特指酸和碱反应生成盐和水
Fe2O3+6HCl= 2FeCl3+ 3H2O
二、中和反应的应用
1.用熟石灰改良酸性土壤/中和酸性废水
Ca(OH)2+H2SO4=
CaSO4+2H2O
Al(OH)3 + 3HCl=
Mg(OH)2 + 2HCl=
AlCl3 + 3H2O
MgCl2 + 2H2O
蚊虫叮咬后分泌蚁酸,造成皮肤肿痛可涂抹一些含有碱性物质(如氨水NH3·H2O)的药水,或肥皂水(碱性)。
2.医疗上中和胃酸过多/蚊虫叮咬
思考:改良酸性土壤/中和胃酸,能否用氢氧化钠?
不可以,因为氢氧化钠腐蚀性太强,且价格昂贵。
定义:酸 + 碱 =__________(易错辨析)
实质:____________________
盐:__________ + __________(_________盐不含金属离子)
1.用_________________改良酸性土壤/处理酸性废水
2.治疗胃酸过多用的两种碱________和_________
Al(OH)3
一、中和反应
二、中和反应的应用
盐 + 水
H+ + OH- = H2O
金属离子
酸根离子
铵NH4+
熟石灰Ca(OH)2
Al(OH)3 + 3HCl=AlCl3 + 3H2O
Mg(OH)2 + 2HCl=MgCl2 + 2H2O
Mg(OH)2
- Learning objectives -
第
2
课
时
1.
了解溶液酸碱度的表示方法—pH值
2.
使用pH试纸检验溶液酸碱度的方法
3.
了解溶液酸碱性对生活、生产的意义
本课件内嵌2个视频,即点即播,使用方便(此页可删除)。
Video1:用pH试纸测定溶液的酸碱度
说明:本课件使用WPS制作,使用WPS体验更佳效果。
Video2:身边一些物质的pH
使用指示剂只可以检验溶液的酸碱性,如何测定和表示溶液的酸碱性强弱程度呢?
溶液酸碱度的表示方法—pH值
视频:用pH试纸测定溶液的酸碱度
1.pH试纸的测定范围在_____之间。
2.使用方法:用________蘸取待测液滴到pH试纸上,把试纸显示的颜色与____________对比读数。(数值为整数)
3.注意事项:
(1)测定溶液pH值时,不能事先将玻璃棒或试纸润湿
(2)不能将pH试纸浸入溶液中
0~14
玻璃棒
标准比色卡
三、溶液酸碱度的表示法—pH
1.(2019.河南改编)下列测定溶液pH的操作,错误的是( )
B
A
B
C
D
常用的pH计
三、溶液酸碱度的表示法—pH
(3)pH__7,显碱性,存在___。pH越__,碱性越强,OH-浓度越___。
(2)pH 7,显酸性,存在__。pH越__,酸性越强,H+浓度越___。
(1)pH 7,显中性。
酸性最强
碱性最强
酸性
pH<7
中性
pH=7
碱性
pH>7
3.pH与溶液酸碱性的关系:
=
>
如:水,NaCl溶液等
如:HCl、H2SO4
如:Ca(OH)2 、NaOH等碱;部分盐如Na2CO3溶液等
<
大
大
小
大
增强
增强
H+
OH-
1.若用润湿的玻璃棒(或将pH试纸用水润湿),测酸的pH时,将使酸性______,pH______。
2.测碱溶液的pH时,若用润湿的玻璃棒(或将pH试纸用水润湿),使碱性______,pH______。
减弱
减弱
变大
变小
碱性增强
酸性增强
中性
0 7 14
4.改变溶液酸碱度的方法(改变H+/OH-的浓度)
(1)使酸性溶液的pH增大应加_____或_____性溶液。
(2)使碱性溶液的pH减小应加_____或_____性溶液。
酸中加水
酸中加碱
碱中加酸
碱中加水
水
碱
水
酸
三、溶液酸碱度的表示法—pH
7
pH
7
pH
7
pH
7
pH
1.(2009.河北)用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示。
(1)该反应的化学方程式为______________________
(2)该实验操作是将 溶液
滴加到另一种溶液中。
(3)当加入溶液的质量为a g时,
所得溶液中的溶质为 。
(4)当加入溶液的质量为b g时,向所得溶液中滴加酚酞溶液,溶液呈 色。
HCl、NaCl
NaOH+HCl=NaCl+H2O
NaOH
红
5.溶液酸碱度的应用
(1)工业:许多化学反应必须在一定pH溶液里进行;
(2)农业:农作物适宜在pH为7或接近7的土壤中生长;
考点:正常雨水pH约为5.6(显酸性)原因:___________________
(4)测定人体体液的pH,了解人体健康状况。
H2O + CO2 = H2CO3
三、溶液酸碱度的表示法—pH
(3)测定雨水的pH,可以了解空气的污染情况
酸雨的形成:SO2+H2O=H2SO3
视频:身边一些物质的pH
1.身边一些物质的PH
含HCl
含NaOH
2.人体一些体液正常pH范围
血浆 7.35~ 7.45
唾液 6.6 ~ 7.1
胃液 0.9 ~ 1.5
一、溶液的酸碱度
二、溶液酸碱度的调节
1.定义:表示溶液酸碱性的_________。
2.表示方法:用_____表示,测定范围______。
3.测定溶液PH方法及注意事项
A B C D
强弱程度
pH
0~14
2022-2023学年九年级化学下册 (人教版)
第十单元 酸和碱 Acids and bases
课题2 酸和碱的中和反应
- Learning objectives -
第
1
课
时
1.
知道中和反应的概念
2.
了解中和反应的实质
3.
了解中和反应的应用
本课件内嵌1个视频,即点即播,使用方便(此页可删除)。
Video1:在氢氧化钠溶液中滴加稀盐酸
说明:本课件使用WPS制作,使用WPS体验更佳效果。
夏天,被蚊虫叮咬以后,有人会用肥皂水来消痛止痒。你能利用学过的知识解释其中的化学原理吗?
视频:在氢氧化钠溶液中滴加稀盐酸
在氢氧化钠溶液中滴加稀盐酸
步 骤 现 象
1.向NaOH溶液中滴加酚酞溶液 溶液由无色变为______
2.逐滴滴加稀盐酸并不断振荡 溶液由红色恰好变为_____
结论: 红色
无色
盐酸和氢氧化钠发生了反应。
1.加入酚酞原因:_____________________酚酞起_____作用。
2.逐滴滴入稀盐酸目的:防止_______过量。
3.当溶液由___色恰好变为___色时中和反应恰好完成。
指示
无
稀盐酸
红
两者反应现象不明显
1.某同学向氢氧化钠溶液中加入稀盐酸后,发现忘记加入酚酞,他赶紧向反应后的溶液中加入酚酞试液,溶液呈无色,他认为二者恰好完全反应,溶液呈中性,他的说法是否正确?说明原因。
不正确;酚酞试液不变色,可能是二者恰好反应,溶液呈中性,也可能稀盐酸过量;溶液呈酸性。
2.能否把酸和碱的先后顺序调换?
不可以,因为盐酸中滴加酚酞时不变色,滴加氢氧化钠溶液溶液变红色时,氢氧化钠溶液已经过量,不能指示出恰好完全反应的时刻。
中和反应操作顺序:先加酚酞再滴盐酸
3. 能否把无色酚酞换成紫色石蕊?那个效果更好?
答:可以,NaOH溶液中滴加石蕊变蓝色,再加入盐酸,恰好由蓝色变为紫色时,即恰好完全反应;
用酚酞溶液效果更好,红色变无色更明显。
4.如何判断稀盐酸是否过量?(利用酸的化学性质)
方 案 现 象
①滴加_________试剂 溶液变红色
②加入H前金属,如_____ 有气泡产生
③加_____盐:CaCO3、Na2CO3 ④滴加一滴__________溶液 溶液仍为无色
氢氧化钠
锌粒
紫色石蕊
碳酸
一、中和反应
HCl + NaOH = NaCl + H2O
1.定义:___和___反应生成_______。
酸
盐和水
碱
金属离子
酸根离子
NaCl、CuSO4 、CaCO3 、Na2CO3、FeSO4
注意:不是所有的盐都含有金属离子(如铵盐—NH4NO3)
盐
H2SO4 + 2NaOH = Na2SO4 + 2 H2O
2HCl + Ca(OH)2 = CaCl2 + 2 H2O
+
(2)中和反应的实质是酸中 的和碱中的 结合生成水。用离子方程式表示为 。
(2019.河南改编)如图是氢氧化钠与盐酸反应示意图。
Na+、Cl-
H++OH-=H2O
(1)反应前后没有发生变化的离子有 。
H+
OH-
生成盐和水的反应,不一定都是中和反应。
如: 1.酸+金属氧化物→盐+水
2.碱+非金属氧化物→盐+水
CO2+2NaOH=Na2CO3+H2O
强调:中和反应特指酸和碱反应生成盐和水
Fe2O3+6HCl= 2FeCl3+ 3H2O
二、中和反应的应用
1.用熟石灰改良酸性土壤/中和酸性废水
Ca(OH)2+H2SO4=
CaSO4+2H2O
Al(OH)3 + 3HCl=
Mg(OH)2 + 2HCl=
AlCl3 + 3H2O
MgCl2 + 2H2O
蚊虫叮咬后分泌蚁酸,造成皮肤肿痛可涂抹一些含有碱性物质(如氨水NH3·H2O)的药水,或肥皂水(碱性)。
2.医疗上中和胃酸过多/蚊虫叮咬
思考:改良酸性土壤/中和胃酸,能否用氢氧化钠?
不可以,因为氢氧化钠腐蚀性太强,且价格昂贵。
定义:酸 + 碱 =__________(易错辨析)
实质:____________________
盐:__________ + __________(_________盐不含金属离子)
1.用_________________改良酸性土壤/处理酸性废水
2.治疗胃酸过多用的两种碱________和_________
Al(OH)3
一、中和反应
二、中和反应的应用
盐 + 水
H+ + OH- = H2O
金属离子
酸根离子
铵NH4+
熟石灰Ca(OH)2
Al(OH)3 + 3HCl=AlCl3 + 3H2O
Mg(OH)2 + 2HCl=MgCl2 + 2H2O
Mg(OH)2
- Learning objectives -
第
2
课
时
1.
了解溶液酸碱度的表示方法—pH值
2.
使用pH试纸检验溶液酸碱度的方法
3.
了解溶液酸碱性对生活、生产的意义
本课件内嵌2个视频,即点即播,使用方便(此页可删除)。
Video1:用pH试纸测定溶液的酸碱度
说明:本课件使用WPS制作,使用WPS体验更佳效果。
Video2:身边一些物质的pH
使用指示剂只可以检验溶液的酸碱性,如何测定和表示溶液的酸碱性强弱程度呢?
溶液酸碱度的表示方法—pH值
视频:用pH试纸测定溶液的酸碱度
1.pH试纸的测定范围在_____之间。
2.使用方法:用________蘸取待测液滴到pH试纸上,把试纸显示的颜色与____________对比读数。(数值为整数)
3.注意事项:
(1)测定溶液pH值时,不能事先将玻璃棒或试纸润湿
(2)不能将pH试纸浸入溶液中
0~14
玻璃棒
标准比色卡
三、溶液酸碱度的表示法—pH
1.(2019.河南改编)下列测定溶液pH的操作,错误的是( )
B
A
B
C
D
常用的pH计
三、溶液酸碱度的表示法—pH
(3)pH__7,显碱性,存在___。pH越__,碱性越强,OH-浓度越___。
(2)pH 7,显酸性,存在__。pH越__,酸性越强,H+浓度越___。
(1)pH 7,显中性。
酸性最强
碱性最强
酸性
pH<7
中性
pH=7
碱性
pH>7
3.pH与溶液酸碱性的关系:
=
>
如:水,NaCl溶液等
如:HCl、H2SO4
如:Ca(OH)2 、NaOH等碱;部分盐如Na2CO3溶液等
<
大
大
小
大
增强
增强
H+
OH-
1.若用润湿的玻璃棒(或将pH试纸用水润湿),测酸的pH时,将使酸性______,pH______。
2.测碱溶液的pH时,若用润湿的玻璃棒(或将pH试纸用水润湿),使碱性______,pH______。
减弱
减弱
变大
变小
碱性增强
酸性增强
中性
0 7 14
4.改变溶液酸碱度的方法(改变H+/OH-的浓度)
(1)使酸性溶液的pH增大应加_____或_____性溶液。
(2)使碱性溶液的pH减小应加_____或_____性溶液。
酸中加水
酸中加碱
碱中加酸
碱中加水
水
碱
水
酸
三、溶液酸碱度的表示法—pH
7
pH
7
pH
7
pH
7
pH
1.(2009.河北)用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示。
(1)该反应的化学方程式为______________________
(2)该实验操作是将 溶液
滴加到另一种溶液中。
(3)当加入溶液的质量为a g时,
所得溶液中的溶质为 。
(4)当加入溶液的质量为b g时,向所得溶液中滴加酚酞溶液,溶液呈 色。
HCl、NaCl
NaOH+HCl=NaCl+H2O
NaOH
红
5.溶液酸碱度的应用
(1)工业:许多化学反应必须在一定pH溶液里进行;
(2)农业:农作物适宜在pH为7或接近7的土壤中生长;
考点:正常雨水pH约为5.6(显酸性)原因:___________________
(4)测定人体体液的pH,了解人体健康状况。
H2O + CO2 = H2CO3
三、溶液酸碱度的表示法—pH
(3)测定雨水的pH,可以了解空气的污染情况
酸雨的形成:SO2+H2O=H2SO3
视频:身边一些物质的pH
1.身边一些物质的PH
含HCl
含NaOH
2.人体一些体液正常pH范围
血浆 7.35~ 7.45
唾液 6.6 ~ 7.1
胃液 0.9 ~ 1.5
一、溶液的酸碱度
二、溶液酸碱度的调节
1.定义:表示溶液酸碱性的_________。
2.表示方法:用_____表示,测定范围______。
3.测定溶液PH方法及注意事项
A B C D
强弱程度
pH
0~14
同课章节目录
