10.1+常见的酸和碱(共3课时)(教学课件54页)-2022-2023学年九年级化学下册同步教学课件+课时练(人教版)
文档属性
| 名称 | 10.1+常见的酸和碱(共3课时)(教学课件54页)-2022-2023学年九年级化学下册同步教学课件+课时练(人教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 162.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-06 17:14:31 | ||
图片预览











文档简介
(共54张PPT)
2022-2023学年九年级化学下册 (人教版)
第十单元 酸和碱 Acids and bases
课题一 常见的酸和碱
本课件内嵌6个视频,即点即播,使用方便(此页可删除)。
Video1:酸爽吃柠檬
说明:本课件使用WPS制作,使用WPS体验更佳效果。
Video2:酸、碱与指示剂的作用
Video3:自制酸碱指示剂
Video4:盐酸和硫酸的物理性质
Video5:浓硫酸的腐蚀性
Video6:浓硫酸的稀释
- Learning objectives -
第
1
课
时
1.
会用酸碱指示剂检验溶液的酸碱性
2.
了解几种常见的酸的主要性质和用途
3.
了解浓硫酸的腐蚀性和稀释的方法
视频:酸爽吃柠檬
柠檬中含有柠檬酸
食醋中含有醋酸
酸奶中含有乳酸
油污清洁剂含NaOH
石灰水
石灰水含有Ca(OH)2
清凉油中含有氨水
酸
Acid
碱
Alkali
酸和碱是两类不同的化合物,我们应该怎样区分酸和碱呢?
视频: 酸、碱与指示剂的作用
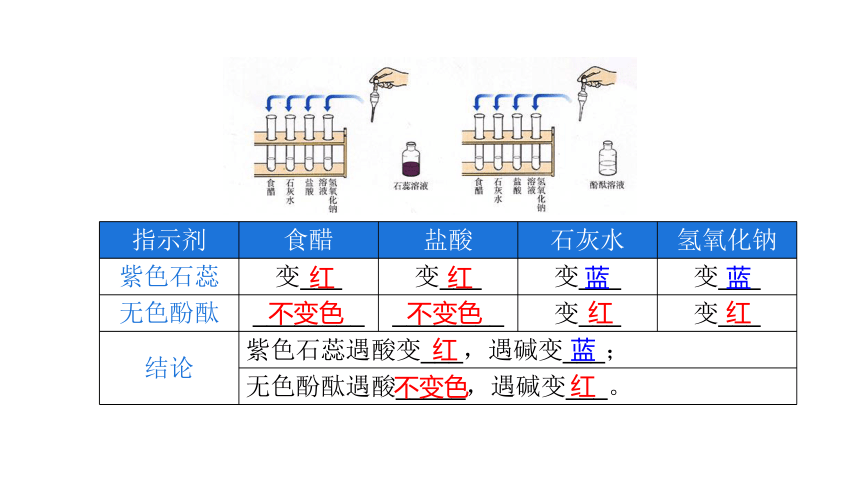
指示剂 食醋 盐酸 石灰水 氢氧化钠
紫色石蕊 变___ 变___ 变___ 变___
无色酚酞 ________ ________ 变___ 变___
结论 紫色石蕊遇酸变___,遇碱变___; 无色酚酞遇酸_____,遇碱变___。 红
蓝
红
不变色
红
蓝
不变色
不变色
红
红
红
蓝
一、酸、碱与指示剂的作用
1.某溶液滴入酚酞保持无色,该溶液显酸性,对吗?
可能显酸性,也可能显中性
2.要一次鉴别出稀盐酸、澄清石灰水和食盐溶液,可以用 。
A.紫色石蕊 B.无色酚酞
紫色石蕊
视频: 自制酸碱指示剂
自制酸碱指示剂
白醋 石灰水 稀盐酸 氢氧化钠溶液
牵牛花汁液 红 蓝 红 蓝
月季花汁液 红 草绿 红 草绿
紫甘蓝汁液 红 黄绿 红 黄绿
牵牛花
月季花
紫甘蓝
视频: 盐酸和硫酸的物理性质
二、几种常见的酸
物理性质 盐酸(HCl) 硫酸(H2SO4)
颜色、状态 无色、水状 无色、油状
打开瓶盖后
气味
密度 浓盐酸(37%~38%) 1.19g/cm3 浓硫酸(98%)
1.84g/cm3
出现白雾(挥发性,物理性质)
无明显现象
剌激性气味
无味
均大于水
1.盐酸和硫酸的物理性质
二、几种常见的酸
2.盐酸和硫酸的用途
用 途
盐酸(HCl)
硫酸(H2SO4)
1.金属除锈
2.制造药物
3._____成分,帮助消化
1.生产化肥、农药、火药、燃料
2.冶炼金属、精炼石油
3.金属除锈
4.浓硫酸具有吸水性,做干燥剂
物理性质
胃酸
1.实验室制取二氧化碳时能否用浓盐酸?
石灰石
和
浓盐酸
不能,浓盐酸具有挥发性,使制得的CO2中混有HCl气体。
2.干燥H2、CO2、O2,可以利用图所示的洗瓶,洗气时气体从___端进___端出,利用浓硫酸的________干燥气体。
B
A
吸水性
浓硫酸
A B
3.已平衡的天平两端放着两个分别盛有浓盐酸和浓硫酸的敞口烧杯,过一段时间后,天平会( )
A.左端下沉 B.右端下沉 C.仍平衡
B
敞口久置 溶液质量 浓度 原因
浓硫酸 变_____ 均变_____
浓盐酸 变_____
保存方法 浓硫酸/浓盐酸均要________保存 大
溶质质量减少
小
溶剂质量增加
密封
小
除了盐酸(HCl)、硫酸(H2SO4),还有碳酸(H2CO3)硝酸(HNO3)、醋酸(CH3COOH)等。
蓄电池含有硫酸
食醋中含有醋酸
酸的构成: H+ + 酸根
二、几种常见的酸
实验室用硝酸
视频: 浓硫酸的腐蚀性
实验对象 现 象
纸 纸上出现____色字迹
小木棍 小木棍触及浓硫酸的部位变____
布 滴有浓硫酸的的部位变____
黑
黑
黑
浓硫酸的吸水性属于_____性质;炭化/脱水性/腐蚀性属于______性质。
物理
化学
二、几种常见的酸
1.浓硫酸的腐蚀性
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
Zn+H2SO4=ZnSO4+H2↑
浓硫酸有强氧化性,它与活泼金属反应不会生成氢气,生成的气体是二氧化硫。但随着反应进行,硫酸被消耗,其浓度变小,逐渐变成稀硫酸,又会生成氢气。
所以,制取氢气时不用浓硫酸,要用稀硫酸。
浓硫酸的强氧化性
视频: 稀释浓硫酸
2.浓硫酸的稀释
添加顺序:_______
颠倒后果:____________________
玻璃棒作用:____________________
说明:浓硫酸溶于水_____热
如不慎将浓硫酸沾到衣服或皮肤上,应立即___________,然后涂上3%~5%的碳酸氢钠溶液。
搅拌,加快热量散失
酸液沸溅,造成危险
大量水冲洗
放
酸入水
二、几种常见的酸
浓硫酸密度比水大,水浮在浓硫酸表面,浓硫酸溶于水放热,酸液沸溅,造成危险。
遇水放热
固体NaOH
浓硫酸
生石灰CaO
吸水性,物理变化
能与水反应,化学变化
练习:基训P119:12
几种干燥剂的干燥原理
一、酸、碱与指示剂的反应
紫色石蕊试剂遇酸变____,遇碱变______。
无色酚酞试剂遇酸______,遇碱变_____。
二、浓盐酸、浓硫酸的性质比较
盐酸(HCl) 硫酸(H2SO4)
物理性质 颜色、状态 无色、水状液体 无色、油状液体
挥发性
气味
吸水性
化学性质 腐蚀性 有挥发性
无挥发性
有剌激性气味
无味
无吸水性
有吸水性
三、浓硫酸的稀释
顺序:酸入水
红色
蓝色
红色
不变色
都具有腐蚀性
- Learning objectives -
第
2
课
时
1.
酸与指示剂的作用
2.
酸与活泼金属的反应
3.
酸与金属氧化物反应
本课件内嵌3个视频,即点即播,使用方便(此页可删除)。
Video1:酸与指示剂的作用
说明:本课件使用WPS制作,使用WPS体验更佳效果。
Video2:酸与生锈铁钉的反应
Video3:氧化铜与稀硫酸反应
视频:酸与指示剂的作用
一、酸的化学性质
滴加石蕊
滴加酚酞
紫色石蕊遇酸变______
1.酸与指示剂的作用
红
不变色
无色酚酞遇酸________
稀硫酸 盐酸
镁
铝
锌
铁
Mg+H2SO4=MgSO4 +H2↑
Mg+2HCl=MgCl2 + H2 ↑
Zn + H2SO4 =ZnSO4+H2 ↑
Zn + 2HCl = ZnCl2+ H2 ↑
Fe+H2SO4=FeSO4 +H2 ↑
Fe+2HCl=FeCl2 + H2 ↑
2Al+3H2SO4=Al 2(SO4)3 + 3H2 ↑
2Al+6HCl =2Al Cl3+3H2 ↑
一、酸的化学性质
2.酸+活泼金属→盐+氢气
视频:酸与生锈铁钉的反应
一、酸的化学性质
现象及化学方程式
现 象 铁锈____,无色溶液变为___色
铁锈+盐酸
铁锈+硫酸
用途
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
消失
金属表面除锈
黄
Fe3+
3.酸+金属氧化物→盐+水
【讨论】用盐酸除铁锈时,能否将铁钉长时间浸没在稀盐酸中?
不能,因为稀盐酸能够与铁钉反应。
现 象 _____色粉末消失,无色溶液变为_____色 化学方程式 + HCl
+ H2SO4
H2SO4 + CuO = CuSO4 + H2O
蓝
2HCl + CuO = CuCl2 + H2O
黑
视频:氧化铜与稀硫酸反应
3.酸+金属氧化物=_______(用途: )
红
盐+氢气
酸的化学性质
金属表面除锈
盐+水
不变色
紫色石蕊溶液遇酸变 ,无色酚酞溶液遇酸 。
1.酸与指示剂的作用
2.酸+金属=__________
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
- Learning objectives -
第
3
课
时
1.
了解常见的碱的物理性质
2.
了解常见的碱的化学性质
3.
知道酸、碱具有相似性质的原因
本课件内嵌3个视频,即点即播,使用方便(此页可删除)。
Video1:氢氧化钠的潮解
说明:本课件使用WPS制作,使用WPS体验更佳效果。
Video2:碱的化学性质
Video3:试验物质的导电性
学习目标
- Learning objectives -
1.
了解常见的碱的物理性质
2.
了解常见的碱的化学性质
3.
知道酸、碱具有相似性质的原因
视频:氢氧化钠的潮解
(1)____色固体。俗名: , , 。
(2)溶解性:_____溶于水, (吸/放)热
(3)具有______性,能吸收水分而潮解,可做 。
(4)用途:① ;② ;③ 。
一、常见的碱
1.氢氧化钠(NaOH)
火碱
烧碱
苛性钠
白
气体干燥剂
去除油污
肥皂、造纸、纺织
易
放
吸水
气体干燥剂
直接放在托盘上
放在纸片上
放在玻璃器皿中
NaOH
判断下列称量氢氧化钠固体方法是否合理
【解析】NaOH易潮解,且有强烈的腐蚀性,须放在玻璃器皿中称量
NaOH
一、常见的碱
(1)俗名: , 。____色固体,____溶于水。
(2)制取: 。
(3)用途:①农业上改良 ;配制 ; ② (石灰乳、石灰浆);
③试剂 的主要成分。
2.氢氧化钙—Ca(OH)2
熟石灰
消石灰
白
酸性土壤
微
CaO+H2O=Ca(OH)2
波尔多液
建筑材料
澄清石灰水
一、常见的碱
氢氧化钠 NaOH
氢氧化钙 Ca(OH)2
氢氧化钾 KOH
氨 水 NH3·H2O
碱的构成:___________ + _______
OH-
金属离子
不含金属离子
视频:碱的化学性质
二、碱的化学性质
2 Na2SO3 + H2O
2 Na2SO4 + H2O
紫色石蕊溶液遇碱变 色,无色酚酞溶液遇碱变 色。
1.碱与指示剂的作用
蓝
红
2.碱 + 非金属氧化物 = 盐 + 水
Ca(OH)2+CO2=CaCO3↓+ H2O
2NaOH + CO2 =Na2CO3 + H2O
NaOH + SO2 =
NaOH + SO3 =
检验CO2
吸收CO2
(氢氧化钠变质)
练习:分别写出氢氧化钠与SO3 和SO2反应的化学方程式:
1.氢氧化钠为什么要密封保存?
(1) ;(2) 。
氢氧化钠在空气中易吸水潮解
与空气中的CO2反应而变质
2.怎样鉴别石灰水和氢氧化钠溶液?(课本第2题)
向任一种溶液中通入CO2,变浑浊是石灰水
物质 质量变化 变化类型
NaOH固体 变____ _____变化
生石灰CaO 变____ _____变化
化学
2NaOH + CO2 = Na2CO3 + H2O
大
大
化学
物质 质量变化 浓度变化 变化类型
NaOH溶液 变____ 变____ _____变化
Ca(OH)2溶液 变____ 变____ _____变化
Ca(OH)2+CO2=CaCO3↓+ H2O
44
100
80
106
1.下列物质敞口放置后各有什么变化。
小
大
小
大
化学
化学
NaOH溶液
CO
(1)固体NaOH可作某些气体的干燥剂(_____性)
吸水
(2)NaOH溶液用途:_________
吸收CO2
例:除杂CO(CO2)
能否干燥CO2?
不能,氢氧化钠能与CO2反应。
2NaOH + CO2 = Na2CO3 + H2O
2.NaOH的碱的用途
在水中加入少量的NaOH可以增强溶液的______性。
电解水实验装置
导电
视频:试验物质的导电性
物质 是否发光 导电性
稀盐酸、稀硫酸、醋酸
氢氧化钠、氢氧化钙、氢氧化钾 碳酸钠溶液 蒸馏水、乙醇
发光
不发光
良好
弱
溶液能够导电原因:存在能自由移动的_________。
酸:___+__________ 碱:__________+_____
酸具有相似性质的原因:酸溶液中都有相同的_______ 碱具有相似性质的原因:碱溶液中都有相同的_______ OH-
金属离子
酸根离子
H+
带电粒子
H+
OH-
三、物质的导电性
HNO3 = H+ + NO3-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
KOH = K+ + OH-
Ca(OH)2 = Ca2+ + 2OH-
NaOH = Na+ + OH-
水和乙醇是由分子构成的,分子不带电,所以导电能力弱。
名称 氢氧化钠(NaOH) 氢氧化钙(Ca(OH)2)
俗名
溶解性
用途 1.气体干燥剂(吸水性) 2.吸收二氧化碳 1.改良酸性土壤
2.建筑材料(石灰乳、石灰浆)
3.配制农药波尔多液、
化学 性质 1.与指示剂作用:酚酞遇碱变_____;石蕊遇碱变_____ 2.碱+非金属氧化物 =盐+水 一、常见的碱
Ca(OH)2+ CO2 = CaCO3↓ + H2O(检验CO2)
2NaOH + CO2 = Na2CO3 + H2O(吸收CO2)
火碱、烧碱、苛性钠
熟石灰、消石灰
易溶(放热)
微溶
蓝色
红色
二、溶液能导电原因:存在能自由移动的_________。
三、酸
1.酸的构成:_____+_______
2.酸具有相似性质的原因:酸溶液中都存在____
四、碱
1.碱的构成:_________________+_____
2.碱具有相似性质的原因:水溶液中都存在_____
带电粒子
H+ 酸根
H+
OH-
HCl、H2SO4、HNO3、CH3COOH、H2CO3
NaOH、KOH、Ca(OH)2、Ba(OH)2、NH3 H2O
金属离子或(NH4+) OH-
1.下列物质溶于水,不导电的是( )
A.硫酸 B.硝酸钾 C.酒精 D.氢氧化钾
C
2.生石灰做干燥剂的原理 (用化学方程式表示)
经过一段时间后,会发现纸袋内的白色颗粒粘在一起成为块状。这块状固体是 ,原理 。
CaO + H2O = Ca(OH)2
Ca(OH)2+CO2= CaCO3↓+H2O
CaCO3
2022-2023学年九年级化学下册 (人教版)
第十单元 酸和碱 Acids and bases
课题一 常见的酸和碱
本课件内嵌6个视频,即点即播,使用方便(此页可删除)。
Video1:酸爽吃柠檬
说明:本课件使用WPS制作,使用WPS体验更佳效果。
Video2:酸、碱与指示剂的作用
Video3:自制酸碱指示剂
Video4:盐酸和硫酸的物理性质
Video5:浓硫酸的腐蚀性
Video6:浓硫酸的稀释
- Learning objectives -
第
1
课
时
1.
会用酸碱指示剂检验溶液的酸碱性
2.
了解几种常见的酸的主要性质和用途
3.
了解浓硫酸的腐蚀性和稀释的方法
视频:酸爽吃柠檬
柠檬中含有柠檬酸
食醋中含有醋酸
酸奶中含有乳酸
油污清洁剂含NaOH
石灰水
石灰水含有Ca(OH)2
清凉油中含有氨水
酸
Acid
碱
Alkali
酸和碱是两类不同的化合物,我们应该怎样区分酸和碱呢?
视频: 酸、碱与指示剂的作用
指示剂 食醋 盐酸 石灰水 氢氧化钠
紫色石蕊 变___ 变___ 变___ 变___
无色酚酞 ________ ________ 变___ 变___
结论 紫色石蕊遇酸变___,遇碱变___; 无色酚酞遇酸_____,遇碱变___。 红
蓝
红
不变色
红
蓝
不变色
不变色
红
红
红
蓝
一、酸、碱与指示剂的作用
1.某溶液滴入酚酞保持无色,该溶液显酸性,对吗?
可能显酸性,也可能显中性
2.要一次鉴别出稀盐酸、澄清石灰水和食盐溶液,可以用 。
A.紫色石蕊 B.无色酚酞
紫色石蕊
视频: 自制酸碱指示剂
自制酸碱指示剂
白醋 石灰水 稀盐酸 氢氧化钠溶液
牵牛花汁液 红 蓝 红 蓝
月季花汁液 红 草绿 红 草绿
紫甘蓝汁液 红 黄绿 红 黄绿
牵牛花
月季花
紫甘蓝
视频: 盐酸和硫酸的物理性质
二、几种常见的酸
物理性质 盐酸(HCl) 硫酸(H2SO4)
颜色、状态 无色、水状 无色、油状
打开瓶盖后
气味
密度 浓盐酸(37%~38%) 1.19g/cm3 浓硫酸(98%)
1.84g/cm3
出现白雾(挥发性,物理性质)
无明显现象
剌激性气味
无味
均大于水
1.盐酸和硫酸的物理性质
二、几种常见的酸
2.盐酸和硫酸的用途
用 途
盐酸(HCl)
硫酸(H2SO4)
1.金属除锈
2.制造药物
3._____成分,帮助消化
1.生产化肥、农药、火药、燃料
2.冶炼金属、精炼石油
3.金属除锈
4.浓硫酸具有吸水性,做干燥剂
物理性质
胃酸
1.实验室制取二氧化碳时能否用浓盐酸?
石灰石
和
浓盐酸
不能,浓盐酸具有挥发性,使制得的CO2中混有HCl气体。
2.干燥H2、CO2、O2,可以利用图所示的洗瓶,洗气时气体从___端进___端出,利用浓硫酸的________干燥气体。
B
A
吸水性
浓硫酸
A B
3.已平衡的天平两端放着两个分别盛有浓盐酸和浓硫酸的敞口烧杯,过一段时间后,天平会( )
A.左端下沉 B.右端下沉 C.仍平衡
B
敞口久置 溶液质量 浓度 原因
浓硫酸 变_____ 均变_____
浓盐酸 变_____
保存方法 浓硫酸/浓盐酸均要________保存 大
溶质质量减少
小
溶剂质量增加
密封
小
除了盐酸(HCl)、硫酸(H2SO4),还有碳酸(H2CO3)硝酸(HNO3)、醋酸(CH3COOH)等。
蓄电池含有硫酸
食醋中含有醋酸
酸的构成: H+ + 酸根
二、几种常见的酸
实验室用硝酸
视频: 浓硫酸的腐蚀性
实验对象 现 象
纸 纸上出现____色字迹
小木棍 小木棍触及浓硫酸的部位变____
布 滴有浓硫酸的的部位变____
黑
黑
黑
浓硫酸的吸水性属于_____性质;炭化/脱水性/腐蚀性属于______性质。
物理
化学
二、几种常见的酸
1.浓硫酸的腐蚀性
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
Zn+H2SO4=ZnSO4+H2↑
浓硫酸有强氧化性,它与活泼金属反应不会生成氢气,生成的气体是二氧化硫。但随着反应进行,硫酸被消耗,其浓度变小,逐渐变成稀硫酸,又会生成氢气。
所以,制取氢气时不用浓硫酸,要用稀硫酸。
浓硫酸的强氧化性
视频: 稀释浓硫酸
2.浓硫酸的稀释
添加顺序:_______
颠倒后果:____________________
玻璃棒作用:____________________
说明:浓硫酸溶于水_____热
如不慎将浓硫酸沾到衣服或皮肤上,应立即___________,然后涂上3%~5%的碳酸氢钠溶液。
搅拌,加快热量散失
酸液沸溅,造成危险
大量水冲洗
放
酸入水
二、几种常见的酸
浓硫酸密度比水大,水浮在浓硫酸表面,浓硫酸溶于水放热,酸液沸溅,造成危险。
遇水放热
固体NaOH
浓硫酸
生石灰CaO
吸水性,物理变化
能与水反应,化学变化
练习:基训P119:12
几种干燥剂的干燥原理
一、酸、碱与指示剂的反应
紫色石蕊试剂遇酸变____,遇碱变______。
无色酚酞试剂遇酸______,遇碱变_____。
二、浓盐酸、浓硫酸的性质比较
盐酸(HCl) 硫酸(H2SO4)
物理性质 颜色、状态 无色、水状液体 无色、油状液体
挥发性
气味
吸水性
化学性质 腐蚀性 有挥发性
无挥发性
有剌激性气味
无味
无吸水性
有吸水性
三、浓硫酸的稀释
顺序:酸入水
红色
蓝色
红色
不变色
都具有腐蚀性
- Learning objectives -
第
2
课
时
1.
酸与指示剂的作用
2.
酸与活泼金属的反应
3.
酸与金属氧化物反应
本课件内嵌3个视频,即点即播,使用方便(此页可删除)。
Video1:酸与指示剂的作用
说明:本课件使用WPS制作,使用WPS体验更佳效果。
Video2:酸与生锈铁钉的反应
Video3:氧化铜与稀硫酸反应
视频:酸与指示剂的作用
一、酸的化学性质
滴加石蕊
滴加酚酞
紫色石蕊遇酸变______
1.酸与指示剂的作用
红
不变色
无色酚酞遇酸________
稀硫酸 盐酸
镁
铝
锌
铁
Mg+H2SO4=MgSO4 +H2↑
Mg+2HCl=MgCl2 + H2 ↑
Zn + H2SO4 =ZnSO4+H2 ↑
Zn + 2HCl = ZnCl2+ H2 ↑
Fe+H2SO4=FeSO4 +H2 ↑
Fe+2HCl=FeCl2 + H2 ↑
2Al+3H2SO4=Al 2(SO4)3 + 3H2 ↑
2Al+6HCl =2Al Cl3+3H2 ↑
一、酸的化学性质
2.酸+活泼金属→盐+氢气
视频:酸与生锈铁钉的反应
一、酸的化学性质
现象及化学方程式
现 象 铁锈____,无色溶液变为___色
铁锈+盐酸
铁锈+硫酸
用途
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
消失
金属表面除锈
黄
Fe3+
3.酸+金属氧化物→盐+水
【讨论】用盐酸除铁锈时,能否将铁钉长时间浸没在稀盐酸中?
不能,因为稀盐酸能够与铁钉反应。
现 象 _____色粉末消失,无色溶液变为_____色 化学方程式 + HCl
+ H2SO4
H2SO4 + CuO = CuSO4 + H2O
蓝
2HCl + CuO = CuCl2 + H2O
黑
视频:氧化铜与稀硫酸反应
3.酸+金属氧化物=_______(用途: )
红
盐+氢气
酸的化学性质
金属表面除锈
盐+水
不变色
紫色石蕊溶液遇酸变 ,无色酚酞溶液遇酸 。
1.酸与指示剂的作用
2.酸+金属=__________
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
- Learning objectives -
第
3
课
时
1.
了解常见的碱的物理性质
2.
了解常见的碱的化学性质
3.
知道酸、碱具有相似性质的原因
本课件内嵌3个视频,即点即播,使用方便(此页可删除)。
Video1:氢氧化钠的潮解
说明:本课件使用WPS制作,使用WPS体验更佳效果。
Video2:碱的化学性质
Video3:试验物质的导电性
学习目标
- Learning objectives -
1.
了解常见的碱的物理性质
2.
了解常见的碱的化学性质
3.
知道酸、碱具有相似性质的原因
视频:氢氧化钠的潮解
(1)____色固体。俗名: , , 。
(2)溶解性:_____溶于水, (吸/放)热
(3)具有______性,能吸收水分而潮解,可做 。
(4)用途:① ;② ;③ 。
一、常见的碱
1.氢氧化钠(NaOH)
火碱
烧碱
苛性钠
白
气体干燥剂
去除油污
肥皂、造纸、纺织
易
放
吸水
气体干燥剂
直接放在托盘上
放在纸片上
放在玻璃器皿中
NaOH
判断下列称量氢氧化钠固体方法是否合理
【解析】NaOH易潮解,且有强烈的腐蚀性,须放在玻璃器皿中称量
NaOH
一、常见的碱
(1)俗名: , 。____色固体,____溶于水。
(2)制取: 。
(3)用途:①农业上改良 ;配制 ; ② (石灰乳、石灰浆);
③试剂 的主要成分。
2.氢氧化钙—Ca(OH)2
熟石灰
消石灰
白
酸性土壤
微
CaO+H2O=Ca(OH)2
波尔多液
建筑材料
澄清石灰水
一、常见的碱
氢氧化钠 NaOH
氢氧化钙 Ca(OH)2
氢氧化钾 KOH
氨 水 NH3·H2O
碱的构成:___________ + _______
OH-
金属离子
不含金属离子
视频:碱的化学性质
二、碱的化学性质
2 Na2SO3 + H2O
2 Na2SO4 + H2O
紫色石蕊溶液遇碱变 色,无色酚酞溶液遇碱变 色。
1.碱与指示剂的作用
蓝
红
2.碱 + 非金属氧化物 = 盐 + 水
Ca(OH)2+CO2=CaCO3↓+ H2O
2NaOH + CO2 =Na2CO3 + H2O
NaOH + SO2 =
NaOH + SO3 =
检验CO2
吸收CO2
(氢氧化钠变质)
练习:分别写出氢氧化钠与SO3 和SO2反应的化学方程式:
1.氢氧化钠为什么要密封保存?
(1) ;(2) 。
氢氧化钠在空气中易吸水潮解
与空气中的CO2反应而变质
2.怎样鉴别石灰水和氢氧化钠溶液?(课本第2题)
向任一种溶液中通入CO2,变浑浊是石灰水
物质 质量变化 变化类型
NaOH固体 变____ _____变化
生石灰CaO 变____ _____变化
化学
2NaOH + CO2 = Na2CO3 + H2O
大
大
化学
物质 质量变化 浓度变化 变化类型
NaOH溶液 变____ 变____ _____变化
Ca(OH)2溶液 变____ 变____ _____变化
Ca(OH)2+CO2=CaCO3↓+ H2O
44
100
80
106
1.下列物质敞口放置后各有什么变化。
小
大
小
大
化学
化学
NaOH溶液
CO
(1)固体NaOH可作某些气体的干燥剂(_____性)
吸水
(2)NaOH溶液用途:_________
吸收CO2
例:除杂CO(CO2)
能否干燥CO2?
不能,氢氧化钠能与CO2反应。
2NaOH + CO2 = Na2CO3 + H2O
2.NaOH的碱的用途
在水中加入少量的NaOH可以增强溶液的______性。
电解水实验装置
导电
视频:试验物质的导电性
物质 是否发光 导电性
稀盐酸、稀硫酸、醋酸
氢氧化钠、氢氧化钙、氢氧化钾 碳酸钠溶液 蒸馏水、乙醇
发光
不发光
良好
弱
溶液能够导电原因:存在能自由移动的_________。
酸:___+__________ 碱:__________+_____
酸具有相似性质的原因:酸溶液中都有相同的_______ 碱具有相似性质的原因:碱溶液中都有相同的_______ OH-
金属离子
酸根离子
H+
带电粒子
H+
OH-
三、物质的导电性
HNO3 = H+ + NO3-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
KOH = K+ + OH-
Ca(OH)2 = Ca2+ + 2OH-
NaOH = Na+ + OH-
水和乙醇是由分子构成的,分子不带电,所以导电能力弱。
名称 氢氧化钠(NaOH) 氢氧化钙(Ca(OH)2)
俗名
溶解性
用途 1.气体干燥剂(吸水性) 2.吸收二氧化碳 1.改良酸性土壤
2.建筑材料(石灰乳、石灰浆)
3.配制农药波尔多液、
化学 性质 1.与指示剂作用:酚酞遇碱变_____;石蕊遇碱变_____ 2.碱+非金属氧化物 =盐+水 一、常见的碱
Ca(OH)2+ CO2 = CaCO3↓ + H2O(检验CO2)
2NaOH + CO2 = Na2CO3 + H2O(吸收CO2)
火碱、烧碱、苛性钠
熟石灰、消石灰
易溶(放热)
微溶
蓝色
红色
二、溶液能导电原因:存在能自由移动的_________。
三、酸
1.酸的构成:_____+_______
2.酸具有相似性质的原因:酸溶液中都存在____
四、碱
1.碱的构成:_________________+_____
2.碱具有相似性质的原因:水溶液中都存在_____
带电粒子
H+ 酸根
H+
OH-
HCl、H2SO4、HNO3、CH3COOH、H2CO3
NaOH、KOH、Ca(OH)2、Ba(OH)2、NH3 H2O
金属离子或(NH4+) OH-
1.下列物质溶于水,不导电的是( )
A.硫酸 B.硝酸钾 C.酒精 D.氢氧化钾
C
2.生石灰做干燥剂的原理 (用化学方程式表示)
经过一段时间后,会发现纸袋内的白色颗粒粘在一起成为块状。这块状固体是 ,原理 。
CaO + H2O = Ca(OH)2
Ca(OH)2+CO2= CaCO3↓+H2O
CaCO3
同课章节目录
