化学人教版(2019)必修第一册3.1.2.铁、铁的氧化物和铁的氢氧化物(共29张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1.2.铁、铁的氧化物和铁的氢氧化物(共29张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-06 11:29:02 | ||
图片预览






文档简介
(共29张PPT)
复习提问
一.利用特殊性质检验Fe3+和Fe2+:
Fe3+的检验:加入KSCN(硫氰酸钾或硫氰化钾)溶液,若溶液变为血红色,证明含有Fe3+
Fe2+的检验:加入K3[Fe(CN)6]溶液,若生成蓝色沉淀,证明含有Fe2+
Fe3++3SCN- ==Fe(SCN)3(血红)(硫氰化铁)
3Fe2++2[Fe(CN)6]3- ==Fe3[Fe(CN)6]2↓(蓝色)
二、FeCl3分别与铁粉、KI溶液、铜粉反应
Fe+2Fe3+=3Fe2+ 2Fe3++ 2I- = 2Fe2++I2 2Fe3++ Cu = 2Fe2++Cu2+
三、Fe2+既有氧化性又有还原性,与KMnO4(H+)、氯水、锌片反应
5Fe2++MnO4-+8H+==Mn2++5Fe3++4H2O Fe2++Zn=Fe+Zn2+
四、实验室里如何保存FeSO4溶液呢?为什么?
加入铁钉或者铁粉
4Fe2+ +O2+ 4H+ =4Fe3++2H2O
2Fe2++Cl2=2Fe3++2Cl-
目 标 评 价
设计实验,验证FeSO4溶液被氧化的程度。
变质程度1:没有被氧化
证明没有Fe3+
取少量溶液于一支试管中,滴加KSCN溶液,无明显现象,说明没有变质。
变质程度2:部分被氧化
证明既有Fe3+
又有Fe2+
变质程度3:完全被氧化
证明没有Fe2+
取少量酸性高锰酸钾溶液于一支试管中,滴加该溶液,高锰酸钾溶液的紫色不退去,说明完全变质。
取少量溶液于一支试管中,滴加KSCN溶液,溶液变为红色,说明已经变质。
取少量酸性高锰酸钾溶液于一支试管中,滴加该溶液,高锰酸钾溶液的紫色退去,说明部分变质。
缺铁性贫血的人需要补充铁。补的是铁单质么?补铁用的药片为什么要包糖衣?补铁的同时为什么要补维C(维C具有还原性)?
人体补铁补的是二价铁,糖衣起保护膜作用,防止二价铁与空气接触被氧化。维C起还原剂作用,防止二价铁被氧化。
学以致用——生活中的化学 你知道么?
维C和铁搭档 维D和钙搭档
第1节 铁的多样性
第2课时 铁、铁的氧化物和铁的氢氧化物
第3章 物质的性质与转化
学习目标
1 .能够基于元素的价态和物质的所属类别,完整有序地写出含有铁元素的物质的化学式。
3 .能够建立起代表物类比、类比通性和化合价的综合去应对未知的探究模型并结合“价—类”二维图,形成新的认识和探究视角。
2 .初步形成预设、设计,实验和归纳的化学探究方法并了解含铁元素的物质在生产、生活中的应用。
评价目标
1 .诊断并提高学生认识物质并研究其性质的方法和水平。
2 .诊断并发展学生对物质性质实验探究和设计的水平及其化学价值的认识水平。
3 .诊断并发展学生对实验中基于化学性质控制反应实验条件的认识水平。
2Fe + 3Cl2 =2FeCl3
3Fe + 2O2 = Fe3O4
Fe + 2H+ =Fe2+ + H2↑
Fe + Cu2+ =Fe2+ + Cu
Fe + 2Fe3+ =3Fe2+
点燃
点燃
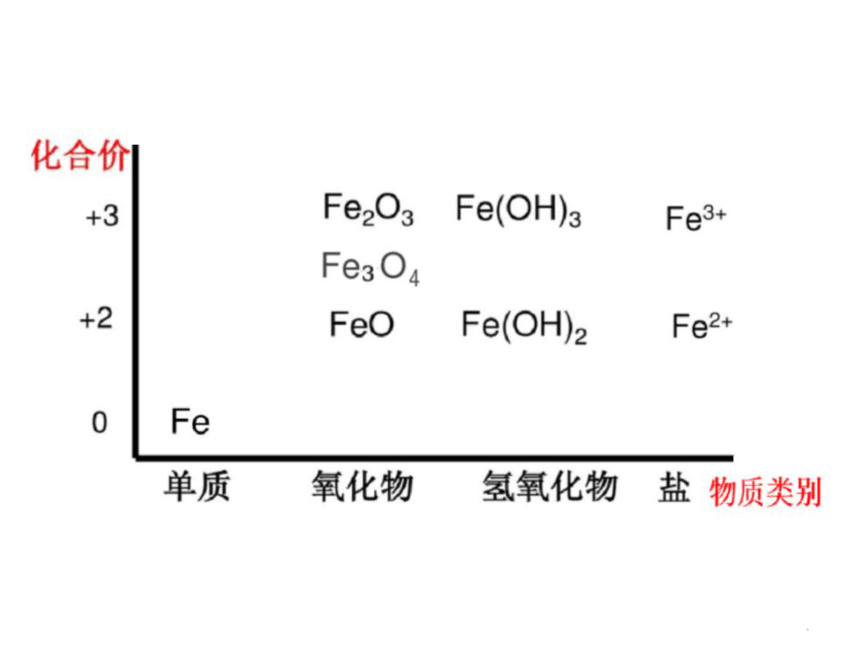
Fe
探究预测一:从物质类别的角度预测性质
思考:有下列物质:①O2 ②AgNO3溶液 ③CuCl2溶液 ④稀硫酸 ⑤FeCl3溶液 ⑥Cl2 ⑦水蒸气(高温) ⑧S与Fe反应时只生成+2价铁的化合物的是_________(填序号,下同),只生成+3价铁的化合物的是________,
既生成+2价又生成+3价铁的化合物的是________。
大本73页上边3T
Fe+S==FeS
△
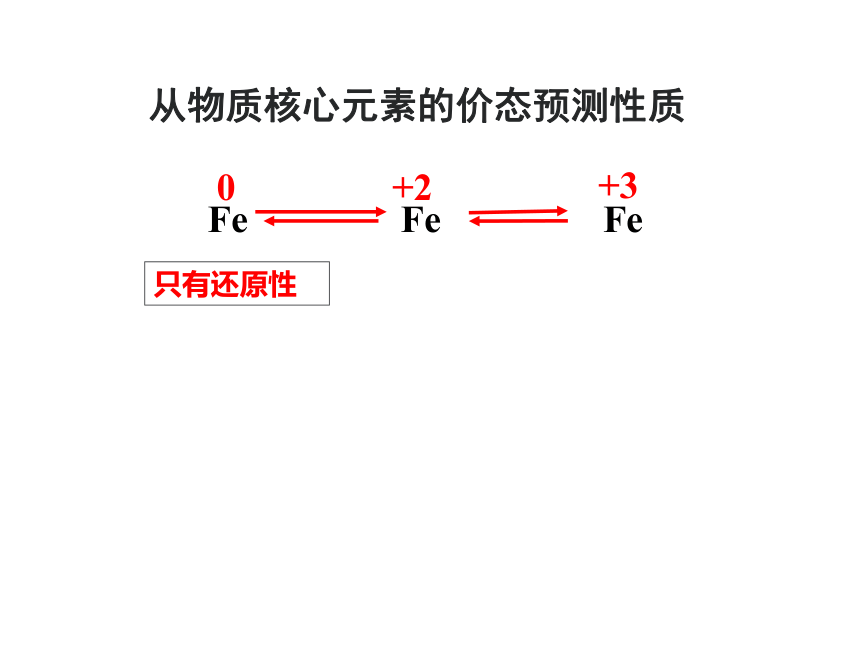
Fe
0
Fe
+3
Fe
+2
只有还原性
从物质核心元素的价态预测性质
单质Fe的还原性
(1)试管底部放一团
湿棉花的目的是什么?
(2)生成的气体是什么?
如何验证?
思考:
Fe+H2O=
?
提供水
产生大量肥皂泡,用火柴点燃听到爆鸣声
3Fe+4H2O(g)==Fe3O4 +4H2
高温
实验操作 实验现象
稀硫酸
产物
酸性KMnO4溶液
KSCN溶液
①
②
试管①:酸性KMnO4溶液紫色褪色
试管②:溶液变红
黑色氧化物的成分探究
FeO
Fe3O4
资料记载:铁的氧化物不溶于水,能溶于酸
?
磁性氧化铁
铁红
黑
黑
红棕
+2
+2、+3
+3
Fe2O3 + 6H+ = 2Fe3+ + 3H2O
Fe的氧化物的性质
FeO + 2H+ = Fe2+ + H2O
碱性氧化物
1. 与水反应生成对应的碱
2. 与酸反应生成盐和水
3. 与酸性氧化物反应生成盐
FeO
Fe2O3
Fe3O4
Fe3O4+ 8H+ = 2Fe3+ +Fe2+ + 3H2O
探究预测二:从物质类别的角度预测性质
选择还原剂
方法引导
探究物质
的氧化性
Fe
0
Fe
+3
Fe
+2
只有氧化性
固态三价铁和CO、H2等
还原剂的反应
探究预测二:从化合价的角度预测性质
写出高炉炼铁的反应原理:
Fe2O3的氧化性
应用:焊接钢轨,
冶炼钒、铬、锰等难熔金属。
2Al + Fe2O3
2Fe+ Al2O3
铝热反应
FeO、Fe2O3、Fe3O4、MnO2、WO3、V2O5等难熔金属氧化物与铝粉的反应也叫铝热反应,常用KClO3和镁条引发该反应。
磁性氧化铁
铁红
黑
黑
红棕
+2
+2、+3
+3
与盐酸反应 FeO+2H+=Fe2++H2O Fe3O4+8H+=Fe2++2Fe3++4H2O Fe2O3+6H+=2Fe3++3H2O
与铝粉反应 3FeO+2Al=3Fe+Al2O3 — 2Al+Fe2O3=2Fe+Al2O3
Fe
0
Fe
+3
Fe
+2
氧化性
FeO的性质
Cl2.H2O2
HNO3
CO、H2
以还原性为主
还原性
6FeO+O2= 2Fe3O4
FeO为碱性氧化物
应用
①铁的哪种氧化物可以用来做录音磁带的原材料
②红砖青砖:红砖的成分是黏土,其红色来自于氧化铁。
烧制出窑冷却前加适量的水,就会烧制出青砖。
请分析烧制原理。
红砖中的Fe2O3 在一定条件下被还原成青砖中的
FeO和Fe3O4
Fe2O3
FeO、Fe3O4
1. 能使指示剂变色
2. 能与酸性氧化物反应
3. 能与酸反应
4. 能与某些盐溶液反应
碱
探究预测三:从物质类别的角度预测性质
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Fe(OH)2+2H+=Fe2++2H2O
Fe的氢氧化物的性质
Fe(OH)2
Fe(OH)3
铁的氢氧化物
【思考】
①Fe(OH)3、 Fe(OH)2可否由Fe2O3 、FeO溶于水制得?
②怎样制备Fe(OH)3?
怎样制备Fe(OH)2?
—FeCl3 溶液
—NaOH溶液
白色
灰绿色
红褐色
红褐色
FeSO4溶液
Fe3+ + 3OH- =Fe(OH)3↓
再思考:Fe(OH)2的制备可以用同样的操作方法吗?
长试管
短试管
问题1:氢氧化亚铁到底是什么颜色呢?
问题2:为什么制取Fe(OH)2现象会是
新问题
红褐色
白色
灰绿色
原因
因为生成的白色Fe(OH)2极易被空气中的氧气氧化成红褐色的Fe(OH)3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
失 4×e-
得 2×2e-
+2
0
-2
+3
应用
在实验过程中,Fe(OH)2白色沉淀存在时间很短,不易观察,其原因是什么?如何改进实验,可以观察到明显的白色沉淀呢?
①将蒸馏水煮沸后配制溶液
②在反应液面上层加盖一层
油脂或者苯,来隔绝空气
③在氢气或者是惰性气体氛围内制备
④滴管末端插入液面以下
⑤亚铁盐必须新制,并放入铁粉,防止被氧化
a
b
铁的氢氧化物
③分解
2Fe(OH)3==Fe2O3 + 3H2O
Fe(OH)2 ====FeO+ 2H2O
隔绝空气
在空气中加热Fe(OH)2 呢?产物?
Fe2O3
Fe(OH)2 Fe(OH)3
颜色、状态 白色固体 红褐色固体
与盐酸反应 Fe(OH)2+2HCl=FeCl2+2H2O Fe(OH)3+3HCl=FeCl3+3H2O
受热分解 - 2Fe(OH)3=Fe2O3+3H2O
制备 可溶性亚铁盐与碱溶液反应:Fe2++2OH-=Fe(OH)2↓ 可溶性铁盐与碱溶液反应:Fe3++3OH-=Fe(OH)3↓
转化 在空气中,Fe(OH)2能够迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3
溶液变红
有Fe2+
有Fe2+
无Fe2+
【Fe2+、Fe3+的检验方法】
[问题5] 除去铜粉中混有的铁粉,可以用什么方法?
加稀盐酸,再过滤
1.下列物质不能通过单质间化合反应直接制得的是( )
A.FeCl2 B.FeCl3 C.Fe3O4 D.CuCl2
A
2.下列过程最终一定有+3价铁生成的是( )
A.过量的Fe与Cl2反应
B.Fe粉加入CuSO4溶液中
C.Fe和Fe2O3的混合物溶于盐酸中
D. Fe粉加入稀盐酸溶液中
A
当堂检测
+2
+3
+8/3
Fe2(SO4)3 FeCl3
FeSO4 FeCl2
复习提问
一.利用特殊性质检验Fe3+和Fe2+:
Fe3+的检验:加入KSCN(硫氰酸钾或硫氰化钾)溶液,若溶液变为血红色,证明含有Fe3+
Fe2+的检验:加入K3[Fe(CN)6]溶液,若生成蓝色沉淀,证明含有Fe2+
Fe3++3SCN- ==Fe(SCN)3(血红)(硫氰化铁)
3Fe2++2[Fe(CN)6]3- ==Fe3[Fe(CN)6]2↓(蓝色)
二、FeCl3分别与铁粉、KI溶液、铜粉反应
Fe+2Fe3+=3Fe2+ 2Fe3++ 2I- = 2Fe2++I2 2Fe3++ Cu = 2Fe2++Cu2+
三、Fe2+既有氧化性又有还原性,与KMnO4(H+)、氯水、锌片反应
5Fe2++MnO4-+8H+==Mn2++5Fe3++4H2O Fe2++Zn=Fe+Zn2+
四、实验室里如何保存FeSO4溶液呢?为什么?
加入铁钉或者铁粉
4Fe2+ +O2+ 4H+ =4Fe3++2H2O
2Fe2++Cl2=2Fe3++2Cl-
目 标 评 价
设计实验,验证FeSO4溶液被氧化的程度。
变质程度1:没有被氧化
证明没有Fe3+
取少量溶液于一支试管中,滴加KSCN溶液,无明显现象,说明没有变质。
变质程度2:部分被氧化
证明既有Fe3+
又有Fe2+
变质程度3:完全被氧化
证明没有Fe2+
取少量酸性高锰酸钾溶液于一支试管中,滴加该溶液,高锰酸钾溶液的紫色不退去,说明完全变质。
取少量溶液于一支试管中,滴加KSCN溶液,溶液变为红色,说明已经变质。
取少量酸性高锰酸钾溶液于一支试管中,滴加该溶液,高锰酸钾溶液的紫色退去,说明部分变质。
缺铁性贫血的人需要补充铁。补的是铁单质么?补铁用的药片为什么要包糖衣?补铁的同时为什么要补维C(维C具有还原性)?
人体补铁补的是二价铁,糖衣起保护膜作用,防止二价铁与空气接触被氧化。维C起还原剂作用,防止二价铁被氧化。
学以致用——生活中的化学 你知道么?
维C和铁搭档 维D和钙搭档
第1节 铁的多样性
第2课时 铁、铁的氧化物和铁的氢氧化物
第3章 物质的性质与转化
学习目标
1 .能够基于元素的价态和物质的所属类别,完整有序地写出含有铁元素的物质的化学式。
3 .能够建立起代表物类比、类比通性和化合价的综合去应对未知的探究模型并结合“价—类”二维图,形成新的认识和探究视角。
2 .初步形成预设、设计,实验和归纳的化学探究方法并了解含铁元素的物质在生产、生活中的应用。
评价目标
1 .诊断并提高学生认识物质并研究其性质的方法和水平。
2 .诊断并发展学生对物质性质实验探究和设计的水平及其化学价值的认识水平。
3 .诊断并发展学生对实验中基于化学性质控制反应实验条件的认识水平。
2Fe + 3Cl2 =2FeCl3
3Fe + 2O2 = Fe3O4
Fe + 2H+ =Fe2+ + H2↑
Fe + Cu2+ =Fe2+ + Cu
Fe + 2Fe3+ =3Fe2+
点燃
点燃
Fe
探究预测一:从物质类别的角度预测性质
思考:有下列物质:①O2 ②AgNO3溶液 ③CuCl2溶液 ④稀硫酸 ⑤FeCl3溶液 ⑥Cl2 ⑦水蒸气(高温) ⑧S与Fe反应时只生成+2价铁的化合物的是_________(填序号,下同),只生成+3价铁的化合物的是________,
既生成+2价又生成+3价铁的化合物的是________。
大本73页上边3T
Fe+S==FeS
△
Fe
0
Fe
+3
Fe
+2
只有还原性
从物质核心元素的价态预测性质
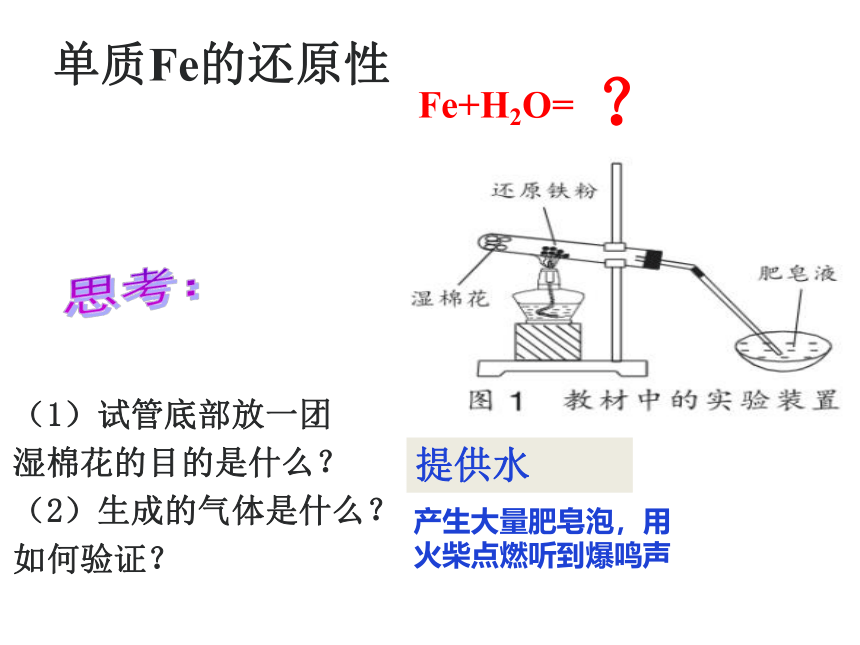
单质Fe的还原性
(1)试管底部放一团
湿棉花的目的是什么?
(2)生成的气体是什么?
如何验证?
思考:
Fe+H2O=
?
提供水
产生大量肥皂泡,用火柴点燃听到爆鸣声
3Fe+4H2O(g)==Fe3O4 +4H2
高温
实验操作 实验现象
稀硫酸
产物
酸性KMnO4溶液
KSCN溶液
①
②
试管①:酸性KMnO4溶液紫色褪色
试管②:溶液变红
黑色氧化物的成分探究
FeO
Fe3O4
资料记载:铁的氧化物不溶于水,能溶于酸
?
磁性氧化铁
铁红
黑
黑
红棕
+2
+2、+3
+3
Fe2O3 + 6H+ = 2Fe3+ + 3H2O
Fe的氧化物的性质
FeO + 2H+ = Fe2+ + H2O
碱性氧化物
1. 与水反应生成对应的碱
2. 与酸反应生成盐和水
3. 与酸性氧化物反应生成盐
FeO
Fe2O3
Fe3O4
Fe3O4+ 8H+ = 2Fe3+ +Fe2+ + 3H2O
探究预测二:从物质类别的角度预测性质
选择还原剂
方法引导
探究物质
的氧化性
Fe
0
Fe
+3
Fe
+2
只有氧化性
固态三价铁和CO、H2等
还原剂的反应
探究预测二:从化合价的角度预测性质
写出高炉炼铁的反应原理:
Fe2O3的氧化性
应用:焊接钢轨,
冶炼钒、铬、锰等难熔金属。
2Al + Fe2O3
2Fe+ Al2O3
铝热反应
FeO、Fe2O3、Fe3O4、MnO2、WO3、V2O5等难熔金属氧化物与铝粉的反应也叫铝热反应,常用KClO3和镁条引发该反应。
磁性氧化铁
铁红
黑
黑
红棕
+2
+2、+3
+3
与盐酸反应 FeO+2H+=Fe2++H2O Fe3O4+8H+=Fe2++2Fe3++4H2O Fe2O3+6H+=2Fe3++3H2O
与铝粉反应 3FeO+2Al=3Fe+Al2O3 — 2Al+Fe2O3=2Fe+Al2O3
Fe
0
Fe
+3
Fe
+2
氧化性
FeO的性质
Cl2.H2O2
HNO3
CO、H2
以还原性为主
还原性
6FeO+O2= 2Fe3O4
FeO为碱性氧化物
应用
①铁的哪种氧化物可以用来做录音磁带的原材料
②红砖青砖:红砖的成分是黏土,其红色来自于氧化铁。
烧制出窑冷却前加适量的水,就会烧制出青砖。
请分析烧制原理。
红砖中的Fe2O3 在一定条件下被还原成青砖中的
FeO和Fe3O4
Fe2O3
FeO、Fe3O4
1. 能使指示剂变色
2. 能与酸性氧化物反应
3. 能与酸反应
4. 能与某些盐溶液反应
碱
探究预测三:从物质类别的角度预测性质
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Fe(OH)2+2H+=Fe2++2H2O
Fe的氢氧化物的性质
Fe(OH)2
Fe(OH)3
铁的氢氧化物
【思考】
①Fe(OH)3、 Fe(OH)2可否由Fe2O3 、FeO溶于水制得?
②怎样制备Fe(OH)3?
怎样制备Fe(OH)2?
—FeCl3 溶液
—NaOH溶液
白色
灰绿色
红褐色
红褐色
FeSO4溶液
Fe3+ + 3OH- =Fe(OH)3↓
再思考:Fe(OH)2的制备可以用同样的操作方法吗?
长试管
短试管
问题1:氢氧化亚铁到底是什么颜色呢?
问题2:为什么制取Fe(OH)2现象会是
新问题
红褐色
白色
灰绿色
原因
因为生成的白色Fe(OH)2极易被空气中的氧气氧化成红褐色的Fe(OH)3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
失 4×e-
得 2×2e-
+2
0
-2
+3
应用
在实验过程中,Fe(OH)2白色沉淀存在时间很短,不易观察,其原因是什么?如何改进实验,可以观察到明显的白色沉淀呢?
①将蒸馏水煮沸后配制溶液
②在反应液面上层加盖一层
油脂或者苯,来隔绝空气
③在氢气或者是惰性气体氛围内制备
④滴管末端插入液面以下
⑤亚铁盐必须新制,并放入铁粉,防止被氧化
a
b
铁的氢氧化物
③分解
2Fe(OH)3==Fe2O3 + 3H2O
Fe(OH)2 ====FeO+ 2H2O
隔绝空气
在空气中加热Fe(OH)2 呢?产物?
Fe2O3
Fe(OH)2 Fe(OH)3
颜色、状态 白色固体 红褐色固体
与盐酸反应 Fe(OH)2+2HCl=FeCl2+2H2O Fe(OH)3+3HCl=FeCl3+3H2O
受热分解 - 2Fe(OH)3=Fe2O3+3H2O
制备 可溶性亚铁盐与碱溶液反应:Fe2++2OH-=Fe(OH)2↓ 可溶性铁盐与碱溶液反应:Fe3++3OH-=Fe(OH)3↓
转化 在空气中,Fe(OH)2能够迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3
溶液变红
有Fe2+
有Fe2+
无Fe2+
【Fe2+、Fe3+的检验方法】
[问题5] 除去铜粉中混有的铁粉,可以用什么方法?
加稀盐酸,再过滤
1.下列物质不能通过单质间化合反应直接制得的是( )
A.FeCl2 B.FeCl3 C.Fe3O4 D.CuCl2
A
2.下列过程最终一定有+3价铁生成的是( )
A.过量的Fe与Cl2反应
B.Fe粉加入CuSO4溶液中
C.Fe和Fe2O3的混合物溶于盐酸中
D. Fe粉加入稀盐酸溶液中
A
当堂检测
+2
+3
+8/3
Fe2(SO4)3 FeCl3
FeSO4 FeCl2
