2022-2023学年化学沪教版(上海) 第五单元 初识酸和碱(含答案)
文档属性
| 名称 | 2022-2023学年化学沪教版(上海) 第五单元 初识酸和碱(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 162.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-06 17:15:43 | ||
图片预览

文档简介
2022-2023学年化学沪教版(上海)--初识酸和碱
一、单选题
1.将20g质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法中不正确的是
A.实验步骤:计算、量取、混匀、装瓶贴标签
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
2.下列化学方程式与客观事实相符,且书写完全正确的是
A.用过氧化氢溶液制氧气:
B.铁丝在氧气中燃烧:
C.用稀硫酸除铁锈:
D.用澄清石灰水检验二氧化碳:
3.下列现象从微观粒子的角度解释错误的是
选项 现象 解释
A 路过梨花园,闻到梨花香 分子在不停运动
B 100mL水与100mL酒精混合后体积小于200mL 分子之间有间隔
C 氢氧化钠溶液能导电 溶液中存在自由移动的钠离子、氢氧根离子
D 温度计水银球受热体积膨胀 温度升高汞原子体积变大
A.A B.B C.C D.D
4.下列图像不能正确反映对应变化关系的是
A.室温(25℃)下往石灰水中不断加入氧化钙
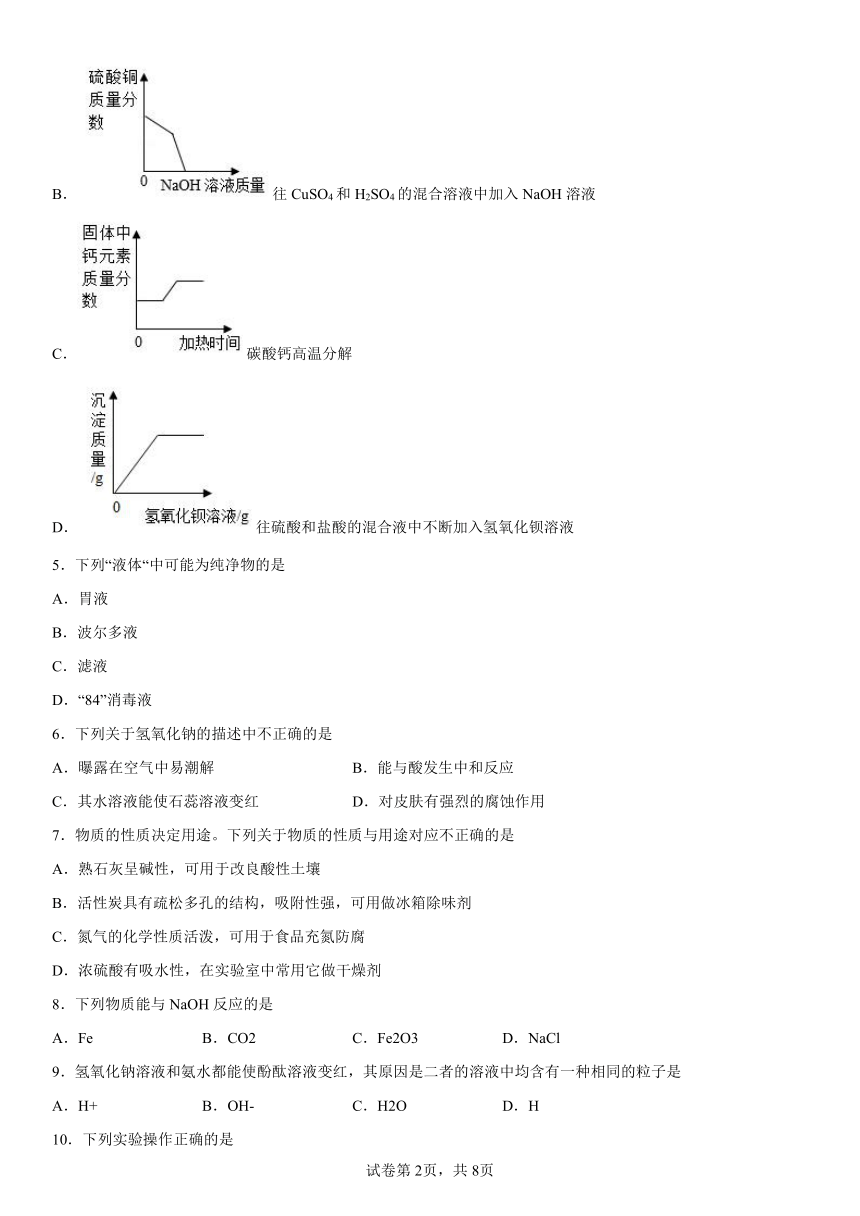
B.往CuSO4和H2SO4的混合溶液中加入NaOH溶液
C.碳酸钙高温分解
D.往硫酸和盐酸的混合液中不断加入氢氧化钡溶液
5.下列“液体“中可能为纯净物的是
A.胃液
B.波尔多液
C.滤液
D.“84”消毒液
6.下列关于氢氧化钠的描述中不正确的是
A.曝露在空气中易潮解 B.能与酸发生中和反应
C.其水溶液能使石蕊溶液变红 D.对皮肤有强烈的腐蚀作用
7.物质的性质决定用途。下列关于物质的性质与用途对应不正确的是
A.熟石灰呈碱性,可用于改良酸性土壤
B.活性炭具有疏松多孔的结构,吸附性强,可用做冰箱除味剂
C.氮气的化学性质活泼,可用于食品充氮防腐
D.浓硫酸有吸水性,在实验室中常用它做干燥剂
8.下列物质能与NaOH反应的是
A.Fe B.CO2 C.Fe2O3 D.NaCl
9.氢氧化钠溶液和氨水都能使酚酞溶液变红,其原因是二者的溶液中均含有一种相同的粒子是
A.H+ B.OH- C.H2O D.H
10.下列实验操作正确的是
A.加热液体 B.稀释浓硫酸
C.检查气密性 D.称量固体
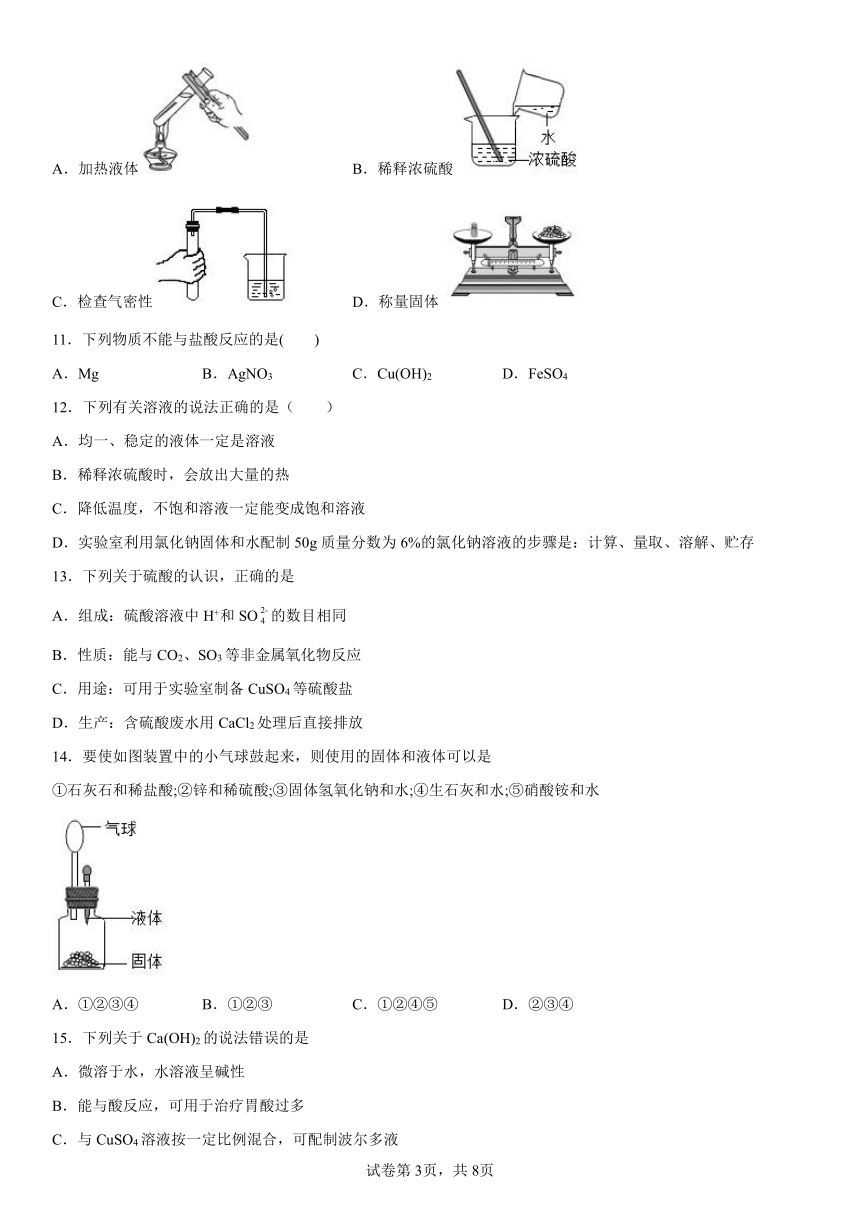
11.下列物质不能与盐酸反应的是( )
A.Mg B.AgNO3 C.Cu(OH)2 D.FeSO4
12.下列有关溶液的说法正确的是( )
A.均一、稳定的液体一定是溶液
B.稀释浓硫酸时,会放出大量的热
C.降低温度,不饱和溶液一定能变成饱和溶液
D.实验室利用氯化钠固体和水配制50g质量分数为6%的氯化钠溶液的步骤是:计算、量取、溶解、贮存
13.下列关于硫酸的认识,正确的是
A.组成:硫酸溶液中H+和SO的数目相同
B.性质:能与CO2、SO3等非金属氧化物反应
C.用途:可用于实验室制备CuSO4等硫酸盐
D.生产:含硫酸废水用CaCl2处理后直接排放
14.要使如图装置中的小气球鼓起来,则使用的固体和液体可以是
①石灰石和稀盐酸;②锌和稀硫酸;③固体氢氧化钠和水;④生石灰和水;⑤硝酸铵和水
A.①②③④ B.①②③ C.①②④⑤ D.②③④
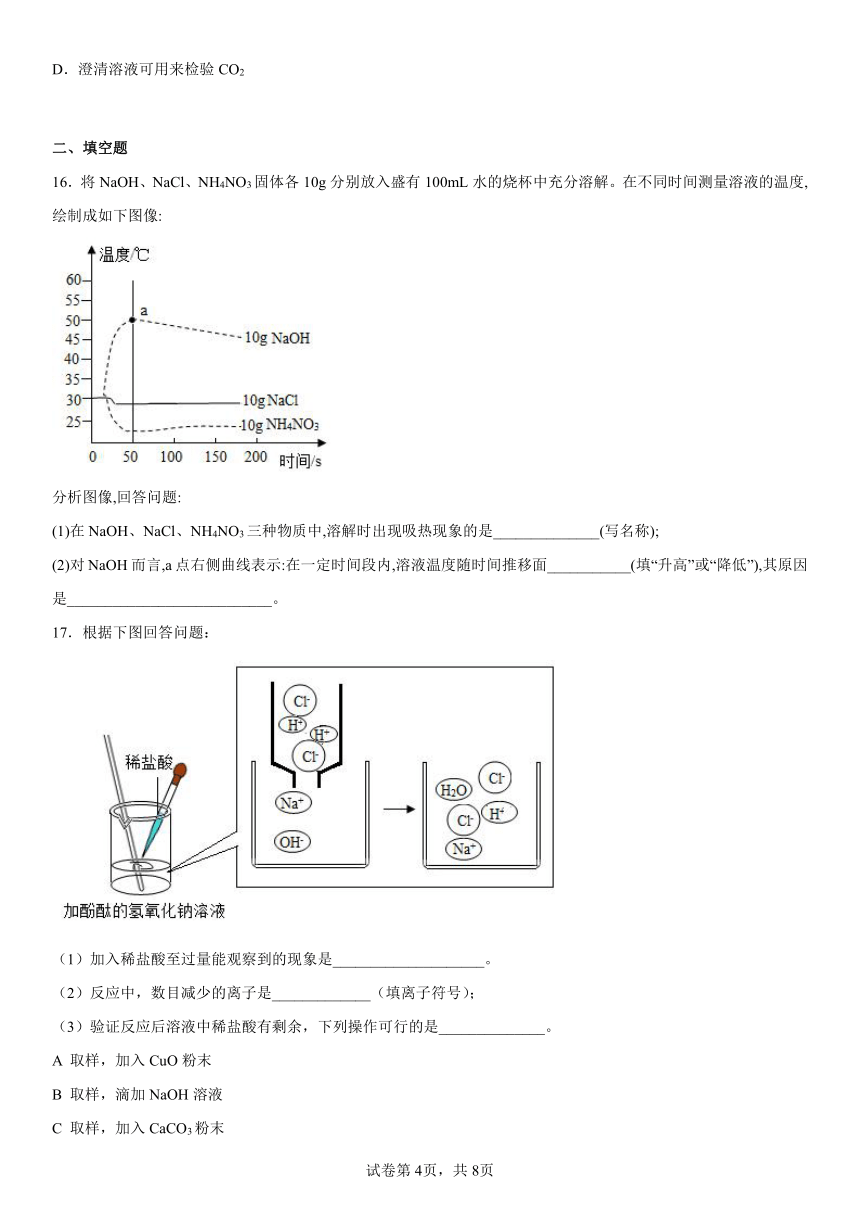
15.下列关于Ca(OH)2的说法错误的是
A.微溶于水,水溶液呈碱性
B.能与酸反应,可用于治疗胃酸过多
C.与CuSO4溶液按一定比例混合,可配制波尔多液
D.澄清溶液可用来检验CO2
二、填空题
16.将NaOH、NaCl、NH4NO3固体各10g分别放入盛有100mL水的烧杯中充分溶解。在不同时间测量溶液的温度,绘制成如下图像:
分析图像,回答问题:
(1)在NaOH、NaCl、NH4NO3三种物质中,溶解时出现吸热现象的是______________(写名称);
(2)对NaOH而言,a点右侧曲线表示:在一定时间段内,溶液温度随时间推移面___________(填“升高”或“降低”),其原因是___________________________。
17.根据下图回答问题:
(1)加入稀盐酸至过量能观察到的现象是____________________。
(2)反应中,数目减少的离子是_____________(填离子符号);
(3)验证反应后溶液中稀盐酸有剩余,下列操作可行的是______________。
A 取样,加入CuO粉末
B 取样,滴加NaOH溶液
C 取样,加入CaCO3粉末
D 取样,滴加AgNO3溶液
18.化学源于生活,应用于生活。
(1)储备化学知识
①钠的原子结构示意图_______;
②三个氧原子构成的分子_______(填化学式);
③2OH﹣_______(填表达的含义)。
(2)解答生活问题:
①蚊虫叮咬处,涂抹肥皂水,可减轻痛痒,这是因为肥皂水显_______性;
②中国的水墨画一般用墨汁完成,比西方的油画容易保存,这是因为墨汁中的碳在常温下_______。
19.综合复习时,同学们又来到化学实验室进行实验,加强对酸的化学性质的整体认识。他们将适量的稀盐酸分别滴加到六只试管中进行实验(如图所示),请回答下列问题:
(1)上述六只试管中有气泡产生的是______(填序号),相关反应的化学方程式为_______(只写出一个)。
(2)能证明“C试管中发生了化学反应”的现象是____________。
(3)有一只试管中的物质不与稀盐酸反应,原因是________。
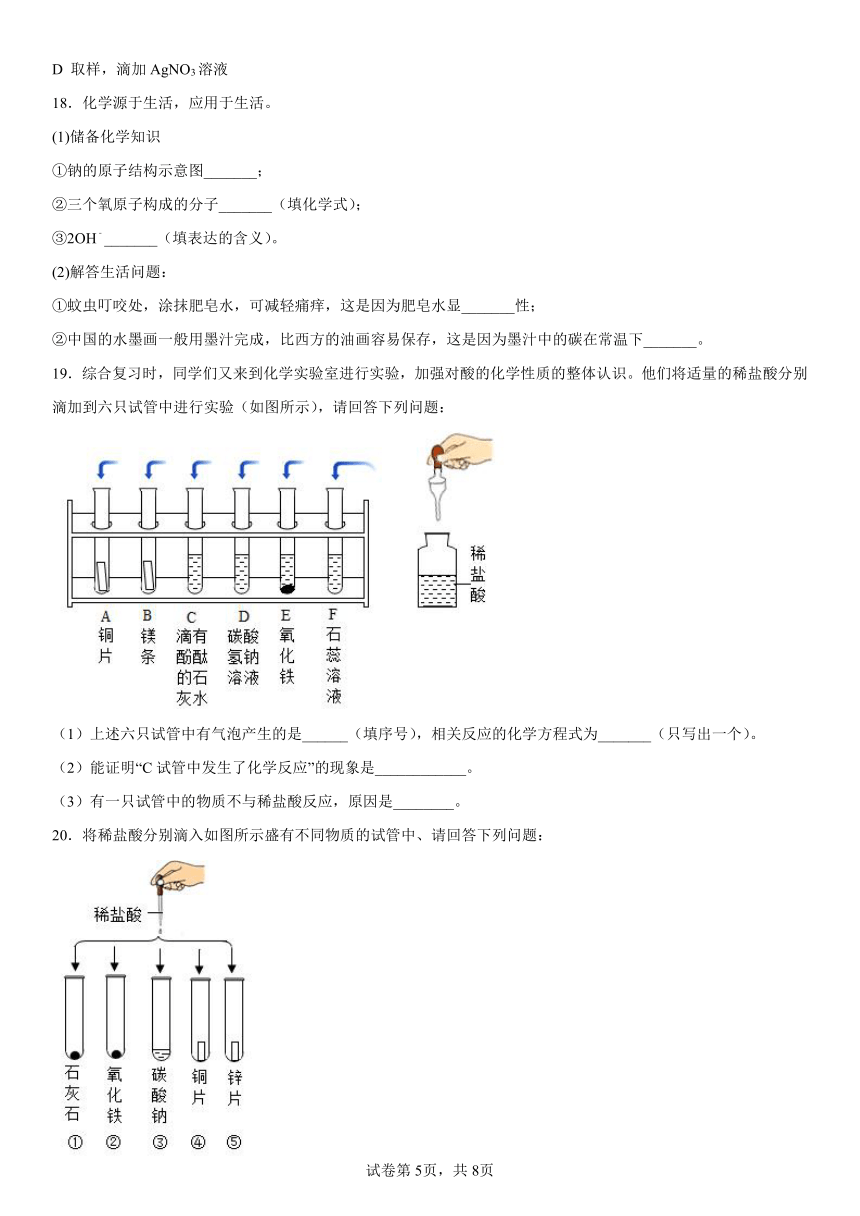
20.将稀盐酸分别滴入如图所示盛有不同物质的试管中、请回答下列问题:
(1)有气泡产生的试管为______(填序号)。
(2)不与稀盐酸发生反应的物质是______。
(3)实验后试管②中溶液变为______色,该试管中发生反应的化学方程式为______。
三、实验题
21.氯化氢(HCl)是极易溶于水的无色气体,其水溶液叫盐酸。
(1)在充满HCl气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象;再滴入水,现象是___________________________________________________。
(2)向盛有NaHCO3粉末的试管中通入HCl气体,无明显现象;停止通气,再加入少量水,现象是_____________________,发生反应的化学方程式是___________________。
(3) 画出HCl气体和盐酸的微观粒子组成示意图,并进行必要的标注_______________(水分子不用画出)。
22.如图三个实验均可验证无现象的化学反应发生了。
【实验一】当观察到______现象时,证明化学反应发生,化学方程式是______。
【实验二】加入X可验证稀硫酸与NaOH能发生反应,符合此条件的X是______。
AFeCl3
B
CNa2CO3
D
【实验三】用气压传感器测得曲线1和2,要证明CO2与NaOH一定发生了反应,左瓶中应加入______;曲线1变化平缓的原因是______。
【反思】上述实验的设计思想是通过证明______,来判断化学反应的发生。
四、计算题
23.实验室欲测定一瓶标签破损的稀H2SO4的溶质质量分数。现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶段加入,溶液液的pH的变化如图所示。试回答:
(1)a点溶液中含有的离子有____________________________。
(2)当pH=7时,消耗NaOH溶液中NaOH的质量为____________。
(3)计算稀H2SO4的溶质质量分数。
24.向表面生锈的铁片中滴加稀硫酸,产生氢气的质量与所加稀硫酸的质量关系如图所示,请回答:
(1)从图中可以看出完全反应后产生氢气的质量为 g。
(2)求所加稀硫酸中溶质的质量分数。(写出计算过程,计算结果精确到0.1%)
25.某兴趣小组对石灰石样品进行如下实验分析:取13g样品放入烧杯中,将80g稀盐酸分4次倒入烧杯中,所得实验数据记录如下。
次数 1 2 3 4
加入稀盐酸的质量/g 20 20 20 20
剩余固体的质量/g 10 7 4 3
请计算:
(1)样品中碳酸钙的质量_____。
(2)计算所用稀盐酸的溶质质量分数______。
(3)最终所得溶液中氯化钙的质量分数______。(最终结果保留0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.D
4.A
5.C
6.C
7.C
8.B
9.B
10.C
11.D
12.B
13.C
14.A
15.B
16. 氧化钠、硝酸铵 降低 溶液散失热量
17. 溶解由红色变为无色 H+、OH- ABC
18.(1) O3 两个氢氧根离子
(2) 碱 化学性质稳定(或不易与其他物质反应等,合理即可)
19. BD 溶液由红色变为无色 在金属活动顺序中铜位于氢后面,所以不与稀盐酸反应
20.(1)③⑤
(2)铜片
(3) 黄色
21. 染有石蕊的纸条变红色 固体溶解,有气泡产生
22. 溶液由红色变为无色 A 20mL水 二氧化碳能够溶于水,和水反应的较少 反应物已转化为其他物质
23.(1)Na+、H+、 SO42-
(2)0.8
(3)9.8%
24.(1)0.2g;(2)9.8%
25.(1)10g
石灰石主要成分是碳酸钙,与稀盐酸反应生成氯化钙、二氧化碳和水,由于杂质不反应,则根据前三次都是固体减少3g,第四次只减少1g,说明此时碳酸钙已经反应完全,剩余的固体为杂质,碳酸钙的质量为13g-3g=10g;
(2)10.95%
解:由表格中数据可知,每20g稀盐酸与3g碳酸钙恰好完全反应,设每20g稀盐酸中溶质质量为x,则有
所用稀盐酸的溶质质量分数为×100%= 10.95%。
(3)反应后溶液的质量为80g+10g-4.4g=85.6g,
最终所得溶液中氯化钙的质量分数为×100%≈ 13.0%。
答:样品中碳酸钙的质量为10g;所用稀盐酸的溶质质量分数10.95%;最终所得溶液中氯化钙的质量分数为13.0%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.将20g质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法中不正确的是
A.实验步骤:计算、量取、混匀、装瓶贴标签
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
2.下列化学方程式与客观事实相符,且书写完全正确的是
A.用过氧化氢溶液制氧气:
B.铁丝在氧气中燃烧:
C.用稀硫酸除铁锈:
D.用澄清石灰水检验二氧化碳:
3.下列现象从微观粒子的角度解释错误的是
选项 现象 解释
A 路过梨花园,闻到梨花香 分子在不停运动
B 100mL水与100mL酒精混合后体积小于200mL 分子之间有间隔
C 氢氧化钠溶液能导电 溶液中存在自由移动的钠离子、氢氧根离子
D 温度计水银球受热体积膨胀 温度升高汞原子体积变大
A.A B.B C.C D.D
4.下列图像不能正确反映对应变化关系的是
A.室温(25℃)下往石灰水中不断加入氧化钙
B.往CuSO4和H2SO4的混合溶液中加入NaOH溶液
C.碳酸钙高温分解
D.往硫酸和盐酸的混合液中不断加入氢氧化钡溶液
5.下列“液体“中可能为纯净物的是
A.胃液
B.波尔多液
C.滤液
D.“84”消毒液
6.下列关于氢氧化钠的描述中不正确的是
A.曝露在空气中易潮解 B.能与酸发生中和反应
C.其水溶液能使石蕊溶液变红 D.对皮肤有强烈的腐蚀作用
7.物质的性质决定用途。下列关于物质的性质与用途对应不正确的是
A.熟石灰呈碱性,可用于改良酸性土壤
B.活性炭具有疏松多孔的结构,吸附性强,可用做冰箱除味剂
C.氮气的化学性质活泼,可用于食品充氮防腐
D.浓硫酸有吸水性,在实验室中常用它做干燥剂
8.下列物质能与NaOH反应的是
A.Fe B.CO2 C.Fe2O3 D.NaCl
9.氢氧化钠溶液和氨水都能使酚酞溶液变红,其原因是二者的溶液中均含有一种相同的粒子是
A.H+ B.OH- C.H2O D.H
10.下列实验操作正确的是
A.加热液体 B.稀释浓硫酸
C.检查气密性 D.称量固体
11.下列物质不能与盐酸反应的是( )
A.Mg B.AgNO3 C.Cu(OH)2 D.FeSO4
12.下列有关溶液的说法正确的是( )
A.均一、稳定的液体一定是溶液
B.稀释浓硫酸时,会放出大量的热
C.降低温度,不饱和溶液一定能变成饱和溶液
D.实验室利用氯化钠固体和水配制50g质量分数为6%的氯化钠溶液的步骤是:计算、量取、溶解、贮存
13.下列关于硫酸的认识,正确的是
A.组成:硫酸溶液中H+和SO的数目相同
B.性质:能与CO2、SO3等非金属氧化物反应
C.用途:可用于实验室制备CuSO4等硫酸盐
D.生产:含硫酸废水用CaCl2处理后直接排放
14.要使如图装置中的小气球鼓起来,则使用的固体和液体可以是
①石灰石和稀盐酸;②锌和稀硫酸;③固体氢氧化钠和水;④生石灰和水;⑤硝酸铵和水
A.①②③④ B.①②③ C.①②④⑤ D.②③④
15.下列关于Ca(OH)2的说法错误的是
A.微溶于水,水溶液呈碱性
B.能与酸反应,可用于治疗胃酸过多
C.与CuSO4溶液按一定比例混合,可配制波尔多液
D.澄清溶液可用来检验CO2
二、填空题
16.将NaOH、NaCl、NH4NO3固体各10g分别放入盛有100mL水的烧杯中充分溶解。在不同时间测量溶液的温度,绘制成如下图像:
分析图像,回答问题:
(1)在NaOH、NaCl、NH4NO3三种物质中,溶解时出现吸热现象的是______________(写名称);
(2)对NaOH而言,a点右侧曲线表示:在一定时间段内,溶液温度随时间推移面___________(填“升高”或“降低”),其原因是___________________________。
17.根据下图回答问题:
(1)加入稀盐酸至过量能观察到的现象是____________________。
(2)反应中,数目减少的离子是_____________(填离子符号);
(3)验证反应后溶液中稀盐酸有剩余,下列操作可行的是______________。
A 取样,加入CuO粉末
B 取样,滴加NaOH溶液
C 取样,加入CaCO3粉末
D 取样,滴加AgNO3溶液
18.化学源于生活,应用于生活。
(1)储备化学知识
①钠的原子结构示意图_______;
②三个氧原子构成的分子_______(填化学式);
③2OH﹣_______(填表达的含义)。
(2)解答生活问题:
①蚊虫叮咬处,涂抹肥皂水,可减轻痛痒,这是因为肥皂水显_______性;
②中国的水墨画一般用墨汁完成,比西方的油画容易保存,这是因为墨汁中的碳在常温下_______。
19.综合复习时,同学们又来到化学实验室进行实验,加强对酸的化学性质的整体认识。他们将适量的稀盐酸分别滴加到六只试管中进行实验(如图所示),请回答下列问题:
(1)上述六只试管中有气泡产生的是______(填序号),相关反应的化学方程式为_______(只写出一个)。
(2)能证明“C试管中发生了化学反应”的现象是____________。
(3)有一只试管中的物质不与稀盐酸反应,原因是________。
20.将稀盐酸分别滴入如图所示盛有不同物质的试管中、请回答下列问题:
(1)有气泡产生的试管为______(填序号)。
(2)不与稀盐酸发生反应的物质是______。
(3)实验后试管②中溶液变为______色,该试管中发生反应的化学方程式为______。
三、实验题
21.氯化氢(HCl)是极易溶于水的无色气体,其水溶液叫盐酸。
(1)在充满HCl气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象;再滴入水,现象是___________________________________________________。
(2)向盛有NaHCO3粉末的试管中通入HCl气体,无明显现象;停止通气,再加入少量水,现象是_____________________,发生反应的化学方程式是___________________。
(3) 画出HCl气体和盐酸的微观粒子组成示意图,并进行必要的标注_______________(水分子不用画出)。
22.如图三个实验均可验证无现象的化学反应发生了。
【实验一】当观察到______现象时,证明化学反应发生,化学方程式是______。
【实验二】加入X可验证稀硫酸与NaOH能发生反应,符合此条件的X是______。
AFeCl3
B
CNa2CO3
D
【实验三】用气压传感器测得曲线1和2,要证明CO2与NaOH一定发生了反应,左瓶中应加入______;曲线1变化平缓的原因是______。
【反思】上述实验的设计思想是通过证明______,来判断化学反应的发生。
四、计算题
23.实验室欲测定一瓶标签破损的稀H2SO4的溶质质量分数。现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶段加入,溶液液的pH的变化如图所示。试回答:
(1)a点溶液中含有的离子有____________________________。
(2)当pH=7时,消耗NaOH溶液中NaOH的质量为____________。
(3)计算稀H2SO4的溶质质量分数。
24.向表面生锈的铁片中滴加稀硫酸,产生氢气的质量与所加稀硫酸的质量关系如图所示,请回答:
(1)从图中可以看出完全反应后产生氢气的质量为 g。
(2)求所加稀硫酸中溶质的质量分数。(写出计算过程,计算结果精确到0.1%)
25.某兴趣小组对石灰石样品进行如下实验分析:取13g样品放入烧杯中,将80g稀盐酸分4次倒入烧杯中,所得实验数据记录如下。
次数 1 2 3 4
加入稀盐酸的质量/g 20 20 20 20
剩余固体的质量/g 10 7 4 3
请计算:
(1)样品中碳酸钙的质量_____。
(2)计算所用稀盐酸的溶质质量分数______。
(3)最终所得溶液中氯化钙的质量分数______。(最终结果保留0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.D
4.A
5.C
6.C
7.C
8.B
9.B
10.C
11.D
12.B
13.C
14.A
15.B
16. 氧化钠、硝酸铵 降低 溶液散失热量
17. 溶解由红色变为无色 H+、OH- ABC
18.(1) O3 两个氢氧根离子
(2) 碱 化学性质稳定(或不易与其他物质反应等,合理即可)
19. BD 溶液由红色变为无色 在金属活动顺序中铜位于氢后面,所以不与稀盐酸反应
20.(1)③⑤
(2)铜片
(3) 黄色
21. 染有石蕊的纸条变红色 固体溶解,有气泡产生
22. 溶液由红色变为无色 A 20mL水 二氧化碳能够溶于水,和水反应的较少 反应物已转化为其他物质
23.(1)Na+、H+、 SO42-
(2)0.8
(3)9.8%
24.(1)0.2g;(2)9.8%
25.(1)10g
石灰石主要成分是碳酸钙,与稀盐酸反应生成氯化钙、二氧化碳和水,由于杂质不反应,则根据前三次都是固体减少3g,第四次只减少1g,说明此时碳酸钙已经反应完全,剩余的固体为杂质,碳酸钙的质量为13g-3g=10g;
(2)10.95%
解:由表格中数据可知,每20g稀盐酸与3g碳酸钙恰好完全反应,设每20g稀盐酸中溶质质量为x,则有
所用稀盐酸的溶质质量分数为×100%= 10.95%。
(3)反应后溶液的质量为80g+10g-4.4g=85.6g,
最终所得溶液中氯化钙的质量分数为×100%≈ 13.0%。
答:样品中碳酸钙的质量为10g;所用稀盐酸的溶质质量分数10.95%;最终所得溶液中氯化钙的质量分数为13.0%。
答案第1页,共2页
答案第1页,共2页
