高中化学人教版(2019)必修1 第三章 铁 金属材料 章末测评验收卷(三)(word版含解析)
文档属性
| 名称 | 高中化学人教版(2019)必修1 第三章 铁 金属材料 章末测评验收卷(三)(word版含解析) |  | |
| 格式 | DOCX | ||
| 文件大小 | 302.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-06 17:08:49 | ||
图片预览



文档简介
第三章 铁 金属材料 章末测评验收卷(三)
(时间:75分钟 满分:100分)
一、选择题(本题包括14小题,每小题只有一个选项符合题意,每小题4分,共56分)
1.(2021·河北石家庄第六中学高一期中)既能用氯气跟单质化合制得也能用金属和盐酸反应制取的物质是( )
A.AlCl3 B.FeCl2
C.FeCl3 D.CuCl2
2.药品“速力菲”中Fe2+会被空气缓慢氧化,国家规定如果药物中有超过10%的Fe2+被氧化即不可服用。若要证明该药是否已被氧化,下列试剂能达到实验目的的是( )
A.新制氯水 B.KSCN溶液
C.酸性KMnO4溶液 D.KCl溶液
3.金属和合金是生活中常用的材料。下列说法正确的是( )
A.不锈钢是铁合金,只含金属元素
B.镧镍(La-Ni)合金能大量吸收H2,并与H2结合成金属氢化物,可作储氢材料
C.目前世界上使用量最大的合金是铝合金
D.常温下,铁粉可以和水发生置换反应得到氢气
4.下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中
A.②③①④ B.③②①④
C.③①②④ D.①②③④
5.工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
下列叙述不正确的是( )
A.试剂X可以是氢氧化钠溶液
B.反应①过滤后所得沉淀为氧化铁
C.图中所示转化反应包含氧化还原反应
D.反应②的化学方程式为2NaAlO2+3H2O+CO2===2Al(OH)3↓+Na2CO3
6.(2021·山西高一段练)某合金与铁的物理性质的比较如下表所示:
熔点/℃ 密度/g/cm3 硬度(金刚石为10) 导电性(银为100)
某合金 2 500 3.00 7.4 2.3
铁 1 535 7.86 4.5 17
还知该合金耐腐蚀强度大。从以上性能看,该合金不适合作( )
A.炉具 B.飞船外壳
C.导线 D.建筑门窗
7.在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡,将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是( )
A.铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
B.铝球表面有气泡产生,溶液澄清
C.反应后去掉两烧杯,杠杆仍平衡
D.铁球表面有红色物质析出,溶液蓝色变浅,杠杆右边上升
8.(2021·安徽芜湖高一段练)新型镁铝合金(Mg17Al12)有储氢性能,下列说法正确的是( )
A.1 mol Mg17Al12与足量盐酸完全反应放出H2的总物质的量为34 mol
B.等质量的镁、铝和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压)由大到小的顺序为V(Al)>V(合金)>V(Mg)
C.该合金中存在Al3+
D.该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
9.(2021·云南昆明高一期中)“价类二维图”是学习元素化合物知识的高效模型。下图为铁元素的“价类二维图”,图中字母代表含铁元素的物质。下列判断正确的是( )
A.X在高温下与水蒸气反应可生成Z
B.在常温下N能与氧气、水发生化合反应生成M
C.Y是一种红棕色粉末,常用作红色油漆和涂料
D.Q可以是一种新型净水剂碱式硫酸铁[Fe(OH)SO4]
10.向由FeCl3和CuCl2组成的混合溶液中加入m g Fe粉(过量),充分反应后,过滤、洗涤、干燥至恒重,残留固体的质量仍为m g,则原混合溶液中n(FeCl3)∶n(CuCl2)为( )
A.2∶7 B.3∶5
C.4∶3 D.5∶4
11.对实验Ⅰ~Ⅳ的实验操作现象判断正确的是( )
A.实验Ⅰ:产生红褐色沉淀
B.实验Ⅱ:溶液颜色变红
C.实验Ⅲ:放出大量气体
D.实验Ⅳ:铜片表面有黑色固体生成
12.将1.5 g两种金属混合物的粉末与足量的盐酸反应,反应完全后,得到标准状况下的氢气1.12 L。则这两种金属可能是( )
A.Ag和Cu B.Zn和Fe
C.Mg和Al D.Zn和Mg
13.(2021·湖南长沙高一段练)工业废弃物的资源化回收再利用,可以更大限度地发挥原材料的价值。下图是工业生产纳米磁性氧化铁的流程:
下列说法不正确的是( )
A.用Na2CO3溶液浸泡是为了除去废铁屑表面的油污
B.若生产中不通入N2,暴露在空气中生产,将不能得到高纯度产品
C.加适量的H2O2是为了将部分Fe2+氧化为Fe3+,涉及反应:H2O2+2Fe2++2H+===2Fe3++2H2O
D.溶液A中Fe2+和Fe3+的浓度比为1∶1
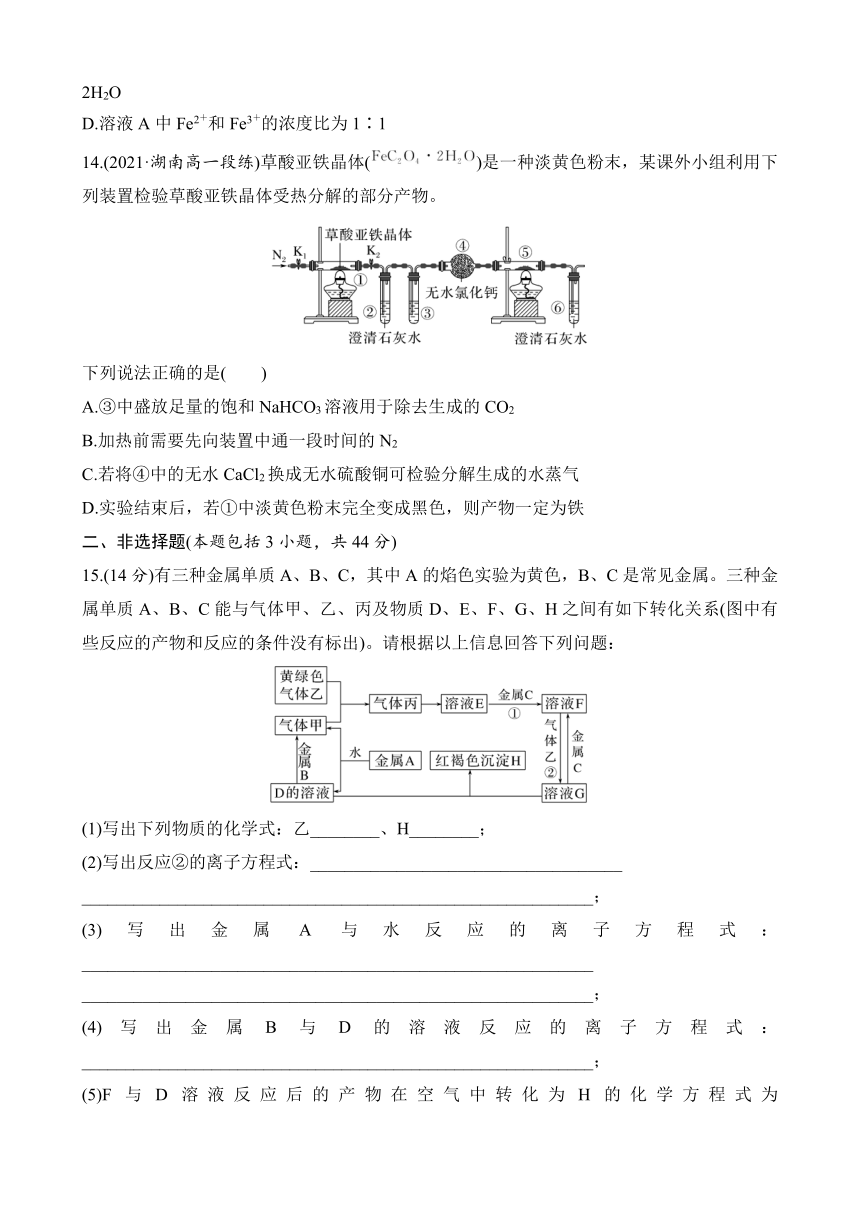
14.(2021·湖南高一段练)草酸亚铁晶体()是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
下列说法正确的是( )
A.③中盛放足量的饱和NaHCO3溶液用于除去生成的CO2
B.加热前需要先向装置中通一段时间的N2
C.若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D.实验结束后,若①中淡黄色粉末完全变成黑色,则产物一定为铁
二、非选择题(本题包括3小题,共44分)
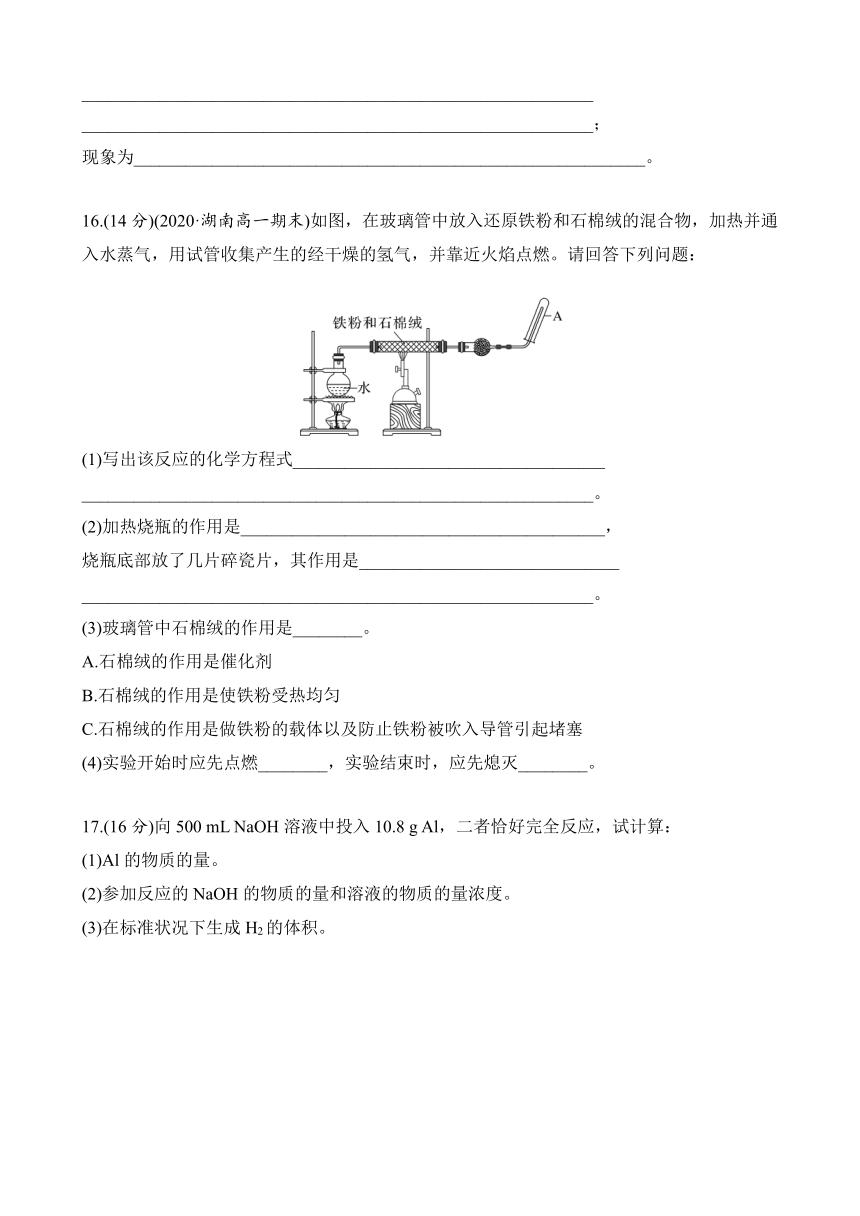
15.(14分)有三种金属单质A、B、C,其中A的焰色实验为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间有如下转化关系(图中有些反应的产物和反应的条件没有标出)。请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙________、H________;
(2)写出反应②的离子方程式:____________________________________
___________________________________________________________;
(3)写出金属A与水反应的离子方程式:___________________________________________________________
___________________________________________________________;
(4)写出金属B与D的溶液反应的离子方程式:___________________________________________________________;
(5)F与D溶液反应后的产物在空气中转化为H的化学方程式为___________________________________________________________
___________________________________________________________;
现象为___________________________________________________________。
16.(14分)(2020·湖南高一期末)如图,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的氢气,并靠近火焰点燃。请回答下列问题:
(1)写出该反应的化学方程式____________________________________
___________________________________________________________。
(2)加热烧瓶的作用是__________________________________________,
烧瓶底部放了几片碎瓷片,其作用是______________________________
___________________________________________________________。
(3)玻璃管中石棉绒的作用是________。
A.石棉绒的作用是催化剂
B.石棉绒的作用是使铁粉受热均匀
C.石棉绒的作用是做铁粉的载体以及防止铁粉被吹入导管引起堵塞
(4)实验开始时应先点燃________,实验结束时,应先熄灭________。
17.(16分)向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,试计算:
(1)Al的物质的量。
(2)参加反应的NaOH的物质的量和溶液的物质的量浓度。
(3)在标准状况下生成H2的体积。
第三章 铁 金属材料 章末测评验收卷(三)
(时间:75分钟 满分:100分)
一、选择题(本题包括14小题,每小题只有一个选项符合题意,每小题4分,共56分)
1.(2021·河北石家庄第六中学高一期中)既能用氯气跟单质化合制得也能用金属和盐酸反应制取的物质是( )
A.AlCl3 B.FeCl2
C.FeCl3 D.CuCl2
答案 A
解析 Al为活泼金属,既能与氯气化合反应又能和盐酸置换反应均可生成AlCl3,故A正确;FeCl2只能由Fe与HCl反应制取,而不能由Fe与Cl2反应制取,故B错;FeCl3只能由Fe与Cl2反应制取,而不能由Fe与HCl反应制取,故C错;Cu为较不活泼金属,不能与HCl反应,则CuCl2只能由Cu与Cl2反应制取,故D错。
2.药品“速力菲”中Fe2+会被空气缓慢氧化,国家规定如果药物中有超过10%的Fe2+被氧化即不可服用。若要证明该药是否已被氧化,下列试剂能达到实验目的的是( )
A.新制氯水 B.KSCN溶液
C.酸性KMnO4溶液 D.KCl溶液
答案 B
解析 要证明该药品已被氧化,只需证明药品中存在Fe3+即可。KSCN溶液与Fe3+反应生成Fe(SCN)3,使溶液显红色,能达到实验目的,B项正确。
3.金属和合金是生活中常用的材料。下列说法正确的是( )
A.不锈钢是铁合金,只含金属元素
B.镧镍(La-Ni)合金能大量吸收H2,并与H2结合成金属氢化物,可作储氢材料
C.目前世界上使用量最大的合金是铝合金
D.常温下,铁粉可以和水发生置换反应得到氢气
答案 B
解析 不锈钢中含碳元素,A项错误;镧镍合金能大量吸收H2,并与H2结合成金属氢化物,稍稍加热又会分解,将储存在其中的氢释放出来,可作储氢材料,B项正确;目前世界上使用量最大的合金是钢铁,C项错误;铁粉和水蒸气在高温条件下才能发生置换反应得到氢气,D项错误。
4.下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中
A.②③①④ B.③②①④
C.③①②④ D.①②③④
答案 B
解析 ①金属钠在纯氧中燃烧生成淡黄色的过氧化钠;②FeSO4溶液和NaOH溶液反应生成白色氢氧化亚铁沉淀,然后迅速被氧化为红褐色氢氧化铁;③FeCl3溶液中滴入KSCN溶液,溶液呈红色;④无水硫酸铜放入医用酒精中,医用酒精中含有水,溶液变蓝,故其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列依次是③②①④。
5.工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
下列叙述不正确的是( )
A.试剂X可以是氢氧化钠溶液
B.反应①过滤后所得沉淀为氧化铁
C.图中所示转化反应包含氧化还原反应
D.反应②的化学方程式为2NaAlO2+3H2O+CO2===2Al(OH)3↓+Na2CO3
答案 D
解析 试剂X为强碱溶液,可以是NaOH溶液;反应①过滤后得沉淀Fe2O3;电解Al2O3的反应为氧化还原反应;反应②为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3(CO2过量)。
6.(2021·山西高一段练)某合金与铁的物理性质的比较如下表所示:
熔点/℃ 密度/g/cm3 硬度(金刚石为10) 导电性(银为100)
某合金 2 500 3.00 7.4 2.3
铁 1 535 7.86 4.5 17
还知该合金耐腐蚀强度大。从以上性能看,该合金不适合作( )
A.炉具 B.飞船外壳
C.导线 D.建筑门窗
答案 C
解析 作炉具主要利用其熔点高和耐腐蚀性强,故A正确;作飞船外壳则是利用硬度大和密度小的性质,故B正确;该合金与铁相比导电性较差,不适合作导线,故C错误;作门窗框主要是利用该合金的硬度大和耐腐蚀性强,故D正确;故选C。
7.在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡,将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是( )
A.铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
B.铝球表面有气泡产生,溶液澄清
C.反应后去掉两烧杯,杠杆仍平衡
D.铁球表面有红色物质析出,溶液蓝色变浅,杠杆右边上升
答案 B
解析 左边烧杯中发生反应:2Al+2NaOH+2H2O===2NaAlO2+3H2↑,铝球表面有气泡产生,溶液变澄清,A项错误,B项正确;右边烧杯中发生反应:Fe+CuSO4===Cu+FeSO4,铁球表面有红色物质析出,溶液中c(CuSO4)减小,溶液蓝色变浅,左边烧杯中消耗Al,铝球的质量变小,右边烧杯中铁球上析出Cu,质量变大,杠杆右边下沉,D项错误;反应后去掉两烧杯,杠杆不能平衡,C项错误。
8.(2021·安徽芜湖高一段练)新型镁铝合金(Mg17Al12)有储氢性能,下列说法正确的是( )
A.1 mol Mg17Al12与足量盐酸完全反应放出H2的总物质的量为34 mol
B.等质量的镁、铝和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压)由大到小的顺序为V(Al)>V(合金)>V(Mg)
C.该合金中存在Al3+
D.该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
答案 B
解析 1 mol Mg、Al分别与足量盐酸完全反应放出H2的物质的量分别为1 mol、1.5 mol。则1 mol Mg17Al12与足量盐酸完全反应放出H2的总物质的量为1×17+1.5×12=35 mol,A错误;设金属质量均为m,金属提供电子越多则生成氢气体积越大,铝提供电子的物质的量为 mol,镁提供电子的物质的量为 mol,合金提供电子的物质的量为 mol~ mol,故等质量的镁、铝和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压)由大到小的顺序为V(Al)>V(合金)>V(Mg),B正确;合金中的金属以单质形式存在,故C错误;镁和氮气在一定温度下会发生反应,故不能用氮气做保护气,D错误。
9.(2021·云南昆明高一期中)“价类二维图”是学习元素化合物知识的高效模型。下图为铁元素的“价类二维图”,图中字母代表含铁元素的物质。下列判断正确的是( )
A.X在高温下与水蒸气反应可生成Z
B.在常温下N能与氧气、水发生化合反应生成M
C.Y是一种红棕色粉末,常用作红色油漆和涂料
D.Q可以是一种新型净水剂碱式硫酸铁[Fe(OH)SO4]
答案 B
解析 Fe在高温下与水蒸气反应可生成Fe3O4,故A错误;在常温下氢氧化亚铁能与氧气、水发生化合反应生成氢氧化铁,故B正确;Y是氧化亚铁,是黑色粉末,Z为氧化铁,是一种红棕色粉末,常用作红色油漆和涂料,故C错误;Q是+2价的盐,P为+3价盐,P可以是一种新型净水剂碱式硫酸铁[Fe(OH)SO4],故D错误。
10.向由FeCl3和CuCl2组成的混合溶液中加入m g Fe粉(过量),充分反应后,过滤、洗涤、干燥至恒重,残留固体的质量仍为m g,则原混合溶液中n(FeCl3)∶n(CuCl2)为( )
A.2∶7 B.3∶5
C.4∶3 D.5∶4
答案 A
解析 2Fe3++Fe===3Fe2+
x
Cu2++Fe===Cu+Fe2+
y y y
由题意:56=64y,故x∶y=2∶7。
11.对实验Ⅰ~Ⅳ的实验操作现象判断正确的是( )
A.实验Ⅰ:产生红褐色沉淀
B.实验Ⅱ:溶液颜色变红
C.实验Ⅲ:放出大量气体
D.实验Ⅳ:铜片表面有黑色固体生成
答案 C
解析 将氯化铁饱和溶液加入到沸水中加热至溶液呈红褐色可得到氢氧化铁胶体,不是氢氧化铁红褐色沉淀,故A错误;三价铁离子与硫氰化钾溶液反应生成硫氰合铁,溶液变红色,与二价铁离子溶液不显红色,故B错误;铝与氢氧化钠溶液反应生成NaAlO2和氢气,有大量气体生成,故C正确;硫酸铁与铜单质反应生成硫酸亚铁和硫酸铜,不会有黑色固体生成,故D错误。
12.将1.5 g两种金属混合物的粉末与足量的盐酸反应,反应完全后,得到标准状况下的氢气1.12 L。则这两种金属可能是( )
A.Ag和Cu B.Zn和Fe
C.Mg和Al D.Zn和Mg
答案 D
解析 1.12 L氢气的物质的量为=0.05 mol,假设金属都为+2价,则金属混合物的平均相对原子质量为M===30。Ag和Cu均与盐酸不反应,故A不符合;Mg的相对原子质量为24,当Al的化合价为+2价时,可看成其相对原子质量为×27=18,二者都小于30,平均值不可能为30,故C不符合,而Fe的相对原子质量为56,Zn的相对原子质量为65,二者都大于30,平均值不可能等于30,B不符合;Zn、Mg的相对原子质量分别为65和24,故D符合。
13.(2021·湖南长沙高一段练)工业废弃物的资源化回收再利用,可以更大限度地发挥原材料的价值。下图是工业生产纳米磁性氧化铁的流程:
下列说法不正确的是( )
A.用Na2CO3溶液浸泡是为了除去废铁屑表面的油污
B.若生产中不通入N2,暴露在空气中生产,将不能得到高纯度产品
C.加适量的H2O2是为了将部分Fe2+氧化为Fe3+,涉及反应:H2O2+2Fe2++2H+===2Fe3++2H2O
D.溶液A中Fe2+和Fe3+的浓度比为1∶1
答案 D
解析 用Na2CO3溶液浸泡废铁屑是为了除去废铁屑表面的油污,故A正确;若生产中不通入N2,暴露在空气中生产,Fe2+被氧气氧化为Fe3+,不能得到高纯度产品,故B正确;四氧化三铁中含有+2价和+3价的铁,H2O2具有氧化性,加适量的H2O2是为了将部分Fe2+氧化为Fe3+,涉及反应:H2O2+2Fe2++2H+===2Fe3++2H2O,故C正确;四氧化三铁中+2价和+3价的铁物质的量比为1∶2,所以溶液A中Fe2+和Fe3+的浓度比为1∶2,故D错误。
14.(2021·湖南高一段练)草酸亚铁晶体()是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
下列说法正确的是( )
A.③中盛放足量的饱和NaHCO3溶液用于除去生成的CO2
B.加热前需要先向装置中通一段时间的N2
C.若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D.实验结束后,若①中淡黄色粉末完全变成黑色,则产物一定为铁
答案 B
解析 ③除去CO2,应选能和CO2能发生反应的氢氧化钠或氢氧化钡,碳酸氢钠不和二氧化碳反应,A错误;实验开始后,装置中的空气对分解及检验都有干扰,所以必须先通入N2除去装置中的空气,B正确;由于从②、③溶液中导出的气体会带出水蒸气,因此④中放置无水硫酸铜无法检验分解生成的水蒸气,C错误;草酸亚铁晶体分解剩余的固体为FeO,如果没有完全变为黑色,也有可能是由于晶体没有完全分解,D错误。
二、非选择题(本题包括3小题,共44分)
15.(14分)有三种金属单质A、B、C,其中A的焰色实验为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间有如下转化关系(图中有些反应的产物和反应的条件没有标出)。请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙________、H________;
(2)写出反应②的离子方程式:____________________________________
___________________________________________________________;
(3)写出金属A与水反应的离子方程式:___________________________________________________________
___________________________________________________________;
(4)写出金属B与D的溶液反应的离子方程式:___________________________________________________________;
(5)F与D溶液反应后的产物在空气中转化为H的化学方程式为___________________________________________________________
___________________________________________________________;
现象为___________________________________________________________。
答案 (1)Cl2 Fe(OH)3 (2)2Fe2++Cl2===2Fe3++2Cl-
(3)2Na+2H2O===2Na++2OH-+H2↑
(4)2Al+2OH-+2H2O===2AlO+3H2↑
(5)4Fe(OH)2+O2+2H2O===4Fe(OH)3 白色沉淀迅速变为灰绿色,最后变为红褐色
解析 金属A的焰色为黄色,则A为Na,Na与水反应生成H2和NaOH,则甲为H2,D为NaOH;黄绿色气体为氯气,和气体甲反应生成气体丙,则气体丙为HCl;金属B和NaOH溶液反应生成氢气,则B为Al;红褐色沉淀H为Fe(OH)3,则溶液G中含有Fe3+,溶液F与氯气反应生成Fe3+,则溶液F中含有Fe2+;C是常见金属,能和盐酸反应得到溶液F,则金属C为Fe。
16.(14分)(2020·湖南高一期末)如图,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的氢气,并靠近火焰点燃。请回答下列问题:
(1)写出该反应的化学方程式____________________________________
___________________________________________________________。
(2)加热烧瓶的作用是__________________________________________,
烧瓶底部放了几片碎瓷片,其作用是______________________________
___________________________________________________________。
(3)玻璃管中石棉绒的作用是________。
A.石棉绒的作用是催化剂
B.石棉绒的作用是使铁粉受热均匀
C.石棉绒的作用是做铁粉的载体以及防止铁粉被吹入导管引起堵塞
(4)实验开始时应先点燃________,实验结束时,应先熄灭________。
答案 (1)3Fe+4H2O(g)Fe3O4+4H2
(2)产生水蒸气 防止爆沸 (3)C
(4)酒精灯 酒精喷灯
解析 (1)在高温条件下Fe与水蒸气反应生成Fe3O4和氢气,反应的化学方程式为3Fe+4H2O(g)Fe3O4+4H2;(2)加热左侧烧瓶,烧瓶中的水蒸发为水蒸气,便于后续的反应,烧瓶底部放碎瓷片的目的是防止暴沸;(3)硬质玻璃管中加入石棉绒的目的是做铁粉的载体,防止铁粉被气体吹入导管中,故答案选C;(4)实验前应先点燃酒精灯使装置中充满气体,防止装置爆炸,反应结束后应先熄灭酒精喷灯,后熄灭酒精灯,以免空气中的氧气进入装置发生反应生成杂质影响产物。
17.(16分)向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,试计算:
(1)Al的物质的量。
(2)参加反应的NaOH的物质的量和溶液的物质的量浓度。
(3)在标准状况下生成H2的体积。
答案 (1)Al的物质的量为0.4 mol
(2)参加反应的NaOH的物质的量是0.4 mol NaOH溶液物质的量浓度是0.8 mol·L-1
(3)在标准状况下生成H2的体积为13.44 L
解析 (1)Al的摩尔质量是27 g·mol-1,
n(Al)==0.4 mol。
(2)设参加反应的NaOH物质的量是n,生成标准状况下的H2的体积是V。
则=,n=0.4 mol,
c(NaOH)==0.8 mol·L-1。
(3)V==13.44 L。
(时间:75分钟 满分:100分)
一、选择题(本题包括14小题,每小题只有一个选项符合题意,每小题4分,共56分)
1.(2021·河北石家庄第六中学高一期中)既能用氯气跟单质化合制得也能用金属和盐酸反应制取的物质是( )
A.AlCl3 B.FeCl2
C.FeCl3 D.CuCl2
2.药品“速力菲”中Fe2+会被空气缓慢氧化,国家规定如果药物中有超过10%的Fe2+被氧化即不可服用。若要证明该药是否已被氧化,下列试剂能达到实验目的的是( )
A.新制氯水 B.KSCN溶液
C.酸性KMnO4溶液 D.KCl溶液
3.金属和合金是生活中常用的材料。下列说法正确的是( )
A.不锈钢是铁合金,只含金属元素
B.镧镍(La-Ni)合金能大量吸收H2,并与H2结合成金属氢化物,可作储氢材料
C.目前世界上使用量最大的合金是铝合金
D.常温下,铁粉可以和水发生置换反应得到氢气
4.下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中
A.②③①④ B.③②①④
C.③①②④ D.①②③④
5.工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
下列叙述不正确的是( )
A.试剂X可以是氢氧化钠溶液
B.反应①过滤后所得沉淀为氧化铁
C.图中所示转化反应包含氧化还原反应
D.反应②的化学方程式为2NaAlO2+3H2O+CO2===2Al(OH)3↓+Na2CO3
6.(2021·山西高一段练)某合金与铁的物理性质的比较如下表所示:
熔点/℃ 密度/g/cm3 硬度(金刚石为10) 导电性(银为100)
某合金 2 500 3.00 7.4 2.3
铁 1 535 7.86 4.5 17
还知该合金耐腐蚀强度大。从以上性能看,该合金不适合作( )
A.炉具 B.飞船外壳
C.导线 D.建筑门窗
7.在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡,将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是( )
A.铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
B.铝球表面有气泡产生,溶液澄清
C.反应后去掉两烧杯,杠杆仍平衡
D.铁球表面有红色物质析出,溶液蓝色变浅,杠杆右边上升
8.(2021·安徽芜湖高一段练)新型镁铝合金(Mg17Al12)有储氢性能,下列说法正确的是( )
A.1 mol Mg17Al12与足量盐酸完全反应放出H2的总物质的量为34 mol
B.等质量的镁、铝和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压)由大到小的顺序为V(Al)>V(合金)>V(Mg)
C.该合金中存在Al3+
D.该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
9.(2021·云南昆明高一期中)“价类二维图”是学习元素化合物知识的高效模型。下图为铁元素的“价类二维图”,图中字母代表含铁元素的物质。下列判断正确的是( )
A.X在高温下与水蒸气反应可生成Z
B.在常温下N能与氧气、水发生化合反应生成M
C.Y是一种红棕色粉末,常用作红色油漆和涂料
D.Q可以是一种新型净水剂碱式硫酸铁[Fe(OH)SO4]
10.向由FeCl3和CuCl2组成的混合溶液中加入m g Fe粉(过量),充分反应后,过滤、洗涤、干燥至恒重,残留固体的质量仍为m g,则原混合溶液中n(FeCl3)∶n(CuCl2)为( )
A.2∶7 B.3∶5
C.4∶3 D.5∶4
11.对实验Ⅰ~Ⅳ的实验操作现象判断正确的是( )
A.实验Ⅰ:产生红褐色沉淀
B.实验Ⅱ:溶液颜色变红
C.实验Ⅲ:放出大量气体
D.实验Ⅳ:铜片表面有黑色固体生成
12.将1.5 g两种金属混合物的粉末与足量的盐酸反应,反应完全后,得到标准状况下的氢气1.12 L。则这两种金属可能是( )
A.Ag和Cu B.Zn和Fe
C.Mg和Al D.Zn和Mg
13.(2021·湖南长沙高一段练)工业废弃物的资源化回收再利用,可以更大限度地发挥原材料的价值。下图是工业生产纳米磁性氧化铁的流程:
下列说法不正确的是( )
A.用Na2CO3溶液浸泡是为了除去废铁屑表面的油污
B.若生产中不通入N2,暴露在空气中生产,将不能得到高纯度产品
C.加适量的H2O2是为了将部分Fe2+氧化为Fe3+,涉及反应:H2O2+2Fe2++2H+===2Fe3++2H2O
D.溶液A中Fe2+和Fe3+的浓度比为1∶1
14.(2021·湖南高一段练)草酸亚铁晶体()是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
下列说法正确的是( )
A.③中盛放足量的饱和NaHCO3溶液用于除去生成的CO2
B.加热前需要先向装置中通一段时间的N2
C.若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D.实验结束后,若①中淡黄色粉末完全变成黑色,则产物一定为铁
二、非选择题(本题包括3小题,共44分)
15.(14分)有三种金属单质A、B、C,其中A的焰色实验为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间有如下转化关系(图中有些反应的产物和反应的条件没有标出)。请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙________、H________;
(2)写出反应②的离子方程式:____________________________________
___________________________________________________________;
(3)写出金属A与水反应的离子方程式:___________________________________________________________
___________________________________________________________;
(4)写出金属B与D的溶液反应的离子方程式:___________________________________________________________;
(5)F与D溶液反应后的产物在空气中转化为H的化学方程式为___________________________________________________________
___________________________________________________________;
现象为___________________________________________________________。
16.(14分)(2020·湖南高一期末)如图,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的氢气,并靠近火焰点燃。请回答下列问题:
(1)写出该反应的化学方程式____________________________________
___________________________________________________________。
(2)加热烧瓶的作用是__________________________________________,
烧瓶底部放了几片碎瓷片,其作用是______________________________
___________________________________________________________。
(3)玻璃管中石棉绒的作用是________。
A.石棉绒的作用是催化剂
B.石棉绒的作用是使铁粉受热均匀
C.石棉绒的作用是做铁粉的载体以及防止铁粉被吹入导管引起堵塞
(4)实验开始时应先点燃________,实验结束时,应先熄灭________。
17.(16分)向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,试计算:
(1)Al的物质的量。
(2)参加反应的NaOH的物质的量和溶液的物质的量浓度。
(3)在标准状况下生成H2的体积。
第三章 铁 金属材料 章末测评验收卷(三)
(时间:75分钟 满分:100分)
一、选择题(本题包括14小题,每小题只有一个选项符合题意,每小题4分,共56分)
1.(2021·河北石家庄第六中学高一期中)既能用氯气跟单质化合制得也能用金属和盐酸反应制取的物质是( )
A.AlCl3 B.FeCl2
C.FeCl3 D.CuCl2
答案 A
解析 Al为活泼金属,既能与氯气化合反应又能和盐酸置换反应均可生成AlCl3,故A正确;FeCl2只能由Fe与HCl反应制取,而不能由Fe与Cl2反应制取,故B错;FeCl3只能由Fe与Cl2反应制取,而不能由Fe与HCl反应制取,故C错;Cu为较不活泼金属,不能与HCl反应,则CuCl2只能由Cu与Cl2反应制取,故D错。
2.药品“速力菲”中Fe2+会被空气缓慢氧化,国家规定如果药物中有超过10%的Fe2+被氧化即不可服用。若要证明该药是否已被氧化,下列试剂能达到实验目的的是( )
A.新制氯水 B.KSCN溶液
C.酸性KMnO4溶液 D.KCl溶液
答案 B
解析 要证明该药品已被氧化,只需证明药品中存在Fe3+即可。KSCN溶液与Fe3+反应生成Fe(SCN)3,使溶液显红色,能达到实验目的,B项正确。
3.金属和合金是生活中常用的材料。下列说法正确的是( )
A.不锈钢是铁合金,只含金属元素
B.镧镍(La-Ni)合金能大量吸收H2,并与H2结合成金属氢化物,可作储氢材料
C.目前世界上使用量最大的合金是铝合金
D.常温下,铁粉可以和水发生置换反应得到氢气
答案 B
解析 不锈钢中含碳元素,A项错误;镧镍合金能大量吸收H2,并与H2结合成金属氢化物,稍稍加热又会分解,将储存在其中的氢释放出来,可作储氢材料,B项正确;目前世界上使用量最大的合金是钢铁,C项错误;铁粉和水蒸气在高温条件下才能发生置换反应得到氢气,D项错误。
4.下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中
A.②③①④ B.③②①④
C.③①②④ D.①②③④
答案 B
解析 ①金属钠在纯氧中燃烧生成淡黄色的过氧化钠;②FeSO4溶液和NaOH溶液反应生成白色氢氧化亚铁沉淀,然后迅速被氧化为红褐色氢氧化铁;③FeCl3溶液中滴入KSCN溶液,溶液呈红色;④无水硫酸铜放入医用酒精中,医用酒精中含有水,溶液变蓝,故其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列依次是③②①④。
5.工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
下列叙述不正确的是( )
A.试剂X可以是氢氧化钠溶液
B.反应①过滤后所得沉淀为氧化铁
C.图中所示转化反应包含氧化还原反应
D.反应②的化学方程式为2NaAlO2+3H2O+CO2===2Al(OH)3↓+Na2CO3
答案 D
解析 试剂X为强碱溶液,可以是NaOH溶液;反应①过滤后得沉淀Fe2O3;电解Al2O3的反应为氧化还原反应;反应②为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3(CO2过量)。
6.(2021·山西高一段练)某合金与铁的物理性质的比较如下表所示:
熔点/℃ 密度/g/cm3 硬度(金刚石为10) 导电性(银为100)
某合金 2 500 3.00 7.4 2.3
铁 1 535 7.86 4.5 17
还知该合金耐腐蚀强度大。从以上性能看,该合金不适合作( )
A.炉具 B.飞船外壳
C.导线 D.建筑门窗
答案 C
解析 作炉具主要利用其熔点高和耐腐蚀性强,故A正确;作飞船外壳则是利用硬度大和密度小的性质,故B正确;该合金与铁相比导电性较差,不适合作导线,故C错误;作门窗框主要是利用该合金的硬度大和耐腐蚀性强,故D正确;故选C。
7.在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡,将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是( )
A.铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
B.铝球表面有气泡产生,溶液澄清
C.反应后去掉两烧杯,杠杆仍平衡
D.铁球表面有红色物质析出,溶液蓝色变浅,杠杆右边上升
答案 B
解析 左边烧杯中发生反应:2Al+2NaOH+2H2O===2NaAlO2+3H2↑,铝球表面有气泡产生,溶液变澄清,A项错误,B项正确;右边烧杯中发生反应:Fe+CuSO4===Cu+FeSO4,铁球表面有红色物质析出,溶液中c(CuSO4)减小,溶液蓝色变浅,左边烧杯中消耗Al,铝球的质量变小,右边烧杯中铁球上析出Cu,质量变大,杠杆右边下沉,D项错误;反应后去掉两烧杯,杠杆不能平衡,C项错误。
8.(2021·安徽芜湖高一段练)新型镁铝合金(Mg17Al12)有储氢性能,下列说法正确的是( )
A.1 mol Mg17Al12与足量盐酸完全反应放出H2的总物质的量为34 mol
B.等质量的镁、铝和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压)由大到小的顺序为V(Al)>V(合金)>V(Mg)
C.该合金中存在Al3+
D.该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
答案 B
解析 1 mol Mg、Al分别与足量盐酸完全反应放出H2的物质的量分别为1 mol、1.5 mol。则1 mol Mg17Al12与足量盐酸完全反应放出H2的总物质的量为1×17+1.5×12=35 mol,A错误;设金属质量均为m,金属提供电子越多则生成氢气体积越大,铝提供电子的物质的量为 mol,镁提供电子的物质的量为 mol,合金提供电子的物质的量为 mol~ mol,故等质量的镁、铝和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压)由大到小的顺序为V(Al)>V(合金)>V(Mg),B正确;合金中的金属以单质形式存在,故C错误;镁和氮气在一定温度下会发生反应,故不能用氮气做保护气,D错误。
9.(2021·云南昆明高一期中)“价类二维图”是学习元素化合物知识的高效模型。下图为铁元素的“价类二维图”,图中字母代表含铁元素的物质。下列判断正确的是( )
A.X在高温下与水蒸气反应可生成Z
B.在常温下N能与氧气、水发生化合反应生成M
C.Y是一种红棕色粉末,常用作红色油漆和涂料
D.Q可以是一种新型净水剂碱式硫酸铁[Fe(OH)SO4]
答案 B
解析 Fe在高温下与水蒸气反应可生成Fe3O4,故A错误;在常温下氢氧化亚铁能与氧气、水发生化合反应生成氢氧化铁,故B正确;Y是氧化亚铁,是黑色粉末,Z为氧化铁,是一种红棕色粉末,常用作红色油漆和涂料,故C错误;Q是+2价的盐,P为+3价盐,P可以是一种新型净水剂碱式硫酸铁[Fe(OH)SO4],故D错误。
10.向由FeCl3和CuCl2组成的混合溶液中加入m g Fe粉(过量),充分反应后,过滤、洗涤、干燥至恒重,残留固体的质量仍为m g,则原混合溶液中n(FeCl3)∶n(CuCl2)为( )
A.2∶7 B.3∶5
C.4∶3 D.5∶4
答案 A
解析 2Fe3++Fe===3Fe2+
x
Cu2++Fe===Cu+Fe2+
y y y
由题意:56=64y,故x∶y=2∶7。
11.对实验Ⅰ~Ⅳ的实验操作现象判断正确的是( )
A.实验Ⅰ:产生红褐色沉淀
B.实验Ⅱ:溶液颜色变红
C.实验Ⅲ:放出大量气体
D.实验Ⅳ:铜片表面有黑色固体生成
答案 C
解析 将氯化铁饱和溶液加入到沸水中加热至溶液呈红褐色可得到氢氧化铁胶体,不是氢氧化铁红褐色沉淀,故A错误;三价铁离子与硫氰化钾溶液反应生成硫氰合铁,溶液变红色,与二价铁离子溶液不显红色,故B错误;铝与氢氧化钠溶液反应生成NaAlO2和氢气,有大量气体生成,故C正确;硫酸铁与铜单质反应生成硫酸亚铁和硫酸铜,不会有黑色固体生成,故D错误。
12.将1.5 g两种金属混合物的粉末与足量的盐酸反应,反应完全后,得到标准状况下的氢气1.12 L。则这两种金属可能是( )
A.Ag和Cu B.Zn和Fe
C.Mg和Al D.Zn和Mg
答案 D
解析 1.12 L氢气的物质的量为=0.05 mol,假设金属都为+2价,则金属混合物的平均相对原子质量为M===30。Ag和Cu均与盐酸不反应,故A不符合;Mg的相对原子质量为24,当Al的化合价为+2价时,可看成其相对原子质量为×27=18,二者都小于30,平均值不可能为30,故C不符合,而Fe的相对原子质量为56,Zn的相对原子质量为65,二者都大于30,平均值不可能等于30,B不符合;Zn、Mg的相对原子质量分别为65和24,故D符合。
13.(2021·湖南长沙高一段练)工业废弃物的资源化回收再利用,可以更大限度地发挥原材料的价值。下图是工业生产纳米磁性氧化铁的流程:
下列说法不正确的是( )
A.用Na2CO3溶液浸泡是为了除去废铁屑表面的油污
B.若生产中不通入N2,暴露在空气中生产,将不能得到高纯度产品
C.加适量的H2O2是为了将部分Fe2+氧化为Fe3+,涉及反应:H2O2+2Fe2++2H+===2Fe3++2H2O
D.溶液A中Fe2+和Fe3+的浓度比为1∶1
答案 D
解析 用Na2CO3溶液浸泡废铁屑是为了除去废铁屑表面的油污,故A正确;若生产中不通入N2,暴露在空气中生产,Fe2+被氧气氧化为Fe3+,不能得到高纯度产品,故B正确;四氧化三铁中含有+2价和+3价的铁,H2O2具有氧化性,加适量的H2O2是为了将部分Fe2+氧化为Fe3+,涉及反应:H2O2+2Fe2++2H+===2Fe3++2H2O,故C正确;四氧化三铁中+2价和+3价的铁物质的量比为1∶2,所以溶液A中Fe2+和Fe3+的浓度比为1∶2,故D错误。
14.(2021·湖南高一段练)草酸亚铁晶体()是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
下列说法正确的是( )
A.③中盛放足量的饱和NaHCO3溶液用于除去生成的CO2
B.加热前需要先向装置中通一段时间的N2
C.若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D.实验结束后,若①中淡黄色粉末完全变成黑色,则产物一定为铁
答案 B
解析 ③除去CO2,应选能和CO2能发生反应的氢氧化钠或氢氧化钡,碳酸氢钠不和二氧化碳反应,A错误;实验开始后,装置中的空气对分解及检验都有干扰,所以必须先通入N2除去装置中的空气,B正确;由于从②、③溶液中导出的气体会带出水蒸气,因此④中放置无水硫酸铜无法检验分解生成的水蒸气,C错误;草酸亚铁晶体分解剩余的固体为FeO,如果没有完全变为黑色,也有可能是由于晶体没有完全分解,D错误。
二、非选择题(本题包括3小题,共44分)
15.(14分)有三种金属单质A、B、C,其中A的焰色实验为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间有如下转化关系(图中有些反应的产物和反应的条件没有标出)。请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙________、H________;
(2)写出反应②的离子方程式:____________________________________
___________________________________________________________;
(3)写出金属A与水反应的离子方程式:___________________________________________________________
___________________________________________________________;
(4)写出金属B与D的溶液反应的离子方程式:___________________________________________________________;
(5)F与D溶液反应后的产物在空气中转化为H的化学方程式为___________________________________________________________
___________________________________________________________;
现象为___________________________________________________________。
答案 (1)Cl2 Fe(OH)3 (2)2Fe2++Cl2===2Fe3++2Cl-
(3)2Na+2H2O===2Na++2OH-+H2↑
(4)2Al+2OH-+2H2O===2AlO+3H2↑
(5)4Fe(OH)2+O2+2H2O===4Fe(OH)3 白色沉淀迅速变为灰绿色,最后变为红褐色
解析 金属A的焰色为黄色,则A为Na,Na与水反应生成H2和NaOH,则甲为H2,D为NaOH;黄绿色气体为氯气,和气体甲反应生成气体丙,则气体丙为HCl;金属B和NaOH溶液反应生成氢气,则B为Al;红褐色沉淀H为Fe(OH)3,则溶液G中含有Fe3+,溶液F与氯气反应生成Fe3+,则溶液F中含有Fe2+;C是常见金属,能和盐酸反应得到溶液F,则金属C为Fe。
16.(14分)(2020·湖南高一期末)如图,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的氢气,并靠近火焰点燃。请回答下列问题:
(1)写出该反应的化学方程式____________________________________
___________________________________________________________。
(2)加热烧瓶的作用是__________________________________________,
烧瓶底部放了几片碎瓷片,其作用是______________________________
___________________________________________________________。
(3)玻璃管中石棉绒的作用是________。
A.石棉绒的作用是催化剂
B.石棉绒的作用是使铁粉受热均匀
C.石棉绒的作用是做铁粉的载体以及防止铁粉被吹入导管引起堵塞
(4)实验开始时应先点燃________,实验结束时,应先熄灭________。
答案 (1)3Fe+4H2O(g)Fe3O4+4H2
(2)产生水蒸气 防止爆沸 (3)C
(4)酒精灯 酒精喷灯
解析 (1)在高温条件下Fe与水蒸气反应生成Fe3O4和氢气,反应的化学方程式为3Fe+4H2O(g)Fe3O4+4H2;(2)加热左侧烧瓶,烧瓶中的水蒸发为水蒸气,便于后续的反应,烧瓶底部放碎瓷片的目的是防止暴沸;(3)硬质玻璃管中加入石棉绒的目的是做铁粉的载体,防止铁粉被气体吹入导管中,故答案选C;(4)实验前应先点燃酒精灯使装置中充满气体,防止装置爆炸,反应结束后应先熄灭酒精喷灯,后熄灭酒精灯,以免空气中的氧气进入装置发生反应生成杂质影响产物。
17.(16分)向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,试计算:
(1)Al的物质的量。
(2)参加反应的NaOH的物质的量和溶液的物质的量浓度。
(3)在标准状况下生成H2的体积。
答案 (1)Al的物质的量为0.4 mol
(2)参加反应的NaOH的物质的量是0.4 mol NaOH溶液物质的量浓度是0.8 mol·L-1
(3)在标准状况下生成H2的体积为13.44 L
解析 (1)Al的摩尔质量是27 g·mol-1,
n(Al)==0.4 mol。
(2)设参加反应的NaOH物质的量是n,生成标准状况下的H2的体积是V。
则=,n=0.4 mol,
c(NaOH)==0.8 mol·L-1。
(3)V==13.44 L。
