化学人教版(2019)选择性必修3 2.1.1 烷烃的结构与性质(共25张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 2.1.1 烷烃的结构与性质(共25张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-08 15:53:00 | ||
图片预览





文档简介
(共25张PPT)
选择性必修3
第二章 烃
第一节 烷烃
烃的分类
仅含碳、氢元素的化合物
碳
氢
芳香烃
含苯环
脂肪烃
不含苯环
饱和烃
不含不饱和键
不饱和烃
含不饱和键 C=C、C≡C
烃
烷烃
烷烃的存在:天然气、液化石油气、汽油、柴油、凡士林、石蜡等,它们的主要成分都是烷烃。
天然气
液化石油气
汽油、柴油
凡士林
石蜡
学习
目标
第1课时
烷烃的结构与性质
PART
01
PART
02
通过微观的化学键视角分析几种简单烷烃分子的结构,以甲烷的结构为模型,认识烷烃的结构。
能依据甲烷的性质预测烷烃可能具有的化学性质。
PART
03
通过对典型烷烃代表物的部分物理性质的数据分析,
认识烷烃同系物物理性质的递变性与其微观结构的关系
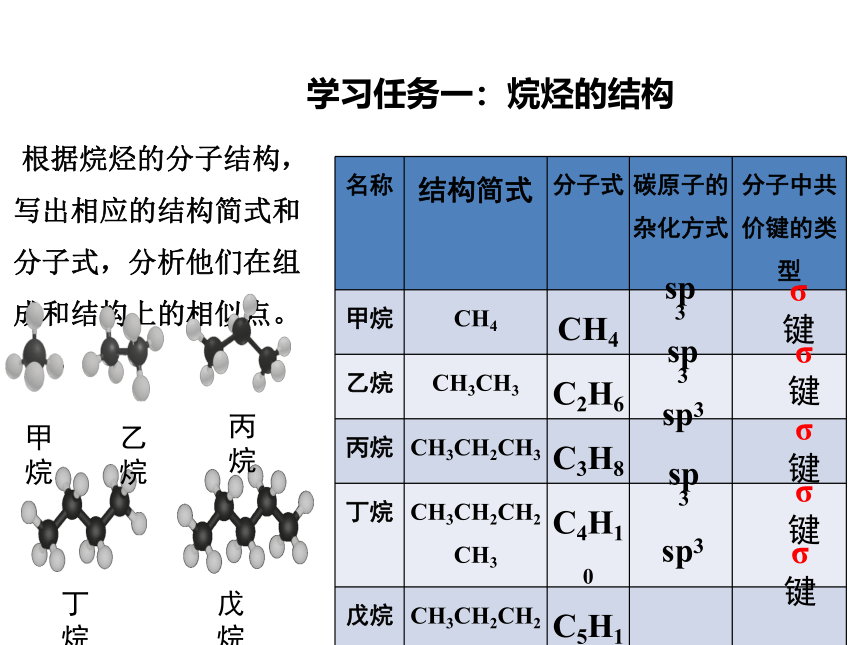
名称 结构简式 分子式 碳原子的杂化方式 分子中共价键的类型
甲烷 CH4 CH4
乙烷 CH3CH3 C2H6
丙烷 CH3CH2CH3 C3H8
丁烷 CH3CH2CH2CH3 C4H10
戊烷 CH3CH2CH2CH2CH3 C5H12
sp3
sp3
sp3
sp3
sp3
σ键
σ键
σ键
σ键
σ键
根据烷烃的分子结构,写出相应的结构简式和分子式,分析他们在组成和结构上的相似点。
甲烷
乙烷
丙烷
丁烷
戊烷
学习任务一:烷烃的结构
1.烷烃的结构特点
(1)碳原子都采取sp3杂化,以伸向四面体4个顶点方向的sp3杂化轨道与其他碳原子或氢原子结合,形成σ键。
(2)分子中的共价键全部是单键,且碳链呈锯齿状排列。
(3)链状烷烃的通式为CnH2n+2(n≥1),且有机化合物中分子式只要符合此通式的,一定是链状烷烃。
归纳小结
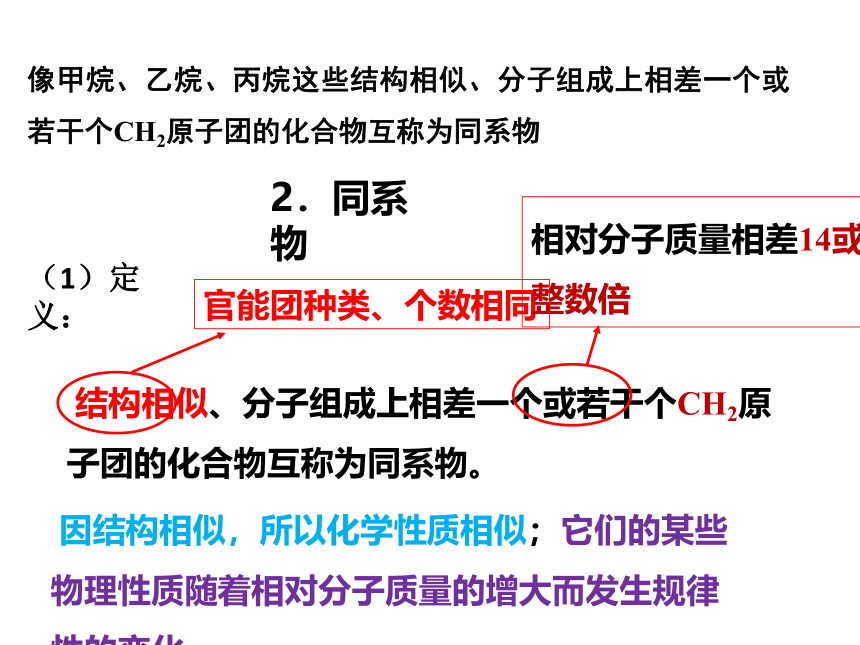
2.同系物
(1)定义:
像甲烷、乙烷、丙烷这些结构相似、分子组成上相差一个或若干个CH2原子团的化合物互称为同系物
结构相似、分子组成上相差一个或若干个CH2原子团的化合物互称为同系物。
官能团种类、个数相同
相对分子质量相差14或14的
整数倍
因结构相似,所以化学性质相似;它们的某些物理性质随着相对分子质量的增大而发生规律性的变化。
(2)特点:
①通式相同,结构相似,化学性质相似属于同一类物质;
②物理性质一般随碳原子数目的增多而呈规律性变化,如随着碳原子数的增多,同系物的溶沸点逐渐升高,密度逐渐增大 ;
③在分子组成上相差一个或若干个“CH2”原子团,所以同系物一定具有不同的分子式,但相对分子质量的差值一定是14的整数倍。
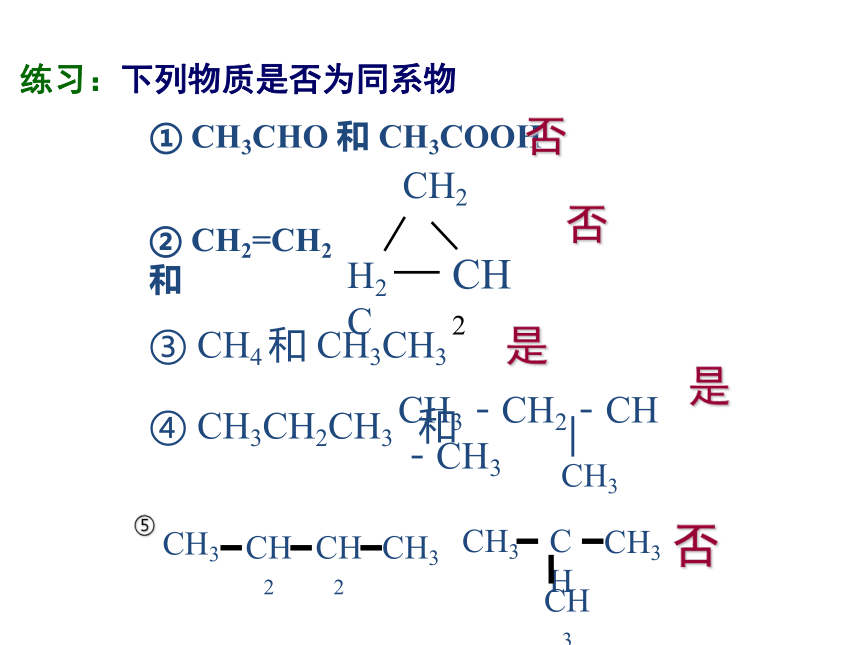
练习:下列物质是否为同系物
① CH3CHO 和 CH3COOH
② CH2=CH2 和
③ CH4 和 CH3CH3
④ CH3CH2CH3 和
H2C
CH2
CH2
CH3-CH2-CH-CH3
│
CH3
否
否
是
是
CH3
CH2
CH2
CH3
CH3
CH3
CH
CH3
⑤
否
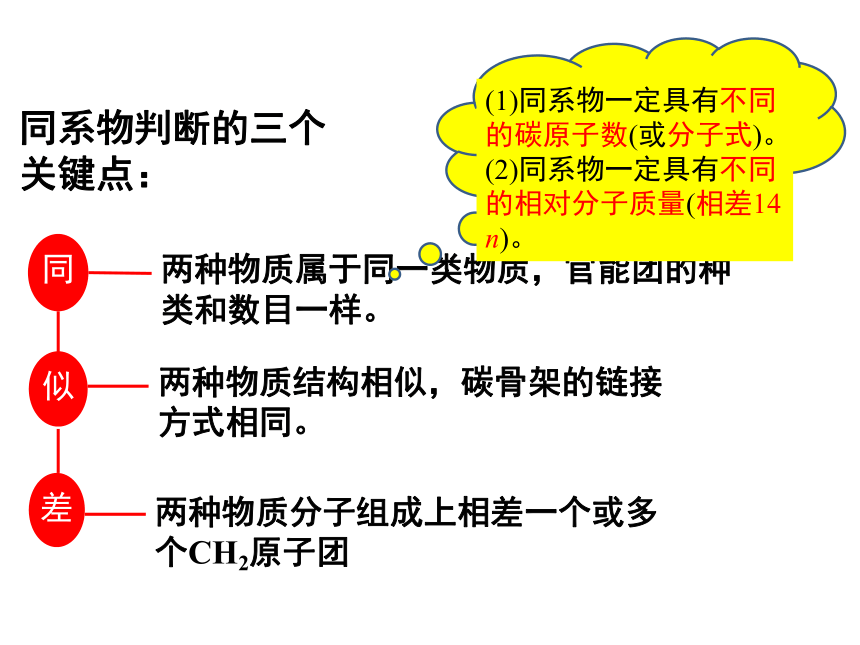
同系物判断的三个关键点:
同
两种物质属于同一类物质,官能团的种类和数目一样。
似
差
两种物质结构相似,碳骨架的链接方式相同。
两种物质分子组成上相差一个或多个CH2原子团
(1)同系物一定具有不同的碳原子数(或分子式)。
(2)同系物一定具有不同的相对分子质量(相差14 n)。
1.烷烃的物理性质
部分烷烃的熔点、沸点和密度
烷烃名称 分子式 结构简式 常温下状态 熔点/℃ 沸点/℃ 密度/(g·cm-3)
甲烷 CH4 CH4 气体 -182 -164 0.423
乙烷 C2H6 CH3CH3 气体 -172 -89 0.545
丙烷 C3H8 CH3CH2CH3 气体 -187 -42 0.501
丁烷 C4H10 CH3CH2CH2CH3 气体 -138 -0.5 0.579
戊烷 C5H12 CH3(CH2)3CH3 气体 -129 36 0.626
壬烷 C9H20 CH3(CH2)7CH3 气体 -54 151 0.718
十一烷 C11H24 CH3(CH2)9CH3 气体 -26 196 0.740
十六烷 C16H34 CH3(CH2)14CH3 气体 18 280 0.775
十八烷 C18H38 CH3(CH2)16CH3 气体 28 308 0.777
学习任务二:烷烃的性质
分子中碳原子数
正戊烷
异戊烷
新戊烷
比较戊烷的沸点
>
>
36.1 ℃
27.9 ℃
9.5 ℃
③常温下的存在状态,由气态逐渐过渡到液态、固态。
①随着分子中碳原子数的递增,烷烃熔沸点逐渐升高。
② 随着分子中碳原子数的递增,烷烃密度逐渐增大。
常温下烷烃的状态:
④所有烷烃均难溶于水,密度均小于1
C17以上为固态
C5~C16液态
C1~C4气态
烷烃同系物的物理性质的递变规律
归纳小结
C个数相同,支链越多,熔沸点越低
颜色 溶解性 可燃性 与酸性高锰酸钾溶液 与溴的四氯化碳溶液 与强酸、强碱溶液 与氯气(在光照下)
无色
难溶于水
易燃
不反应
不反应
不反应
取代反应
2.烷烃的化学性质
思考与讨论1:根据甲烷的性质推测烷烃可能具有的性质,填写下表。
连续反应,反应过程不会停留在某一步,所以产物较为复杂,不适合制备物质。
反应生成两种气态物质,三种液态物质。最多的产物是HCl。
甲烷与氯气的反应
+
Cl—Cl
光
C
C
H
H
H
H
H
H
C
C
Cl
H
H
H
H
H
Cl
H
+
思考与讨论2:根据甲烷与氯气的反应,写出乙烷与氯气反应生成一氯乙烷的化学方程式。
上述反应属于取代反应,乙烷分子中C—H键断裂,其中的氢原子被氯原子代替,生成C—Cl键。
CH3
Cl
Cl
Cl
Cl
Cl
CH3
Cl
Cl
Cl
Cl
CH3
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
一氯乙烷(1种),二氯乙烷(2种),三氯乙烷(2种),四氯乙烷(2种),五氯乙烷(1种),六氯乙烷(1种)
共9种。
可能的产物:CH3CH2Cl、CH3CHCl2、CH2ClCH2Cl、CH3CCl3、CH2CICHC12、CH2CICC13、CHCl2CHCl2、CHCl2CCl3、CCl3CCl3
思考与讨论3:乙烷与氯气在光照下反应,可能生成哪些产物?请写出它们的结构简式。
燃烧通式:CnH2n+2 + O2nCO2 + (n+1)H2O
点燃
烷烃与氧气的燃烧反应方程式通式(燃烧方程式中有机物一般用分子式)
现象:烷烃燃烧火焰呈淡蓝色,无黑烟 ,放出大量热,且烷烃中碳的质量分数越低放出热量越多。
小规律:完全燃烧相同质量的烃时,消耗氧气的体积(物质的量)随着碳原子数的递增二减小。
拓展:烃CxHy与氧气的反应的一般燃烧反应方程式(烃的燃烧通式)
CxHy+(x+y/4)O2 → xCO2+y/2H2O
点燃
烷烃在绝氧条件下高温分解一般生成另一种烷烃和烯烃(裂化或裂解)
CH3CH2CH2CH3 CH3CH3+CH2=CH2
高温
或CH3CH2CH2CH3 CH4 + CH3CH=CH2
高温
C16H34C8H16+C8H18
(1)甲烷的化学性质比较稳定,常温下不能被酸性KMnO4溶液氧化,也不与强酸、强碱及溴的四氯化碳溶液反应。但能在空气中发生燃烧反应和在光照下与Cl2发生取代反应。
烷烃的化学性质
(2)烷烃的性质与甲烷相似
①不与酸性KMnO4溶液、溴的四氯化碳溶液、强酸溶液、强碱溶液反应。
归纳小结
(2)烷烃的性质与甲烷相似
②氧化反应——可燃性
注:当碳含量少时,产生淡蓝色火焰,但随着碳原子数的增多,碳的质量分数逐渐增大,有黑烟产生
乙烷的取代反应
H-C-C-H+Cl-Cl → H-C-C-Cl+HCl
H H
H H
H H
H H
光照
键断裂
③特征反应——取代反应
烷烃可以与卤素单质(气态)在光照下发生取代反应生成卤代烃和卤化氢。
乙烷断裂的键为C—H键,形成键为C—Cl键和H—Cl键。
特征:分步取代,产物多
烷烃取代反应的特点:
①在光照条件下;
②与纯卤素反应;
③1mol卤素单质只能取代1molH
④连锁反应,有多种产物(卤代烃和卤化氢气体)
④受热分解:烷烃在隔绝空气的条件下,加热或加催化剂可发生裂化或裂解
通式:一分子烷烃
一分子烷烃+一分子烯烃
举例:
课堂小结
结
质
质
烷烃分子中的共价键全部是单键
化
学
性
物
理
性
构
烷烃的结构与甲烷的相似
其分子中的碳原子都采取sp3杂化,碳原子与碳原子或其他原子形成σ键
烷烃的结构与性质
能在光照下与氯气发生取代反应
常温下不能被酸性高锰酸钾溶液氧化,不与强酸、强碱及溴的四氯化碳溶液反应
能在空气中燃烧(可燃性)
随着烷烃碳原子数的增加,烷烃的熔点和沸点逐渐升高
随着烷烃碳原子数的增加,烷烃的密度逐渐增大
随着烷烃碳原子数的增加,常温下的存在状态也由气态逐渐过渡到液态、固态。
选择性必修3
第二章 烃
第一节 烷烃
烃的分类
仅含碳、氢元素的化合物
碳
氢
芳香烃
含苯环
脂肪烃
不含苯环
饱和烃
不含不饱和键
不饱和烃
含不饱和键 C=C、C≡C
烃
烷烃
烷烃的存在:天然气、液化石油气、汽油、柴油、凡士林、石蜡等,它们的主要成分都是烷烃。
天然气
液化石油气
汽油、柴油
凡士林
石蜡
学习
目标
第1课时
烷烃的结构与性质
PART
01
PART
02
通过微观的化学键视角分析几种简单烷烃分子的结构,以甲烷的结构为模型,认识烷烃的结构。
能依据甲烷的性质预测烷烃可能具有的化学性质。
PART
03
通过对典型烷烃代表物的部分物理性质的数据分析,
认识烷烃同系物物理性质的递变性与其微观结构的关系
名称 结构简式 分子式 碳原子的杂化方式 分子中共价键的类型
甲烷 CH4 CH4
乙烷 CH3CH3 C2H6
丙烷 CH3CH2CH3 C3H8
丁烷 CH3CH2CH2CH3 C4H10
戊烷 CH3CH2CH2CH2CH3 C5H12
sp3
sp3
sp3
sp3
sp3
σ键
σ键
σ键
σ键
σ键
根据烷烃的分子结构,写出相应的结构简式和分子式,分析他们在组成和结构上的相似点。
甲烷
乙烷
丙烷
丁烷
戊烷
学习任务一:烷烃的结构
1.烷烃的结构特点
(1)碳原子都采取sp3杂化,以伸向四面体4个顶点方向的sp3杂化轨道与其他碳原子或氢原子结合,形成σ键。
(2)分子中的共价键全部是单键,且碳链呈锯齿状排列。
(3)链状烷烃的通式为CnH2n+2(n≥1),且有机化合物中分子式只要符合此通式的,一定是链状烷烃。
归纳小结
2.同系物
(1)定义:
像甲烷、乙烷、丙烷这些结构相似、分子组成上相差一个或若干个CH2原子团的化合物互称为同系物
结构相似、分子组成上相差一个或若干个CH2原子团的化合物互称为同系物。
官能团种类、个数相同
相对分子质量相差14或14的
整数倍
因结构相似,所以化学性质相似;它们的某些物理性质随着相对分子质量的增大而发生规律性的变化。
(2)特点:
①通式相同,结构相似,化学性质相似属于同一类物质;
②物理性质一般随碳原子数目的增多而呈规律性变化,如随着碳原子数的增多,同系物的溶沸点逐渐升高,密度逐渐增大 ;
③在分子组成上相差一个或若干个“CH2”原子团,所以同系物一定具有不同的分子式,但相对分子质量的差值一定是14的整数倍。
练习:下列物质是否为同系物
① CH3CHO 和 CH3COOH
② CH2=CH2 和
③ CH4 和 CH3CH3
④ CH3CH2CH3 和
H2C
CH2
CH2
CH3-CH2-CH-CH3
│
CH3
否
否
是
是
CH3
CH2
CH2
CH3
CH3
CH3
CH
CH3
⑤
否
同系物判断的三个关键点:
同
两种物质属于同一类物质,官能团的种类和数目一样。
似
差
两种物质结构相似,碳骨架的链接方式相同。
两种物质分子组成上相差一个或多个CH2原子团
(1)同系物一定具有不同的碳原子数(或分子式)。
(2)同系物一定具有不同的相对分子质量(相差14 n)。
1.烷烃的物理性质
部分烷烃的熔点、沸点和密度
烷烃名称 分子式 结构简式 常温下状态 熔点/℃ 沸点/℃ 密度/(g·cm-3)
甲烷 CH4 CH4 气体 -182 -164 0.423
乙烷 C2H6 CH3CH3 气体 -172 -89 0.545
丙烷 C3H8 CH3CH2CH3 气体 -187 -42 0.501
丁烷 C4H10 CH3CH2CH2CH3 气体 -138 -0.5 0.579
戊烷 C5H12 CH3(CH2)3CH3 气体 -129 36 0.626
壬烷 C9H20 CH3(CH2)7CH3 气体 -54 151 0.718
十一烷 C11H24 CH3(CH2)9CH3 气体 -26 196 0.740
十六烷 C16H34 CH3(CH2)14CH3 气体 18 280 0.775
十八烷 C18H38 CH3(CH2)16CH3 气体 28 308 0.777
学习任务二:烷烃的性质
分子中碳原子数
正戊烷
异戊烷
新戊烷
比较戊烷的沸点
>
>
36.1 ℃
27.9 ℃
9.5 ℃
③常温下的存在状态,由气态逐渐过渡到液态、固态。
①随着分子中碳原子数的递增,烷烃熔沸点逐渐升高。
② 随着分子中碳原子数的递增,烷烃密度逐渐增大。
常温下烷烃的状态:
④所有烷烃均难溶于水,密度均小于1
C17以上为固态
C5~C16液态
C1~C4气态
烷烃同系物的物理性质的递变规律
归纳小结
C个数相同,支链越多,熔沸点越低
颜色 溶解性 可燃性 与酸性高锰酸钾溶液 与溴的四氯化碳溶液 与强酸、强碱溶液 与氯气(在光照下)
无色
难溶于水
易燃
不反应
不反应
不反应
取代反应
2.烷烃的化学性质
思考与讨论1:根据甲烷的性质推测烷烃可能具有的性质,填写下表。
连续反应,反应过程不会停留在某一步,所以产物较为复杂,不适合制备物质。
反应生成两种气态物质,三种液态物质。最多的产物是HCl。
甲烷与氯气的反应
+
Cl—Cl
光
C
C
H
H
H
H
H
H
C
C
Cl
H
H
H
H
H
Cl
H
+
思考与讨论2:根据甲烷与氯气的反应,写出乙烷与氯气反应生成一氯乙烷的化学方程式。
上述反应属于取代反应,乙烷分子中C—H键断裂,其中的氢原子被氯原子代替,生成C—Cl键。
CH3
Cl
Cl
Cl
Cl
Cl
CH3
Cl
Cl
Cl
Cl
CH3
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
一氯乙烷(1种),二氯乙烷(2种),三氯乙烷(2种),四氯乙烷(2种),五氯乙烷(1种),六氯乙烷(1种)
共9种。
可能的产物:CH3CH2Cl、CH3CHCl2、CH2ClCH2Cl、CH3CCl3、CH2CICHC12、CH2CICC13、CHCl2CHCl2、CHCl2CCl3、CCl3CCl3
思考与讨论3:乙烷与氯气在光照下反应,可能生成哪些产物?请写出它们的结构简式。
燃烧通式:CnH2n+2 + O2nCO2 + (n+1)H2O
点燃
烷烃与氧气的燃烧反应方程式通式(燃烧方程式中有机物一般用分子式)
现象:烷烃燃烧火焰呈淡蓝色,无黑烟 ,放出大量热,且烷烃中碳的质量分数越低放出热量越多。
小规律:完全燃烧相同质量的烃时,消耗氧气的体积(物质的量)随着碳原子数的递增二减小。
拓展:烃CxHy与氧气的反应的一般燃烧反应方程式(烃的燃烧通式)
CxHy+(x+y/4)O2 → xCO2+y/2H2O
点燃
烷烃在绝氧条件下高温分解一般生成另一种烷烃和烯烃(裂化或裂解)
CH3CH2CH2CH3 CH3CH3+CH2=CH2
高温
或CH3CH2CH2CH3 CH4 + CH3CH=CH2
高温
C16H34C8H16+C8H18
(1)甲烷的化学性质比较稳定,常温下不能被酸性KMnO4溶液氧化,也不与强酸、强碱及溴的四氯化碳溶液反应。但能在空气中发生燃烧反应和在光照下与Cl2发生取代反应。
烷烃的化学性质
(2)烷烃的性质与甲烷相似
①不与酸性KMnO4溶液、溴的四氯化碳溶液、强酸溶液、强碱溶液反应。
归纳小结
(2)烷烃的性质与甲烷相似
②氧化反应——可燃性
注:当碳含量少时,产生淡蓝色火焰,但随着碳原子数的增多,碳的质量分数逐渐增大,有黑烟产生
乙烷的取代反应
H-C-C-H+Cl-Cl → H-C-C-Cl+HCl
H H
H H
H H
H H
光照
键断裂
③特征反应——取代反应
烷烃可以与卤素单质(气态)在光照下发生取代反应生成卤代烃和卤化氢。
乙烷断裂的键为C—H键,形成键为C—Cl键和H—Cl键。
特征:分步取代,产物多
烷烃取代反应的特点:
①在光照条件下;
②与纯卤素反应;
③1mol卤素单质只能取代1molH
④连锁反应,有多种产物(卤代烃和卤化氢气体)
④受热分解:烷烃在隔绝空气的条件下,加热或加催化剂可发生裂化或裂解
通式:一分子烷烃
一分子烷烃+一分子烯烃
举例:
课堂小结
结
质
质
烷烃分子中的共价键全部是单键
化
学
性
物
理
性
构
烷烃的结构与甲烷的相似
其分子中的碳原子都采取sp3杂化,碳原子与碳原子或其他原子形成σ键
烷烃的结构与性质
能在光照下与氯气发生取代反应
常温下不能被酸性高锰酸钾溶液氧化,不与强酸、强碱及溴的四氯化碳溶液反应
能在空气中燃烧(可燃性)
随着烷烃碳原子数的增加,烷烃的熔点和沸点逐渐升高
随着烷烃碳原子数的增加,烷烃的密度逐渐增大
随着烷烃碳原子数的增加,常温下的存在状态也由气态逐渐过渡到液态、固态。
