2022-2023学年人教版高中化学选择性必修1 4.2 电解池 第一课时电解原理(共16张PPT)
文档属性
| 名称 | 2022-2023学年人教版高中化学选择性必修1 4.2 电解池 第一课时电解原理(共16张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-07 13:41:31 | ||
图片预览






文档简介
(共16张PPT)
课前准备
1.物品准备:
课本;笔记本、练习本;两种颜色的笔;
2.实验用品检查:
盛有氯化铜溶液的U形管,学生电源,两根导线,两个石墨电极,两个烧杯;
淀粉碘化钾试纸,NaOH溶液
3.旧知回顾:回忆电解水实验,填写学案“旧知回顾”
人教版选择性必修1 《化学反应原理》第四章
第二节 电解池
第一课时 电解原理
1.通过对CuCl2溶液电解过程的分析,了解电解、电解池的概念,建立电解池的结构模型。
2.从氧化还原角度理解电解过程离子放电顺序,形成系统分析电解池的思维模型,并能用电极反应和总反应进行表征。
课程目标
“电解”这个词在最近几年的健康、保健领域很火
电解水足疗仪 电解纯净水
导
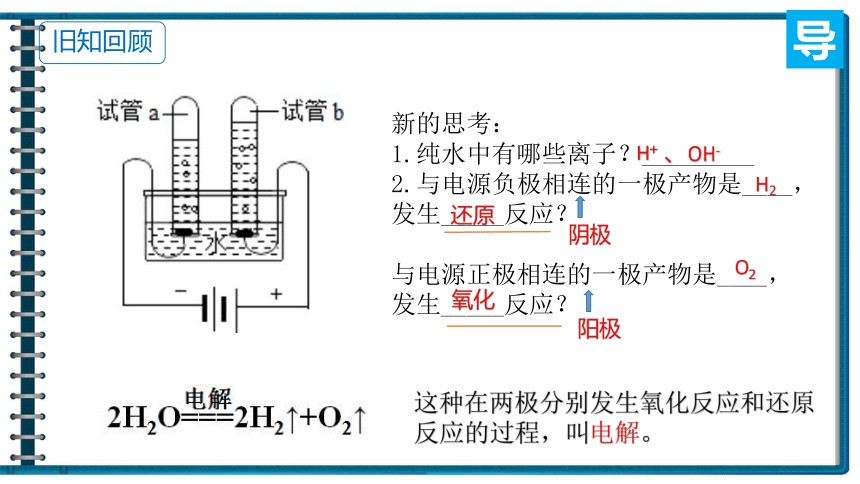
新的思考:
1.纯水中有哪些离子?_________
2.与电源负极相连的一极产物是____,发生_____反应?
与电源正极相连的一极产物是____,发生_____反应?
阴极
阳极
H+ 、OH-
H2
还原
O2
氧化
导
这种在两极分别发生氧化反应和还原反应的过程,叫电解。
旧知回顾
经过我们的分析得知,电解水只能得到H2与O2,所以喝电解纯净水更健康的说法是骗人的。
事实上,纯水导电能力很差,为了增强其导电性在电解过程中会滴加NaOH或稀硫酸,电解产物仍然是H2和O2,那是不是添加任何电解质进行电解产物都不变呢?今天我们利用电解CuCl2溶液实验对电解的基本规律进行探究。
导
1.类比电解水实验,思考以下问题,进行实验预设:(2min)
① 氯化铜溶液中存在哪些离子?
② 阴阳两极可能的产物?
③ 由可能产物的生成,你认为实验中应做什么防护?
思
8min
2.操作实验,并用自己的语言描述实验现象。(3min)
3.从离子流向、电子流向、两极反应对实验原理进行探究和描述。
带着问题去做实验
独立思考,发现未知
(1)交流答案,展示问题
(2)组内讨论,解决疑难
议
5min
以电解氯化铜溶液为例,画出电解池工作原理图,标注电子流向、离子流向,写出两极名称和电极反应式。
展
6min
OH- Cl-
(阴极)
- +
C C
(阳极)
CuCl2溶液
H+ Cu2+
-
电子流向
离子流向
电极反应 阴极:Cu2++2e-=Cu
阳极:2Cl-+2e-=Cl2
阳极→正极
阴极→负极
阳离子(H+ Cu2+ )→阴极
阴离子(OH- Cl- )→阳极
-
-
-
评
一、电解CuCl2溶液原理分析
先
后
用惰性电极(Pt、Au、石墨)时,溶液中阴离子的放电顺序是:
在阴极发生反应的是溶液中的阳离子。
阳离子放电顺序是:
Ag+>Fe3+ >Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>(H+)> Al3+>Mg2+>Na+>Ca2+>K+
阴极
阳极
活性电极先失去电子。
S 2->SO32->I->Br->Cl->OH->NO3-
SO42-(等含氧酸根离子)>F-
二、离子放电顺序:
评
用惰性电极分别电解NaOH溶液和稀H2SO4,分别写出电极反应式以及电解总方程式。
评
迁移应用
阳极:4OH--4e-=O2↑+2H2O
阴极:2H++2e-=H2↑ 或2H2O+2e-=H2↑ +2OH-
总反应:2H2O = 2O2↑+H2↑
H2O H+ + OH—
NaOH = Na++ OH-
离子放电的顺序
阳离子
阴离子
H+ >Na+
OH—
NaOH溶液
评
电解
溶液中存在哪些离子
通电时离子如何移动
判断离子放电顺序,谁强谁放电
产物、电极方程式
电解方程式的书写
阳离子→阴极
阴离子→阳极
阴极 得电子—还原反应
阳极 失电子—氧化反应
评
小结:
(1)电极反应:
正阳氧、负阴还
(2)离子流向:
(3)电子流向:
电子从负极流向阴极,经溶液离子
导电,再从阳极流回正极
异性相吸
注意:电子不能在溶液中移动
1.构成电解池的条件
①直流电源
②电极
③电解质溶液或熔融电解质
④形成闭合回路
评
2.电解原理
(4)电极反应:
放电顺序
阴极:阳离子的氧化性
阳极:先活性电极
检
1.利用电解水制备氧气时,因为水是极弱电解质,纯水的导电性很差,为了增强其导电性,可以向其中添加下列哪种电解质:
A CuSO4 B NaCl C K2SO4 D CaCl2
2.利用电解法使Cu+H2SO4=CuSO4+H2,请设计对应的电解池,标出电极材料、电解质溶液并写出电极反应式?
课前准备
1.物品准备:
课本;笔记本、练习本;两种颜色的笔;
2.实验用品检查:
盛有氯化铜溶液的U形管,学生电源,两根导线,两个石墨电极,两个烧杯;
淀粉碘化钾试纸,NaOH溶液
3.旧知回顾:回忆电解水实验,填写学案“旧知回顾”
人教版选择性必修1 《化学反应原理》第四章
第二节 电解池
第一课时 电解原理
1.通过对CuCl2溶液电解过程的分析,了解电解、电解池的概念,建立电解池的结构模型。
2.从氧化还原角度理解电解过程离子放电顺序,形成系统分析电解池的思维模型,并能用电极反应和总反应进行表征。
课程目标
“电解”这个词在最近几年的健康、保健领域很火
电解水足疗仪 电解纯净水
导
新的思考:
1.纯水中有哪些离子?_________
2.与电源负极相连的一极产物是____,发生_____反应?
与电源正极相连的一极产物是____,发生_____反应?
阴极
阳极
H+ 、OH-
H2
还原
O2
氧化
导
这种在两极分别发生氧化反应和还原反应的过程,叫电解。
旧知回顾
经过我们的分析得知,电解水只能得到H2与O2,所以喝电解纯净水更健康的说法是骗人的。
事实上,纯水导电能力很差,为了增强其导电性在电解过程中会滴加NaOH或稀硫酸,电解产物仍然是H2和O2,那是不是添加任何电解质进行电解产物都不变呢?今天我们利用电解CuCl2溶液实验对电解的基本规律进行探究。
导
1.类比电解水实验,思考以下问题,进行实验预设:(2min)
① 氯化铜溶液中存在哪些离子?
② 阴阳两极可能的产物?
③ 由可能产物的生成,你认为实验中应做什么防护?
思
8min
2.操作实验,并用自己的语言描述实验现象。(3min)
3.从离子流向、电子流向、两极反应对实验原理进行探究和描述。
带着问题去做实验
独立思考,发现未知
(1)交流答案,展示问题
(2)组内讨论,解决疑难
议
5min
以电解氯化铜溶液为例,画出电解池工作原理图,标注电子流向、离子流向,写出两极名称和电极反应式。
展
6min
OH- Cl-
(阴极)
- +
C C
(阳极)
CuCl2溶液
H+ Cu2+
-
电子流向
离子流向
电极反应 阴极:Cu2++2e-=Cu
阳极:2Cl-+2e-=Cl2
阳极→正极
阴极→负极
阳离子(H+ Cu2+ )→阴极
阴离子(OH- Cl- )→阳极
-
-
-
评
一、电解CuCl2溶液原理分析
先
后
用惰性电极(Pt、Au、石墨)时,溶液中阴离子的放电顺序是:
在阴极发生反应的是溶液中的阳离子。
阳离子放电顺序是:
Ag+>Fe3+ >Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>(H+)> Al3+>Mg2+>Na+>Ca2+>K+
阴极
阳极
活性电极先失去电子。
S 2->SO32->I->Br->Cl->OH->NO3-
SO42-(等含氧酸根离子)>F-
二、离子放电顺序:
评
用惰性电极分别电解NaOH溶液和稀H2SO4,分别写出电极反应式以及电解总方程式。
评
迁移应用
阳极:4OH--4e-=O2↑+2H2O
阴极:2H++2e-=H2↑ 或2H2O+2e-=H2↑ +2OH-
总反应:2H2O = 2O2↑+H2↑
H2O H+ + OH—
NaOH = Na++ OH-
离子放电的顺序
阳离子
阴离子
H+ >Na+
OH—
NaOH溶液
评
电解
溶液中存在哪些离子
通电时离子如何移动
判断离子放电顺序,谁强谁放电
产物、电极方程式
电解方程式的书写
阳离子→阴极
阴离子→阳极
阴极 得电子—还原反应
阳极 失电子—氧化反应
评
小结:
(1)电极反应:
正阳氧、负阴还
(2)离子流向:
(3)电子流向:
电子从负极流向阴极,经溶液离子
导电,再从阳极流回正极
异性相吸
注意:电子不能在溶液中移动
1.构成电解池的条件
①直流电源
②电极
③电解质溶液或熔融电解质
④形成闭合回路
评
2.电解原理
(4)电极反应:
放电顺序
阴极:阳离子的氧化性
阳极:先活性电极
检
1.利用电解水制备氧气时,因为水是极弱电解质,纯水的导电性很差,为了增强其导电性,可以向其中添加下列哪种电解质:
A CuSO4 B NaCl C K2SO4 D CaCl2
2.利用电解法使Cu+H2SO4=CuSO4+H2,请设计对应的电解池,标出电极材料、电解质溶液并写出电极反应式?
