2022-2023学年人教版高中化学必修1 4.2《元素周期律》第一课时(共16张PPT)
文档属性
| 名称 | 2022-2023学年人教版高中化学必修1 4.2《元素周期律》第一课时(共16张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 8.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-07 13:43:53 | ||
图片预览




文档简介
(共16张PPT)
第二节 元 素 周 期 律
第一课时
人教版化学必修一第四章
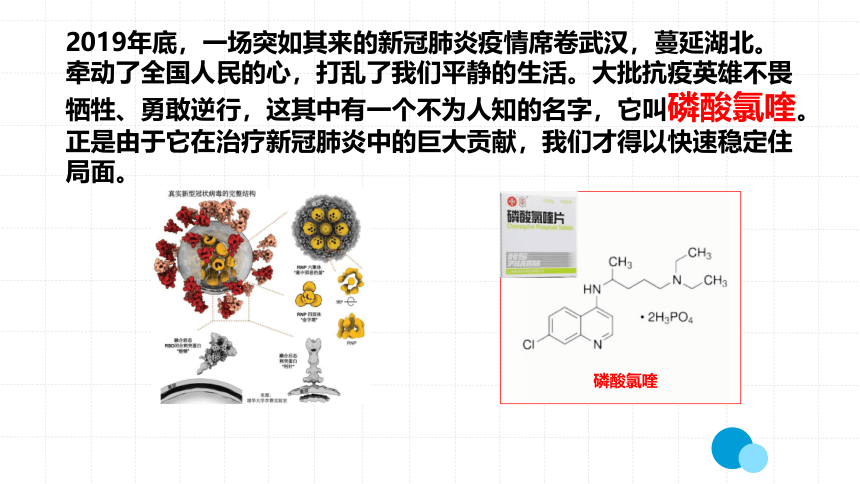
2019年底,一场突如其来的新冠肺炎疫情席卷武汉,蔓延湖北。牵动了全国人民的心,打乱了我们平静的生活。大批抗疫英雄不畏牺牲、勇敢逆行,这其中有一个不为人知的名字,它叫磷酸氯喹。正是由于它在治疗新冠肺炎中的巨大贡献,我们才得以快速稳定住局面。
磷酸氯喹
主题一:数据分析、规律预测
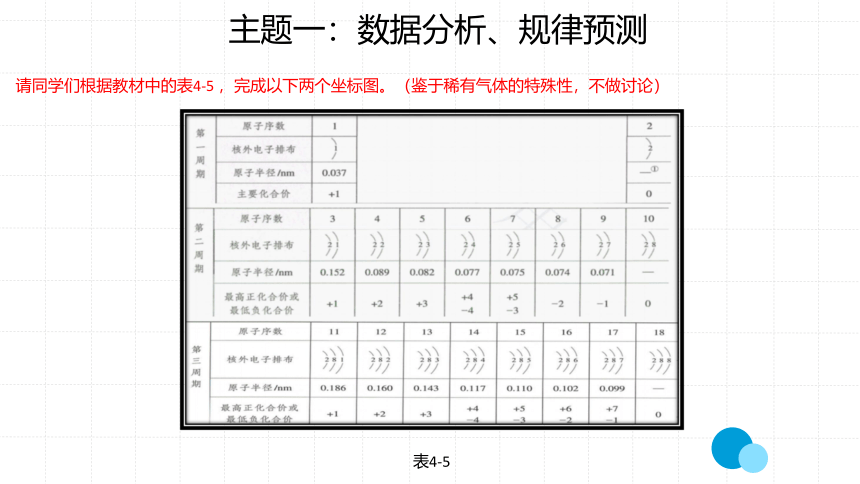
请同学们根据教材中的表4-5 ,完成以下两个坐标图。(鉴于稀有气体的特殊性,不做讨论)
表4-5
主题一:数据分析、规律预测
请观察教材中的表4-5,绘制折线图和柱状图,并从点(同主族元素)、线(同周期元素)、面(不同周期变化趋势)观察所得图形,分析其中规律,完成问题组相关问题。
1.以原子序数为横坐标,原子最外层电子数及化合价
(最高正价、最低负价)为纵坐标。
2.以原子序数为横坐标,原子半径为纵坐标。
主题一:数据分析、规律预测
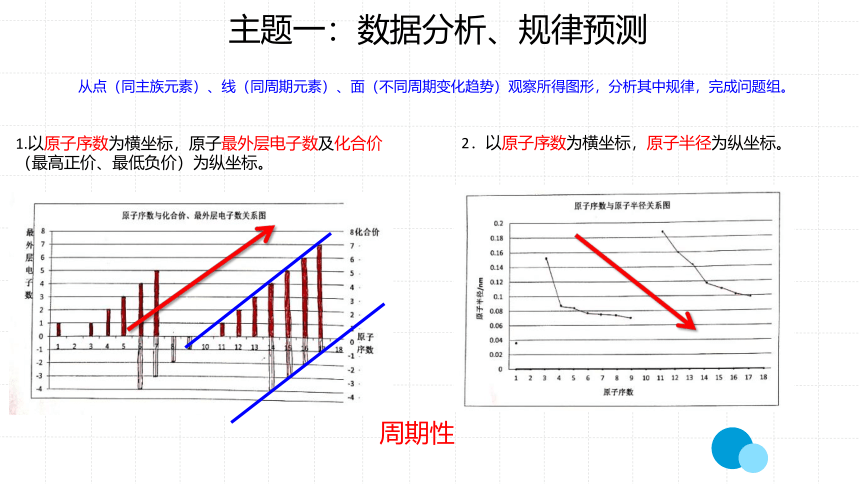
从点(同主族元素)、线(同周期元素)、面(不同周期变化趋势)观察所得图形,分析其中规律,完成问题组。
1.以原子序数为横坐标,原子最外层电子数及化合价
(最高正价、最低负价)为纵坐标。
2.以原子序数为横坐标,原子半径为纵坐标。
周期性
问题组:
1.元素原子最外层电子数是如何变化的?
2.元素原子的最高正化合价和最低负化合价是如何变化的?有没有内在联系?
3.元素原子的半径是如何变化的?
4.以上变化是连续的?还是呈现一定的周期性?
分析结果1:除氢和氦外,随着元素原子序数的递增,最外电子层上的电子数从1递增到8,元素原子最外层电子的排
布呈现周期性变化。
分析结果2:元素的主要化合价随着元子序数递增,化合价呈现周期性变化。
最外层电子数等于最高正化合价,最高正化合价和最低负化合价绝对值的代数和为8。
分析结果3:随着原子序数的递增,原子半径呈现从大到小的变化趋势,呈现周期性变化。
随着元素原子序数的递增,元素主要化合价、最外层电子数、原子半径等均呈现周期性变化。
规律预测
注:规律是共性问题,但要注意特殊性的存在。
主题二:实验验证、得出结论
基于以上数据分析,我们明确了,元素的微观角度的原子半径、最外层电子数乃至化合价,均随原子序数递增呈现出周期性变化,那宏观的金属性和非金属性是不是也具备这样的规律呢?
【实验探究1】
【实验探究2】
取一小段镁条,用砂纸除去表面的氧化膜,放到试管中。向试管中加入2mL水,并滴入2滴酚酞溶液,观察现象。过一会儿,加热试管至液体沸腾,观察现象。与钠和水的反应相比,镁和水的反应难易程度如何 生成了什么物质
向试管中加入2mL1mol/L的AlCl3溶液,然后滴加氨水,直到不再产生白色絮状Al(OH)3沉淀为止。将Al(OH)3沉淀分装在两只试管中,向一只试管中滴加2mol/L盐酸,向另一只试管中滴加2mol/LNaOH溶液,边滴加边振荡,观察现象。将氯化铝溶液换成氯化镁溶液,重复上述实验。
致密氧化膜
控制变量
实验报告
实验原理 实验现象 实验结论
金属单质与水(或酸)反应置换出氢气越容易, 金属性越强。 常温下镁与水的反应较缓慢,无明显气泡,镁条表面有一些红色;加热后反应剧烈,镁条表面有大量气泡,溶液变为红色。
钠的金属性强于镁的金属性
实验报告
实验原理 实验现象 实验结论
金属最高价氧化物对应的水化物(氢氧化物)的碱性越强,其对金属性越强。 氢氧化铝沉淀既溶于盐酸溶液又溶于氢氧化钠溶液;氢氧化镁沉淀只溶于盐酸溶液。
NaOH是强碱,Mg(OH)2是中强碱,而Al(OH)3是两性氢氧化物。
可以得出金属性:
Na>Mg>Al
主题二:实验验证、得出结论
【理论探究1】
【理论探究2】
科学事实:
Al(OH)3是两性氢氧化物,铝虽是金属,但已经表现出一定的非金属性。硅是一种灰黑色具有金属光泽的半导体材料。
规律不一定非得通过从零开始的实验探究得出,也可以分析归纳已经存在的科学事实得出。
科学事实:
依据非金属元素最高价氧化物对应水化物(最高价含氧酸)的酸性越强,其对应的非金属性越强。
非金属性顺序:Cl>S>P>Si
铝表现出一定的非金属性,硅表现出一定的金属性。
金属性和非金属性是逐渐过渡的。
通过以上4组科学探究活动,第三周期元素金属性非金属性如何变化?
第三周期元素,从左到右,随着原子序数的增加,金属性逐渐减弱,非金属性逐渐增强,且存在逐渐过渡。
元素的性质随着原子序数的递增而呈现周期性变化。
普适性
周期性
元素周期律
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
主题三:构建模型、学以致用
【思考】如何从原子结构角度解释元素性质的周期性变化,元素周期律有哪些应用?
19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br
VIII
Li Be
B C N O F
123
H
IIIA IVA VA VIA VIIA
IA
IIIB IVB VB VIB VIIB
IIA
Al Si P S Cl
IB IIB
Na Mg
非金属
金属
半导体
制备药物
非金属性逐渐增强
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
2019年底,一场突如其来的新冠肺炎疫情席卷武汉,蔓延湖北。牵动了全国人民的心,打乱了我们平静的生活。大批抗疫英雄不畏牺牲、勇敢逆行,这其中有一个不为人知的名字,它叫磷酸氯喹。正是由于它在治疗新冠肺炎中的巨大贡献,我们才得以快速稳定住局面。
磷酸氯喹
数据分析—预测规律—实验验证—得出结论—构建模型—学以致用
通过本课的学习,我们大家知道可以通过数据分析、证据推理等方法认识和研究对象的本质特征,从特殊到一般,建立“结构决定性质”的模型,并运用模型解释化学现象,揭示本质和规律。
解决问题的模型“结构决定性质”
【课堂作业】元素周期表和周期律的应用
门捷列夫在研究元素周期表时,科学地预言了11 种尚未发现的元素,为它们在周期表中留下了空位。例如,他认为在铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家发现了这种元素,将它命名为镓。镓的性质与门捷列夫推测的一样。门捷列夫还预测在硅和锡之间存在一种元素——“类硅”,15 年后该元素被德国化学家文克勒发现,为了纪念他的祖国,将其命名为“锗”。
1.门捷列夫作出这些伟大预言的科学依据是什么?
2.你能根据本节课所学知识,预测非金属元素砷(As)的性质吗?
试试看。
第二节 元 素 周 期 律
第一课时
人教版化学必修一第四章
2019年底,一场突如其来的新冠肺炎疫情席卷武汉,蔓延湖北。牵动了全国人民的心,打乱了我们平静的生活。大批抗疫英雄不畏牺牲、勇敢逆行,这其中有一个不为人知的名字,它叫磷酸氯喹。正是由于它在治疗新冠肺炎中的巨大贡献,我们才得以快速稳定住局面。
磷酸氯喹
主题一:数据分析、规律预测
请同学们根据教材中的表4-5 ,完成以下两个坐标图。(鉴于稀有气体的特殊性,不做讨论)
表4-5
主题一:数据分析、规律预测
请观察教材中的表4-5,绘制折线图和柱状图,并从点(同主族元素)、线(同周期元素)、面(不同周期变化趋势)观察所得图形,分析其中规律,完成问题组相关问题。
1.以原子序数为横坐标,原子最外层电子数及化合价
(最高正价、最低负价)为纵坐标。
2.以原子序数为横坐标,原子半径为纵坐标。
主题一:数据分析、规律预测
从点(同主族元素)、线(同周期元素)、面(不同周期变化趋势)观察所得图形,分析其中规律,完成问题组。
1.以原子序数为横坐标,原子最外层电子数及化合价
(最高正价、最低负价)为纵坐标。
2.以原子序数为横坐标,原子半径为纵坐标。
周期性
问题组:
1.元素原子最外层电子数是如何变化的?
2.元素原子的最高正化合价和最低负化合价是如何变化的?有没有内在联系?
3.元素原子的半径是如何变化的?
4.以上变化是连续的?还是呈现一定的周期性?
分析结果1:除氢和氦外,随着元素原子序数的递增,最外电子层上的电子数从1递增到8,元素原子最外层电子的排
布呈现周期性变化。
分析结果2:元素的主要化合价随着元子序数递增,化合价呈现周期性变化。
最外层电子数等于最高正化合价,最高正化合价和最低负化合价绝对值的代数和为8。
分析结果3:随着原子序数的递增,原子半径呈现从大到小的变化趋势,呈现周期性变化。
随着元素原子序数的递增,元素主要化合价、最外层电子数、原子半径等均呈现周期性变化。
规律预测
注:规律是共性问题,但要注意特殊性的存在。
主题二:实验验证、得出结论
基于以上数据分析,我们明确了,元素的微观角度的原子半径、最外层电子数乃至化合价,均随原子序数递增呈现出周期性变化,那宏观的金属性和非金属性是不是也具备这样的规律呢?
【实验探究1】
【实验探究2】
取一小段镁条,用砂纸除去表面的氧化膜,放到试管中。向试管中加入2mL水,并滴入2滴酚酞溶液,观察现象。过一会儿,加热试管至液体沸腾,观察现象。与钠和水的反应相比,镁和水的反应难易程度如何 生成了什么物质
向试管中加入2mL1mol/L的AlCl3溶液,然后滴加氨水,直到不再产生白色絮状Al(OH)3沉淀为止。将Al(OH)3沉淀分装在两只试管中,向一只试管中滴加2mol/L盐酸,向另一只试管中滴加2mol/LNaOH溶液,边滴加边振荡,观察现象。将氯化铝溶液换成氯化镁溶液,重复上述实验。
致密氧化膜
控制变量
实验报告
实验原理 实验现象 实验结论
金属单质与水(或酸)反应置换出氢气越容易, 金属性越强。 常温下镁与水的反应较缓慢,无明显气泡,镁条表面有一些红色;加热后反应剧烈,镁条表面有大量气泡,溶液变为红色。
钠的金属性强于镁的金属性
实验报告
实验原理 实验现象 实验结论
金属最高价氧化物对应的水化物(氢氧化物)的碱性越强,其对金属性越强。 氢氧化铝沉淀既溶于盐酸溶液又溶于氢氧化钠溶液;氢氧化镁沉淀只溶于盐酸溶液。
NaOH是强碱,Mg(OH)2是中强碱,而Al(OH)3是两性氢氧化物。
可以得出金属性:
Na>Mg>Al
主题二:实验验证、得出结论
【理论探究1】
【理论探究2】
科学事实:
Al(OH)3是两性氢氧化物,铝虽是金属,但已经表现出一定的非金属性。硅是一种灰黑色具有金属光泽的半导体材料。
规律不一定非得通过从零开始的实验探究得出,也可以分析归纳已经存在的科学事实得出。
科学事实:
依据非金属元素最高价氧化物对应水化物(最高价含氧酸)的酸性越强,其对应的非金属性越强。
非金属性顺序:Cl>S>P>Si
铝表现出一定的非金属性,硅表现出一定的金属性。
金属性和非金属性是逐渐过渡的。
通过以上4组科学探究活动,第三周期元素金属性非金属性如何变化?
第三周期元素,从左到右,随着原子序数的增加,金属性逐渐减弱,非金属性逐渐增强,且存在逐渐过渡。
元素的性质随着原子序数的递增而呈现周期性变化。
普适性
周期性
元素周期律
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
主题三:构建模型、学以致用
【思考】如何从原子结构角度解释元素性质的周期性变化,元素周期律有哪些应用?
19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br
VIII
Li Be
B C N O F
123
H
IIIA IVA VA VIA VIIA
IA
IIIB IVB VB VIB VIIB
IIA
Al Si P S Cl
IB IIB
Na Mg
非金属
金属
半导体
制备药物
非金属性逐渐增强
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
2019年底,一场突如其来的新冠肺炎疫情席卷武汉,蔓延湖北。牵动了全国人民的心,打乱了我们平静的生活。大批抗疫英雄不畏牺牲、勇敢逆行,这其中有一个不为人知的名字,它叫磷酸氯喹。正是由于它在治疗新冠肺炎中的巨大贡献,我们才得以快速稳定住局面。
磷酸氯喹
数据分析—预测规律—实验验证—得出结论—构建模型—学以致用
通过本课的学习,我们大家知道可以通过数据分析、证据推理等方法认识和研究对象的本质特征,从特殊到一般,建立“结构决定性质”的模型,并运用模型解释化学现象,揭示本质和规律。
解决问题的模型“结构决定性质”
【课堂作业】元素周期表和周期律的应用
门捷列夫在研究元素周期表时,科学地预言了11 种尚未发现的元素,为它们在周期表中留下了空位。例如,他认为在铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家发现了这种元素,将它命名为镓。镓的性质与门捷列夫推测的一样。门捷列夫还预测在硅和锡之间存在一种元素——“类硅”,15 年后该元素被德国化学家文克勒发现,为了纪念他的祖国,将其命名为“锗”。
1.门捷列夫作出这些伟大预言的科学依据是什么?
2.你能根据本节课所学知识,预测非金属元素砷(As)的性质吗?
试试看。
