2022-2023学年 化学京改版(2013)---溶液 单元测试(有答案)
文档属性
| 名称 | 2022-2023学年 化学京改版(2013)---溶液 单元测试(有答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 170.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-06 22:39:40 | ||
图片预览



文档简介
2022-2023学年化学京改版(2013)---溶液
一、单选题
1.溶液在生产生活中有着广泛的应用,下列溶液中溶剂不是水的是( )
A.碘酒 B.盐酸 C.氯化钠溶液 D.酒精溶液
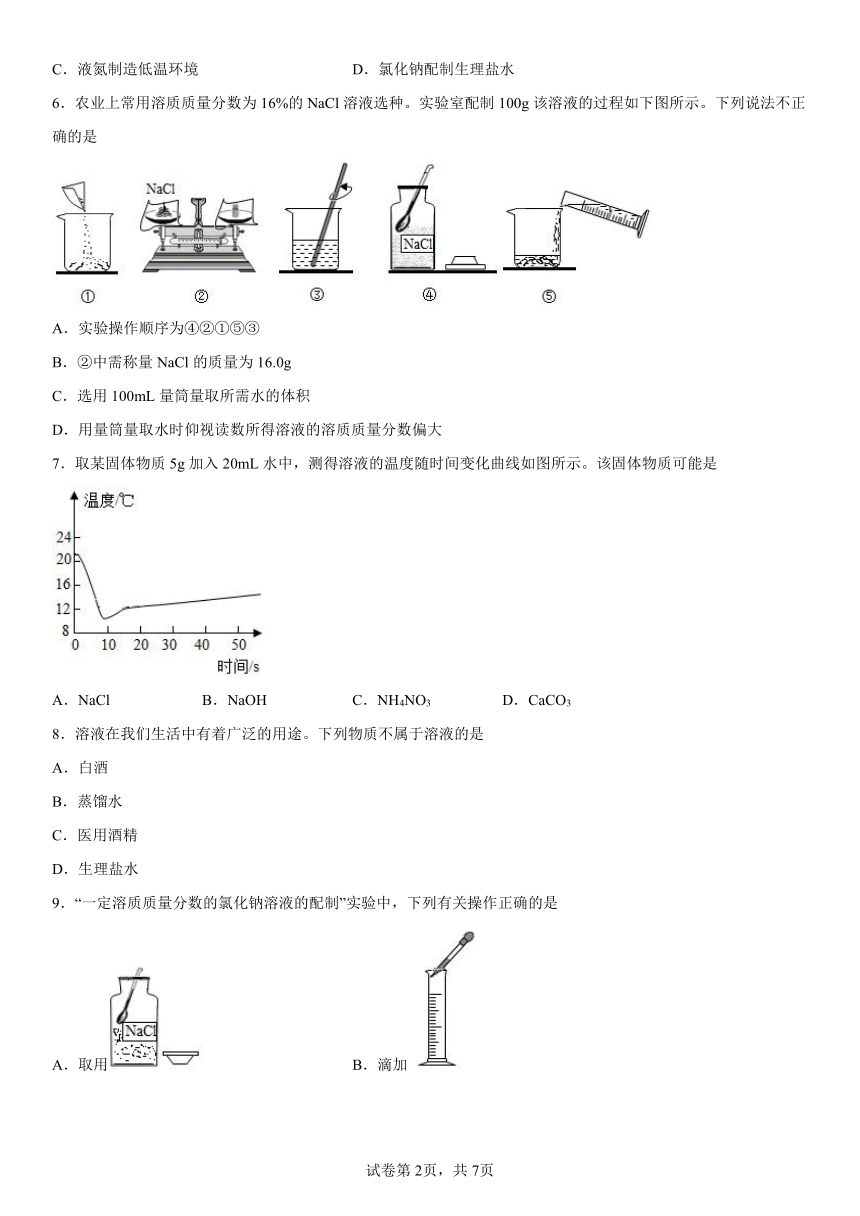
2.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
3.现有一接近饱和的溶液,下列方法中一定能使之成为饱和溶液的是 ( )
①蒸发溶剂,②增加溶质,③降低温度,④加热升温
A.只有①② B.只有②③ C.①②③ D.①②④
4.配制70克16%的 NaCl溶液,下列操作会使所配溶液溶质质量分数大于16%的是
A.称取氯化钠 B.转移氯化钠
C.量取水 D.配好后装瓶
5.下列物质用途主要由化学性质决定的是
A.稀有气体作电光源 B.生石灰用于食品加热
C.液氮制造低温环境 D.氯化钠配制生理盐水
6.农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法不正确的是
A.实验操作顺序为④②①⑤③
B.②中需称量NaCl的质量为16.0g
C.选用100mL量筒量取所需水的体积
D.用量筒量取水时仰视读数所得溶液的溶质质量分数偏大
7.取某固体物质5g加入20mL水中,测得溶液的温度随时间变化曲线如图所示。该固体物质可能是
A.NaCl B.NaOH C.NH4NO3 D.CaCO3
8.溶液在我们生活中有着广泛的用途。下列物质不属于溶液的是
A.白酒
B.蒸馏水
C.医用酒精
D.生理盐水
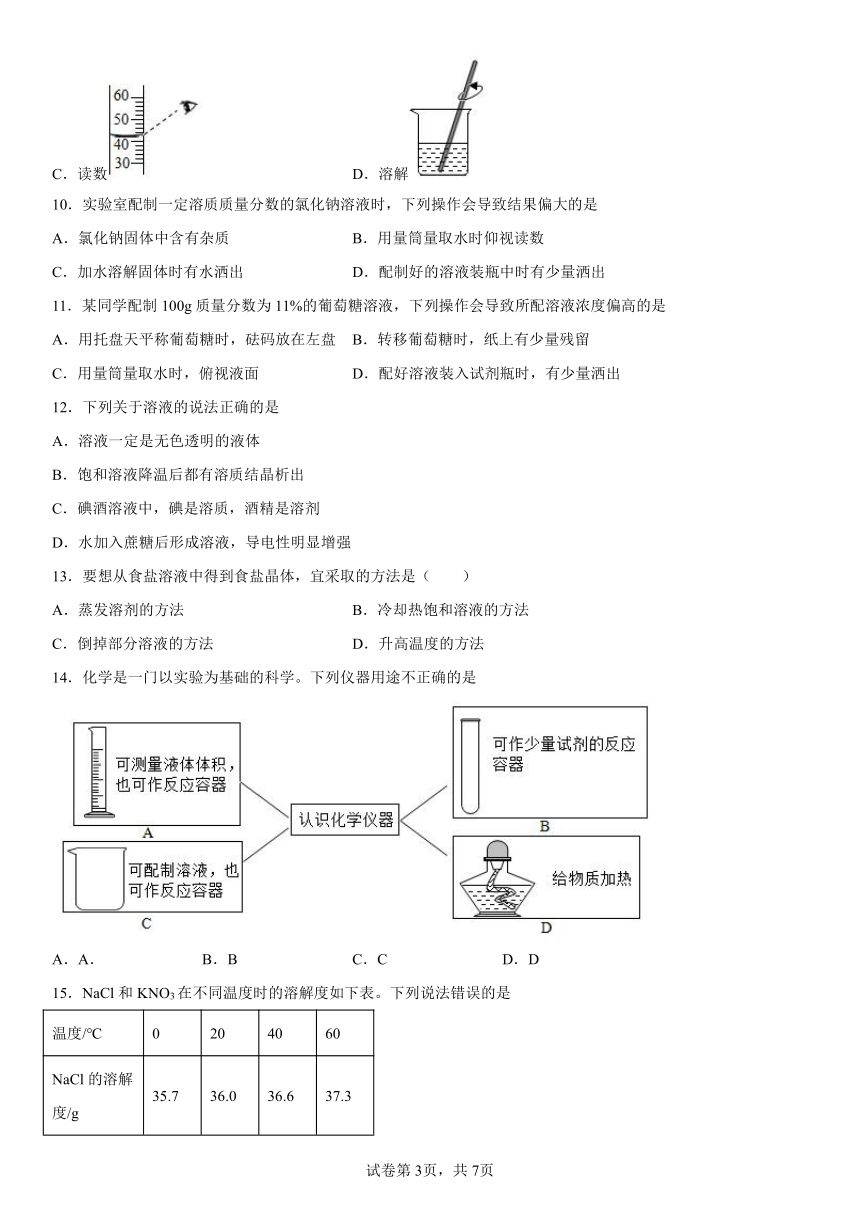
9.“一定溶质质量分数的氯化钠溶液的配制”实验中,下列有关操作正确的是
A.取用 B.滴加
C.读数 D.溶解
10.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏大的是
A.氯化钠固体中含有杂质 B.用量筒量取水时仰视读数
C.加水溶解固体时有水洒出 D.配制好的溶液装瓶中时有少量洒出
11.某同学配制100g质量分数为11%的葡萄糖溶液,下列操作会导致所配溶液浓度偏高的是
A.用托盘天平称葡萄糖时,砝码放在左盘 B.转移葡萄糖时,纸上有少量残留
C.用量筒量取水时,俯视液面 D.配好溶液装入试剂瓶时,有少量洒出
12.下列关于溶液的说法正确的是
A.溶液一定是无色透明的液体
B.饱和溶液降温后都有溶质结晶析出
C.碘酒溶液中,碘是溶质,酒精是溶剂
D.水加入蔗糖后形成溶液,导电性明显增强
13.要想从食盐溶液中得到食盐晶体,宜采取的方法是( )
A.蒸发溶剂的方法 B.冷却热饱和溶液的方法
C.倒掉部分溶液的方法 D.升高温度的方法
14.化学是一门以实验为基础的科学。下列仪器用途不正确的是
A.A. B.B C.C D.D
15.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是
温度/℃ 0 20 40 60
NaCl的溶解度/g 35.7 36.0 36.6 37.3
KNO3的溶解度/g 13.3 31.6 63.9 110
A.20℃时,100gH2O最多能溶解36.0gNaCl
B.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
二、填空题
16.小华在饮用碳酸饮料时。发现有大量气泡溢出。他联系学过的知识从不同角度加以解释。从物理变化的角度解释为_____________________。从化学变化的角度解释为_____________________(化学方程式表示)。
17.甲、乙两种物质的溶解度曲线如图所示,请回答下列问题:
(1)要使接近饱和的甲溶液变成饱和溶液,可采用的方法有_______(写一种)。
(2)将30℃时等质量的甲、乙的饱和溶液分别降温至t1℃,它们析出晶体(晶体中不含结晶水)的质量关系是_______(填“甲>乙”“甲<乙”或“甲=乙”)
18.在实验室,用溶质质量分数为6%的氯化钠溶液配制50g溶质质量分数为3%的氯化钠溶液,回答下列问题
(1)需溶质质量分数为6%的氯化钠溶液______g。
(2)若用量筒量取水时仰视读数,而其它操作均正确,则所得溶液中溶质质量分数_____(选填“大于”“小于”或“等于”)3%。
(3)混匀时用到的玻璃仪器由烧杯、______。
19.如图是硝酸钾(KNO3)和氯化钾(KC1)的溶解度曲线,请回答下列问题。
(1)10℃时,KNO3和KCl的溶解度大小关系是:KNO3________KCl(填“>”“<”或“=”)。
(2)60℃时,将120g KNO3固体放入100g水中,充分溶解后,所得溶液的质量为________g。
(3)KNO3中混有少量的KCl,可用______________的方法提纯KNO3。
(4)据题图,下列有关说法正确的是______________。
a.KCl的不饱和溶液只能采用蒸发溶剂的方法才可变成饱和溶液
b.60℃时,KNO3溶液的溶质质量分数一定比KCl溶液的大
c.将60℃时KNO3和KC1两种溶液分别降温至10℃,析出晶体较多的是KNO3溶液
d.60℃时,从KNO3和KC1两种饱和溶液中获得等质量晶体,蒸发水较多的是KC1溶液
20.用氢氧化钠固体和水配制3%的氢氧化钠溶液,若量取水时仰视读数,其它操作均正确,则配制的氢氧化钠溶液中溶质质量分数____________3%(填“>”“<”或“=”)。实验室中可以通过____________的方法将硬水软化。
三、推断题
21.碳酸钾广泛应用于玻璃、纺织印染和肥皂生产等领域,制取碳酸钾的工艺流程示意图如图:
温度/℃ 0 10 20 30 40 60 80 100
K2CO3的溶解度/g 107.0 109.0 111.0 114.0 117.0 126.0 139.0 156.0
KCl的溶解度/g 28 31 34 37 40 45 51 56
根据如图图表信息,回答下列问题:
(1)生成碳酸钾的化学方程式为______。
(2)上述流程中可循环使用的物质是______,NH4Cl在农业上可用作______。
(3)得到K2CO3晶浆的结晶方法是______。
(4)上述流程中洗涤K2CO3晶体应选用______(填序号)。
①NH4Cl溶液 ②热水 ③饱和K2CO3溶液
(5)往40℃700g氯化钾饱和溶液中,不断通入氨气和二氧化碳,控制温度在60~80℃之间,充分吸收混合。在有机萃取后,冷却至20℃时,理论上能得到K2CO3晶体______g。(忽略实验过程中的水分蒸发,结果保留整数)
(6)某CaCl2中混有KCl杂质,简述提纯该CaCl2的实验操作:______。
四、流程题
22.粗盐中除NaCl外还含有MgSO4以及泥沙等杂质。初步提纯粗盐的实验流程如下:
(1)“滤渣”是粗盐中含有的_______。
(2)实验过程中四次用到玻璃棒,分别是:
第一次:溶解时搅拌;
第二次:_______;
第三次:_______;
第四次:将精盐从蒸发皿转移出来。
(3)本实验从滤液得到精盐,采用的是蒸发溶剂的方法而不用降低溶液温度的方法,参考溶解度曲线图分析的原因:______
(4)看图可知,20时NaCl的溶解度为___g,本实验溶解3.6g的粗盐,蒸馏水的最佳使用量约为___ml.增加蒸馏水的用量虽然能加快粗盐的溶解,但会引起的不良后果是____。
五、计算题
23.某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为64.5g.
(1)反应中生成多少克二氧化碳__________?
(2)通过计算说明实际钙含量是否与标注相符__________?
(3)试计算所用稀盐酸的溶质质量分数__________。
24.化学与生活息息相关。如图是某输液瓶标签上的部分内容。由此可知:
(1)葡萄糖由______种元素组成。
(2)葡萄糖的相对分子质量为______。
(3)要把10g这种葡萄糖稀释为2%的溶液,需要加入水的质量为______g。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.A
4.C
5.B
6.D
7.C
8.B
9.D
10.C
11.C
12.C
13.A
14.A
15.C
16. 气体溶解度随压强减小而减小,打开饮料瓶塞,气压减小,二氧化碳溶解度降低,所以有大量气泡冒出 H2CO3====CO2↑+H2O
17.(1)降低温度或加溶质或蒸发溶剂
(2)甲>乙
18. 25 小于 玻璃棒
19. < 210g 冷却结晶 d
20. < 蒸馏
21.(1)
(2) 有机萃剂 氮肥
(3)蒸发结晶
(4)③
(5)185
(6)加入足量的碳酸钾,过滤、洗涤,往滤渣中加入适量的稀盐酸,蒸发结晶的氯化钙
22. 泥沙 过滤时引流 蒸发时搅拌 氯化钠的溶解度受温度影响不大 36 10 不利于后续蒸发溶剂,蒸发溶剂时间会大大延长,消耗燃料
23. 5.5g 不相符 18.25%
24.(1)3
(2)180
(3)15
答案第1页,共2页
答案第1页,共2页
一、单选题
1.溶液在生产生活中有着广泛的应用,下列溶液中溶剂不是水的是( )
A.碘酒 B.盐酸 C.氯化钠溶液 D.酒精溶液
2.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
3.现有一接近饱和的溶液,下列方法中一定能使之成为饱和溶液的是 ( )
①蒸发溶剂,②增加溶质,③降低温度,④加热升温
A.只有①② B.只有②③ C.①②③ D.①②④
4.配制70克16%的 NaCl溶液,下列操作会使所配溶液溶质质量分数大于16%的是
A.称取氯化钠 B.转移氯化钠
C.量取水 D.配好后装瓶
5.下列物质用途主要由化学性质决定的是
A.稀有气体作电光源 B.生石灰用于食品加热
C.液氮制造低温环境 D.氯化钠配制生理盐水
6.农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法不正确的是
A.实验操作顺序为④②①⑤③
B.②中需称量NaCl的质量为16.0g
C.选用100mL量筒量取所需水的体积
D.用量筒量取水时仰视读数所得溶液的溶质质量分数偏大
7.取某固体物质5g加入20mL水中,测得溶液的温度随时间变化曲线如图所示。该固体物质可能是
A.NaCl B.NaOH C.NH4NO3 D.CaCO3
8.溶液在我们生活中有着广泛的用途。下列物质不属于溶液的是
A.白酒
B.蒸馏水
C.医用酒精
D.生理盐水
9.“一定溶质质量分数的氯化钠溶液的配制”实验中,下列有关操作正确的是
A.取用 B.滴加
C.读数 D.溶解
10.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏大的是
A.氯化钠固体中含有杂质 B.用量筒量取水时仰视读数
C.加水溶解固体时有水洒出 D.配制好的溶液装瓶中时有少量洒出
11.某同学配制100g质量分数为11%的葡萄糖溶液,下列操作会导致所配溶液浓度偏高的是
A.用托盘天平称葡萄糖时,砝码放在左盘 B.转移葡萄糖时,纸上有少量残留
C.用量筒量取水时,俯视液面 D.配好溶液装入试剂瓶时,有少量洒出
12.下列关于溶液的说法正确的是
A.溶液一定是无色透明的液体
B.饱和溶液降温后都有溶质结晶析出
C.碘酒溶液中,碘是溶质,酒精是溶剂
D.水加入蔗糖后形成溶液,导电性明显增强
13.要想从食盐溶液中得到食盐晶体,宜采取的方法是( )
A.蒸发溶剂的方法 B.冷却热饱和溶液的方法
C.倒掉部分溶液的方法 D.升高温度的方法
14.化学是一门以实验为基础的科学。下列仪器用途不正确的是
A.A. B.B C.C D.D
15.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是
温度/℃ 0 20 40 60
NaCl的溶解度/g 35.7 36.0 36.6 37.3
KNO3的溶解度/g 13.3 31.6 63.9 110
A.20℃时,100gH2O最多能溶解36.0gNaCl
B.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
二、填空题
16.小华在饮用碳酸饮料时。发现有大量气泡溢出。他联系学过的知识从不同角度加以解释。从物理变化的角度解释为_____________________。从化学变化的角度解释为_____________________(化学方程式表示)。
17.甲、乙两种物质的溶解度曲线如图所示,请回答下列问题:
(1)要使接近饱和的甲溶液变成饱和溶液,可采用的方法有_______(写一种)。
(2)将30℃时等质量的甲、乙的饱和溶液分别降温至t1℃,它们析出晶体(晶体中不含结晶水)的质量关系是_______(填“甲>乙”“甲<乙”或“甲=乙”)
18.在实验室,用溶质质量分数为6%的氯化钠溶液配制50g溶质质量分数为3%的氯化钠溶液,回答下列问题
(1)需溶质质量分数为6%的氯化钠溶液______g。
(2)若用量筒量取水时仰视读数,而其它操作均正确,则所得溶液中溶质质量分数_____(选填“大于”“小于”或“等于”)3%。
(3)混匀时用到的玻璃仪器由烧杯、______。
19.如图是硝酸钾(KNO3)和氯化钾(KC1)的溶解度曲线,请回答下列问题。
(1)10℃时,KNO3和KCl的溶解度大小关系是:KNO3________KCl(填“>”“<”或“=”)。
(2)60℃时,将120g KNO3固体放入100g水中,充分溶解后,所得溶液的质量为________g。
(3)KNO3中混有少量的KCl,可用______________的方法提纯KNO3。
(4)据题图,下列有关说法正确的是______________。
a.KCl的不饱和溶液只能采用蒸发溶剂的方法才可变成饱和溶液
b.60℃时,KNO3溶液的溶质质量分数一定比KCl溶液的大
c.将60℃时KNO3和KC1两种溶液分别降温至10℃,析出晶体较多的是KNO3溶液
d.60℃时,从KNO3和KC1两种饱和溶液中获得等质量晶体,蒸发水较多的是KC1溶液
20.用氢氧化钠固体和水配制3%的氢氧化钠溶液,若量取水时仰视读数,其它操作均正确,则配制的氢氧化钠溶液中溶质质量分数____________3%(填“>”“<”或“=”)。实验室中可以通过____________的方法将硬水软化。
三、推断题
21.碳酸钾广泛应用于玻璃、纺织印染和肥皂生产等领域,制取碳酸钾的工艺流程示意图如图:
温度/℃ 0 10 20 30 40 60 80 100
K2CO3的溶解度/g 107.0 109.0 111.0 114.0 117.0 126.0 139.0 156.0
KCl的溶解度/g 28 31 34 37 40 45 51 56
根据如图图表信息,回答下列问题:
(1)生成碳酸钾的化学方程式为______。
(2)上述流程中可循环使用的物质是______,NH4Cl在农业上可用作______。
(3)得到K2CO3晶浆的结晶方法是______。
(4)上述流程中洗涤K2CO3晶体应选用______(填序号)。
①NH4Cl溶液 ②热水 ③饱和K2CO3溶液
(5)往40℃700g氯化钾饱和溶液中,不断通入氨气和二氧化碳,控制温度在60~80℃之间,充分吸收混合。在有机萃取后,冷却至20℃时,理论上能得到K2CO3晶体______g。(忽略实验过程中的水分蒸发,结果保留整数)
(6)某CaCl2中混有KCl杂质,简述提纯该CaCl2的实验操作:______。
四、流程题
22.粗盐中除NaCl外还含有MgSO4以及泥沙等杂质。初步提纯粗盐的实验流程如下:
(1)“滤渣”是粗盐中含有的_______。
(2)实验过程中四次用到玻璃棒,分别是:
第一次:溶解时搅拌;
第二次:_______;
第三次:_______;
第四次:将精盐从蒸发皿转移出来。
(3)本实验从滤液得到精盐,采用的是蒸发溶剂的方法而不用降低溶液温度的方法,参考溶解度曲线图分析的原因:______
(4)看图可知,20时NaCl的溶解度为___g,本实验溶解3.6g的粗盐,蒸馏水的最佳使用量约为___ml.增加蒸馏水的用量虽然能加快粗盐的溶解,但会引起的不良后果是____。
五、计算题
23.某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为64.5g.
(1)反应中生成多少克二氧化碳__________?
(2)通过计算说明实际钙含量是否与标注相符__________?
(3)试计算所用稀盐酸的溶质质量分数__________。
24.化学与生活息息相关。如图是某输液瓶标签上的部分内容。由此可知:
(1)葡萄糖由______种元素组成。
(2)葡萄糖的相对分子质量为______。
(3)要把10g这种葡萄糖稀释为2%的溶液,需要加入水的质量为______g。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.A
4.C
5.B
6.D
7.C
8.B
9.D
10.C
11.C
12.C
13.A
14.A
15.C
16. 气体溶解度随压强减小而减小,打开饮料瓶塞,气压减小,二氧化碳溶解度降低,所以有大量气泡冒出 H2CO3====CO2↑+H2O
17.(1)降低温度或加溶质或蒸发溶剂
(2)甲>乙
18. 25 小于 玻璃棒
19. < 210g 冷却结晶 d
20. < 蒸馏
21.(1)
(2) 有机萃剂 氮肥
(3)蒸发结晶
(4)③
(5)185
(6)加入足量的碳酸钾,过滤、洗涤,往滤渣中加入适量的稀盐酸,蒸发结晶的氯化钙
22. 泥沙 过滤时引流 蒸发时搅拌 氯化钠的溶解度受温度影响不大 36 10 不利于后续蒸发溶剂,蒸发溶剂时间会大大延长,消耗燃料
23. 5.5g 不相符 18.25%
24.(1)3
(2)180
(3)15
答案第1页,共2页
答案第1页,共2页
