化学人教版(2019)选择性必修1 3.3.3盐溶液中离子浓度间的关系(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.3.3盐溶液中离子浓度间的关系(共19张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 616.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-07 00:00:00 | ||
图片预览




文档简介
(共19张PPT)
第三节 盐类的水解
第三课时 盐溶液中离子浓度间的关系
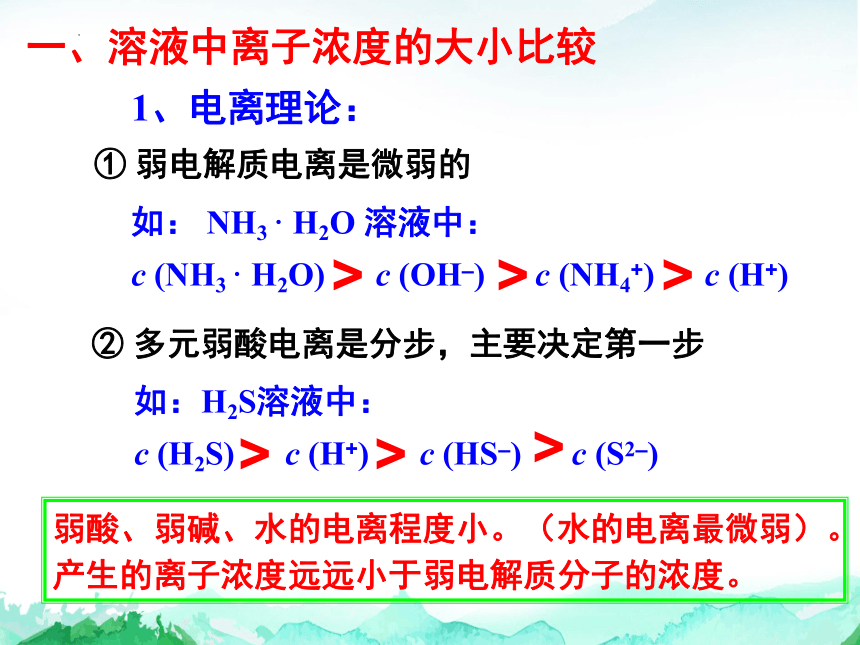
一、溶液中离子浓度的大小比较
1、电离理论:
② 多元弱酸电离是分步,主要决定第一步
① 弱电解质电离是微弱的
如: NH3 · H2O 溶液中:
c (NH3 · H2O) c (OH–) c (NH4+) c (H+)
如:H2S溶液中:
c (H2S) c (H+) c (HS–) c (S2–)
>
>
>
>
>
>
弱酸、弱碱、水的电离程度小。(水的电离最微弱)。产生的离子浓度远远小于弱电解质分子的浓度。
2、水解理论:
① 弱离子由于水解而损耗。
如:KAl(SO4)2 溶液中:c (K+) c (Al3+)
② 水解是微弱
③ 多元弱酸水解是分步,主要决定第一步
c (Cl–) c (NH4+) c (H+) c (NH3·H2O) c (OH–)
如:Na2CO3 溶液中:
c (CO3–) c (HCO3–) c (H2CO3)
>
>
>
>
>
>
如:NH4Cl 溶液中:
(六)溶液中离子浓度的大小比较:
盐电离后要考虑水解!(电离和水解都是微弱的)
但水的电离程度远远小于盐的水解程度
>
④多元弱酸酸式盐溶液—根据电离和水解的相对大小来判断
例题:在NaHCO3溶液中各离子的浓度由大到小的排列是:
c(Na+)>c(HCO3-)> c(OH-) >c(H+)>c(CO32-)
c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
NaHSO3溶液(显酸性)中离子浓度由大到小的顺序 :
3、相同浓度的下列溶液中,c(NH4+)的大小关系依次为 。
①NH4Cl ②(NH4)2SO4 ③ NH4HSO4
④NH4HCO3 ⑤(NH4)2CO3
4、Na2CO3溶液中离子浓度大小顺序为:
。
② > ⑤ >③ > ① >④
练习
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
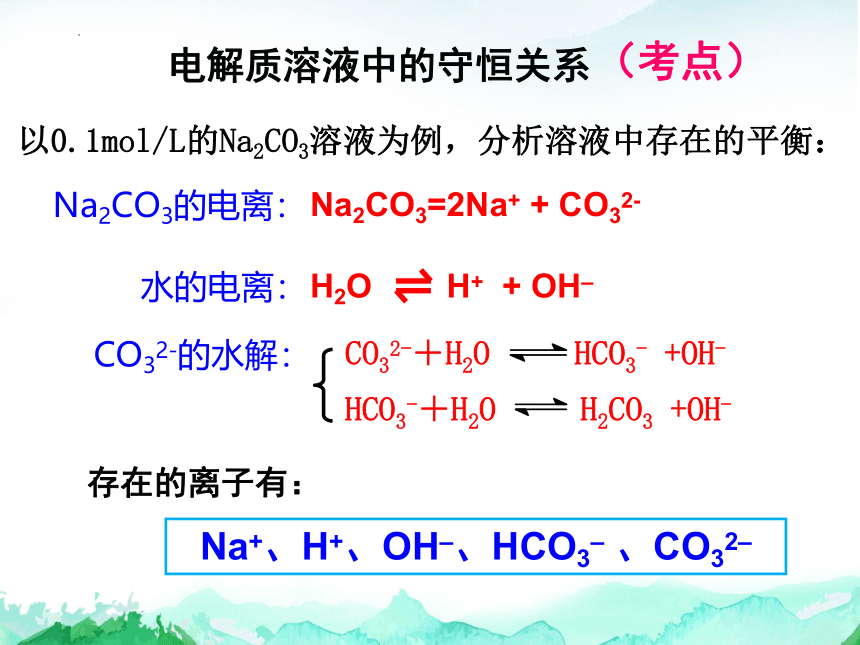
电解质溶液中的守恒关系
以0.1mol/L的Na2CO3溶液为例,分析溶液中存在的平衡:
Na2CO3的电离:
水的电离:
CO32-的水解:
存在的离子有:
CO32-+H2O HCO3- +OH-
HCO3-+H2O H2CO3 +OH-
H2O H+ + OH–
Na2CO3=2Na+ + CO32-
Na+、H+、OH–、HCO3– 、CO32–
(考点)
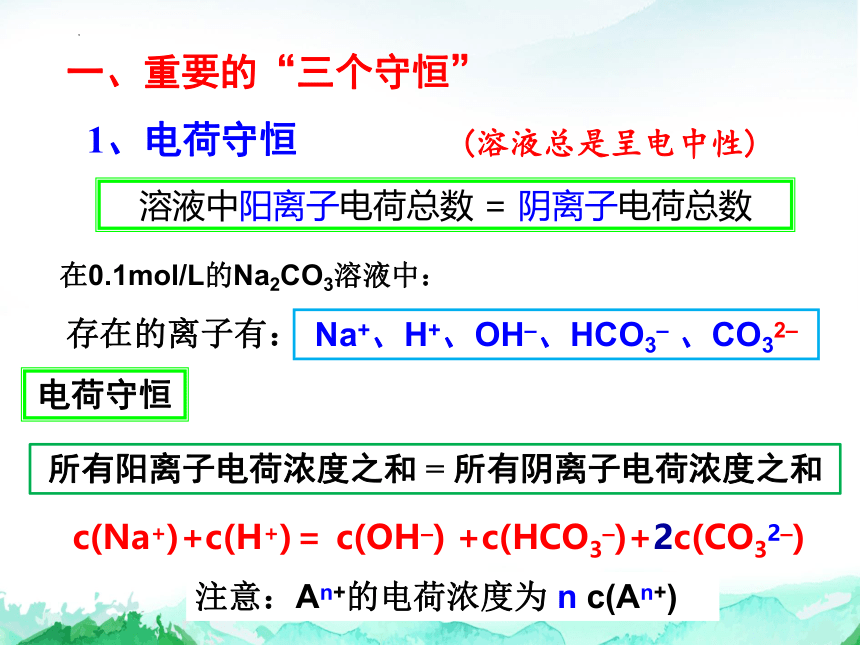
一、重要的“三个守恒”
1、电荷守恒
溶液中阳离子电荷总数 = 阴离子电荷总数
在0.1mol/L的Na2CO3溶液中:
存在的离子有:
c(Na+)+c(H+)= c(OH–) +c(HCO3–)+2c(CO32–)
电荷守恒
Na+、H+、OH–、HCO3– 、CO32–
(溶液总是呈电中性)
所有阳离子电荷浓度之和 = 所有阴离子电荷浓度之和
注意:An+的电荷浓度为 n c(An+)
c (Na+ ) + c ( H+ ) = c ( OH– ) + 2c ( S2–) + c ( HS– )
正电荷总数浓度之和 = 负电荷总数浓度之和
如:Na2S 溶液
Na2S = 2Na+ + S2- H2O H+ + OH–
S2– + H2O HS– + OH–
HS– + H2O H2S + OH–
2、物料守恒
(元素质量守恒或原子守恒)
电解质溶液中,由于电离和水解,离子种类增多,但某些关键性的原子和其原子团总是守恒的。
在0.1mol/L的Na2CO3溶液中:
c (Na+) = 0.2 mol/L
c(CO32-)+c(HCO3-)+ c(H2CO3)=0.1mol/L
c(Na+)=2c(CO32-)+2c(HCO3-)+ 2c(H2CO3)
物料守恒
碳元素质量守恒:
电解质溶液中某一组份的起始浓度应等于它在溶液中各种存在形式的浓度之和.
试一试:写出Na2S 溶液中的物料守恒关系。
3、质子(H+)守恒
电解质溶液中分子(H2O)或弱离子得到或失去质子(H+)的物质的量应相等。
在Na2CO3溶液中:
c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
质子守恒
注意:电荷守恒与物料守恒两式联立也可得质子守恒。
得质子
失质子
① NaHCO3溶液,pH﹥7:
电荷守恒:
c(Na+)+c(H+)=2c(CO32-)+C(HCO3-)+c(OH-)
物料守恒:
c(Na+)=c(CO32-)+C(HCO3-)+C(H2CO3)
质子守恒:
c(OH-)+c(CO32-)=c(H+)+C(H2CO3)
课后作业:
根据三大守恒写出NaHCO3、 CH3COONa、NH4Cl的浓度之间的关系式。
③ NH4Cl溶液,pH﹤7:
电荷守恒:c(NH4+)+c(H+)=c( Cl-)+c(OH-)
物料守恒:c ( Cl-)=c(NH4+)+c(NH3·H2O)
质子守恒:c(OH-)+c(NH3·H2O)=c(H+)
② CH3COONa溶液,pH﹥7
电荷守恒
c ( Na+)+c(H+)=c(CH3COO-)+c(OH-)
物料守恒:
c( Na+)=c(CH3COO-)+c(CH3COOH)
质子守恒:
c( OH-)=c(H+)+c(CH3COOH)
C
4. 两种溶液混合后不同离子浓度的比较:
对策:
①首先考虑电荷守恒;
②然后考虑离子间的反应;
③再次酸、碱混合时考虑是完全反应还是一种过量;
④生成的盐与过量的酸或碱若是等物质的量混合时要考虑是电离为主还是水解为主。
例:用物质的量都是0.1 mol的CH3COOH与CH3COONa配成1 L混合溶液,已知其中c(CH3COO-) 大于c(Na+),对该混合溶液下列判断正确的是( )
A. c(H+)>c(OH-)
B. c(CH3COOH)+c(CH3COO-)=0.2 mol/L
C. c(CH3COOH)>c(CH3COO-)
D. c(CH3COO-)+c(OH-)=0.1 mol/L
⑴两种物质混合不反应:
AB
⑵两种物质恰好完全反应:
在10ml 0.1mol·L-1NaOH溶液中加入同体积、同浓度CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是( )
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(Na+)=c(CH3COO-)+c(CH3COOH)
D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
A
例:将0.4 mol/L NH4Cl溶液和0.2 mol/L NaOH溶液等体积混合后,溶液中下列微粒的物质的量关系正确的是( )
A. c(NH4+)=c(Na+)=c(OH-)>c(NH3·H2O)
B. c(NH4+)=c(Na+)>c(NH3·H2O) >c(OH-)>c(H+)
C. c(NH4+)>c(Na+)>c(OH-)>c(NH3·H2O)
D. c(NH4+)>c(Na+)>c(NH3·H2O) >c(OH-)>c(H+)
D
⑶两种物质反应,其中一种有剩余:
(1)离子浓度大小:__________________________________。
(2)电荷守恒式: __ 。
(3)能否写出物料守恒式___(填“能”或“否”)。
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
否
pH=2的CH3COOH与pH=12的NaOH等体积混合
c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
【练习】
第三节 盐类的水解
第三课时 盐溶液中离子浓度间的关系
一、溶液中离子浓度的大小比较
1、电离理论:
② 多元弱酸电离是分步,主要决定第一步
① 弱电解质电离是微弱的
如: NH3 · H2O 溶液中:
c (NH3 · H2O) c (OH–) c (NH4+) c (H+)
如:H2S溶液中:
c (H2S) c (H+) c (HS–) c (S2–)
>
>
>
>
>
>
弱酸、弱碱、水的电离程度小。(水的电离最微弱)。产生的离子浓度远远小于弱电解质分子的浓度。
2、水解理论:
① 弱离子由于水解而损耗。
如:KAl(SO4)2 溶液中:c (K+) c (Al3+)
② 水解是微弱
③ 多元弱酸水解是分步,主要决定第一步
c (Cl–) c (NH4+) c (H+) c (NH3·H2O) c (OH–)
如:Na2CO3 溶液中:
c (CO3–) c (HCO3–) c (H2CO3)
>
>
>
>
>
>
如:NH4Cl 溶液中:
(六)溶液中离子浓度的大小比较:
盐电离后要考虑水解!(电离和水解都是微弱的)
但水的电离程度远远小于盐的水解程度
>
④多元弱酸酸式盐溶液—根据电离和水解的相对大小来判断
例题:在NaHCO3溶液中各离子的浓度由大到小的排列是:
c(Na+)>c(HCO3-)> c(OH-) >c(H+)>c(CO32-)
c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
NaHSO3溶液(显酸性)中离子浓度由大到小的顺序 :
3、相同浓度的下列溶液中,c(NH4+)的大小关系依次为 。
①NH4Cl ②(NH4)2SO4 ③ NH4HSO4
④NH4HCO3 ⑤(NH4)2CO3
4、Na2CO3溶液中离子浓度大小顺序为:
。
② > ⑤ >③ > ① >④
练习
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
电解质溶液中的守恒关系
以0.1mol/L的Na2CO3溶液为例,分析溶液中存在的平衡:
Na2CO3的电离:
水的电离:
CO32-的水解:
存在的离子有:
CO32-+H2O HCO3- +OH-
HCO3-+H2O H2CO3 +OH-
H2O H+ + OH–
Na2CO3=2Na+ + CO32-
Na+、H+、OH–、HCO3– 、CO32–
(考点)
一、重要的“三个守恒”
1、电荷守恒
溶液中阳离子电荷总数 = 阴离子电荷总数
在0.1mol/L的Na2CO3溶液中:
存在的离子有:
c(Na+)+c(H+)= c(OH–) +c(HCO3–)+2c(CO32–)
电荷守恒
Na+、H+、OH–、HCO3– 、CO32–
(溶液总是呈电中性)
所有阳离子电荷浓度之和 = 所有阴离子电荷浓度之和
注意:An+的电荷浓度为 n c(An+)
c (Na+ ) + c ( H+ ) = c ( OH– ) + 2c ( S2–) + c ( HS– )
正电荷总数浓度之和 = 负电荷总数浓度之和
如:Na2S 溶液
Na2S = 2Na+ + S2- H2O H+ + OH–
S2– + H2O HS– + OH–
HS– + H2O H2S + OH–
2、物料守恒
(元素质量守恒或原子守恒)
电解质溶液中,由于电离和水解,离子种类增多,但某些关键性的原子和其原子团总是守恒的。
在0.1mol/L的Na2CO3溶液中:
c (Na+) = 0.2 mol/L
c(CO32-)+c(HCO3-)+ c(H2CO3)=0.1mol/L
c(Na+)=2c(CO32-)+2c(HCO3-)+ 2c(H2CO3)
物料守恒
碳元素质量守恒:
电解质溶液中某一组份的起始浓度应等于它在溶液中各种存在形式的浓度之和.
试一试:写出Na2S 溶液中的物料守恒关系。
3、质子(H+)守恒
电解质溶液中分子(H2O)或弱离子得到或失去质子(H+)的物质的量应相等。
在Na2CO3溶液中:
c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
质子守恒
注意:电荷守恒与物料守恒两式联立也可得质子守恒。
得质子
失质子
① NaHCO3溶液,pH﹥7:
电荷守恒:
c(Na+)+c(H+)=2c(CO32-)+C(HCO3-)+c(OH-)
物料守恒:
c(Na+)=c(CO32-)+C(HCO3-)+C(H2CO3)
质子守恒:
c(OH-)+c(CO32-)=c(H+)+C(H2CO3)
课后作业:
根据三大守恒写出NaHCO3、 CH3COONa、NH4Cl的浓度之间的关系式。
③ NH4Cl溶液,pH﹤7:
电荷守恒:c(NH4+)+c(H+)=c( Cl-)+c(OH-)
物料守恒:c ( Cl-)=c(NH4+)+c(NH3·H2O)
质子守恒:c(OH-)+c(NH3·H2O)=c(H+)
② CH3COONa溶液,pH﹥7
电荷守恒
c ( Na+)+c(H+)=c(CH3COO-)+c(OH-)
物料守恒:
c( Na+)=c(CH3COO-)+c(CH3COOH)
质子守恒:
c( OH-)=c(H+)+c(CH3COOH)
C
4. 两种溶液混合后不同离子浓度的比较:
对策:
①首先考虑电荷守恒;
②然后考虑离子间的反应;
③再次酸、碱混合时考虑是完全反应还是一种过量;
④生成的盐与过量的酸或碱若是等物质的量混合时要考虑是电离为主还是水解为主。
例:用物质的量都是0.1 mol的CH3COOH与CH3COONa配成1 L混合溶液,已知其中c(CH3COO-) 大于c(Na+),对该混合溶液下列判断正确的是( )
A. c(H+)>c(OH-)
B. c(CH3COOH)+c(CH3COO-)=0.2 mol/L
C. c(CH3COOH)>c(CH3COO-)
D. c(CH3COO-)+c(OH-)=0.1 mol/L
⑴两种物质混合不反应:
AB
⑵两种物质恰好完全反应:
在10ml 0.1mol·L-1NaOH溶液中加入同体积、同浓度CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是( )
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(Na+)=c(CH3COO-)+c(CH3COOH)
D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
A
例:将0.4 mol/L NH4Cl溶液和0.2 mol/L NaOH溶液等体积混合后,溶液中下列微粒的物质的量关系正确的是( )
A. c(NH4+)=c(Na+)=c(OH-)>c(NH3·H2O)
B. c(NH4+)=c(Na+)>c(NH3·H2O) >c(OH-)>c(H+)
C. c(NH4+)>c(Na+)>c(OH-)>c(NH3·H2O)
D. c(NH4+)>c(Na+)>c(NH3·H2O) >c(OH-)>c(H+)
D
⑶两种物质反应,其中一种有剩余:
(1)离子浓度大小:__________________________________。
(2)电荷守恒式: __ 。
(3)能否写出物料守恒式___(填“能”或“否”)。
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
否
pH=2的CH3COOH与pH=12的NaOH等体积混合
c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
【练习】
