5.1二氧化硫的性质与应用 2022-2023学年上学期高中化学人教版(2019)必修第二册(18张ppt)
文档属性
| 名称 | 5.1二氧化硫的性质与应用 2022-2023学年上学期高中化学人教版(2019)必修第二册(18张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-07 14:12:13 | ||
图片预览




文档简介
(共18张PPT)
二氧化硫的性质与应用
对于SO2,我们应该如何评价?是天使还是魔鬼?
SO2的功与过
SO2的功与过
SO2的功与过
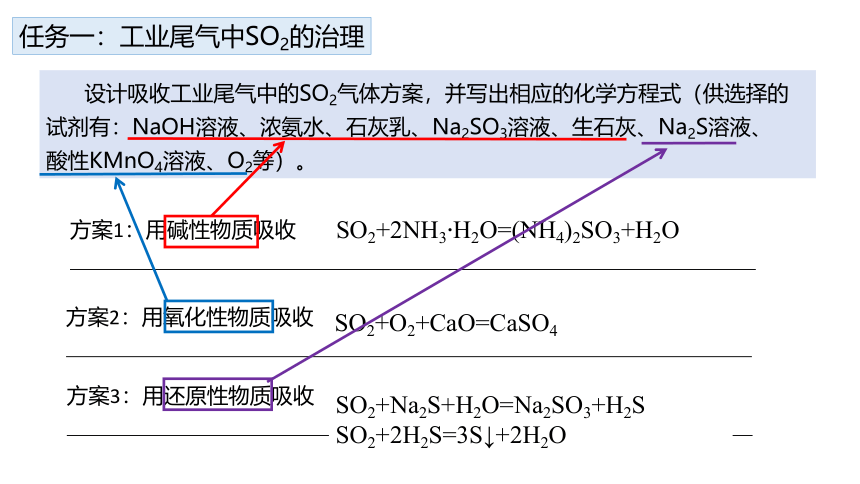
任务一:工业尾气中SO2的治理
设计吸收工业尾气中的SO2气体方案,并写出相应的化学方程式(供选择的试剂有:NaOH溶液、浓氨水、石灰乳、Na2SO3溶液、生石灰、Na2S溶液、
酸性KMnO4溶液、O2等)。
方案1:用碱性物质吸收
方案2:用氧化性物质吸收
方案3:用还原性物质吸收
SO2+2NH3·H2O=(NH4)2SO3+H2O
SO2+O2+CaO=CaSO4
SO2+Na2S+H2O=Na2SO3+H2S
SO2+2H2S=3S↓+2H2O
体现酸性氧化物的性质
体现氧化性
体现还原性
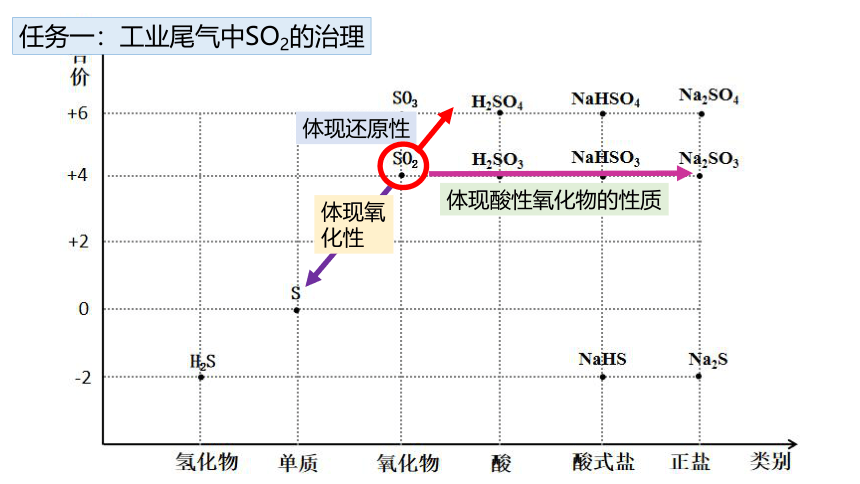
任务一:工业尾气中SO2的治理
任务一:工业尾气中SO2的治理
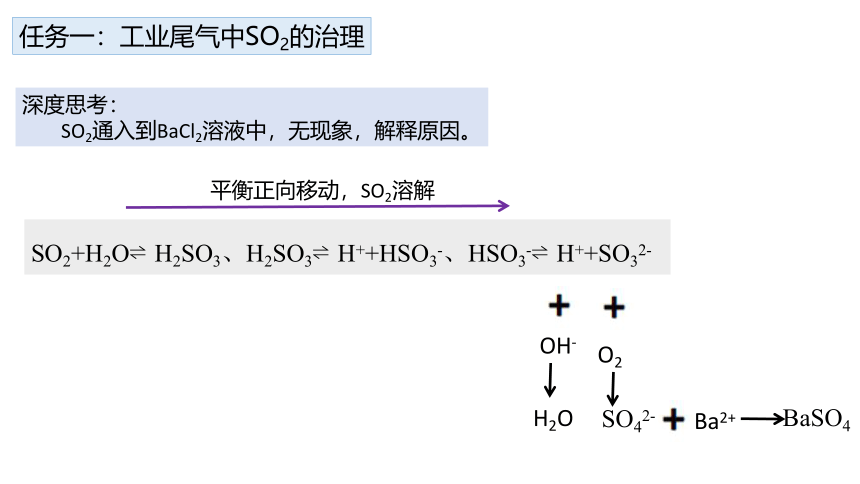
深度思考:
SO2通入到BaCl2溶液中,无现象,解释原因。
SO2+H2O H2SO3、H2SO3 H++HSO3-、HSO3- H++SO32-
OH-
H2O
平衡正向移动,SO2溶解
O2
SO42-
Ba2+
BaSO4
深度思考:
如何检验葡萄酒中是否含有SO2
任务二:葡萄酒中的SO2的检测
【活动一】葡萄酒中SO2的定性检验
+ SO2 + H2O →
红色
(醌式结构)
无色
(非醌式结构、不稳定)
任务二:葡萄酒中的SO2的检测
紫色石蕊
深度思考:
SO2的水溶液中存在 SO2、H2SO3、HSO3-、SO32-,真正使品红褪色的是哪种粒子?已知SO2气体,NaHSO3、Na2SO3固体难溶于无水乙醇。
编号 实验方案 实验现象 实验结论
1 将干燥的SO2通入品红的无水乙醇溶液 品红的无水乙醇溶液不褪色
2 将等浓度,等体积的SO2水溶液、NaHSO3溶液Na2SO3溶液分别滴入装有品红水溶液的试管中 品红的水溶液都褪色,褪色速度Na2SO3溶液 > NaHSO3溶液 > SO2水溶液
3 将等物质的量的NaHSO3、Na2SO3固体分别加入装有品红的无水乙醇溶液 品红的无水乙醇溶液都不褪色
任务二:葡萄酒中的SO2的检测
品红褪色的主要原因是SO32-的作用
任务二:葡萄酒中的SO2的检测
活动二:葡萄酒中SO2的定量测定
设计实验方案,测量葡萄酒中SO2的含量,简要说明实验方案写出反应方程式。
(供选择的试剂有:一定浓度的酸性高锰酸钾标准溶液、一定浓度的碘水标准溶液、一定浓度的双氧水标准溶液,其余试剂自选)
实验方案:滴定法
高锰酸钾溶液:
双氧水
碘水:
SO2+H2O2=SO42-+2H+
SO2+I2+H2O2=SO42-+2I-+4H+
中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g·L-1某兴趣小组用如图装置(夹持装置略)收集某葡萄酒中SO2,并检验其含量是否超标。
(1)B中加入200.00mL葡萄酒和适量硫酸,加热使SO2全部逸出并与C中H2O2完全反应。
(2)C中用过量的H2O2吸收SO2,除去过量H2O2,加入酚酞,然后用0.0500mol·L-1NaOH标准溶液进行滴定,滴定至终点时,消耗NaOH溶液20.00mL,该葡萄酒中SO2含量 (填是否)超标 。
任务二:葡萄酒中的SO2的检测
否
任务二:葡萄酒中的SO2的检测
物质含量测定常用方法
沉淀法
气体法
滴定法
常用计算方法:关系式法
任务三:SO2综合利用
活动一:利用SO2制备Na2S2O3
可由SO2制备Na2S2O3,反应原理为:3SO2(g)+2Na2S(aq)+3Na2SO3(aq) 3Na2S2O3(aq),选择合适装置模拟实验室用SO2制备Na2S2O3过程,写出仪器接口连接顺序。
发生装置
净化装置
核心实验装置
尾气处理装置
任务三:SO2综合利用
任务三:SO2综合利用
(2022·山东)实验室利用FeCl2·4H2O和亚硫酰氯(SOCl2)制备无水FeCl2的装置如图所示(加热及夹持装置略)。已知SOCl2沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题
(1)实验开始先通N2。一段时间后,先加热装置_______(填“a”或“b”)。装置b内发生反应的化学方程式为_________________________。装置c、d共同起到的作用是________________。(2)装置f的作用为 ____________________,装置e、f可用 ________________________代替。
发生装置
核心实验装置
尾气处理装置
FeCl2·4H2O+4SOCl2=FeCl2+4SO2+8HCl
a
冷凝回流亚硫酰氯
吸收SO2、HCl,防止污染环境,防倒吸
盛有碱石灰的干燥管
【活动二】Na2S2O3产品的检验
活动一制得的Na2S2O3产品,其中可能含有Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论
已知Na2S2O3 5H2O遇酸易分解:S2O32 +2H+=S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
任务三:SO2综合利用
将产品溶于稀盐酸中,静置,向上层清液中加入BaCl2溶液,若有白色沉淀出现,则含有Na2SO4杂质;反之,则不含Na2SO4杂质。
酸性
氧化物
氧化性
还原性
漂白性
SO2的功与过
SO2的检测与防治
SO2综合利用制备工业产品
二氧化硫的性质与应用
对于SO2,我们应该如何评价?是天使还是魔鬼?
SO2的功与过
SO2的功与过
SO2的功与过
任务一:工业尾气中SO2的治理
设计吸收工业尾气中的SO2气体方案,并写出相应的化学方程式(供选择的试剂有:NaOH溶液、浓氨水、石灰乳、Na2SO3溶液、生石灰、Na2S溶液、
酸性KMnO4溶液、O2等)。
方案1:用碱性物质吸收
方案2:用氧化性物质吸收
方案3:用还原性物质吸收
SO2+2NH3·H2O=(NH4)2SO3+H2O
SO2+O2+CaO=CaSO4
SO2+Na2S+H2O=Na2SO3+H2S
SO2+2H2S=3S↓+2H2O
体现酸性氧化物的性质
体现氧化性
体现还原性
任务一:工业尾气中SO2的治理
任务一:工业尾气中SO2的治理
深度思考:
SO2通入到BaCl2溶液中,无现象,解释原因。
SO2+H2O H2SO3、H2SO3 H++HSO3-、HSO3- H++SO32-
OH-
H2O
平衡正向移动,SO2溶解
O2
SO42-
Ba2+
BaSO4
深度思考:
如何检验葡萄酒中是否含有SO2
任务二:葡萄酒中的SO2的检测
【活动一】葡萄酒中SO2的定性检验
+ SO2 + H2O →
红色
(醌式结构)
无色
(非醌式结构、不稳定)
任务二:葡萄酒中的SO2的检测
紫色石蕊
深度思考:
SO2的水溶液中存在 SO2、H2SO3、HSO3-、SO32-,真正使品红褪色的是哪种粒子?已知SO2气体,NaHSO3、Na2SO3固体难溶于无水乙醇。
编号 实验方案 实验现象 实验结论
1 将干燥的SO2通入品红的无水乙醇溶液 品红的无水乙醇溶液不褪色
2 将等浓度,等体积的SO2水溶液、NaHSO3溶液Na2SO3溶液分别滴入装有品红水溶液的试管中 品红的水溶液都褪色,褪色速度Na2SO3溶液 > NaHSO3溶液 > SO2水溶液
3 将等物质的量的NaHSO3、Na2SO3固体分别加入装有品红的无水乙醇溶液 品红的无水乙醇溶液都不褪色
任务二:葡萄酒中的SO2的检测
品红褪色的主要原因是SO32-的作用
任务二:葡萄酒中的SO2的检测
活动二:葡萄酒中SO2的定量测定
设计实验方案,测量葡萄酒中SO2的含量,简要说明实验方案写出反应方程式。
(供选择的试剂有:一定浓度的酸性高锰酸钾标准溶液、一定浓度的碘水标准溶液、一定浓度的双氧水标准溶液,其余试剂自选)
实验方案:滴定法
高锰酸钾溶液:
双氧水
碘水:
SO2+H2O2=SO42-+2H+
SO2+I2+H2O2=SO42-+2I-+4H+
中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g·L-1某兴趣小组用如图装置(夹持装置略)收集某葡萄酒中SO2,并检验其含量是否超标。
(1)B中加入200.00mL葡萄酒和适量硫酸,加热使SO2全部逸出并与C中H2O2完全反应。
(2)C中用过量的H2O2吸收SO2,除去过量H2O2,加入酚酞,然后用0.0500mol·L-1NaOH标准溶液进行滴定,滴定至终点时,消耗NaOH溶液20.00mL,该葡萄酒中SO2含量 (填是否)超标 。
任务二:葡萄酒中的SO2的检测
否
任务二:葡萄酒中的SO2的检测
物质含量测定常用方法
沉淀法
气体法
滴定法
常用计算方法:关系式法
任务三:SO2综合利用
活动一:利用SO2制备Na2S2O3
可由SO2制备Na2S2O3,反应原理为:3SO2(g)+2Na2S(aq)+3Na2SO3(aq) 3Na2S2O3(aq),选择合适装置模拟实验室用SO2制备Na2S2O3过程,写出仪器接口连接顺序。
发生装置
净化装置
核心实验装置
尾气处理装置
任务三:SO2综合利用
任务三:SO2综合利用
(2022·山东)实验室利用FeCl2·4H2O和亚硫酰氯(SOCl2)制备无水FeCl2的装置如图所示(加热及夹持装置略)。已知SOCl2沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题
(1)实验开始先通N2。一段时间后,先加热装置_______(填“a”或“b”)。装置b内发生反应的化学方程式为_________________________。装置c、d共同起到的作用是________________。(2)装置f的作用为 ____________________,装置e、f可用 ________________________代替。
发生装置
核心实验装置
尾气处理装置
FeCl2·4H2O+4SOCl2=FeCl2+4SO2+8HCl
a
冷凝回流亚硫酰氯
吸收SO2、HCl,防止污染环境,防倒吸
盛有碱石灰的干燥管
【活动二】Na2S2O3产品的检验
活动一制得的Na2S2O3产品,其中可能含有Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论
已知Na2S2O3 5H2O遇酸易分解:S2O32 +2H+=S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
任务三:SO2综合利用
将产品溶于稀盐酸中,静置,向上层清液中加入BaCl2溶液,若有白色沉淀出现,则含有Na2SO4杂质;反之,则不含Na2SO4杂质。
酸性
氧化物
氧化性
还原性
漂白性
SO2的功与过
SO2的检测与防治
SO2综合利用制备工业产品
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
