《中学教材全解》2013-2014学年高中化学人教版必修一本章复习方课件:第三章 金属及其化合物
文档属性
| 名称 | 《中学教材全解》2013-2014学年高中化学人教版必修一本章复习方课件:第三章 金属及其化合物 |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-01-01 13:23:54 | ||
图片预览






文档简介
课件18张PPT。学习目标:
1.了解钠、铝、铁等金属及其重要化合物的主要性质。
2.了解钠的强还原性,过氧化钠、碳酸钠和碳酸氢钠的重要性质。
3.了解铝的性质特点,了解氧化铝、氢氧化铝的特殊性质。
4.了解铁的性质,铁的化合物的性质,以及、的相互转化和、的检验。?本章复习方案重点
1.钠的氧化和钠与水的反应,铝与NaOH溶液的反应。
2.氢氧化铝、氢氧化铁的性质,、的相互转化。
难点
1.钠与水的反应、铝与NaOH溶液的反应。
2.氧化铝、氢氧化铝的特殊性质,、的转化。?重点难点探究一 和的性质及计算?典型例题例1 现有25 mL 2 mol/L 溶液和75 mL 1 mol/L的稀盐酸。①将溶液缓慢滴加到稀盐酸中;②将稀盐酸缓慢滴加到溶液中,在标准状况下产生的气体的体积( )
?A.均为0.84 L B.均为0.56 L
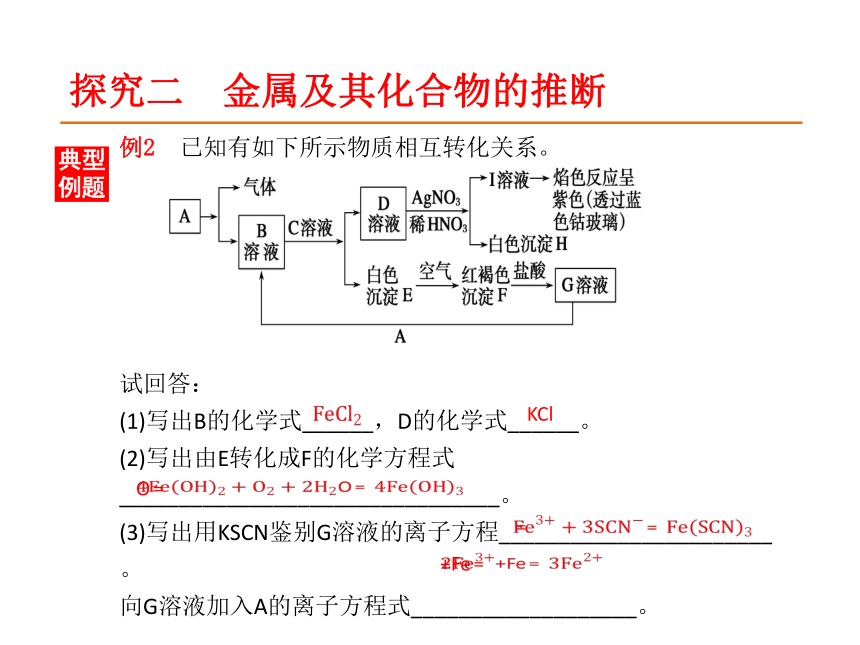
C.①>② D.②>①?C探究二 金属及其化合物的推断典型例题例2 已知有如下所示物质相互转化关系。
试回答:
(1)写出B的化学式______,D的化学式______。
(2)写出由E转化成F的化学方程式________________________________。
(3)写出用KSCN鉴别G溶液的离子方程_______________________。
向G溶液加入A的离子方程式___________________。?KClO﹦?﹦?+Fe﹦?探究三 可溶性铝盐与强碱反应的有关计算典型例题例3 向20 mL 1 mol/L的溶液中加入30 mL KOH溶液,充分反应得到0.78 g沉淀,则KOH溶液的物质的量浓度可能是( )
A.1 mol/L B.3 mol/L C.5 mol/L D.7 mol/L?AC探究四 、的性质及检验?既有氧化性,又有还原性,具有较强的氧化性。
如:﹦
﹦O
+Cu﹦
﹦
(1)配制溶液时加铁粉,防止被氧化,实验室制备时防止被氧化用新配制的溶液,配制NaOH溶液的蒸馏水要煮沸。
与)、)等在水溶液中不能大量共存,与、、在水溶液中不能大量共存,均是因为发生氧化还原反应。
(3)除杂,除去)加或氯水,除去)加Fe粉。?探究四 、的性质及检验?与的检验方法
(1)观察法
盐溶液呈棕黄色,盐溶液呈浅绿色。
法
滴入KSCN或其他可溶性的硫氰化物溶液,呈红色者是溶液,不变红但滴加少量氯水后变红色者为溶液。
(3)碱液法
分别加入碱液(如NaOH溶液),生成红褐色沉淀者为溶液;先生成白色絮状沉淀,又迅速转变为灰绿色,最后变为红褐色者为溶液。
(或溴水)法
分别加入少量酸性溶液(或溴水),能使之褪色者为溶液,不能使之褪色者为溶液。
(5)铜片法
分别加入铜片,铜片溶解且溶液逐渐变为蓝绿色者为溶液,铜片不溶解,溶液颜色不变者为溶液。?探究四 、的性质及检验?典型例题例4 黄铜矿)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为:
若中Fe的化合价为+2,反应中被还原的元素是_______(填元素符号)。
(2)过二硫酸钾)具有强氧化性,可将氧化为:﹦
通过改变反应途径,、均可催化上述反应。试用离子方程式表示对上述反应催化的过程:__________________、________________________(不必配平)。?Cu、O﹦?﹦?探究四 、的性质及检验?典型例题(3)利用黄铜矿冶炼铜产生的炉渣(含、FeO、、)可制备。方法为:①用稀盐酸浸取炉渣,过滤。②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
据以上信息回答下列问题:
a.除去的离子方程式是________________________。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 溶液 NaOH溶液 碘水
所选试剂为_________________。
证明炉渣中含有FeO的实验现象为
____________________________________。?﹦O?稀硫酸、溶液?稀硫酸浸取炉渣所得溶液使溶液褪色?巩固练习1.有NaCl、、、、五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸 B.烧碱溶液 C.氨水 D.KSCN溶液
?B巩固练习2.下列离子方程式正确的是( )
A.向氢氧化钠溶液中通入少量:﹦
B.铁跟稀硫酸反应:﹦↑
C.硝酸铝溶液中加入过量氨水:·O﹦O
D.硫氰化钾溶液中加入三氯化铁溶液:﹦?D巩固练习3.有关溶液中所含离子的检验,下列判断正确的是( )
A.加入硝酸酸化,再滴加KSCN溶液后有红色物质生成,则原溶液中一定有存在
B.加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的存在
C.用某溶液做焰色反应实验时火焰为黄色,则该溶液中一定有钠元素,可能有钾元素
D.分别含有、、和的四种盐溶液,只用NaOH溶液是不能一次鉴别开的
?C巩固练习4.下列有关铁及其化合物的说法中正确的是( )
A.赤铁矿的主要成分是
B.铁与水蒸气在高温下的反应产物为和
C.除去溶液中的杂质可以向溶液中加铁粉,然后过滤
与KSCN反应产生红色沉淀?C巩固练习5.现有浓度各为1 mol/L的、、混合溶液100 mL,加入一定量的铁粉,按下列情况填空(已知:氧化性>>):
(1)反应完毕,铁粉有剩余。反应后的溶液中一定含_______阳离子。
(2)反应完毕,有铜生成,铁粉无剩余。反应后的溶液中一定含_____阳离子,该阳离子在溶液中物质的量的范围是__________________ ;反应后的溶液中可能含_______阳离子。
(3)反应完毕后,无固体沉积物存在,反应后的溶液中一定含_______阳离子。???0.25 )≤0.35 mol??、?巩固练习6.有一透明溶液,可能含有较大量的、、、、、、、中的一种或几种,取此溶液做下列实验:
①取少量溶液加入用盐酸酸化的溶液,有白色沉淀生成;
②取少量溶液加入过氧化钠粉末,溶液中有白色沉淀产生并逸出无色无味的气体,加入的物质的量与析出沉淀的物质的量如图3-4-1所示。试推断:
(1)溶液中一定含有的离子是______________ 。
(2)溶液中肯定不含有的离子是______________ 。
(3)可能含有的离子是______________ 。?图3-4-1、、?、、、??巩固练习7.某化学课外活动小组欲制取纯溶液并讨论实验过程中的相关问题。可供选择的试剂有:
A大理石;B盐酸;C氢氧化钠溶液;D澄清石灰水。
三名同学设计的制备实验方案的反应流程分别如下:
?巩固练习请完成下列问题:
(1)请指出甲、乙两方案的主要缺点:
甲方案:________________________________。
乙方案:________________________________。
(2)若采用丙方案制取纯溶液,其实验的关键有_________________________________________________________。
(3)假设反应③所得的溶液中含有。现要利用A~D四种试剂证明的存在,你所选择的试剂有_____ (填试剂代号)。
溶液 溶液 C.澄清石灰水 D.稀盐酸
(4)假设反应②所得的固体中混有未分解的。乙同学选择澄清石灰水测定其中的的质量分数,乙同学能否达到实验目的?_____ (填“能”或“不能”);若能,请说明计算所需的数据;若不能,请简要说明理由________________________________。?的通入量不易控制?过程繁琐,操作复杂反应③应充分进行;反应③与④所用NaOH溶液的体积应相等A或B能固体样品质量和沉淀总质量布置作业
完成[复习学案]中交流讨论的内容
1.了解钠、铝、铁等金属及其重要化合物的主要性质。
2.了解钠的强还原性,过氧化钠、碳酸钠和碳酸氢钠的重要性质。
3.了解铝的性质特点,了解氧化铝、氢氧化铝的特殊性质。
4.了解铁的性质,铁的化合物的性质,以及、的相互转化和、的检验。?本章复习方案重点
1.钠的氧化和钠与水的反应,铝与NaOH溶液的反应。
2.氢氧化铝、氢氧化铁的性质,、的相互转化。
难点
1.钠与水的反应、铝与NaOH溶液的反应。
2.氧化铝、氢氧化铝的特殊性质,、的转化。?重点难点探究一 和的性质及计算?典型例题例1 现有25 mL 2 mol/L 溶液和75 mL 1 mol/L的稀盐酸。①将溶液缓慢滴加到稀盐酸中;②将稀盐酸缓慢滴加到溶液中,在标准状况下产生的气体的体积( )
?A.均为0.84 L B.均为0.56 L
C.①>② D.②>①?C探究二 金属及其化合物的推断典型例题例2 已知有如下所示物质相互转化关系。
试回答:
(1)写出B的化学式______,D的化学式______。
(2)写出由E转化成F的化学方程式________________________________。
(3)写出用KSCN鉴别G溶液的离子方程_______________________。
向G溶液加入A的离子方程式___________________。?KClO﹦?﹦?+Fe﹦?探究三 可溶性铝盐与强碱反应的有关计算典型例题例3 向20 mL 1 mol/L的溶液中加入30 mL KOH溶液,充分反应得到0.78 g沉淀,则KOH溶液的物质的量浓度可能是( )
A.1 mol/L B.3 mol/L C.5 mol/L D.7 mol/L?AC探究四 、的性质及检验?既有氧化性,又有还原性,具有较强的氧化性。
如:﹦
﹦O
+Cu﹦
﹦
(1)配制溶液时加铁粉,防止被氧化,实验室制备时防止被氧化用新配制的溶液,配制NaOH溶液的蒸馏水要煮沸。
与)、)等在水溶液中不能大量共存,与、、在水溶液中不能大量共存,均是因为发生氧化还原反应。
(3)除杂,除去)加或氯水,除去)加Fe粉。?探究四 、的性质及检验?与的检验方法
(1)观察法
盐溶液呈棕黄色,盐溶液呈浅绿色。
法
滴入KSCN或其他可溶性的硫氰化物溶液,呈红色者是溶液,不变红但滴加少量氯水后变红色者为溶液。
(3)碱液法
分别加入碱液(如NaOH溶液),生成红褐色沉淀者为溶液;先生成白色絮状沉淀,又迅速转变为灰绿色,最后变为红褐色者为溶液。
(或溴水)法
分别加入少量酸性溶液(或溴水),能使之褪色者为溶液,不能使之褪色者为溶液。
(5)铜片法
分别加入铜片,铜片溶解且溶液逐渐变为蓝绿色者为溶液,铜片不溶解,溶液颜色不变者为溶液。?探究四 、的性质及检验?典型例题例4 黄铜矿)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为:
若中Fe的化合价为+2,反应中被还原的元素是_______(填元素符号)。
(2)过二硫酸钾)具有强氧化性,可将氧化为:﹦
通过改变反应途径,、均可催化上述反应。试用离子方程式表示对上述反应催化的过程:__________________、________________________(不必配平)。?Cu、O﹦?﹦?探究四 、的性质及检验?典型例题(3)利用黄铜矿冶炼铜产生的炉渣(含、FeO、、)可制备。方法为:①用稀盐酸浸取炉渣,过滤。②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
据以上信息回答下列问题:
a.除去的离子方程式是________________________。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 溶液 NaOH溶液 碘水
所选试剂为_________________。
证明炉渣中含有FeO的实验现象为
____________________________________。?﹦O?稀硫酸、溶液?稀硫酸浸取炉渣所得溶液使溶液褪色?巩固练习1.有NaCl、、、、五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸 B.烧碱溶液 C.氨水 D.KSCN溶液
?B巩固练习2.下列离子方程式正确的是( )
A.向氢氧化钠溶液中通入少量:﹦
B.铁跟稀硫酸反应:﹦↑
C.硝酸铝溶液中加入过量氨水:·O﹦O
D.硫氰化钾溶液中加入三氯化铁溶液:﹦?D巩固练习3.有关溶液中所含离子的检验,下列判断正确的是( )
A.加入硝酸酸化,再滴加KSCN溶液后有红色物质生成,则原溶液中一定有存在
B.加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的存在
C.用某溶液做焰色反应实验时火焰为黄色,则该溶液中一定有钠元素,可能有钾元素
D.分别含有、、和的四种盐溶液,只用NaOH溶液是不能一次鉴别开的
?C巩固练习4.下列有关铁及其化合物的说法中正确的是( )
A.赤铁矿的主要成分是
B.铁与水蒸气在高温下的反应产物为和
C.除去溶液中的杂质可以向溶液中加铁粉,然后过滤
与KSCN反应产生红色沉淀?C巩固练习5.现有浓度各为1 mol/L的、、混合溶液100 mL,加入一定量的铁粉,按下列情况填空(已知:氧化性>>):
(1)反应完毕,铁粉有剩余。反应后的溶液中一定含_______阳离子。
(2)反应完毕,有铜生成,铁粉无剩余。反应后的溶液中一定含_____阳离子,该阳离子在溶液中物质的量的范围是__________________ ;反应后的溶液中可能含_______阳离子。
(3)反应完毕后,无固体沉积物存在,反应后的溶液中一定含_______阳离子。???0.25 )≤0.35 mol??、?巩固练习6.有一透明溶液,可能含有较大量的、、、、、、、中的一种或几种,取此溶液做下列实验:
①取少量溶液加入用盐酸酸化的溶液,有白色沉淀生成;
②取少量溶液加入过氧化钠粉末,溶液中有白色沉淀产生并逸出无色无味的气体,加入的物质的量与析出沉淀的物质的量如图3-4-1所示。试推断:
(1)溶液中一定含有的离子是______________ 。
(2)溶液中肯定不含有的离子是______________ 。
(3)可能含有的离子是______________ 。?图3-4-1、、?、、、??巩固练习7.某化学课外活动小组欲制取纯溶液并讨论实验过程中的相关问题。可供选择的试剂有:
A大理石;B盐酸;C氢氧化钠溶液;D澄清石灰水。
三名同学设计的制备实验方案的反应流程分别如下:
?巩固练习请完成下列问题:
(1)请指出甲、乙两方案的主要缺点:
甲方案:________________________________。
乙方案:________________________________。
(2)若采用丙方案制取纯溶液,其实验的关键有_________________________________________________________。
(3)假设反应③所得的溶液中含有。现要利用A~D四种试剂证明的存在,你所选择的试剂有_____ (填试剂代号)。
溶液 溶液 C.澄清石灰水 D.稀盐酸
(4)假设反应②所得的固体中混有未分解的。乙同学选择澄清石灰水测定其中的的质量分数,乙同学能否达到实验目的?_____ (填“能”或“不能”);若能,请说明计算所需的数据;若不能,请简要说明理由________________________________。?的通入量不易控制?过程繁琐,操作复杂反应③应充分进行;反应③与④所用NaOH溶液的体积应相等A或B能固体样品质量和沉淀总质量布置作业
完成[复习学案]中交流讨论的内容
