2022-2023学年化学鲁教版 第五单元 定量研究化学反应 单元练习(含答案)
文档属性
| 名称 | 2022-2023学年化学鲁教版 第五单元 定量研究化学反应 单元练习(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 187.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-07 12:18:20 | ||
图片预览



文档简介
2022-2023学年化学鲁教版--定量研究化学反应
一、单选题
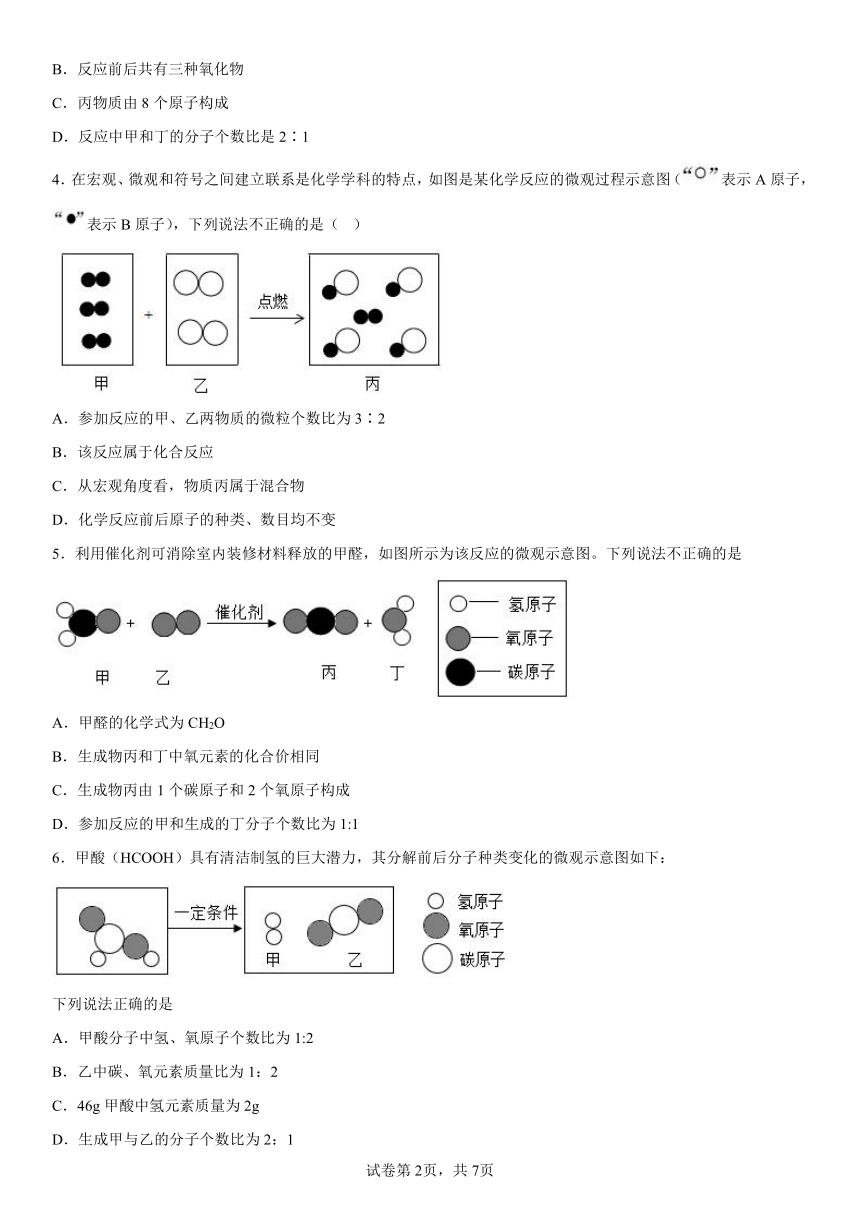
1.一定条件下,密闭容器中发生了某一化学反应,涉及的物质为甲、乙、丙、丁,如图为各物质在反应前和反应后某时刻的质量关系。下列说法不正确的是
A.x的值是31
B.甲、丁的相对分子质量之比可能为7:11
C.丁可能为单质
D.反应中消耗甲和乙的质量比为7:4
2.将下列四种物质放入密闭容器中充分反应,测得反应前后各物质的质量如下表,下列说法错误的是
物质 甲 乙 丙 丁
反应前质量/g 30 20 5 0
反应后质量/g 14 16 a 20
A.a=5
B.甲和乙为反应物
C.丙可能是催化剂
D.甲、乙、丁的相对分子质量之比为2:1:2
3.2022年4月29日《科技日报》报道“我国科学家实现二氧化碳到葡萄糖和油脂的“人工合成”,合成过程中的一个反应微观示意图如下,有关说法正确的是
A.反应前后分子的种类不变
B.反应前后共有三种氧化物
C.丙物质由8个原子构成
D.反应中甲和丁的分子个数比是2∶1
4.在宏观、微观和符号之间建立联系是化学学科的特点,如图是某化学反应的微观过程示意图(表示A原子,表示B原子),下列说法不正确的是( )
A.参加反应的甲、乙两物质的微粒个数比为3∶2
B.该反应属于化合反应
C.从宏观角度看,物质丙属于混合物
D.化学反应前后原子的种类、数目均不变
5.利用催化剂可消除室内装修材料释放的甲醛,如图所示为该反应的微观示意图。下列说法不正确的是
A.甲醛的化学式为CH2O
B.生成物丙和丁中氧元素的化合价相同
C.生成物丙由1个碳原子和2个氧原子构成
D.参加反应的甲和生成的丁分子个数比为1:1
6.甲酸(HCOOH)具有清洁制氢的巨大潜力,其分解前后分子种类变化的微观示意图如下:
下列说法正确的是
A.甲酸分子中氢、氧原子个数比为1:2
B.乙中碳、氧元素质量比为1:2
C.46g甲酸中氢元素质量为2g
D.生成甲与乙的分子个数比为2:1
7.在一个密闭容器中放入P、Q、R、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。则关于此反应的认识正确的是( )
物质 P Q R W
反应前的质量(g) 5 2 14 18
反应后的质量(g) 20 x 4 13
A.参加化学反应的P和W的质量比为3:2
B.该反应用化学方程式表示为:
C.反应后容器中R与Q的质量比为1:2
D.Q在反应中可能作催化剂
8.利用催化剂将工厂废气中的二氧化碳转化为燃料x,是实现“碳中和”的路径之一,该反应的化学方程式为,X的化学式为
A.C B.CH4 C.CH3OH D.CH2O
9.已知某纯净物4.6g在足量的氧气中充分燃烧后,生成8.8g二氧化碳和5.4g水。下列关于该纯净物组成的说法正确的是( )
A.只含有碳、氢元素
B.一定含有碳、氢、氧三种元素
C.一定含有碳、氢元素,可能含有氧元素
D.一定含有碳元素,可能含有氢、氧元素
10.根据化学方程式,推断出B与A的相对分子质量相差( )
A.37.0 B.95.0 C.18.5 D.58.5
11.载人航天器中处理CO2的另一种方法是将CO2与氢气反应,反应前后分子种类变化的微观示意图如下:
下列说法正确的是
A.乙和丙的元素组成相同 B.丙的相对分子质量为16
C.反应前后氧原子个数不相等 D.参加反应的甲和乙的分子个数比为4:1
12.某反应的微观示意图如下,有关说法正确的是
A.此反应遵守质量守恒定律 B.参加反应的各物质分子个数比为1:1
C.反应前后分子数目不变 D.此反应的生成物为混合物
13.将氯化氢转化为氯气的技术是当今化学研究的热点之一,下图是该反应的微观示意图
(其中:表示氢原子,表示氧原子,表示氯原子)
下列说法正确的是
A.该反应涉及两种氧化物 B.生成物均由两种元素组成
C.参加反应的两种物质的质量比为73:16 D.反应前后分子总数不变
14.清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如下(图中的微粒恰好完全反应)。下列说法正确的是
A.丁的化学式为H2O2 B.参加反应的甲与乙的质量比为 3∶1
C.甲是单质,乙、丙、丁均为氧化物 D.该反应遵守质量守恒定律
15.甲、乙、丙、丁四种物质在一定条件下充分混合,此时各物质的质量分数如图1所示。一段时间后,各物质的质量分数如图2所示。下列说法正确的是
A.丁是反应物 B.x的值为20
C.乙是此化学反应的催化剂 D.生成38g甲,需消耗60g丁
二、填空题
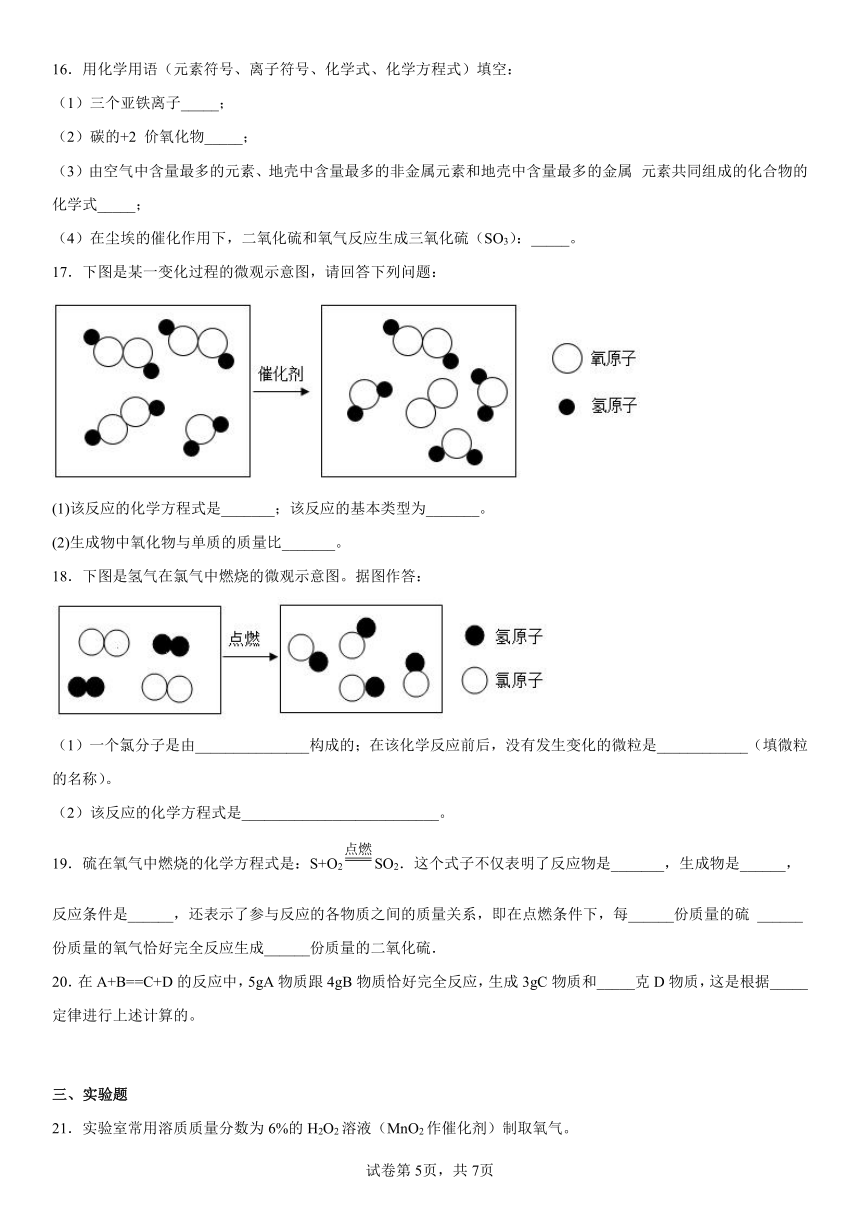
16.用化学用语(元素符号、离子符号、化学式、化学方程式)填空:
(1)三个亚铁离子_____;
(2)碳的+2 价氧化物_____;
(3)由空气中含量最多的元素、地壳中含量最多的非金属元素和地壳中含量最多的金属 元素共同组成的化合物的化学式_____;
(4)在尘埃的催化作用下,二氧化硫和氧气反应生成三氧化硫(SO3):_____。
17.下图是某一变化过程的微观示意图,请回答下列问题:
(1)该反应的化学方程式是_______;该反应的基本类型为_______。
(2)生成物中氧化物与单质的质量比_______。
18.下图是氢气在氯气中燃烧的微观示意图。据图作答:
(1)一个氯分子是由_______________构成的;在该化学反应前后,没有发生变化的微粒是____________(填微粒的名称)。
(2)该反应的化学方程式是__________________________。
19.硫在氧气中燃烧的化学方程式是:S+O2SO2.这个式子不仅表明了反应物是_______,生成物是______,反应条件是______,还表示了参与反应的各物质之间的质量关系,即在点燃条件下,每______份质量的硫 ______份质量的氧气恰好完全反应生成______份质量的二氧化硫.
20.在A+B==C+D的反应中,5gA物质跟4gB物质恰好完全反应,生成3gC物质和_____克D物质,这是根据_____定律进行上述计算的。
三、实验题
21.实验室常用溶质质量分数为6%的H2O2溶液(MnO2作催化剂)制取氧气。
(1)配制质量分数为6%的H2O2溶液。
①计算:配制150g质量分数为6%的H2O2溶液,需要质量分数为30%(密度为1.1g/cm3)的H2O2溶液体积为______mL(计算结果保留一位小数),水为______g。
②量取:用量筒量取所需H2O2溶液和水,倒入烧杯中。用量筒量取液体时,视线应与______。
③混匀:…。
(2)制取氧气(可能用到的部分装置如图)。
①实验室用氯酸钾(MnO2作催化剂)制取干燥的氧气,选择的发生装置和收集装置为______(填字母),反应的化学方程式为______。
②实验室用发生装置B制取氧气的化学方程式为______。
(3)实验反思。
①若其他操作正确,量取水时俯视读数,则配制的H2O2溶液溶质质量分数______6%(填“>”、“<”或“=”)。
②若用E装置收集一瓶(容积为200mL)体积分数为80%的氧气,预先应用量筒量取______mL的水加入该集气瓶中(不考虑水蒸气的影响)。
22.化学实验是进行科学探究的重要途径。某研究性学习小组欲利用下列装置进行相关气体制取的探究,请你分析并回答问题:
(1)图中标号a的仪器名称是______。
(2)若用加热高锰酸钾固体制取并收集一集气瓶氧气,可选用的装置组合是______(填字母序号)。
(3)实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式为______。
主要操作步骤有:①检查装置的气密性;②收集并验满气体;③装入药品;④组装仪器。
正确的操作顺序是______(填数字序号)。
(4)F是密封良好充满空气的单气阀充气袋,现用F收集一袋较纯净的氧气,则导气管口b、c连接之前需进行的一项操作是______。
23.质量守恒定律具有非常重要的价值和意义。
将下列A、B、C装置分别放在装置D天平上,用砝码平衡。然后取下锥形瓶,将锥形瓶倾斜,使液体药品与固体药品接触,一段时间后再把锥形瓶放在天平上。
(1)①以上实验能验证质量守恒定律的是_______(填字母)。
②选一个实验,写出能证明“质量守恒定律”的实验现象___;并写出相应反应的化学方程式____。
(2)以上实验中,选一个不能验证质量守恒定律的实验,解释原因_______。
四、计算题
24.高温煅烧含杂质10%的石灰石(主要成分为CaCO3)100吨,可得生石灰( CaO)多少吨?
25.“蛟龙号”是我国研制出的大深度载人潜水器。为保证载人潜水器长时间潜水,需要在潜水器里配备供氧装置。过氧化物供氧是一种常见的供氧技术,原理是用过氧化钠(化学式为Na2O2)固体常温下与二氧化碳反应,生成碳酸钠和氧气。若用这种方法制取96g氧气,则至少需要含过氧化钠60%的过氧化钠样品多少克?(反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.D
4.A
5.C
6.C
7.D
8.C
9.B
10.C
11.D
12.A
13.C
14.D
15.A
16. 3Fe2+ CO Al(NO3)3 2SO2+O2 2SO3
17.(1) 分解反应
(2)9:8
18. 2个氯原子 氢原子和氯原子
19. 硫和氧气 二氧化硫 点燃 32 32 64
20. 6 质量守恒
21.(1) 27.3 120 液体凹液面的最低处保持水平
(2) ADDA
(3) > 150
22.(1)分液漏斗
(2)ACAEAC或AE
(3) ④①③②
(4)排尽充气袋内的空气
23.(1) B 银白色铁钉表面析出红色固体,溶液由蓝色变为浅绿色,天平读数不变 Fe+CuSO4=FeSO4+Cu
(2)A实验:反应生成氧气,气球鼓起,浮力增大,天平读数变小;C实验:反应产物二氧化碳逸出锥形瓶,未被称量,天平读数变小
24.50.4
25.解:设至少需要含过氧化钠60%的过氧化钠样品的质量为x
x=780g
答:至少需要含过氧化钠60%的过氧化钠样品的质量为780g。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.一定条件下,密闭容器中发生了某一化学反应,涉及的物质为甲、乙、丙、丁,如图为各物质在反应前和反应后某时刻的质量关系。下列说法不正确的是
A.x的值是31
B.甲、丁的相对分子质量之比可能为7:11
C.丁可能为单质
D.反应中消耗甲和乙的质量比为7:4
2.将下列四种物质放入密闭容器中充分反应,测得反应前后各物质的质量如下表,下列说法错误的是
物质 甲 乙 丙 丁
反应前质量/g 30 20 5 0
反应后质量/g 14 16 a 20
A.a=5
B.甲和乙为反应物
C.丙可能是催化剂
D.甲、乙、丁的相对分子质量之比为2:1:2
3.2022年4月29日《科技日报》报道“我国科学家实现二氧化碳到葡萄糖和油脂的“人工合成”,合成过程中的一个反应微观示意图如下,有关说法正确的是
A.反应前后分子的种类不变
B.反应前后共有三种氧化物
C.丙物质由8个原子构成
D.反应中甲和丁的分子个数比是2∶1
4.在宏观、微观和符号之间建立联系是化学学科的特点,如图是某化学反应的微观过程示意图(表示A原子,表示B原子),下列说法不正确的是( )
A.参加反应的甲、乙两物质的微粒个数比为3∶2
B.该反应属于化合反应
C.从宏观角度看,物质丙属于混合物
D.化学反应前后原子的种类、数目均不变
5.利用催化剂可消除室内装修材料释放的甲醛,如图所示为该反应的微观示意图。下列说法不正确的是
A.甲醛的化学式为CH2O
B.生成物丙和丁中氧元素的化合价相同
C.生成物丙由1个碳原子和2个氧原子构成
D.参加反应的甲和生成的丁分子个数比为1:1
6.甲酸(HCOOH)具有清洁制氢的巨大潜力,其分解前后分子种类变化的微观示意图如下:
下列说法正确的是
A.甲酸分子中氢、氧原子个数比为1:2
B.乙中碳、氧元素质量比为1:2
C.46g甲酸中氢元素质量为2g
D.生成甲与乙的分子个数比为2:1
7.在一个密闭容器中放入P、Q、R、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。则关于此反应的认识正确的是( )
物质 P Q R W
反应前的质量(g) 5 2 14 18
反应后的质量(g) 20 x 4 13
A.参加化学反应的P和W的质量比为3:2
B.该反应用化学方程式表示为:
C.反应后容器中R与Q的质量比为1:2
D.Q在反应中可能作催化剂
8.利用催化剂将工厂废气中的二氧化碳转化为燃料x,是实现“碳中和”的路径之一,该反应的化学方程式为,X的化学式为
A.C B.CH4 C.CH3OH D.CH2O
9.已知某纯净物4.6g在足量的氧气中充分燃烧后,生成8.8g二氧化碳和5.4g水。下列关于该纯净物组成的说法正确的是( )
A.只含有碳、氢元素
B.一定含有碳、氢、氧三种元素
C.一定含有碳、氢元素,可能含有氧元素
D.一定含有碳元素,可能含有氢、氧元素
10.根据化学方程式,推断出B与A的相对分子质量相差( )
A.37.0 B.95.0 C.18.5 D.58.5
11.载人航天器中处理CO2的另一种方法是将CO2与氢气反应,反应前后分子种类变化的微观示意图如下:
下列说法正确的是
A.乙和丙的元素组成相同 B.丙的相对分子质量为16
C.反应前后氧原子个数不相等 D.参加反应的甲和乙的分子个数比为4:1
12.某反应的微观示意图如下,有关说法正确的是
A.此反应遵守质量守恒定律 B.参加反应的各物质分子个数比为1:1
C.反应前后分子数目不变 D.此反应的生成物为混合物
13.将氯化氢转化为氯气的技术是当今化学研究的热点之一,下图是该反应的微观示意图
(其中:表示氢原子,表示氧原子,表示氯原子)
下列说法正确的是
A.该反应涉及两种氧化物 B.生成物均由两种元素组成
C.参加反应的两种物质的质量比为73:16 D.反应前后分子总数不变
14.清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如下(图中的微粒恰好完全反应)。下列说法正确的是
A.丁的化学式为H2O2 B.参加反应的甲与乙的质量比为 3∶1
C.甲是单质,乙、丙、丁均为氧化物 D.该反应遵守质量守恒定律
15.甲、乙、丙、丁四种物质在一定条件下充分混合,此时各物质的质量分数如图1所示。一段时间后,各物质的质量分数如图2所示。下列说法正确的是
A.丁是反应物 B.x的值为20
C.乙是此化学反应的催化剂 D.生成38g甲,需消耗60g丁
二、填空题
16.用化学用语(元素符号、离子符号、化学式、化学方程式)填空:
(1)三个亚铁离子_____;
(2)碳的+2 价氧化物_____;
(3)由空气中含量最多的元素、地壳中含量最多的非金属元素和地壳中含量最多的金属 元素共同组成的化合物的化学式_____;
(4)在尘埃的催化作用下,二氧化硫和氧气反应生成三氧化硫(SO3):_____。
17.下图是某一变化过程的微观示意图,请回答下列问题:
(1)该反应的化学方程式是_______;该反应的基本类型为_______。
(2)生成物中氧化物与单质的质量比_______。
18.下图是氢气在氯气中燃烧的微观示意图。据图作答:
(1)一个氯分子是由_______________构成的;在该化学反应前后,没有发生变化的微粒是____________(填微粒的名称)。
(2)该反应的化学方程式是__________________________。
19.硫在氧气中燃烧的化学方程式是:S+O2SO2.这个式子不仅表明了反应物是_______,生成物是______,反应条件是______,还表示了参与反应的各物质之间的质量关系,即在点燃条件下,每______份质量的硫 ______份质量的氧气恰好完全反应生成______份质量的二氧化硫.
20.在A+B==C+D的反应中,5gA物质跟4gB物质恰好完全反应,生成3gC物质和_____克D物质,这是根据_____定律进行上述计算的。
三、实验题
21.实验室常用溶质质量分数为6%的H2O2溶液(MnO2作催化剂)制取氧气。
(1)配制质量分数为6%的H2O2溶液。
①计算:配制150g质量分数为6%的H2O2溶液,需要质量分数为30%(密度为1.1g/cm3)的H2O2溶液体积为______mL(计算结果保留一位小数),水为______g。
②量取:用量筒量取所需H2O2溶液和水,倒入烧杯中。用量筒量取液体时,视线应与______。
③混匀:…。
(2)制取氧气(可能用到的部分装置如图)。
①实验室用氯酸钾(MnO2作催化剂)制取干燥的氧气,选择的发生装置和收集装置为______(填字母),反应的化学方程式为______。
②实验室用发生装置B制取氧气的化学方程式为______。
(3)实验反思。
①若其他操作正确,量取水时俯视读数,则配制的H2O2溶液溶质质量分数______6%(填“>”、“<”或“=”)。
②若用E装置收集一瓶(容积为200mL)体积分数为80%的氧气,预先应用量筒量取______mL的水加入该集气瓶中(不考虑水蒸气的影响)。
22.化学实验是进行科学探究的重要途径。某研究性学习小组欲利用下列装置进行相关气体制取的探究,请你分析并回答问题:
(1)图中标号a的仪器名称是______。
(2)若用加热高锰酸钾固体制取并收集一集气瓶氧气,可选用的装置组合是______(填字母序号)。
(3)实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式为______。
主要操作步骤有:①检查装置的气密性;②收集并验满气体;③装入药品;④组装仪器。
正确的操作顺序是______(填数字序号)。
(4)F是密封良好充满空气的单气阀充气袋,现用F收集一袋较纯净的氧气,则导气管口b、c连接之前需进行的一项操作是______。
23.质量守恒定律具有非常重要的价值和意义。
将下列A、B、C装置分别放在装置D天平上,用砝码平衡。然后取下锥形瓶,将锥形瓶倾斜,使液体药品与固体药品接触,一段时间后再把锥形瓶放在天平上。
(1)①以上实验能验证质量守恒定律的是_______(填字母)。
②选一个实验,写出能证明“质量守恒定律”的实验现象___;并写出相应反应的化学方程式____。
(2)以上实验中,选一个不能验证质量守恒定律的实验,解释原因_______。
四、计算题
24.高温煅烧含杂质10%的石灰石(主要成分为CaCO3)100吨,可得生石灰( CaO)多少吨?
25.“蛟龙号”是我国研制出的大深度载人潜水器。为保证载人潜水器长时间潜水,需要在潜水器里配备供氧装置。过氧化物供氧是一种常见的供氧技术,原理是用过氧化钠(化学式为Na2O2)固体常温下与二氧化碳反应,生成碳酸钠和氧气。若用这种方法制取96g氧气,则至少需要含过氧化钠60%的过氧化钠样品多少克?(反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.D
4.A
5.C
6.C
7.D
8.C
9.B
10.C
11.D
12.A
13.C
14.D
15.A
16. 3Fe2+ CO Al(NO3)3 2SO2+O2 2SO3
17.(1) 分解反应
(2)9:8
18. 2个氯原子 氢原子和氯原子
19. 硫和氧气 二氧化硫 点燃 32 32 64
20. 6 质量守恒
21.(1) 27.3 120 液体凹液面的最低处保持水平
(2) ADDA
(3) > 150
22.(1)分液漏斗
(2)ACAEAC或AE
(3) ④①③②
(4)排尽充气袋内的空气
23.(1) B 银白色铁钉表面析出红色固体,溶液由蓝色变为浅绿色,天平读数不变 Fe+CuSO4=FeSO4+Cu
(2)A实验:反应生成氧气,气球鼓起,浮力增大,天平读数变小;C实验:反应产物二氧化碳逸出锥形瓶,未被称量,天平读数变小
24.50.4
25.解:设至少需要含过氧化钠60%的过氧化钠样品的质量为x
x=780g
答:至少需要含过氧化钠60%的过氧化钠样品的质量为780g。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
