课题9.2 溶解度第1课时(课件26张)
文档属性
| 名称 | 课题9.2 溶解度第1课时(课件26张) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-07 15:29:56 | ||
图片预览





文档简介
(共26张PPT)
中物理
第九单元 溶液
人教版 化学(初中)
课题2 溶解度第1课时
4
典型例题
3
课堂小结
2
新课讲授
1
课堂导入
1
课堂导入
青海湖
在我国西部地区分布着许多美丽而奇特的盐碱湖,其中蕴藏着极其丰富的食盐和纯碱。有趣的是,当地人在生活实践中总结了一条规律,就是“冬天捞碱,夏天晒盐”。你知道
为什么“冬天捞碱,夏天晒盐”吗
这其中蕴含着什么科学道理呢
2
新课讲授
氯化钠在水中的溶解
一、饱和溶液
一、饱和溶液
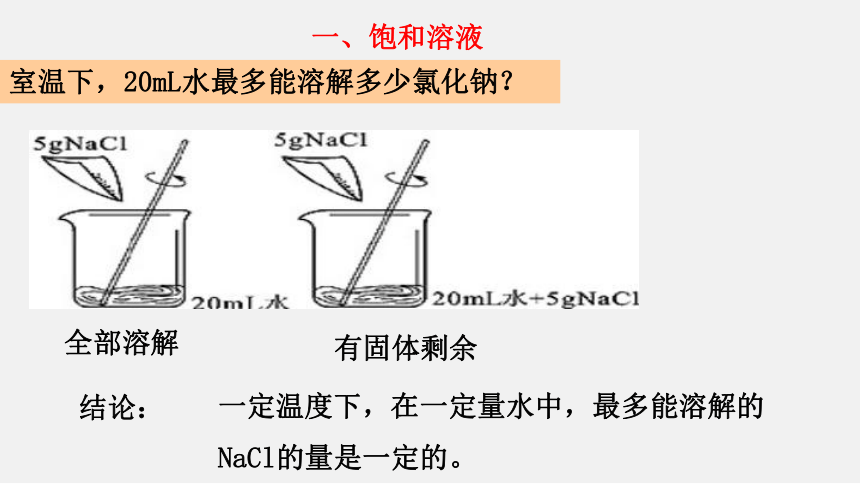
室温下,20mL水最多能溶解多少氯化钠?
全部溶解
有固体剩余
结论:
一定温度下,在一定量水中,最多能溶解的NaCl的量是一定的。
一、饱和溶液
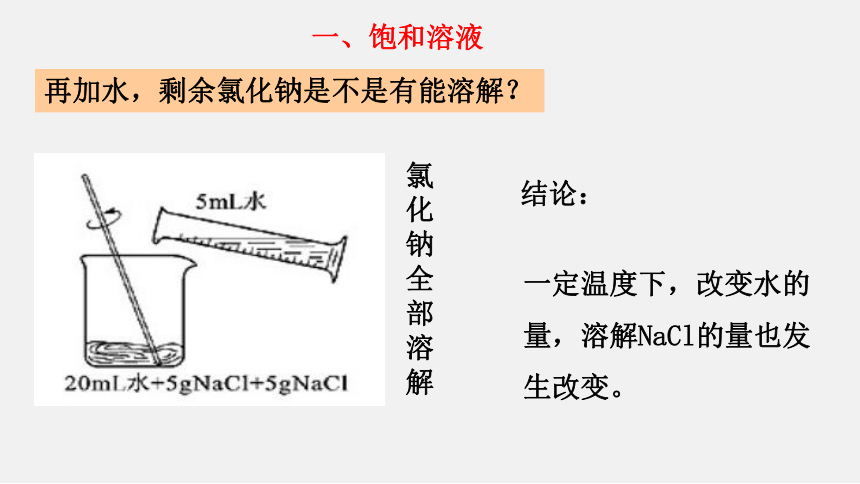
再加水,剩余氯化钠是不是有能溶解?
氯化钠全部溶解
结论:
一定温度下,改变水的量,溶解NaCl的量也发生改变。
一、饱和溶液
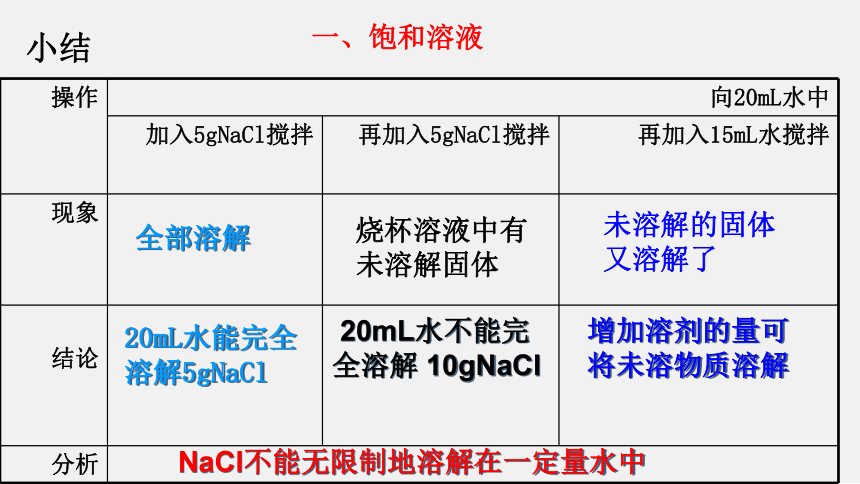
操作 向20mL水中
加入5gNaCl搅拌 再加入5gNaCl搅拌 再加入15mL水搅拌
现象
结论
分析
全部溶解
20mL水能完全溶解5gNaCl
20mL水不能完全溶解 10gNaCl
增加溶剂的量可将未溶物质溶解
NaCl不能无限制地溶解在一定量水中
烧杯溶液中有未溶解固体
未溶解的固体又溶解了
小结
一、饱和溶液
一、饱和溶液
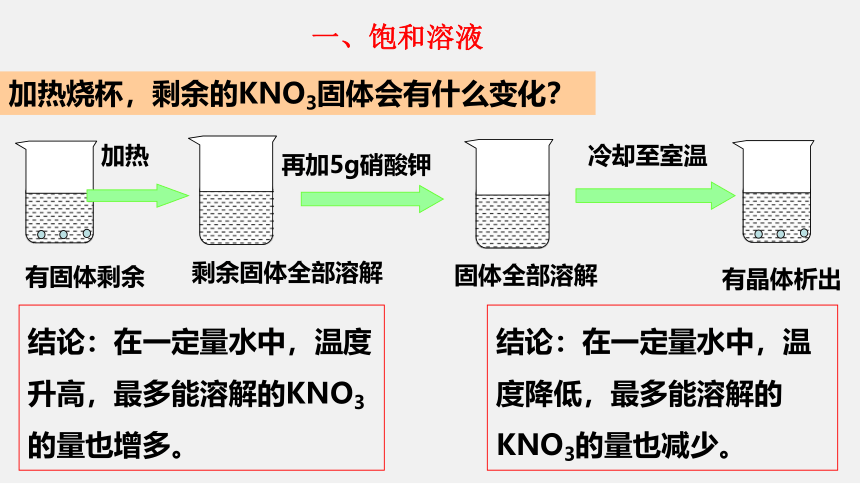
加热烧杯,剩余的KNO3固体会有什么变化?
有固体剩余
加热
剩余固体全部溶解
再加5g硝酸钾
固体全部溶解
冷却至室温
有晶体析出
结论:在一定量水中,温度升高,最多能溶解的KNO3的量也增多。
结论:在一定量水中,温度降低,最多能溶解的KNO3的量也减少。
一、饱和溶液
小结
操作 现象 结论
加入5gKNO3搅拌
再加入5gKNO3搅拌
…… ……
加热
再加入5gKNO3搅拌
冷却
全部溶解
有晶体析出
温度可以影响
KNO3的溶解
能力
一、饱和溶液
◆饱和溶液:
在一定的温度下,向一定量的溶剂里加入某种溶质,当溶质不能再溶解时,所得到的溶液叫做饱和溶液。
在一定的温度下,向一定量的溶剂里加入某种溶质,当溶质还能继续再溶解时,所得到的溶液叫做不饱和溶液。
◆不饱和溶液:
一、饱和溶液
注意:
1.对饱和与不饱和溶液应明确前提条件: “一定量的溶剂里”和“一定温度下” ,因为在一定条件下它们互相转变。
2.应明确溶质的种类:因为在一定温度下,一定量的溶剂里形成的某溶质的饱和溶液,不能再溶解这种物质,但还能溶解其他溶质
3.饱和与不饱和溶液不是固定不变的,外界条件改变时,溶液的饱和状态也会发生相应的改变。
一、饱和溶液
“饱和”与“不饱和”是相对而言的,在一定的条件下是可以互相转变的。
饱和溶液
不饱和溶液
增加溶质、
蒸发溶剂、
增加溶剂、
降低温度
升高温度
注:以上为通常情况,不适合所有的物质。
一、饱和溶液
怎样判断溶液是否饱和?
1. 如果溶液中有未溶解的溶质, 观察能否继续溶解,若不能继续溶解,则是饱和溶液;反之,则是不饱和溶液。
2.如果溶液中无剩余物质,则加少量的溶质,溶质能继续溶解的是不饱和溶液,不能继续溶解的是饱和溶液。
一、饱和溶液
结晶及其方法
热的溶液冷却后,已溶解在溶液中的硝酸钾从溶液中以晶体的形式析出,这一过程叫做结晶。
冷却后硝酸钾晶体从溶液中析出
硝酸钾晶体
冷却热饱和溶液
一、饱和溶液
蒸发结晶
一、饱和溶液
海水晒盐
一、饱和溶液
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工产品
人们利用以上原理从海水中提取食盐,并得到含有大量化工原料的母液(叫做苦卤),其大致过程如下:
一、饱和溶液
1.溶质氯化钠在哪个池中形成的溶液一定是饱和溶液?
4.如何将粗盐中的可溶性杂质氯化钙、硫酸镁等除去?
3.如何将粗盐中的不溶性杂质除去?
2.你能分析母液的成分吗?
结晶池
氯化钠、氯化钙、氯化镁等
过滤
用饱和的氯化钠溶液冲洗
一、饱和溶液
浓溶液与稀溶液
①稀、浓溶液仅指一定量溶液中含有溶质的多少。
饱和溶液与不饱和溶液仅指在一定温度下,一定量溶剂中还能不能继续溶解某种溶质。
溶液是否饱和与溶液的浓稀没有必然关系。
②对于不同溶质或同种溶质在不同温度下来说,饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
③在相同温度下,同种溶剂、同种溶质的饱和溶液要比其不饱和溶液浓度大。
一、饱和溶液
浓、稀溶液与饱和、不饱和溶液的关系:
总结: 浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
浓溶液
稀溶液
不饱和溶液
饱和溶液
用图示表示
3
课堂小结
概念
饱和溶液
结晶方法
在一定温度下,一定量的溶剂里不能再继续溶解某种溶质的溶液称为该物质的饱和溶液。
转换
判断溶液是否饱和的方法
饱和溶液 不饱和溶液
增加溶剂,升高温度
增加溶质,蒸发溶剂,降低温度
溶液饱和与否和溶液浓稀的关系
蒸发溶剂、冷却热饱和溶液
4
典型例题
1·t℃时,有一杯接近饱和的硝酸钾溶液,下列做法一定不能使其变为饱和溶液的是( )
A.恒温蒸发溶剂
B.减低溶液的温度
C.向溶液中加入硝酸钾
D.向溶液中加入t℃时硝酸钾的饱和溶液
2·通常情况下,欲将一杯不饱和的食盐水变成饱和溶液,最适宜的方法是( )
A、往食盐水中加食盐 B、往食盐水中加水
C、往食盐水中加入饱和食盐水 D、把食盐水放入冰箱中
D
A
3、将硝酸钾不饱和溶液Wg,恒温蒸发至有一定量的晶体析出。下图能正确表示该过程中溶质的质量分数(A%)与蒸发时间(t)的关系是( )
4、下列说法正确的是( )
A.均一、稳定的液体都是溶液
B.溶质均以离子形式分散到溶剂中
C.同一温度下,硝酸钾的饱和溶液比不饱和溶液浓
D.饱和溶液析出晶体后溶质质量分数一定变小
C
C
4·用“不变”“增加”或“减少”填空。
在一定温度下,向饱和的NaCl溶液中:
(1)加入少量NaCl后,溶液的质量_________。
(2)若向其中加入少量水,则溶质的质量________,溶液的质量_______。
(3)若温度不变蒸发掉少量水,则溶质的质量________,溶液的质量________。
不变
不变
增加
减少
减少
THANKS
“
”
中物理
第九单元 溶液
人教版 化学(初中)
课题2 溶解度第1课时
4
典型例题
3
课堂小结
2
新课讲授
1
课堂导入
1
课堂导入
青海湖
在我国西部地区分布着许多美丽而奇特的盐碱湖,其中蕴藏着极其丰富的食盐和纯碱。有趣的是,当地人在生活实践中总结了一条规律,就是“冬天捞碱,夏天晒盐”。你知道
为什么“冬天捞碱,夏天晒盐”吗
这其中蕴含着什么科学道理呢
2
新课讲授
氯化钠在水中的溶解
一、饱和溶液
一、饱和溶液
室温下,20mL水最多能溶解多少氯化钠?
全部溶解
有固体剩余
结论:
一定温度下,在一定量水中,最多能溶解的NaCl的量是一定的。
一、饱和溶液
再加水,剩余氯化钠是不是有能溶解?
氯化钠全部溶解
结论:
一定温度下,改变水的量,溶解NaCl的量也发生改变。
一、饱和溶液
操作 向20mL水中
加入5gNaCl搅拌 再加入5gNaCl搅拌 再加入15mL水搅拌
现象
结论
分析
全部溶解
20mL水能完全溶解5gNaCl
20mL水不能完全溶解 10gNaCl
增加溶剂的量可将未溶物质溶解
NaCl不能无限制地溶解在一定量水中
烧杯溶液中有未溶解固体
未溶解的固体又溶解了
小结
一、饱和溶液
一、饱和溶液
加热烧杯,剩余的KNO3固体会有什么变化?
有固体剩余
加热
剩余固体全部溶解
再加5g硝酸钾
固体全部溶解
冷却至室温
有晶体析出
结论:在一定量水中,温度升高,最多能溶解的KNO3的量也增多。
结论:在一定量水中,温度降低,最多能溶解的KNO3的量也减少。
一、饱和溶液
小结
操作 现象 结论
加入5gKNO3搅拌
再加入5gKNO3搅拌
…… ……
加热
再加入5gKNO3搅拌
冷却
全部溶解
有晶体析出
温度可以影响
KNO3的溶解
能力
一、饱和溶液
◆饱和溶液:
在一定的温度下,向一定量的溶剂里加入某种溶质,当溶质不能再溶解时,所得到的溶液叫做饱和溶液。
在一定的温度下,向一定量的溶剂里加入某种溶质,当溶质还能继续再溶解时,所得到的溶液叫做不饱和溶液。
◆不饱和溶液:
一、饱和溶液
注意:
1.对饱和与不饱和溶液应明确前提条件: “一定量的溶剂里”和“一定温度下” ,因为在一定条件下它们互相转变。
2.应明确溶质的种类:因为在一定温度下,一定量的溶剂里形成的某溶质的饱和溶液,不能再溶解这种物质,但还能溶解其他溶质
3.饱和与不饱和溶液不是固定不变的,外界条件改变时,溶液的饱和状态也会发生相应的改变。
一、饱和溶液
“饱和”与“不饱和”是相对而言的,在一定的条件下是可以互相转变的。
饱和溶液
不饱和溶液
增加溶质、
蒸发溶剂、
增加溶剂、
降低温度
升高温度
注:以上为通常情况,不适合所有的物质。
一、饱和溶液
怎样判断溶液是否饱和?
1. 如果溶液中有未溶解的溶质, 观察能否继续溶解,若不能继续溶解,则是饱和溶液;反之,则是不饱和溶液。
2.如果溶液中无剩余物质,则加少量的溶质,溶质能继续溶解的是不饱和溶液,不能继续溶解的是饱和溶液。
一、饱和溶液
结晶及其方法
热的溶液冷却后,已溶解在溶液中的硝酸钾从溶液中以晶体的形式析出,这一过程叫做结晶。
冷却后硝酸钾晶体从溶液中析出
硝酸钾晶体
冷却热饱和溶液
一、饱和溶液
蒸发结晶
一、饱和溶液
海水晒盐
一、饱和溶液
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工产品
人们利用以上原理从海水中提取食盐,并得到含有大量化工原料的母液(叫做苦卤),其大致过程如下:
一、饱和溶液
1.溶质氯化钠在哪个池中形成的溶液一定是饱和溶液?
4.如何将粗盐中的可溶性杂质氯化钙、硫酸镁等除去?
3.如何将粗盐中的不溶性杂质除去?
2.你能分析母液的成分吗?
结晶池
氯化钠、氯化钙、氯化镁等
过滤
用饱和的氯化钠溶液冲洗
一、饱和溶液
浓溶液与稀溶液
①稀、浓溶液仅指一定量溶液中含有溶质的多少。
饱和溶液与不饱和溶液仅指在一定温度下,一定量溶剂中还能不能继续溶解某种溶质。
溶液是否饱和与溶液的浓稀没有必然关系。
②对于不同溶质或同种溶质在不同温度下来说,饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
③在相同温度下,同种溶剂、同种溶质的饱和溶液要比其不饱和溶液浓度大。
一、饱和溶液
浓、稀溶液与饱和、不饱和溶液的关系:
总结: 浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
浓溶液
稀溶液
不饱和溶液
饱和溶液
用图示表示
3
课堂小结
概念
饱和溶液
结晶方法
在一定温度下,一定量的溶剂里不能再继续溶解某种溶质的溶液称为该物质的饱和溶液。
转换
判断溶液是否饱和的方法
饱和溶液 不饱和溶液
增加溶剂,升高温度
增加溶质,蒸发溶剂,降低温度
溶液饱和与否和溶液浓稀的关系
蒸发溶剂、冷却热饱和溶液
4
典型例题
1·t℃时,有一杯接近饱和的硝酸钾溶液,下列做法一定不能使其变为饱和溶液的是( )
A.恒温蒸发溶剂
B.减低溶液的温度
C.向溶液中加入硝酸钾
D.向溶液中加入t℃时硝酸钾的饱和溶液
2·通常情况下,欲将一杯不饱和的食盐水变成饱和溶液,最适宜的方法是( )
A、往食盐水中加食盐 B、往食盐水中加水
C、往食盐水中加入饱和食盐水 D、把食盐水放入冰箱中
D
A
3、将硝酸钾不饱和溶液Wg,恒温蒸发至有一定量的晶体析出。下图能正确表示该过程中溶质的质量分数(A%)与蒸发时间(t)的关系是( )
4、下列说法正确的是( )
A.均一、稳定的液体都是溶液
B.溶质均以离子形式分散到溶剂中
C.同一温度下,硝酸钾的饱和溶液比不饱和溶液浓
D.饱和溶液析出晶体后溶质质量分数一定变小
C
C
4·用“不变”“增加”或“减少”填空。
在一定温度下,向饱和的NaCl溶液中:
(1)加入少量NaCl后,溶液的质量_________。
(2)若向其中加入少量水,则溶质的质量________,溶液的质量_______。
(3)若温度不变蒸发掉少量水,则溶质的质量________,溶液的质量________。
不变
不变
增加
减少
减少
THANKS
“
”
同课章节目录
