2022-2023学年九年级化学人教版下册 11.1生活中常见的盐(第2课时)(共23张PPT)
文档属性
| 名称 | 2022-2023学年九年级化学人教版下册 11.1生活中常见的盐(第2课时)(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-07 17:19:20 | ||
图片预览







文档简介
(共23张PPT)
11.1生活中常见的盐(第2课时)
人教版初中化学—九年级上册—第十一单元:盐 化肥
石灰石
大理石
鸡蛋壳
贝壳、珍珠
CaCO3
一、物理性质
白色固体,难溶于水
二、化学性质
1.与酸反应:CaCO3+2HCl=CaCl2+H2CO3
汉白玉(大理石的品种之一)
CO2↑+H2O
(实验室制CO2)
2.高温分解:CaCO3 CaO+CO2↑
高温
(工业制CO2)
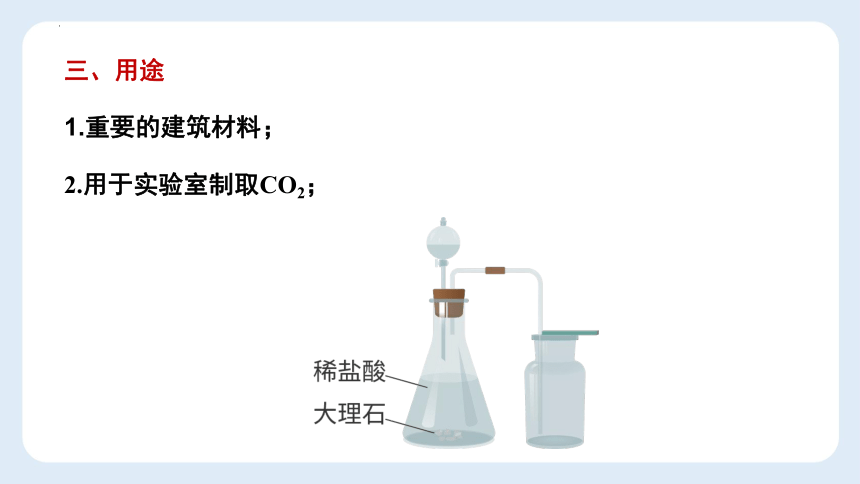
三、用途
1.重要的建筑材料;
三、用途
1.重要的建筑材料;
2.用于实验室制取CO2;
三、用途
1.重要的建筑材料;
2.用于实验室制取CO2;
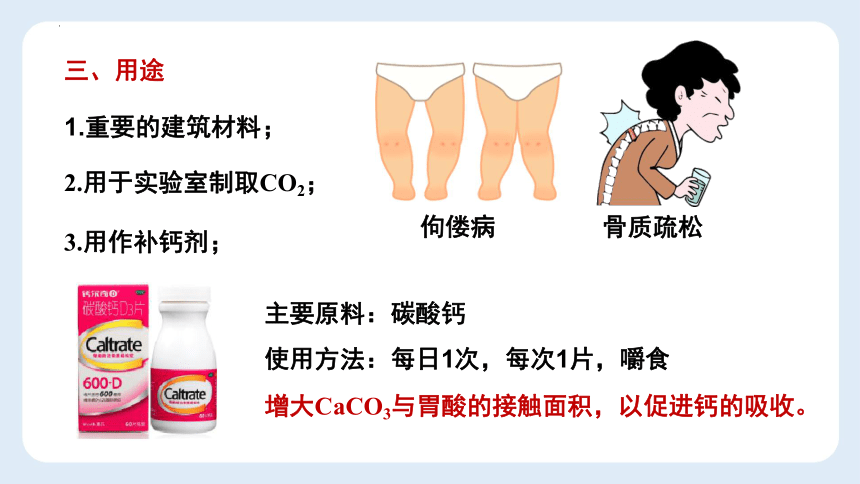
3.用作补钙剂;
骨质疏松
佝偻病
主要原料:碳酸钙
使用方法:每日1次,每次1片,嚼食
增大CaCO3与胃酸的接触面积,以促进钙的吸收。
三、用途
1.重要的建筑材料;
2.用于实验室制取CO2;
3.用作补钙剂;
4.用于工业制CaO和CO2。
四、溶洞的形成
化学原理:
石灰岩
(主要成分是CaCO3)
CaCO3+CO2+H2O Ca(HCO3)2
Ca(HCO3)2 CaCO3↓+CO2↑+H2O
p
钟乳石
石笋
石柱
练习1:将一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯中,可观察到鸡蛋一边冒气泡一边沉到杯底,一会儿又慢慢上浮,到接近液面时又下沉。请解释上述现象。
鸡蛋壳的主要成分是CaCO3,CaCO3能与稀盐酸反应生成CO2气体(CaCO3+2HCl=CaCl2+CO2↑+H2O),气泡附着在鸡蛋壳上,使鸡蛋上浮,接近液面时气泡破裂,鸡蛋下沉,然后又有气泡附着于鸡蛋壳表面,鸡蛋再上浮,于是鸡蛋上下运动。
练习2:“水滴石穿”是指水经常滴在石头上,能使石头穿孔的自然现象。后来常用来比喻只要坚持不懈,持之以恒,细微之力也能做出难办的事。请写出“水滴石穿”这一自然现象中所蕴含的化学原理。
一般石头的主要成分是CaCO3,溶有CO2的水长期与CaCO3作用会生成可溶性的Ca(HCO3)2 (CaCO3+CO2+H2O=Ca(HCO3)2),从而使石块局部缓慢溶解并流失。
四、溶洞的形成
CaCO3+CO2+H2O Ca(HCO3)2
Ca(HCO3)2 CaCO3↓+CO2↑+H2O
一、物理性质
白色固体,难溶于水
二、化学性质
1.与酸反应:CaCO3+2HCl=CaCl2+H2CO3
CO2↑+H2O
(实验室制CO2)
2.高温分解:CaCO3 CaO+CO2↑
高温
(工业制CO2)
三、用途
1.重要的建筑材料;
2.用于实验室制取CO2;
3.用作补钙剂;
4.用于工业制CaO和CO2。
碳酸钠
碳酸氢钠
白色粉末,可溶于水
俗名
物理性质
纯碱、苏打
白色粉末,易溶于水
小苏打
(Na2CO3)
(NaHCO3)
碳酸钠
碳酸氢钠
白色粉末,可溶于水
俗名
物理性质
纯碱、苏打
白色粉末,易溶于水
小苏打
(Na2CO3)
(NaHCO3)
与指示剂作用
化学
性质
能使无色酚酞溶液变红
能使无色酚酞溶液变红
溶液呈碱性
溶液呈碱性
(较深)
(较浅)
(较强)
(较弱)
纯碱不是碱
盐溶液不一定呈中性。
碳酸钠
碳酸氢钠
白色粉末,可溶于水
俗名
物理性质
纯碱、苏打
白色粉末,易溶于水
小苏打
(Na2CO3)
(NaHCO3)
与指示剂作用
化学
性质
能使无色酚酞溶液变红
能使无色酚酞溶液变红
溶液呈碱性
溶液呈碱性
(较深)
(较浅)
(较强)
(较弱)
与酸反应
有气泡冒出
有气泡冒出
变浑浊
变浑浊
两者都能与酸反应,放出CO2
(较剧烈)
Na2CO3+2HCl=2NaCl+H2CO3
CO2↑+ H2O
NaHCO3+HCl=NaCl+H2CO3
CO2↑+ H2O
与指示剂作用
化学
性质
能使无色酚酞溶液变红
能使无色酚酞溶液变红
溶液呈碱性
溶液呈碱性
(较深)
(较浅)
(较强)
(较弱)
与酸反应
Na2CO3+2HCl=2NaCl+H2CO3
CO2↑+ H2O
NaHCO3+HCl=NaCl+H2CO3
CO2↑+ H2O
(较剧烈)
碳酸钠
碳酸氢钠
(Na2CO3)
(NaHCO3)
与澄清石灰水反应
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
能反应
与指示剂作用
化学
性质
能使无色酚酞溶液变红
能使无色酚酞溶液变红
溶液呈碱性
溶液呈碱性
(较深)
(较浅)
(较强)
(较弱)
与酸反应
Na2CO3+2HCl=2NaCl+H2CO3
CO2↑+ H2O
NaHCO3+HCl=NaCl+H2CO3
CO2↑+ H2O
(较剧烈)
碳酸钠
碳酸氢钠
(Na2CO3)
(NaHCO3)
与澄清石灰水反应
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
能反应
热稳定性
稳定
受热易分解
2NaHCO3=Na2CO3+H2O+CO2↑
与指示剂作用
化学
性质
能使无色酚酞溶液变红
能使无色酚酞溶液变红
溶液呈碱性
溶液呈碱性
(较深)
(较浅)
(较强)
(较弱)
与酸反应
Na2CO3+2HCl=2NaCl+H2CO3
CO2↑+ H2O
NaHCO3+HCl=NaCl+H2CO3
CO2↑+ H2O
(较剧烈)
碳酸钠
碳酸氢钠
(Na2CO3)
(NaHCO3)
与澄清石灰水反应
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
能反应
热稳定性
稳定
受热易分解
2NaHCO3=Na2CO3+H2O+CO2↑
用途
洗涤剂、
造纸、纺织;
制NaOH;
制玻璃等
侯德榜
制碱工业先驱
联合制碱法
(又称侯氏制碱法)
与指示剂作用
化学
性质
能使无色酚酞溶液变红
能使无色酚酞溶液变红
溶液呈碱性
溶液呈碱性
(较深)
(较浅)
(较强)
(较弱)
与酸反应
Na2CO3+2HCl=2NaCl+H2CO3
CO2↑+ H2O
NaHCO3+HCl=NaCl+H2CO3
CO2↑+ H2O
(较剧烈)
碳酸钠
碳酸氢钠
(Na2CO3)
(NaHCO3)
与澄清石灰水反应
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
能反应
热稳定性
稳定
受热易分解
2NaHCO3=Na2CO3+H2O+CO2↑
用途
洗涤剂、
造纸、纺织;
制NaOH;
制玻璃等
胃药、
发酵粉;
干粉灭火器、
泡沫灭火器等
与指示剂作用
化学
性质
能使无色酚酞溶液变红
能使无色酚酞溶液变红
溶液呈碱性
溶液呈碱性
(较深)
(较浅)
(较强)
(较弱)
与酸反应
Na2CO3+2HCl=2NaCl+H2CO3
CO2↑+ H2O
NaHCO3+HCl=NaCl+H2CO3
CO2↑+ H2O
(较剧烈)
碳酸钠
碳酸氢钠
(Na2CO3)
(NaHCO3)
与澄清石灰水反应
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
能反应
热稳定性
稳定
受热易分解
2NaHCO3=Na2CO3+H2O+CO2↑
用途
洗涤剂、
造纸、纺织;
制NaOH;
制玻璃等
胃药、
发酵粉;
干粉灭火器、
泡沫灭火器等
练习:下列关于Na2CO3和NaHCO3的说法中正确的是( )
A.Na2CO3广泛用于玻璃、造纸、纺织和洗涤剂的生产,俗称小苏打
B.做面包时常用到一种既能减少面粉发酵产生的酸,又能使面包松软的白色物质是烧碱
C.我国制碱工业先驱侯德榜发明了联合制碱法,制得的纯碱是一种碱
D.小苏打可在一定条件下转化为苏打
D
Thanks
11.1生活中常见的盐(第2课时)
人教版初中化学—九年级上册—第十一单元:盐 化肥
石灰石
大理石
鸡蛋壳
贝壳、珍珠
CaCO3
一、物理性质
白色固体,难溶于水
二、化学性质
1.与酸反应:CaCO3+2HCl=CaCl2+H2CO3
汉白玉(大理石的品种之一)
CO2↑+H2O
(实验室制CO2)
2.高温分解:CaCO3 CaO+CO2↑
高温
(工业制CO2)
三、用途
1.重要的建筑材料;
三、用途
1.重要的建筑材料;
2.用于实验室制取CO2;
三、用途
1.重要的建筑材料;
2.用于实验室制取CO2;
3.用作补钙剂;
骨质疏松
佝偻病
主要原料:碳酸钙
使用方法:每日1次,每次1片,嚼食
增大CaCO3与胃酸的接触面积,以促进钙的吸收。
三、用途
1.重要的建筑材料;
2.用于实验室制取CO2;
3.用作补钙剂;
4.用于工业制CaO和CO2。
四、溶洞的形成
化学原理:
石灰岩
(主要成分是CaCO3)
CaCO3+CO2+H2O Ca(HCO3)2
Ca(HCO3)2 CaCO3↓+CO2↑+H2O
p
钟乳石
石笋
石柱
练习1:将一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯中,可观察到鸡蛋一边冒气泡一边沉到杯底,一会儿又慢慢上浮,到接近液面时又下沉。请解释上述现象。
鸡蛋壳的主要成分是CaCO3,CaCO3能与稀盐酸反应生成CO2气体(CaCO3+2HCl=CaCl2+CO2↑+H2O),气泡附着在鸡蛋壳上,使鸡蛋上浮,接近液面时气泡破裂,鸡蛋下沉,然后又有气泡附着于鸡蛋壳表面,鸡蛋再上浮,于是鸡蛋上下运动。
练习2:“水滴石穿”是指水经常滴在石头上,能使石头穿孔的自然现象。后来常用来比喻只要坚持不懈,持之以恒,细微之力也能做出难办的事。请写出“水滴石穿”这一自然现象中所蕴含的化学原理。
一般石头的主要成分是CaCO3,溶有CO2的水长期与CaCO3作用会生成可溶性的Ca(HCO3)2 (CaCO3+CO2+H2O=Ca(HCO3)2),从而使石块局部缓慢溶解并流失。
四、溶洞的形成
CaCO3+CO2+H2O Ca(HCO3)2
Ca(HCO3)2 CaCO3↓+CO2↑+H2O
一、物理性质
白色固体,难溶于水
二、化学性质
1.与酸反应:CaCO3+2HCl=CaCl2+H2CO3
CO2↑+H2O
(实验室制CO2)
2.高温分解:CaCO3 CaO+CO2↑
高温
(工业制CO2)
三、用途
1.重要的建筑材料;
2.用于实验室制取CO2;
3.用作补钙剂;
4.用于工业制CaO和CO2。
碳酸钠
碳酸氢钠
白色粉末,可溶于水
俗名
物理性质
纯碱、苏打
白色粉末,易溶于水
小苏打
(Na2CO3)
(NaHCO3)
碳酸钠
碳酸氢钠
白色粉末,可溶于水
俗名
物理性质
纯碱、苏打
白色粉末,易溶于水
小苏打
(Na2CO3)
(NaHCO3)
与指示剂作用
化学
性质
能使无色酚酞溶液变红
能使无色酚酞溶液变红
溶液呈碱性
溶液呈碱性
(较深)
(较浅)
(较强)
(较弱)
纯碱不是碱
盐溶液不一定呈中性。
碳酸钠
碳酸氢钠
白色粉末,可溶于水
俗名
物理性质
纯碱、苏打
白色粉末,易溶于水
小苏打
(Na2CO3)
(NaHCO3)
与指示剂作用
化学
性质
能使无色酚酞溶液变红
能使无色酚酞溶液变红
溶液呈碱性
溶液呈碱性
(较深)
(较浅)
(较强)
(较弱)
与酸反应
有气泡冒出
有气泡冒出
变浑浊
变浑浊
两者都能与酸反应,放出CO2
(较剧烈)
Na2CO3+2HCl=2NaCl+H2CO3
CO2↑+ H2O
NaHCO3+HCl=NaCl+H2CO3
CO2↑+ H2O
与指示剂作用
化学
性质
能使无色酚酞溶液变红
能使无色酚酞溶液变红
溶液呈碱性
溶液呈碱性
(较深)
(较浅)
(较强)
(较弱)
与酸反应
Na2CO3+2HCl=2NaCl+H2CO3
CO2↑+ H2O
NaHCO3+HCl=NaCl+H2CO3
CO2↑+ H2O
(较剧烈)
碳酸钠
碳酸氢钠
(Na2CO3)
(NaHCO3)
与澄清石灰水反应
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
能反应
与指示剂作用
化学
性质
能使无色酚酞溶液变红
能使无色酚酞溶液变红
溶液呈碱性
溶液呈碱性
(较深)
(较浅)
(较强)
(较弱)
与酸反应
Na2CO3+2HCl=2NaCl+H2CO3
CO2↑+ H2O
NaHCO3+HCl=NaCl+H2CO3
CO2↑+ H2O
(较剧烈)
碳酸钠
碳酸氢钠
(Na2CO3)
(NaHCO3)
与澄清石灰水反应
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
能反应
热稳定性
稳定
受热易分解
2NaHCO3=Na2CO3+H2O+CO2↑
与指示剂作用
化学
性质
能使无色酚酞溶液变红
能使无色酚酞溶液变红
溶液呈碱性
溶液呈碱性
(较深)
(较浅)
(较强)
(较弱)
与酸反应
Na2CO3+2HCl=2NaCl+H2CO3
CO2↑+ H2O
NaHCO3+HCl=NaCl+H2CO3
CO2↑+ H2O
(较剧烈)
碳酸钠
碳酸氢钠
(Na2CO3)
(NaHCO3)
与澄清石灰水反应
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
能反应
热稳定性
稳定
受热易分解
2NaHCO3=Na2CO3+H2O+CO2↑
用途
洗涤剂、
造纸、纺织;
制NaOH;
制玻璃等
侯德榜
制碱工业先驱
联合制碱法
(又称侯氏制碱法)
与指示剂作用
化学
性质
能使无色酚酞溶液变红
能使无色酚酞溶液变红
溶液呈碱性
溶液呈碱性
(较深)
(较浅)
(较强)
(较弱)
与酸反应
Na2CO3+2HCl=2NaCl+H2CO3
CO2↑+ H2O
NaHCO3+HCl=NaCl+H2CO3
CO2↑+ H2O
(较剧烈)
碳酸钠
碳酸氢钠
(Na2CO3)
(NaHCO3)
与澄清石灰水反应
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
能反应
热稳定性
稳定
受热易分解
2NaHCO3=Na2CO3+H2O+CO2↑
用途
洗涤剂、
造纸、纺织;
制NaOH;
制玻璃等
胃药、
发酵粉;
干粉灭火器、
泡沫灭火器等
与指示剂作用
化学
性质
能使无色酚酞溶液变红
能使无色酚酞溶液变红
溶液呈碱性
溶液呈碱性
(较深)
(较浅)
(较强)
(较弱)
与酸反应
Na2CO3+2HCl=2NaCl+H2CO3
CO2↑+ H2O
NaHCO3+HCl=NaCl+H2CO3
CO2↑+ H2O
(较剧烈)
碳酸钠
碳酸氢钠
(Na2CO3)
(NaHCO3)
与澄清石灰水反应
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
能反应
热稳定性
稳定
受热易分解
2NaHCO3=Na2CO3+H2O+CO2↑
用途
洗涤剂、
造纸、纺织;
制NaOH;
制玻璃等
胃药、
发酵粉;
干粉灭火器、
泡沫灭火器等
练习:下列关于Na2CO3和NaHCO3的说法中正确的是( )
A.Na2CO3广泛用于玻璃、造纸、纺织和洗涤剂的生产,俗称小苏打
B.做面包时常用到一种既能减少面粉发酵产生的酸,又能使面包松软的白色物质是烧碱
C.我国制碱工业先驱侯德榜发明了联合制碱法,制得的纯碱是一种碱
D.小苏打可在一定条件下转化为苏打
D
Thanks
同课章节目录
