2022-2023学年化学沪教版(上海)--初识酸和碱(word 含答案)
文档属性
| 名称 | 2022-2023学年化学沪教版(上海)--初识酸和碱(word 含答案) |
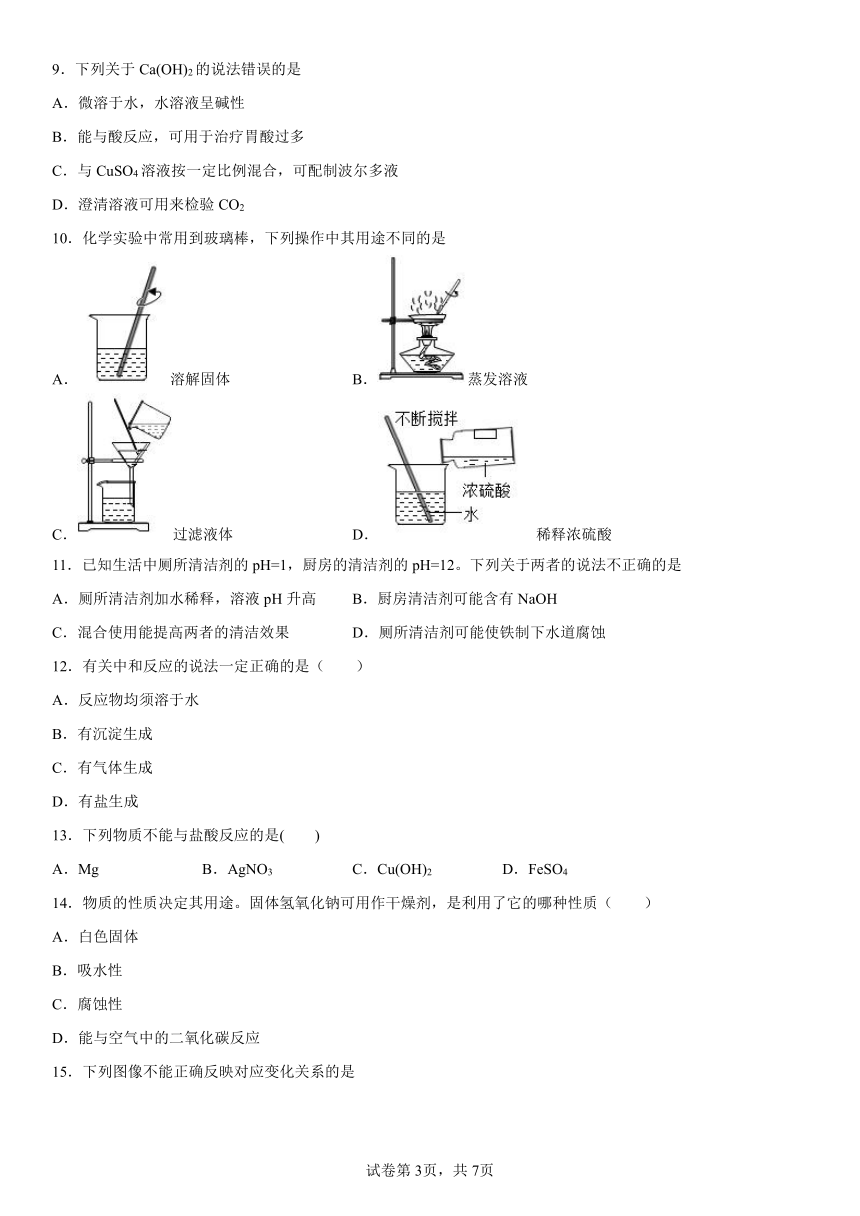
|
|
| 格式 | docx | ||
| 文件大小 | 146.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-07 15:09:42 | ||
图片预览

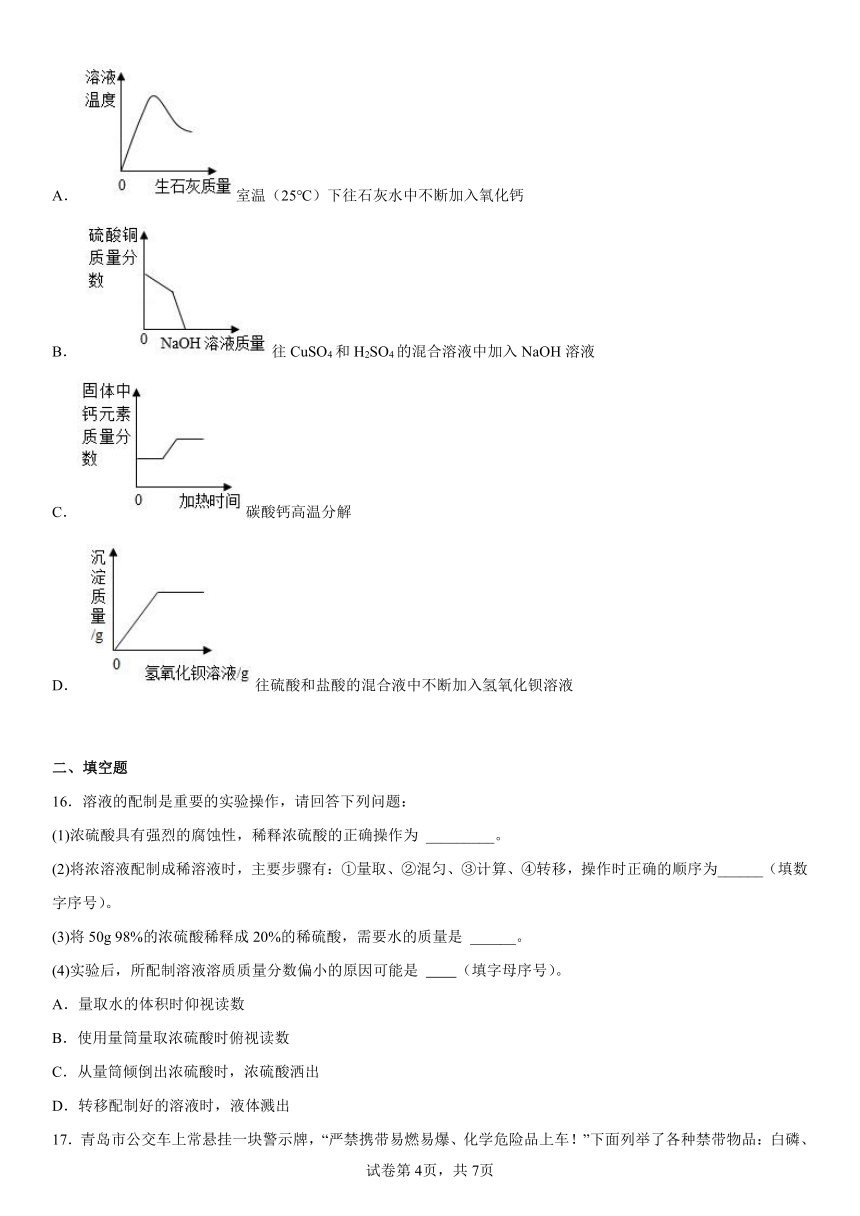

文档简介
2022-2023学年化学沪教版(上海)--初识酸和碱
一、单选题
1.下列有关溶液的说法正确的是
A.碘酒溶液中,酒精为溶质 B.向水中加入蔗糖,导电性明显增强
C.氢氧化钙的溶解度随温度升高而增大 D.积雪的路而撒食盐、可以促进积雪融化
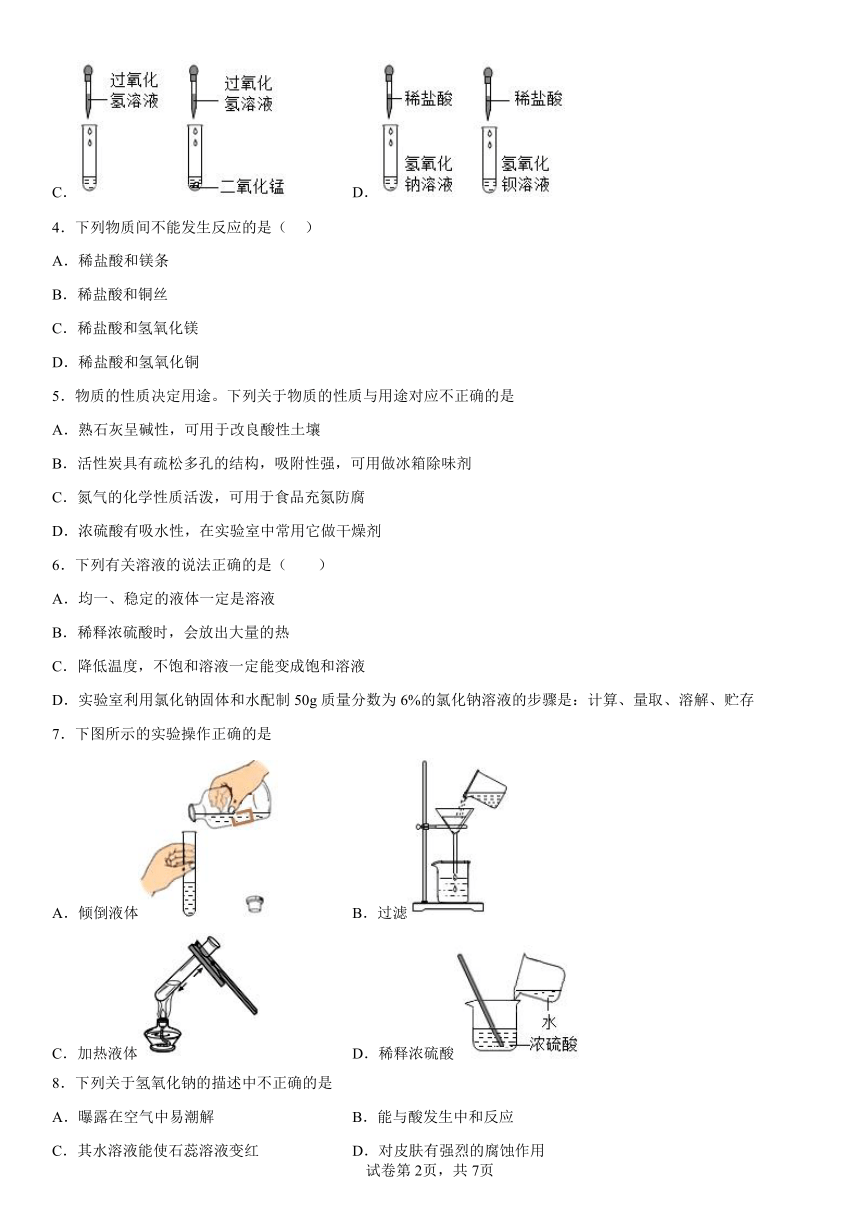
2.化学实验中常会出现一些“出乎意料”的现象或结果,下列各项对相关异常情况的解释不合理的是
实验 验证氧气的化学性质 除去粗盐中的泥沙 测定空气中氧气的含量 检验实验室制出的二氧化碳
异常情况 未看到火星四射 滤液浑浊 测定结果偏大 澄清石灰水未变浑浊
选项 A.可能是温度未达到铁丝的着火点 B.可能是滤纸破损 C.可能是红磷的量不足 D.可能是二氧化碳中混有氯化氢气体
A.A B.B C.C D.D
3.通过观察和实验等方法,人们找到物质变化的证据,下列四组研究化学反应快慢的对比实验中,各组所用溶液浓度相同且适宜、所用固体表面积相同,其中现象最不明显的一组是
A. B.
C. D.
4.下列物质间不能发生反应的是( )
A.稀盐酸和镁条
B.稀盐酸和铜丝
C.稀盐酸和氢氧化镁
D.稀盐酸和氢氧化铜
5.物质的性质决定用途。下列关于物质的性质与用途对应不正确的是
A.熟石灰呈碱性,可用于改良酸性土壤
B.活性炭具有疏松多孔的结构,吸附性强,可用做冰箱除味剂
C.氮气的化学性质活泼,可用于食品充氮防腐
D.浓硫酸有吸水性,在实验室中常用它做干燥剂
6.下列有关溶液的说法正确的是( )
A.均一、稳定的液体一定是溶液
B.稀释浓硫酸时,会放出大量的热
C.降低温度,不饱和溶液一定能变成饱和溶液
D.实验室利用氯化钠固体和水配制50g质量分数为6%的氯化钠溶液的步骤是:计算、量取、溶解、贮存
7.下图所示的实验操作正确的是
A.倾倒液体 B.过滤
C.加热液体 D.稀释浓硫酸
8.下列关于氢氧化钠的描述中不正确的是
A.曝露在空气中易潮解 B.能与酸发生中和反应
C.其水溶液能使石蕊溶液变红 D.对皮肤有强烈的腐蚀作用
9.下列关于Ca(OH)2的说法错误的是
A.微溶于水,水溶液呈碱性
B.能与酸反应,可用于治疗胃酸过多
C.与CuSO4溶液按一定比例混合,可配制波尔多液
D.澄清溶液可用来检验CO2
10.化学实验中常用到玻璃棒,下列操作中其用途不同的是
A.溶解固体 B.蒸发溶液
C.过滤液体 D.稀释浓硫酸
11.已知生活中厕所清洁剂的pH=1,厨房的清洁剂的pH=12。下列关于两者的说法不正确的是
A.厕所清洁剂加水稀释,溶液pH升高 B.厨房清洁剂可能含有NaOH
C.混合使用能提高两者的清洁效果 D.厕所清洁剂可能使铁制下水道腐蚀
12.有关中和反应的说法一定正确的是( )
A.反应物均须溶于水
B.有沉淀生成
C.有气体生成
D.有盐生成
13.下列物质不能与盐酸反应的是( )
A.Mg B.AgNO3 C.Cu(OH)2 D.FeSO4
14.物质的性质决定其用途。固体氢氧化钠可用作干燥剂,是利用了它的哪种性质( )
A.白色固体
B.吸水性
C.腐蚀性
D.能与空气中的二氧化碳反应
15.下列图像不能正确反映对应变化关系的是
A.室温(25℃)下往石灰水中不断加入氧化钙
B.往CuSO4和H2SO4的混合溶液中加入NaOH溶液
C.碳酸钙高温分解
D.往硫酸和盐酸的混合液中不断加入氢氧化钡溶液
二、填空题
16.溶液的配制是重要的实验操作,请回答下列问题:
(1)浓硫酸具有强烈的腐蚀性,稀释浓硫酸的正确操作为 _________。
(2)将浓溶液配制成稀溶液时,主要步骤有:①量取、②混匀、③计算、④转移,操作时正确的顺序为______(填数字序号)。
(3)将50g 98%的浓硫酸稀释成20%的稀硫酸,需要水的质量是 ______。
(4)实验后,所配制溶液溶质质量分数偏小的原因可能是 (填字母序号)。
A.量取水的体积时仰视读数
B.使用量筒量取浓硫酸时俯视读数
C.从量筒倾倒出浓硫酸时,浓硫酸洒出
D.转移配制好的溶液时,液体溅出
17.青岛市公交车上常悬挂一块警示牌,“严禁携带易燃易爆、化学危险品上车!”下面列举了各种禁带物品:白磷、油纸、镁、汽油、酒精、硫酸、过氧化氢、烧碱、炸药、烟花炮竹……请从上述物质中选择合适的物质,将其化学式填写在下列空格中。
(1)一种银白色的金属_____。
(2)一种在空气中易自燃的单质_____。
(3)一种浓溶液具有吸水性的酸_____。
(4)一种可溶性碱_____。
18.通过近一年的学习,同学们一定深刻感受到化学就在身边,人类的衣、食、住、行都离不开化学,它使我们的生活变得更加绚丽多彩。请回答下列问题:
(1)你身上的衣服牢固耐穿、易洗快干、抗皱性好,是因为衣料大多都由__________(填“合成纤维”或“天然纤维”)制成。
(2)自2018年以来,宁夏多地区启动深度净化黄河水替换地下水源供水,保障城乡居民饮水安全。黄河水自取水站经过沉淀、过滤、吸附、杀菌消毒,达到国家生活饮用水标准后,输送至千家万户。小刚通过_____,判断自来水仍然是硬水。饮用前,可_____将其软化。
(3)你住的房屋建造时所用的各种材料也和化学有关。例如,用石灰浆粉刷过的墙壁,一段时间后,变得既白又坚固,其原理是__________(用化学方程式表示)。
(4)“共享电动车”方便市民绿色出行,有效缓解了城市交通压力,减少了大气污染,成为现代城市的又一道靓丽“风景”。为防止电动车钢制车架与空气中的_______等接触而生锈,通常在车架表面进行喷漆处理。
19.(1)写成符合下列要求的物质, 将其化学式填入空格中。
①可用于人工降雨的氧化物______;
②可用于金属表面除锈的酸______;
③可改良酸性土壤的碱______。
(2)用上述几种元素组成适当的物质, 出符合下列要求的化学方程式
①有化合物参加的化合反应:______;
②有氧化物生成的分解反应:______。
20.下图为某学习小组在白色点滴板上进行的有关“酸和碱与指示剂反应”的探究实验。
(1)使用白色点滴板进行实验的优点是_____(答一点)。
(2)稀盐酸和稀硫酸都能使紫色的石蕊溶液变红,是因为在不同酸的溶液中都含有相同的_____离子;氢氧化钠溶液和氢氧化钙溶液都能使无色的酚酞溶液变红,是因为在不同碱的溶液中都含有相同的_____离子。
三、推断题
21.小政同学在复习Ca(OH)2化学性质时,归纳出了Ca(OH)2与其它物质间相互反应的关系如图(图中“﹣﹣”表示相连的两种物质能发生反应)。
(1)若X是与其它三种不同类别的化合物,则X可以是_____。
(2)根据图所示的物质间关系,写出其中两个化学方程式:
①_____; ②_____。
四、流程题
22.某工业含镍废料主要成分为NiO,还含有少量FeO、Fe2O3和PbO。采用如下工艺流程回收其中的镍并制备NiSO4晶体。
已知:ⅰ.FeO、Fe2O3和PbO同属于碱性氧化物,能与酸反应生成相应的盐和水。
ⅱ.在常温下的溶解度为0.0041g。
回答下列问题:
(1)“酸溶”时FeO发生反应的化学方程式为_______,此反应类型为_______反应(填基本反应类型)。
(2)滤渣①的主要成分为_______ (填化学式)。
(3)“氧化”时发生反应:H2O2+2FeSO4+H2SO4=X+2H2O,则X为_______ (填化学式),一段时间后,溶液中有气泡出现,可能的原因是_______。
(4)“沉铁”是是为了除去溶液中的Fe3+,改变反应条件(温度、pH),Fe3+会转化为不同的沉淀(如图)。pH=6、90℃时,Fe3+主要转化为_______(填化学式)。
(5)“系列操作”包括:蒸发浓缩、_______、过滤、洗涤、干燥。
(6)分离出硫酸镍晶体后,收集母液并进行循环使用,其意义是_______,同时减少对环境的污染。
五、计算题
23.将16.0g含杂质25%的硫铁矿(主要成分是含有铁、硫两种元素的化合物),高温条件下与空气中的氧气充分反应(杂质不参与反应〕,只生成二氧化硫和8.0 g氧化铁。
(1)计算溶解8.0g氧化铁需要20%的稀硫酸的质量_______ 。
(2)16.0g硫铁矿中含主要成分的质量为_______g,其中硫元素的质量为_______g。
(3)硫铁矿主要成分的化学式为___________。
24.称取5g含杂质的氢氧化钙固体样品放入烧杯中,向烧杯中加入50g溶质的质量分数为7.3%的稀盐酸(假设杂质不与稀盐酸反应),二者恰好完全反应。请计算:固体样品中氢氧化钙的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.D
4.B
5.C
6.B
7.C
8.C
9.B
10.C
11.C
12.D
13.D
14.B
15.A
16.(1)浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散
(2)③①④②
(3)195g
(4)ABC
17.
18. 合成纤维 肥皂水 煮沸 氧气、水蒸气
19. CO2 HCl或H2SO4 Ca(OH)2
20. 药品的用量少,可节约药品或可以同时完成几个实验,便于观察比较 氢 氢氧根
21. CO2 Ca(OH)2+2HCl=CaCl2+2H2O Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
22.(1) FeO+H2SO4=FeSO4+H2O 复分解
(2)PbSO4
(3) Fe2(SO4)3 Fe3+是H2O2分解的催化剂;反应放热,温度上升,促使H2O2分解
(4)FeOOH
(5)降温结晶
(6)提高镍元素的回收率
23. 73.5g 12 6.4 FeS2
24.74%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列有关溶液的说法正确的是
A.碘酒溶液中,酒精为溶质 B.向水中加入蔗糖,导电性明显增强
C.氢氧化钙的溶解度随温度升高而增大 D.积雪的路而撒食盐、可以促进积雪融化
2.化学实验中常会出现一些“出乎意料”的现象或结果,下列各项对相关异常情况的解释不合理的是
实验 验证氧气的化学性质 除去粗盐中的泥沙 测定空气中氧气的含量 检验实验室制出的二氧化碳
异常情况 未看到火星四射 滤液浑浊 测定结果偏大 澄清石灰水未变浑浊
选项 A.可能是温度未达到铁丝的着火点 B.可能是滤纸破损 C.可能是红磷的量不足 D.可能是二氧化碳中混有氯化氢气体
A.A B.B C.C D.D
3.通过观察和实验等方法,人们找到物质变化的证据,下列四组研究化学反应快慢的对比实验中,各组所用溶液浓度相同且适宜、所用固体表面积相同,其中现象最不明显的一组是
A. B.
C. D.
4.下列物质间不能发生反应的是( )
A.稀盐酸和镁条
B.稀盐酸和铜丝
C.稀盐酸和氢氧化镁
D.稀盐酸和氢氧化铜
5.物质的性质决定用途。下列关于物质的性质与用途对应不正确的是
A.熟石灰呈碱性,可用于改良酸性土壤
B.活性炭具有疏松多孔的结构,吸附性强,可用做冰箱除味剂
C.氮气的化学性质活泼,可用于食品充氮防腐
D.浓硫酸有吸水性,在实验室中常用它做干燥剂
6.下列有关溶液的说法正确的是( )
A.均一、稳定的液体一定是溶液
B.稀释浓硫酸时,会放出大量的热
C.降低温度,不饱和溶液一定能变成饱和溶液
D.实验室利用氯化钠固体和水配制50g质量分数为6%的氯化钠溶液的步骤是:计算、量取、溶解、贮存
7.下图所示的实验操作正确的是
A.倾倒液体 B.过滤
C.加热液体 D.稀释浓硫酸
8.下列关于氢氧化钠的描述中不正确的是
A.曝露在空气中易潮解 B.能与酸发生中和反应
C.其水溶液能使石蕊溶液变红 D.对皮肤有强烈的腐蚀作用
9.下列关于Ca(OH)2的说法错误的是
A.微溶于水,水溶液呈碱性
B.能与酸反应,可用于治疗胃酸过多
C.与CuSO4溶液按一定比例混合,可配制波尔多液
D.澄清溶液可用来检验CO2
10.化学实验中常用到玻璃棒,下列操作中其用途不同的是
A.溶解固体 B.蒸发溶液
C.过滤液体 D.稀释浓硫酸
11.已知生活中厕所清洁剂的pH=1,厨房的清洁剂的pH=12。下列关于两者的说法不正确的是
A.厕所清洁剂加水稀释,溶液pH升高 B.厨房清洁剂可能含有NaOH
C.混合使用能提高两者的清洁效果 D.厕所清洁剂可能使铁制下水道腐蚀
12.有关中和反应的说法一定正确的是( )
A.反应物均须溶于水
B.有沉淀生成
C.有气体生成
D.有盐生成
13.下列物质不能与盐酸反应的是( )
A.Mg B.AgNO3 C.Cu(OH)2 D.FeSO4
14.物质的性质决定其用途。固体氢氧化钠可用作干燥剂,是利用了它的哪种性质( )
A.白色固体
B.吸水性
C.腐蚀性
D.能与空气中的二氧化碳反应
15.下列图像不能正确反映对应变化关系的是
A.室温(25℃)下往石灰水中不断加入氧化钙
B.往CuSO4和H2SO4的混合溶液中加入NaOH溶液
C.碳酸钙高温分解
D.往硫酸和盐酸的混合液中不断加入氢氧化钡溶液
二、填空题
16.溶液的配制是重要的实验操作,请回答下列问题:
(1)浓硫酸具有强烈的腐蚀性,稀释浓硫酸的正确操作为 _________。
(2)将浓溶液配制成稀溶液时,主要步骤有:①量取、②混匀、③计算、④转移,操作时正确的顺序为______(填数字序号)。
(3)将50g 98%的浓硫酸稀释成20%的稀硫酸,需要水的质量是 ______。
(4)实验后,所配制溶液溶质质量分数偏小的原因可能是 (填字母序号)。
A.量取水的体积时仰视读数
B.使用量筒量取浓硫酸时俯视读数
C.从量筒倾倒出浓硫酸时,浓硫酸洒出
D.转移配制好的溶液时,液体溅出
17.青岛市公交车上常悬挂一块警示牌,“严禁携带易燃易爆、化学危险品上车!”下面列举了各种禁带物品:白磷、油纸、镁、汽油、酒精、硫酸、过氧化氢、烧碱、炸药、烟花炮竹……请从上述物质中选择合适的物质,将其化学式填写在下列空格中。
(1)一种银白色的金属_____。
(2)一种在空气中易自燃的单质_____。
(3)一种浓溶液具有吸水性的酸_____。
(4)一种可溶性碱_____。
18.通过近一年的学习,同学们一定深刻感受到化学就在身边,人类的衣、食、住、行都离不开化学,它使我们的生活变得更加绚丽多彩。请回答下列问题:
(1)你身上的衣服牢固耐穿、易洗快干、抗皱性好,是因为衣料大多都由__________(填“合成纤维”或“天然纤维”)制成。
(2)自2018年以来,宁夏多地区启动深度净化黄河水替换地下水源供水,保障城乡居民饮水安全。黄河水自取水站经过沉淀、过滤、吸附、杀菌消毒,达到国家生活饮用水标准后,输送至千家万户。小刚通过_____,判断自来水仍然是硬水。饮用前,可_____将其软化。
(3)你住的房屋建造时所用的各种材料也和化学有关。例如,用石灰浆粉刷过的墙壁,一段时间后,变得既白又坚固,其原理是__________(用化学方程式表示)。
(4)“共享电动车”方便市民绿色出行,有效缓解了城市交通压力,减少了大气污染,成为现代城市的又一道靓丽“风景”。为防止电动车钢制车架与空气中的_______等接触而生锈,通常在车架表面进行喷漆处理。
19.(1)写成符合下列要求的物质, 将其化学式填入空格中。
①可用于人工降雨的氧化物______;
②可用于金属表面除锈的酸______;
③可改良酸性土壤的碱______。
(2)用上述几种元素组成适当的物质, 出符合下列要求的化学方程式
①有化合物参加的化合反应:______;
②有氧化物生成的分解反应:______。
20.下图为某学习小组在白色点滴板上进行的有关“酸和碱与指示剂反应”的探究实验。
(1)使用白色点滴板进行实验的优点是_____(答一点)。
(2)稀盐酸和稀硫酸都能使紫色的石蕊溶液变红,是因为在不同酸的溶液中都含有相同的_____离子;氢氧化钠溶液和氢氧化钙溶液都能使无色的酚酞溶液变红,是因为在不同碱的溶液中都含有相同的_____离子。
三、推断题
21.小政同学在复习Ca(OH)2化学性质时,归纳出了Ca(OH)2与其它物质间相互反应的关系如图(图中“﹣﹣”表示相连的两种物质能发生反应)。
(1)若X是与其它三种不同类别的化合物,则X可以是_____。
(2)根据图所示的物质间关系,写出其中两个化学方程式:
①_____; ②_____。
四、流程题
22.某工业含镍废料主要成分为NiO,还含有少量FeO、Fe2O3和PbO。采用如下工艺流程回收其中的镍并制备NiSO4晶体。
已知:ⅰ.FeO、Fe2O3和PbO同属于碱性氧化物,能与酸反应生成相应的盐和水。
ⅱ.在常温下的溶解度为0.0041g。
回答下列问题:
(1)“酸溶”时FeO发生反应的化学方程式为_______,此反应类型为_______反应(填基本反应类型)。
(2)滤渣①的主要成分为_______ (填化学式)。
(3)“氧化”时发生反应:H2O2+2FeSO4+H2SO4=X+2H2O,则X为_______ (填化学式),一段时间后,溶液中有气泡出现,可能的原因是_______。
(4)“沉铁”是是为了除去溶液中的Fe3+,改变反应条件(温度、pH),Fe3+会转化为不同的沉淀(如图)。pH=6、90℃时,Fe3+主要转化为_______(填化学式)。
(5)“系列操作”包括:蒸发浓缩、_______、过滤、洗涤、干燥。
(6)分离出硫酸镍晶体后,收集母液并进行循环使用,其意义是_______,同时减少对环境的污染。
五、计算题
23.将16.0g含杂质25%的硫铁矿(主要成分是含有铁、硫两种元素的化合物),高温条件下与空气中的氧气充分反应(杂质不参与反应〕,只生成二氧化硫和8.0 g氧化铁。
(1)计算溶解8.0g氧化铁需要20%的稀硫酸的质量_______ 。
(2)16.0g硫铁矿中含主要成分的质量为_______g,其中硫元素的质量为_______g。
(3)硫铁矿主要成分的化学式为___________。
24.称取5g含杂质的氢氧化钙固体样品放入烧杯中,向烧杯中加入50g溶质的质量分数为7.3%的稀盐酸(假设杂质不与稀盐酸反应),二者恰好完全反应。请计算:固体样品中氢氧化钙的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.D
4.B
5.C
6.B
7.C
8.C
9.B
10.C
11.C
12.D
13.D
14.B
15.A
16.(1)浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散
(2)③①④②
(3)195g
(4)ABC
17.
18. 合成纤维 肥皂水 煮沸 氧气、水蒸气
19. CO2 HCl或H2SO4 Ca(OH)2
20. 药品的用量少,可节约药品或可以同时完成几个实验,便于观察比较 氢 氢氧根
21. CO2 Ca(OH)2+2HCl=CaCl2+2H2O Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
22.(1) FeO+H2SO4=FeSO4+H2O 复分解
(2)PbSO4
(3) Fe2(SO4)3 Fe3+是H2O2分解的催化剂;反应放热,温度上升,促使H2O2分解
(4)FeOOH
(5)降温结晶
(6)提高镍元素的回收率
23. 73.5g 12 6.4 FeS2
24.74%
答案第1页,共2页
答案第1页,共2页
