课题3溶液的浓度
图片预览







文档简介
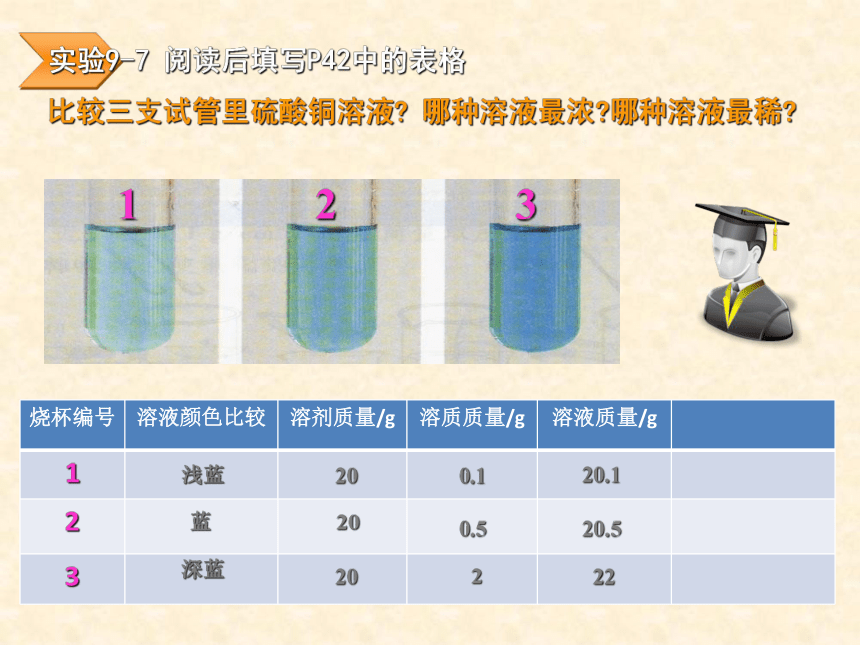
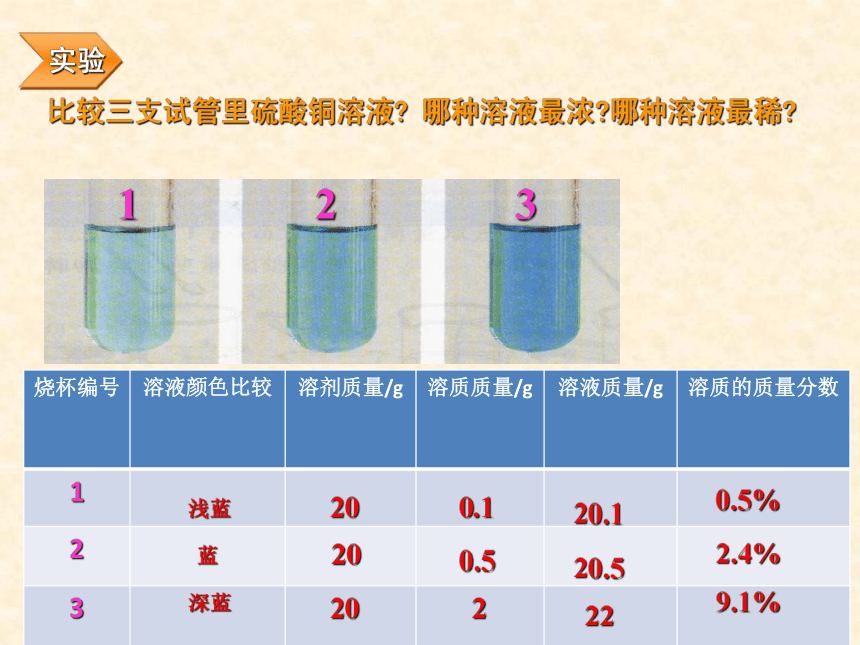
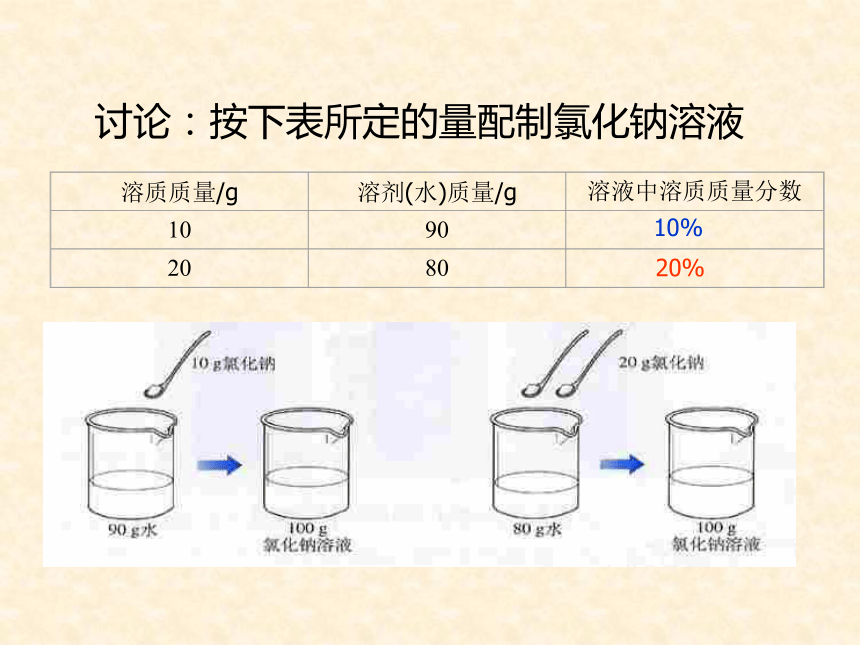
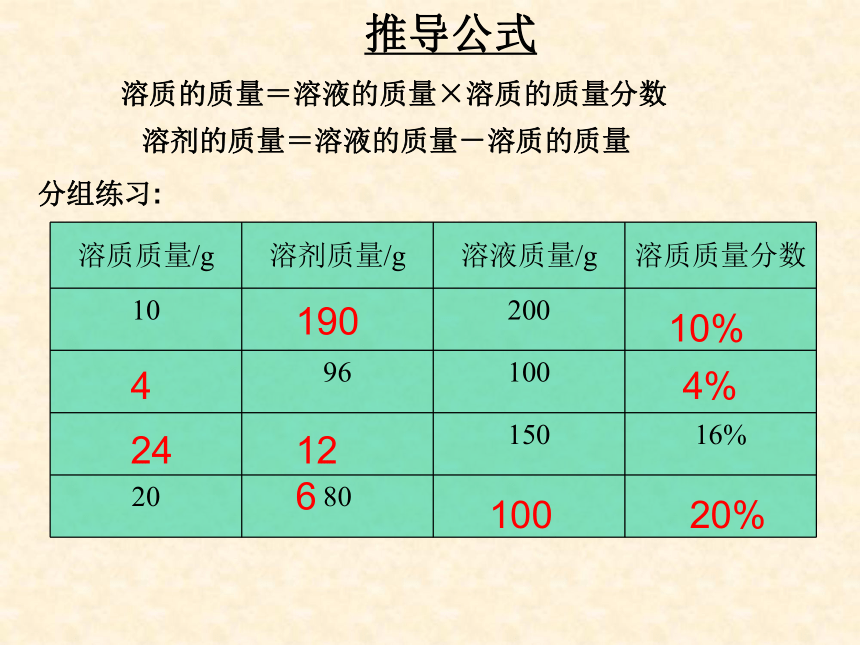
课件32张PPT。复 习1、什么叫饱和溶液?2、KNO3不饱和溶液怎样变成饱和溶液?3、Ca(OH)2饱和溶液怎样变成不饱和溶液?课题3 溶液的浓度第九单元柴沟中学学习目标1.掌握溶液中溶质的质量分数的概念2.会计算有关溶质的质量分数对溶质的质量分数概念的理解学习难点溶液浓度的表示方法----溶质的质量分数溶质的质量分数是溶质质量与溶液质量之比表达式:定义:溶质质量溶液质量100%推导式:溶质质量 = 溶液质量×溶质的质量分数×溶质的质量分数==溶质质量溶质质量+溶剂质量×100%讨论:按下表所定的量配制氯化钠溶液10%20%19010%4%2412610020%4推导公式溶质的质量=溶液的质量×溶质的质量分数溶剂的质量=溶液的质量-溶质的质量分组练习:影响溶液浓度的因素不变不变不变不变不变不变3、影响溶液浓度的因素
溶液由溶质和溶剂组成,溶质、溶剂量的变化会影响溶液的组成。
讨论: 已知200C时,氯化钠的溶解度是36g。有人说:“200C时氯化钠饱和溶液中溶质的质量分数为36%。”这种说法对吗?为什么?36 100 13636g136g100%×=26.5%4、饱和溶液中溶质的质量分数与溶解度换算关系课堂小结:
×100%
例1在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150Kg这种溶液,需要氯化钠和水的质量各是多少?解:有没有其他的方法?配制150 g16%氯化钠溶液二、溶液的配制 计算:需食盐:150 g× 6% = 24 g 需水质量: 150 g–24g= 126 g 体积为126 mL(固体计算出质量、液体计算出体积)1、步骤:称量:用天平称量 24 g食盐 用量筒量取126 mL水溶解:将称量出的24g氯化钠放入烧杯中,并将量取的126 ml水倒 入 用玻璃棒搅拌,使氯化钠全部溶解。2、实验仪器: 天平(砝码)、药匙、量筒(50 mL)、胶头滴管、 烧杯、玻璃棒贮存:将溶液转入试剂瓶中,贴上标签,合理放置。
选准药品左物右码选合适量程配制溶液操作过程需注意:瓶塞倒放正确读数仰视:量的水 ,质量分数 。俯视:量的水 , 质量分数 。
如“物”“码”倒置,又使用游码,则溶质质量分数 。偏多偏低偏少偏高偏低学生讨论,教师点拨2(5分钟) 1.欲配制50g5%的氯化钠溶液。
(1)需要用到的玻璃仪器有 、 、 。
(2)配制全过程的步骤可概括为四步:
① ;② ; ③ ;④ 。
(3)为加快氯化钠的溶解,通常采用 、 、 、
等措施。
(4)实验中,若氯化钠未经干燥就直接配制溶液,则溶质的质量分数将 (填“偏低”“偏高”“不变”)课堂练习(2分钟)量筒烧杯玻璃棒计算称量溶解装瓶贴标签搅拌振荡研碎偏低胶头滴管3.用浓盐酸配制一定溶质质量分数的稀盐酸,实验时必不可少的一组仪器是( )
A.量筒、烧杯、漏斗、玻璃棒
B.托盘天平、玻璃棒、药匙、烧杯
C.托盘天平、玻璃棒、量筒、2.用氯化钠配制100g溶质质量分数为0.9%的生理盐水,现有下列操作:①配制溶液 ②称取氯化钠 ③过滤 ④量取蒸馏水 ⑤计算。正确的操作顺序是( )
A. ①②③④ B. ⑤②④① C. ⑤①②④ D .③②④①BC 例题2 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?分析:解决这道题的关键是什么?解:溶液稀释前后溶质的质量不变如果把50g换成50mL,还需要什么条件?设稀释后溶液的质量为x。50g× 98%=X × 20% X=245g
需要水的质量=245g-50g=195g答:需要水的质量为195g。溶液稀释的计算浓溶液的质量×浓溶液中溶质的质量分数=稀溶液的质量×稀溶液中溶质的质量分数稀释前溶质质量=稀释后溶质质量稀释定律:(M液×a%)前 =(M液×a%)后溶液稀释前后,溶质的质量不变【另解】溶液稀释前后,溶质的质量不变。设:需要水的质量为X50g×98%(50g+X)×20%=X=195g答:需要水的质量为195g。稀释前溶质质量稀释后溶质质量www.xkb1.com1.溶液稀释(或浓缩)前后,溶质的质量 ;
用字母表示:
2.某单位要配制10kg质量分数为0.5%的过氧乙酸做消毒液,需取质量分数为10%的过氧乙酸溶液 kg。
3.50g20 %的NaCl溶液稀释成10%的NaCl溶液,
需加水 g;溶质的质量不变,溶质的质量分数变为原来的1/2,则溶液的质量应是原来的 倍。
4.将100g10%的KNO3溶液蒸发部分水后变成20%的KNO3溶液(无固体析出),则需蒸发水的质量
为 g.溶质的质量不变,溶质的质量分数变为原来的2倍,则溶液的质量应是原来的 倍。
M浓×a浓% M稀×a稀%0.55050不变=练习:M水 M稀-M浓=21/21.溶液加水稀释时,没有发生变化的是( )
溶质的质量分数 B.溶质的质量
C.溶剂的质量 D.溶液的质量
2.浓度为10%的氢氧化钠溶液20g,若将其浓度增大一倍,应采取的方法是( )
A.加20g氢氧化钠 B.蒸去水10g
C.加入20g10%的氢氧化钠溶液
D.将溶液中的水蒸发一半
BB课堂练习 练习 某工厂化验室配制5000g20%的盐酸,需要38%的盐酸(密度为1.19g/mL)的盐酸多少毫升?解:设 练习 配制500mL质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),需要氢氧化钠和水各多少克?解:1cm3=1ml 溶 液 的 配 制配置步骤:1、计算 2、称量 3、溶解例1: (溶质为固体)配制150g16%的食盐水 计算:需食盐:150 g× 16% = 24 g 需水: 150 g– 24 g= 126 g称量:用天平称量 24 g食盐 用量筒量取126mL水溶解:烧杯、玻璃棒 实验仪器:天平(砝码)、药匙、量筒、
胶头滴管、烧杯、玻璃棒 求20℃时食盐饱和溶液的溶质质量分数。 解:20℃时食盐饱和溶液的溶质质量分数为=26.5%36g100g+36g答:略 2、200C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数 分析:溶解度即为“溶解的限度”,50克水若溶不下20克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度 36 /(100+36)。解:x = 18g < 20g则:溶质在溶液中的质量分数为:×100% ≈ 26.5% 100g36g=50gx18g50g+18g或36g100g+36g例4:6.5g锌和100g一定质量分数的稀硫酸恰好完全反应,求:(1)生成氢气的质量?(2)稀硫酸中溶质的质量分数?(3)生成的硫酸锌溶液中溶质的质量分数?解:设生成氢气的质量为x。硫酸的质量为y。生成硫酸锌的质量为z。 Zn+H2SO4 == ZnSO4+H2↑
65 98 161 2
6.5g y z x X=0.2g
y=9.8g
z=16.1g稀硫酸中硫酸的质量分数 = ?100%=9.8%生成的硫酸锌溶液中溶质的质量分数为:
=15.15%答:生成氢气0.2g,稀硫酸中溶质的质量分数为9.8%,生成的硫酸锌溶液溶质的质量分数为15.15%。3、配制溶质质量分数一定的溶液⑴计算 ⑵称量 ⑶溶解 ⑷装瓶药匙 天平 烧杯 量筒 滴管 玻璃棒
1、50g盐酸5与锌完全反应,得0.2g氢气,求盐酸的溶质的质量分数? 2、某盐酸溶液100g,与13g含杂质5%的锌完全反应,这种盐酸的溶质质量分数是多少?溶质质量分数在化学方程式中应用再见祝同学们学习进步!
溶液由溶质和溶剂组成,溶质、溶剂量的变化会影响溶液的组成。
讨论: 已知200C时,氯化钠的溶解度是36g。有人说:“200C时氯化钠饱和溶液中溶质的质量分数为36%。”这种说法对吗?为什么?36 100 13636g136g100%×=26.5%4、饱和溶液中溶质的质量分数与溶解度换算关系课堂小结:
×100%
例1在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150Kg这种溶液,需要氯化钠和水的质量各是多少?解:有没有其他的方法?配制150 g16%氯化钠溶液二、溶液的配制 计算:需食盐:150 g× 6% = 24 g 需水质量: 150 g–24g= 126 g 体积为126 mL(固体计算出质量、液体计算出体积)1、步骤:称量:用天平称量 24 g食盐 用量筒量取126 mL水溶解:将称量出的24g氯化钠放入烧杯中,并将量取的126 ml水倒 入 用玻璃棒搅拌,使氯化钠全部溶解。2、实验仪器: 天平(砝码)、药匙、量筒(50 mL)、胶头滴管、 烧杯、玻璃棒贮存:将溶液转入试剂瓶中,贴上标签,合理放置。
选准药品左物右码选合适量程配制溶液操作过程需注意:瓶塞倒放正确读数仰视:量的水 ,质量分数 。俯视:量的水 , 质量分数 。
如“物”“码”倒置,又使用游码,则溶质质量分数 。偏多偏低偏少偏高偏低学生讨论,教师点拨2(5分钟) 1.欲配制50g5%的氯化钠溶液。
(1)需要用到的玻璃仪器有 、 、 。
(2)配制全过程的步骤可概括为四步:
① ;② ; ③ ;④ 。
(3)为加快氯化钠的溶解,通常采用 、 、 、
等措施。
(4)实验中,若氯化钠未经干燥就直接配制溶液,则溶质的质量分数将 (填“偏低”“偏高”“不变”)课堂练习(2分钟)量筒烧杯玻璃棒计算称量溶解装瓶贴标签搅拌振荡研碎偏低胶头滴管3.用浓盐酸配制一定溶质质量分数的稀盐酸,实验时必不可少的一组仪器是( )
A.量筒、烧杯、漏斗、玻璃棒
B.托盘天平、玻璃棒、药匙、烧杯
C.托盘天平、玻璃棒、量筒、2.用氯化钠配制100g溶质质量分数为0.9%的生理盐水,现有下列操作:①配制溶液 ②称取氯化钠 ③过滤 ④量取蒸馏水 ⑤计算。正确的操作顺序是( )
A. ①②③④ B. ⑤②④① C. ⑤①②④ D .③②④①BC 例题2 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?分析:解决这道题的关键是什么?解:溶液稀释前后溶质的质量不变如果把50g换成50mL,还需要什么条件?设稀释后溶液的质量为x。50g× 98%=X × 20% X=245g
需要水的质量=245g-50g=195g答:需要水的质量为195g。溶液稀释的计算浓溶液的质量×浓溶液中溶质的质量分数=稀溶液的质量×稀溶液中溶质的质量分数稀释前溶质质量=稀释后溶质质量稀释定律:(M液×a%)前 =(M液×a%)后溶液稀释前后,溶质的质量不变【另解】溶液稀释前后,溶质的质量不变。设:需要水的质量为X50g×98%(50g+X)×20%=X=195g答:需要水的质量为195g。稀释前溶质质量稀释后溶质质量www.xkb1.com1.溶液稀释(或浓缩)前后,溶质的质量 ;
用字母表示:
2.某单位要配制10kg质量分数为0.5%的过氧乙酸做消毒液,需取质量分数为10%的过氧乙酸溶液 kg。
3.50g20 %的NaCl溶液稀释成10%的NaCl溶液,
需加水 g;溶质的质量不变,溶质的质量分数变为原来的1/2,则溶液的质量应是原来的 倍。
4.将100g10%的KNO3溶液蒸发部分水后变成20%的KNO3溶液(无固体析出),则需蒸发水的质量
为 g.溶质的质量不变,溶质的质量分数变为原来的2倍,则溶液的质量应是原来的 倍。
M浓×a浓% M稀×a稀%0.55050不变=练习:M水 M稀-M浓=21/21.溶液加水稀释时,没有发生变化的是( )
溶质的质量分数 B.溶质的质量
C.溶剂的质量 D.溶液的质量
2.浓度为10%的氢氧化钠溶液20g,若将其浓度增大一倍,应采取的方法是( )
A.加20g氢氧化钠 B.蒸去水10g
C.加入20g10%的氢氧化钠溶液
D.将溶液中的水蒸发一半
BB课堂练习 练习 某工厂化验室配制5000g20%的盐酸,需要38%的盐酸(密度为1.19g/mL)的盐酸多少毫升?解:设 练习 配制500mL质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),需要氢氧化钠和水各多少克?解:1cm3=1ml 溶 液 的 配 制配置步骤:1、计算 2、称量 3、溶解例1: (溶质为固体)配制150g16%的食盐水 计算:需食盐:150 g× 16% = 24 g 需水: 150 g– 24 g= 126 g称量:用天平称量 24 g食盐 用量筒量取126mL水溶解:烧杯、玻璃棒 实验仪器:天平(砝码)、药匙、量筒、
胶头滴管、烧杯、玻璃棒 求20℃时食盐饱和溶液的溶质质量分数。 解:20℃时食盐饱和溶液的溶质质量分数为=26.5%36g100g+36g答:略 2、200C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数 分析:溶解度即为“溶解的限度”,50克水若溶不下20克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度 36 /(100+36)。解:x = 18g < 20g则:溶质在溶液中的质量分数为:×100% ≈ 26.5% 100g36g=50gx18g50g+18g或36g100g+36g例4:6.5g锌和100g一定质量分数的稀硫酸恰好完全反应,求:(1)生成氢气的质量?(2)稀硫酸中溶质的质量分数?(3)生成的硫酸锌溶液中溶质的质量分数?解:设生成氢气的质量为x。硫酸的质量为y。生成硫酸锌的质量为z。 Zn+H2SO4 == ZnSO4+H2↑
65 98 161 2
6.5g y z x X=0.2g
y=9.8g
z=16.1g稀硫酸中硫酸的质量分数 = ?100%=9.8%生成的硫酸锌溶液中溶质的质量分数为:
=15.15%答:生成氢气0.2g,稀硫酸中溶质的质量分数为9.8%,生成的硫酸锌溶液溶质的质量分数为15.15%。3、配制溶质质量分数一定的溶液⑴计算 ⑵称量 ⑶溶解 ⑷装瓶药匙 天平 烧杯 量筒 滴管 玻璃棒
1、50g盐酸5与锌完全反应,得0.2g氢气,求盐酸的溶质的质量分数? 2、某盐酸溶液100g,与13g含杂质5%的锌完全反应,这种盐酸的溶质质量分数是多少?溶质质量分数在化学方程式中应用再见祝同学们学习进步!
同课章节目录
