第三章第一节 铁及其化合物第一课时 铁的单质铁的氧化物和铁的氢氧化物 课后巩固训练(含合格过关练+素养培优练 解析版)
文档属性
| 名称 | 第三章第一节 铁及其化合物第一课时 铁的单质铁的氧化物和铁的氢氧化物 课后巩固训练(含合格过关练+素养培优练 解析版) |  | |
| 格式 | docx | ||
| 文件大小 | 274.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-07 17:14:19 | ||
图片预览



文档简介
第一课时 铁的单质 铁的氧化物和铁的氢氧化物 课后巩固训练
1.“秦砖汉瓦”是我国传统建筑文化的一个缩影。同是由黏土烧制的砖瓦,有的是黑色的,有的却是红色的,你猜测其中的原因可能( )
A.土壤中含有铁粉、二氧化锰等
B.黑砖瓦是煅烧过程中附着了炭黑,红砖则是添加了红色耐高温染料
C.土壤中含有的铜元素经过不同工艺煅烧,分别生成了黑色CuO和红色Cu
D.土壤中含有的铁元素经过不同工艺煅烧,分别生成了黑色Fe3O4或FeO和红色Fe2O3
2.铁及其化合物应用广泛,下列关于铁单质及铁的化合物的说法错误的是( )
A.自然界中的铁单质主要来自陨石
B.氧化亚铁(FeO)在空气中加热容易被氧气氧化为氧化铁(Fe2O3)
C.氢氧化亚铁是一种还原性很强的白色难溶物质
D.FeO和Fe2O2不与水反应,但都是碱性氧化物
3.有关铁的氧化物的说法中,不正确的是( )
A.赤铁矿主要成分是Fe2O3,Fe2O3是红棕色的,常用作红色油漆和涂料
B.Fe3O4是黑色晶体,其中的铁显+2价,的铁显+3价
C.FeO、Fe2O3、Fe3O4都不溶于水,但都能和盐酸反应生成相应的盐
D.将Fe(OH)2露置在空气中加热灼烧所得的产物为Fe3O4
4.在一定条件下铁粉和水蒸气反应,可以得到铁的氧化物。实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。根据图示判断下列说法不正确的是( )
A.实验进行时试管A中应加入的试剂是铁粉
B.烧瓶B的作用是防止倒吸,烧瓶C的作用是产生水蒸气
C.试管D中收集到的是H2
D.A、B装置都需要酒精灯加热
5.下列说法正确的是( )
A.Fe比Al活泼
B.Fe与盐酸反应的离子方程式为2Fe+6H+===2Fe3++3H2↑
C.铁与CuSO4溶液反应可置换出铜
D.Fe不能与H2O反应
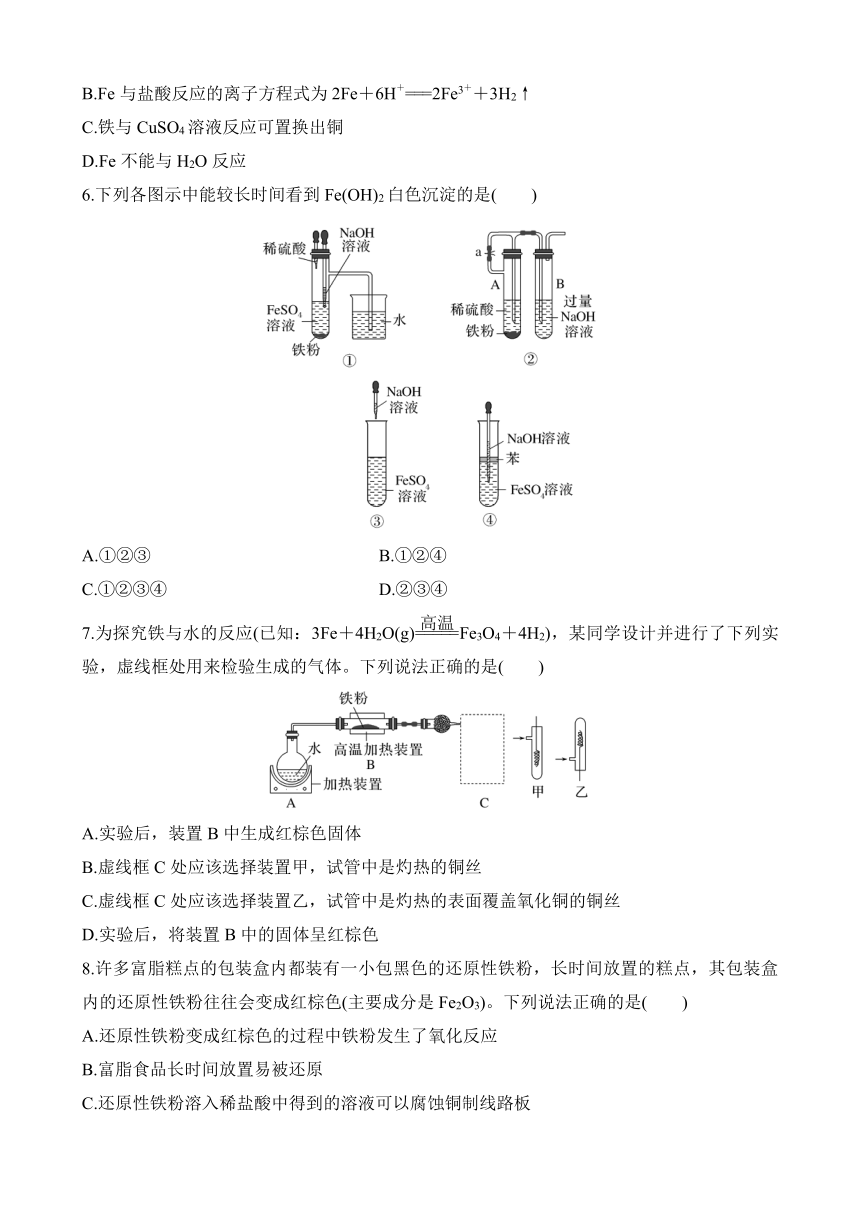
6.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是( )
A.①②③ B.①②④
C.①②③④ D.②③④
7.为探究铁与水的反应(已知:3Fe+4H2O(g)Fe3O4+4H2),某同学设计并进行了下列实验,虚线框处用来检验生成的气体。下列说法正确的是( )
A.实验后,装置B中生成红棕色固体
B.虚线框C处应该选择装置甲,试管中是灼热的铜丝
C.虚线框C处应该选择装置乙,试管中是灼热的表面覆盖氧化铜的铜丝
D.实验后,将装置B中的固体呈红棕色
8.许多富脂糕点的包装盒内都装有一小包黑色的还原性铁粉,长时间放置的糕点,其包装盒内的还原性铁粉往往会变成红棕色(主要成分是Fe2O3)。下列说法正确的是( )
A.还原性铁粉变成红棕色的过程中铁粉发生了氧化反应
B.富脂食品长时间放置易被还原
C.还原性铁粉溶入稀盐酸中得到的溶液可以腐蚀铜制线路板
D.如果在包装盒内放入Fe2(SO4)3,也可起到与铁粉同样的作用
9.实验室用FeCl2和烧碱制备Fe(OH)2,为使生成的产物不被氧化,下列说法错误的是( )
A.配制FeCl2溶液和烧碱溶液所用的蒸馏水要煮沸
B.可在FeCl2溶液的上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管中
D.产生Fe(OH)2沉淀后,不能振荡试管
10.有FeO、Fe2O3的混合物若干克,在CO气流中加热充分反应,冷却后称量剩余固体比原混合物质量减轻1.6 g,若将同质量的混合物与盐酸反应,欲使其完全溶解需1 mol·L-1盐酸的体积为( )
A.200 mL B.100 mL
C.50 mL D.无法计算
11.金属单质A可发生以下反应。试判断:
(1)A、B、C、D、E分别是(写化学式,B写主要成分)
A________、B________、C________、
D________、E________。
(2)写出反应③和⑤的离子方程式:
③___________________________________________________________;
⑤___________________________________________________________。
12.铁及其重要化合物之间的部分转化关系如图所示。
(1)下列金属矿物中用于冶炼金属铁的是________(填序号)。
a.金红石(TiO2)
b..赤铁矿(Fe2O3)
c.辉铜矿(Cu2S)
(2)实现Fe转化为Fe2+可选用足量的________(填序号)。
a.稀盐酸
b.氢氧化钠溶液
c.稀硫酸
(3)在点燃的条件下,Fe与足量Cl2剧烈反应,该反应的化学方程式为___________________________________________________________
___________________________________________________________。
(4)某同学将FeSO4溶液与NaOH溶液混合,未观察到白色沉淀,分析原因是生成的Fe(OH)2易被空气中的O2氧化,请你设计一个防止Fe(OH)2被O2氧化的实验方案___________________________________________________________。
13.某学习小组进行了如图所示的实验,实验后组员之间的交流不合理的是( )
A.甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色的火焰
B.乙同学认为试管a中生成的黑色固体可能为四氧化三铁
C.丙同学认为将少量还原性铁粉放入试管中,加适量的水,加热也可实现该反应
D.丁同学认为用盐酸溶解固体生成物所得溶液有颜色
14.某同学对铁的氧化物具有浓厚兴趣,查阅资料后制成以下卡片:
在空气中把铁灼烧到500 ℃就形成Fe3O4;温度再升高,可形成Fe2O3;在更高的温度下加热Fe2O3(约1 400 ℃)时,可失去氧,又得到Fe3O4,即:
FeFe3O4Fe2O3
下列说法不正确的是( )
A.FeO和Fe3O4均为黑色固体
B.反应①②③均为氧化还原反应
C.热稳定性顺序为:FeO>Fe2O3>Fe3O4
D.Fe3O4若写成氧化物的形式则化学式可写为FeO·Fe2O3,若视Fe3O4为一种盐则其化学式可写为Fe(FeO2)2
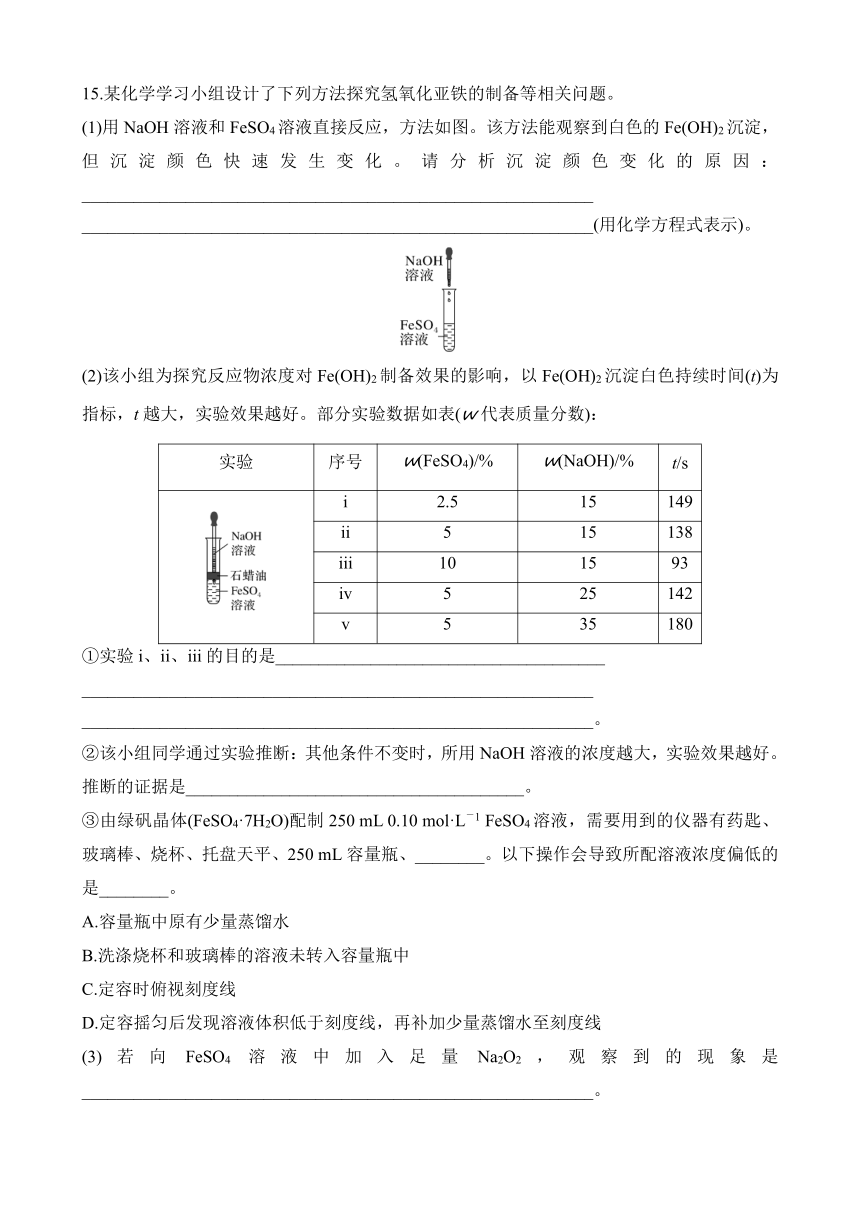
15.某化学学习小组设计了下列方法探究氢氧化亚铁的制备等相关问题。
(1)用NaOH溶液和FeSO4溶液直接反应,方法如图。该方法能观察到白色的Fe(OH)2沉淀,但沉淀颜色快速发生变化。请分析沉淀颜色变化的原因:___________________________________________________________
___________________________________________________________(用化学方程式表示)。
(2)该小组为探究反应物浓度对Fe(OH)2制备效果的影响,以Fe(OH)2沉淀白色持续时间(t)为指标,t越大,实验效果越好。部分实验数据如表(w代表质量分数):
实验 序号 w(FeSO4)/% w(NaOH)/% t/s
i 2.5 15 149
ii 5 15 138
iii 10 15 93
iv 5 25 142
v 5 35 180
①实验i、ii、iii的目的是______________________________________
___________________________________________________________
___________________________________________________________。
②该小组同学通过实验推断:其他条件不变时,所用NaOH溶液的浓度越大,实验效果越好。推断的证据是_______________________________________。
③由绿矾晶体(FeSO4·7H2O)配制250 mL 0.10 mol·L-1 FeSO4溶液,需要用到的仪器有药匙、玻璃棒、烧杯、托盘天平、250 mL容量瓶、________。以下操作会导致所配溶液浓度偏低的是________。
A.容量瓶中原有少量蒸馏水
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
(3)若向FeSO4溶液中加入足量Na2O2,观察到的现象是___________________________________________________________。
第一课时 铁的单质 铁的氧化物和铁的氢氧化物 课后巩固训练
1.“秦砖汉瓦”是我国传统建筑文化的一个缩影。同是由黏土烧制的砖瓦,有的是黑色的,有的却是红色的,你猜测其中的原因可能( )
A.土壤中含有铁粉、二氧化锰等
B.黑砖瓦是煅烧过程中附着了炭黑,红砖则是添加了红色耐高温染料
C.土壤中含有的铜元素经过不同工艺煅烧,分别生成了黑色CuO和红色Cu
D.土壤中含有的铁元素经过不同工艺煅烧,分别生成了黑色Fe3O4或FeO和红色Fe2O3
答案 D
解析 黏土中含有Fe元素,在烧制砖瓦时,与O2反应,生成氧化物,Fe元素的氧化物有3种,FeO与Fe3O4为黑色,Fe2O3为红棕色,故D项正确。
2.铁及其化合物应用广泛,下列关于铁单质及铁的化合物的说法错误的是( )
A.自然界中的铁单质主要来自陨石
B.氧化亚铁(FeO)在空气中加热容易被氧气氧化为氧化铁(Fe2O3)
C.氢氧化亚铁是一种还原性很强的白色难溶物质
D.FeO和Fe2O2不与水反应,但都是碱性氧化物
答案 B
解析 自然界中的铁单质主要来自陨石中的陨铁,A正确;氧化亚铁(FeO)在空气中加热容易被氧气氧化为四氧化三铁,化学式为Fe3O4,B错误;氢氧化亚铁是一种白色难溶物质,Fe元素化合价为+2价,具有强的还原性,很容易被空气中的氧气氧化产生红褐色的Fe(OH)3,C正确;FeO和Fe2O3能和酸反应生成对应的盐和水,故FeO和Fe2O3是碱性氧化物,D正确。
3.有关铁的氧化物的说法中,不正确的是( )
A.赤铁矿主要成分是Fe2O3,Fe2O3是红棕色的,常用作红色油漆和涂料
B.Fe3O4是黑色晶体,其中的铁显+2价,的铁显+3价
C.FeO、Fe2O3、Fe3O4都不溶于水,但都能和盐酸反应生成相应的盐
D.将Fe(OH)2露置在空气中加热灼烧所得的产物为Fe3O4
答案 D
解析 Fe(OH)2露置在空气中易被氧化为Fe(OH)3,所以Fe(OH)2露置在空气中加热产生Fe(OH)3,灼烧Fe(OH)3分解所得的产物为Fe2O3。
4.在一定条件下铁粉和水蒸气反应,可以得到铁的氧化物。实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。根据图示判断下列说法不正确的是( )
A.实验进行时试管A中应加入的试剂是铁粉
B.烧瓶B的作用是防止倒吸,烧瓶C的作用是产生水蒸气
C.试管D中收集到的是H2
D.A、B装置都需要酒精灯加热
答案 B
解析 发生固体与水蒸气的反应,则试管A中应加入的试剂是普通铁粉,故A正确;B为产生水蒸气的装置,C为安全瓶起防止倒吸的作用,故B错误;铁与水蒸气高温反应生成四氧化三铁和氢气,D中排水法收集的气体为氢气,故C正确;由题意可知,加热烧瓶B产生水蒸气,加热试管A使铁粉与水蒸气发生反应,故D正确。
5.下列说法正确的是( )
A.Fe比Al活泼
B.Fe与盐酸反应的离子方程式为2Fe+6H+===2Fe3++3H2↑
C.铁与CuSO4溶液反应可置换出铜
D.Fe不能与H2O反应
答案 C
解析 在金属活动性顺序中Al排在Fe的前面,故Al比Fe活泼,A错误;Fe与盐酸反应的离子方程式应为Fe+2H+===Fe2++H2↑,B错误;铁可置换出铜盐溶液中的铜,如:Fe+CuSO4===FeSO4+Cu,C正确;Fe在高温下可以与H2O(g)发生反应而生成Fe3O4和H2,D错误。
6.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是( )
A.①②③ B.①②④
C.①②③④ D.②③④
答案 B
解析 因为Fe(OH)2在空气中很容易被氧化为红褐色的Fe(OH)3,即发生4Fe(OH)2+O2+2H2O===4Fe(OH)3。因此要较长时间看到Fe(OH)2白色沉淀,就要排除装置中的氧气或空气。①、②原理一样,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;③由于空气中的氧气能迅速将Fe(OH)2氧化,因而不能较长时间看到白色沉淀;④中液面加苯阻止了空气进入,能较长时间看到白色沉淀。答案选B。
7.为探究铁与水的反应(已知:3Fe+4H2O(g)Fe3O4+4H2),某同学设计并进行了下列实验,虚线框处用来检验生成的气体。下列说法正确的是( )
A.实验后,装置B中生成红棕色固体
B.虚线框C处应该选择装置甲,试管中是灼热的铜丝
C.虚线框C处应该选择装置乙,试管中是灼热的表面覆盖氧化铜的铜丝
D.实验后,将装置B中的固体呈红棕色
答案 C
解析 由实验装置可知,A中加热提供水蒸气,B中Fe与水蒸气高温下反应生成四氧化三铁和氢气,且氢气不纯加热易发生爆炸,利用氢气将空气排出后加热。反应产生四氧化三铁,颜色为黑色,所以实验后,装置B中生成黑色固体,故A错误;由于氢气的密度较小,虚线框C处应该选择装置乙,试管中是灼热的表面覆盖氧化铜的铜丝,氢气还原CuO可以观察到黑色铜丝变为红色,检验产生的氢气,故B错误、C正确;四氧化三铁为黑色,故D错误。
8.许多富脂糕点的包装盒内都装有一小包黑色的还原性铁粉,长时间放置的糕点,其包装盒内的还原性铁粉往往会变成红棕色(主要成分是Fe2O3)。下列说法正确的是( )
A.还原性铁粉变成红棕色的过程中铁粉发生了氧化反应
B.富脂食品长时间放置易被还原
C.还原性铁粉溶入稀盐酸中得到的溶液可以腐蚀铜制线路板
D.如果在包装盒内放入Fe2(SO4)3,也可起到与铁粉同样的作用
答案 A
解析 还原Fe粉与食品包装袋中的O2反应产生红棕色的Fe2O3,在反应过程中Fe元素化合价升高,失去电子,被氧化,因此铁粉发生了氧化反应,A正确;富脂食品长时间放置易被包装袋中的残留的氧气氧化,而不是被还原,B错误;还原性铁粉溶入稀盐酸中,二者反应产生FeCl2,FeCl2的氧化性比较弱,不能与Cu反应,因此得到的溶液不能作铜制线路板的腐蚀液,C错误;Fe2(SO4)3只有氧化性,不具有还原性,因此若包装盒内放入Fe2(SO4)3,不能起到与铁粉同样的作用,D错误。
9.实验室用FeCl2和烧碱制备Fe(OH)2,为使生成的产物不被氧化,下列说法错误的是( )
A.配制FeCl2溶液和烧碱溶液所用的蒸馏水要煮沸
B.可在FeCl2溶液的上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管中
D.产生Fe(OH)2沉淀后,不能振荡试管
答案 C
解析 A项,FeCl2和烧碱溶液要现用现配,且配制溶液的蒸馏水要煮沸以除去氧气,确保Fe(OH)2在无氧环境中生成,正确;B项,在FeCl2溶液的上面加一层苯,以隔绝空气,防止氧气溶入,正确;C项,向FeCl2溶液中滴加烧碱溶液时,要将胶头滴管的尖嘴伸入到FeCl2溶液中,防止氢氧化钠溶液在滴入时溶有氧气,错误;D项,产生Fe(OH)2沉淀后,若振荡试管,会增大沉淀与空气接触的机会,使沉淀更易被氧化,正确。
10.有FeO、Fe2O3的混合物若干克,在CO气流中加热充分反应,冷却后称量剩余固体比原混合物质量减轻1.6 g,若将同质量的混合物与盐酸反应,欲使其完全溶解需1 mol·L-1盐酸的体积为( )
A.200 mL B.100 mL
C.50 mL D.无法计算
答案 A
解析 FeO、Fe2O3的混合物若干克,在CO气流中加热充分反应,生成Fe,冷却后称量剩余固体比原混合物质量减轻1.6 g,则减少的质量为氧元素的质量为氧原子的,物质的量是0.1 mol。将FeO、Fe2O3的混合物与盐酸反应生成FeCl2、FeCl3的混合物,相当于其中的O被Cl代替,1个O被2个Cl代替,所以需1 mol·L-1盐酸的体积V(HCl)=0.2 mol÷1 mol·L-1=0.2 L=200 mL。
11.金属单质A可发生以下反应。试判断:
(1)A、B、C、D、E分别是(写化学式,B写主要成分)
A________、B________、C________、
D________、E________。
(2)写出反应③和⑤的离子方程式:
③___________________________________________________________;
⑤___________________________________________________________。
答案 (1)Fe Fe2O3 Fe3O4 Cu H2 (2)Fe+Cu2+===Fe2++Cu Fe+2H+===Fe2++H2↑
解析 推断题的解题思路:根据物质的物理性质(特别是色、态)和化学性质(相互转化关系、反应条件等),找出具有特征条件的物质,再由相互转化关系逐步推断。如本题中结合B、C的颜色及与CuCl2溶液、稀盐酸反应的性质可推知A为Fe。
12.铁及其重要化合物之间的部分转化关系如图所示。
(1)下列金属矿物中用于冶炼金属铁的是________(填序号)。
a.金红石(TiO2)
b..赤铁矿(Fe2O3)
c.辉铜矿(Cu2S)
(2)实现Fe转化为Fe2+可选用足量的________(填序号)。
a.稀盐酸
b.氢氧化钠溶液
c.稀硫酸
(3)在点燃的条件下,Fe与足量Cl2剧烈反应,该反应的化学方程式为___________________________________________________________
___________________________________________________________。
(4)某同学将FeSO4溶液与NaOH溶液混合,未观察到白色沉淀,分析原因是生成的Fe(OH)2易被空气中的O2氧化,请你设计一个防止Fe(OH)2被O2氧化的实验方案___________________________________________________________。
答案 (1)b (2)ac (3)2Fe+3Cl22FeCl3
(4)在FeSO4溶液表面加入适量的煤油,隔绝空气,在硫酸亚铁溶液的液面下挤出胶头滴管中的NaOH溶液
解析 (1)用于冶炼金属铁,可知化合物含Fe元素,只有赤铁矿符合;(2)Fe转化为Fe2+,Fe与弱氧化剂反应,稀硫酸、稀盐酸符合,与NaOH不反应;(3)氯气具有强氧化性,与Fe反应生成氯化铁,该反应的化学方程式为2Fe+3Cl22FeCl3;(4)防止Fe(OH)2被O2氧化的实验方案为在FeSO4溶液表面加入适量的煤油,隔绝空气,在硫酸亚铁溶液的液面下挤出胶头滴管中的NaOH溶液。
13.某学习小组进行了如图所示的实验,实验后组员之间的交流不合理的是( )
A.甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色的火焰
B.乙同学认为试管a中生成的黑色固体可能为四氧化三铁
C.丙同学认为将少量还原性铁粉放入试管中,加适量的水,加热也可实现该反应
D.丁同学认为用盐酸溶解固体生成物所得溶液有颜色
答案 C
解析 在高温下铁与水蒸气反应生成氢气和四氧化三铁。甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色火焰,正确;乙同学认为试管a中生成的黑色固体可能为四氧化三铁,正确;铁与水不反应,应该是铁与水蒸气在高温下反应,丙同学的观点错误;丁同学认为用盐酸溶解固体生成物得到氯化亚铁和氯化铁的混合溶液,溶液带有颜色,正确。
14.某同学对铁的氧化物具有浓厚兴趣,查阅资料后制成以下卡片:
在空气中把铁灼烧到500 ℃就形成Fe3O4;温度再升高,可形成Fe2O3;在更高的温度下加热Fe2O3(约1 400 ℃)时,可失去氧,又得到Fe3O4,即:
FeFe3O4Fe2O3
下列说法不正确的是( )
A.FeO和Fe3O4均为黑色固体
B.反应①②③均为氧化还原反应
C.热稳定性顺序为:FeO>Fe2O3>Fe3O4
D.Fe3O4若写成氧化物的形式则化学式可写为FeO·Fe2O3,若视Fe3O4为一种盐则其化学式可写为Fe(FeO2)2
答案 C
解析 FeO、Fe3O4均为黑色固体,故A正确;反应①②③中铁元素的化合价均发生了变化,均为氧化还原反应,故B正确;FeO不稳定,能被氧化为Fe3O4,故C错误;Fe3O4中铁有两种化合价:+2、+3,FeO·Fe2O3和Fe(FeO2)2的形式均符合,故D正确。
15.某化学学习小组设计了下列方法探究氢氧化亚铁的制备等相关问题。
(1)用NaOH溶液和FeSO4溶液直接反应,方法如图。该方法能观察到白色的Fe(OH)2沉淀,但沉淀颜色快速发生变化。请分析沉淀颜色变化的原因:___________________________________________________________
___________________________________________________________(用化学方程式表示)。
(2)该小组为探究反应物浓度对Fe(OH)2制备效果的影响,以Fe(OH)2沉淀白色持续时间(t)为指标,t越大,实验效果越好。部分实验数据如表(w代表质量分数):
实验 序号 w(FeSO4)/% w(NaOH)/% t/s
i 2.5 15 149
ii 5 15 138
iii 10 15 93
iv 5 25 142
v 5 35 180
①实验i、ii、iii的目的是______________________________________
___________________________________________________________
___________________________________________________________。
②该小组同学通过实验推断:其他条件不变时,所用NaOH溶液的浓度越大,实验效果越好。推断的证据是_______________________________________。
③由绿矾晶体(FeSO4·7H2O)配制250 mL 0.10 mol·L-1 FeSO4溶液,需要用到的仪器有药匙、玻璃棒、烧杯、托盘天平、250 mL容量瓶、________。以下操作会导致所配溶液浓度偏低的是________。
A.容量瓶中原有少量蒸馏水
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
(3)若向FeSO4溶液中加入足量Na2O2,观察到的现象是___________________________________________________________。
答案 (1)4Fe(OH)2+O2+2H2O===4Fe(OH)3 (2)①探究其他条件相同时,FeSO4溶液浓度对Fe(OH)2制备效果的影响 ②沉淀持续时间t:v>iv>ii ③胶头滴管 BD (3)有红褐色沉淀生成,有气体放出
解析 (1)FeSO4和NaOH发生复分解反应生成Fe(OH)2,Fe(OH)2被空气中的氧气氧化生成Fe(OH)3,化学方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3;(2)①实验i、ii、iii的变量是FeSO4溶液浓度,目的是:探究其他条件相同时,FeSO4溶液浓度对Fe(OH)2制备效果的影响;②实验v、iv、ii的变量是NaOH溶液浓度,其他条件不变时,所用NaOH溶液的浓度越大,沉淀持续时间越长,实验效果越好,则证据是:沉淀持续时间t:v>iv>ii;③配制一定物质的量浓度溶液配制的步骤:计算、称量、溶解、移液、洗涤、定容等,用到的仪器:药匙、玻璃棒、烧杯、托盘天平、250 mL容量瓶、胶头滴管;定容时还需要加入蒸馏水,容量瓶中原有少量蒸馏水对所配溶液浓度无影响,A不选;洗涤烧杯和玻璃棒的溶液未转入容量瓶中,则残留在杯壁上的溶质没有完全转移到容量瓶,导致所配溶液浓度偏低,B选;定容时俯视刻度线导致溶液体积偏小,依据c=可知溶液浓度偏高,C不选;定容摇匀后发现溶液凹面低于刻度线,再补加少量蒸馏水至刻度线,导致加入水的体积增大,溶液浓度偏低,D选;故选:BD;(3)Na2O2和水反应生成NaOH和O2,NaOH再和FeSO4溶液反应生成Fe(OH)2,由于Na2O2过量,则Fe(OH)2被氧化为Fe(OH)3,观察到的现象是有红褐色沉淀生成,有气体放出。
1.“秦砖汉瓦”是我国传统建筑文化的一个缩影。同是由黏土烧制的砖瓦,有的是黑色的,有的却是红色的,你猜测其中的原因可能( )
A.土壤中含有铁粉、二氧化锰等
B.黑砖瓦是煅烧过程中附着了炭黑,红砖则是添加了红色耐高温染料
C.土壤中含有的铜元素经过不同工艺煅烧,分别生成了黑色CuO和红色Cu
D.土壤中含有的铁元素经过不同工艺煅烧,分别生成了黑色Fe3O4或FeO和红色Fe2O3
2.铁及其化合物应用广泛,下列关于铁单质及铁的化合物的说法错误的是( )
A.自然界中的铁单质主要来自陨石
B.氧化亚铁(FeO)在空气中加热容易被氧气氧化为氧化铁(Fe2O3)
C.氢氧化亚铁是一种还原性很强的白色难溶物质
D.FeO和Fe2O2不与水反应,但都是碱性氧化物
3.有关铁的氧化物的说法中,不正确的是( )
A.赤铁矿主要成分是Fe2O3,Fe2O3是红棕色的,常用作红色油漆和涂料
B.Fe3O4是黑色晶体,其中的铁显+2价,的铁显+3价
C.FeO、Fe2O3、Fe3O4都不溶于水,但都能和盐酸反应生成相应的盐
D.将Fe(OH)2露置在空气中加热灼烧所得的产物为Fe3O4
4.在一定条件下铁粉和水蒸气反应,可以得到铁的氧化物。实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。根据图示判断下列说法不正确的是( )
A.实验进行时试管A中应加入的试剂是铁粉
B.烧瓶B的作用是防止倒吸,烧瓶C的作用是产生水蒸气
C.试管D中收集到的是H2
D.A、B装置都需要酒精灯加热
5.下列说法正确的是( )
A.Fe比Al活泼
B.Fe与盐酸反应的离子方程式为2Fe+6H+===2Fe3++3H2↑
C.铁与CuSO4溶液反应可置换出铜
D.Fe不能与H2O反应
6.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是( )
A.①②③ B.①②④
C.①②③④ D.②③④
7.为探究铁与水的反应(已知:3Fe+4H2O(g)Fe3O4+4H2),某同学设计并进行了下列实验,虚线框处用来检验生成的气体。下列说法正确的是( )
A.实验后,装置B中生成红棕色固体
B.虚线框C处应该选择装置甲,试管中是灼热的铜丝
C.虚线框C处应该选择装置乙,试管中是灼热的表面覆盖氧化铜的铜丝
D.实验后,将装置B中的固体呈红棕色
8.许多富脂糕点的包装盒内都装有一小包黑色的还原性铁粉,长时间放置的糕点,其包装盒内的还原性铁粉往往会变成红棕色(主要成分是Fe2O3)。下列说法正确的是( )
A.还原性铁粉变成红棕色的过程中铁粉发生了氧化反应
B.富脂食品长时间放置易被还原
C.还原性铁粉溶入稀盐酸中得到的溶液可以腐蚀铜制线路板
D.如果在包装盒内放入Fe2(SO4)3,也可起到与铁粉同样的作用
9.实验室用FeCl2和烧碱制备Fe(OH)2,为使生成的产物不被氧化,下列说法错误的是( )
A.配制FeCl2溶液和烧碱溶液所用的蒸馏水要煮沸
B.可在FeCl2溶液的上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管中
D.产生Fe(OH)2沉淀后,不能振荡试管
10.有FeO、Fe2O3的混合物若干克,在CO气流中加热充分反应,冷却后称量剩余固体比原混合物质量减轻1.6 g,若将同质量的混合物与盐酸反应,欲使其完全溶解需1 mol·L-1盐酸的体积为( )
A.200 mL B.100 mL
C.50 mL D.无法计算
11.金属单质A可发生以下反应。试判断:
(1)A、B、C、D、E分别是(写化学式,B写主要成分)
A________、B________、C________、
D________、E________。
(2)写出反应③和⑤的离子方程式:
③___________________________________________________________;
⑤___________________________________________________________。
12.铁及其重要化合物之间的部分转化关系如图所示。
(1)下列金属矿物中用于冶炼金属铁的是________(填序号)。
a.金红石(TiO2)
b..赤铁矿(Fe2O3)
c.辉铜矿(Cu2S)
(2)实现Fe转化为Fe2+可选用足量的________(填序号)。
a.稀盐酸
b.氢氧化钠溶液
c.稀硫酸
(3)在点燃的条件下,Fe与足量Cl2剧烈反应,该反应的化学方程式为___________________________________________________________
___________________________________________________________。
(4)某同学将FeSO4溶液与NaOH溶液混合,未观察到白色沉淀,分析原因是生成的Fe(OH)2易被空气中的O2氧化,请你设计一个防止Fe(OH)2被O2氧化的实验方案___________________________________________________________。
13.某学习小组进行了如图所示的实验,实验后组员之间的交流不合理的是( )
A.甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色的火焰
B.乙同学认为试管a中生成的黑色固体可能为四氧化三铁
C.丙同学认为将少量还原性铁粉放入试管中,加适量的水,加热也可实现该反应
D.丁同学认为用盐酸溶解固体生成物所得溶液有颜色
14.某同学对铁的氧化物具有浓厚兴趣,查阅资料后制成以下卡片:
在空气中把铁灼烧到500 ℃就形成Fe3O4;温度再升高,可形成Fe2O3;在更高的温度下加热Fe2O3(约1 400 ℃)时,可失去氧,又得到Fe3O4,即:
FeFe3O4Fe2O3
下列说法不正确的是( )
A.FeO和Fe3O4均为黑色固体
B.反应①②③均为氧化还原反应
C.热稳定性顺序为:FeO>Fe2O3>Fe3O4
D.Fe3O4若写成氧化物的形式则化学式可写为FeO·Fe2O3,若视Fe3O4为一种盐则其化学式可写为Fe(FeO2)2
15.某化学学习小组设计了下列方法探究氢氧化亚铁的制备等相关问题。
(1)用NaOH溶液和FeSO4溶液直接反应,方法如图。该方法能观察到白色的Fe(OH)2沉淀,但沉淀颜色快速发生变化。请分析沉淀颜色变化的原因:___________________________________________________________
___________________________________________________________(用化学方程式表示)。
(2)该小组为探究反应物浓度对Fe(OH)2制备效果的影响,以Fe(OH)2沉淀白色持续时间(t)为指标,t越大,实验效果越好。部分实验数据如表(w代表质量分数):
实验 序号 w(FeSO4)/% w(NaOH)/% t/s
i 2.5 15 149
ii 5 15 138
iii 10 15 93
iv 5 25 142
v 5 35 180
①实验i、ii、iii的目的是______________________________________
___________________________________________________________
___________________________________________________________。
②该小组同学通过实验推断:其他条件不变时,所用NaOH溶液的浓度越大,实验效果越好。推断的证据是_______________________________________。
③由绿矾晶体(FeSO4·7H2O)配制250 mL 0.10 mol·L-1 FeSO4溶液,需要用到的仪器有药匙、玻璃棒、烧杯、托盘天平、250 mL容量瓶、________。以下操作会导致所配溶液浓度偏低的是________。
A.容量瓶中原有少量蒸馏水
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
(3)若向FeSO4溶液中加入足量Na2O2,观察到的现象是___________________________________________________________。
第一课时 铁的单质 铁的氧化物和铁的氢氧化物 课后巩固训练
1.“秦砖汉瓦”是我国传统建筑文化的一个缩影。同是由黏土烧制的砖瓦,有的是黑色的,有的却是红色的,你猜测其中的原因可能( )
A.土壤中含有铁粉、二氧化锰等
B.黑砖瓦是煅烧过程中附着了炭黑,红砖则是添加了红色耐高温染料
C.土壤中含有的铜元素经过不同工艺煅烧,分别生成了黑色CuO和红色Cu
D.土壤中含有的铁元素经过不同工艺煅烧,分别生成了黑色Fe3O4或FeO和红色Fe2O3
答案 D
解析 黏土中含有Fe元素,在烧制砖瓦时,与O2反应,生成氧化物,Fe元素的氧化物有3种,FeO与Fe3O4为黑色,Fe2O3为红棕色,故D项正确。
2.铁及其化合物应用广泛,下列关于铁单质及铁的化合物的说法错误的是( )
A.自然界中的铁单质主要来自陨石
B.氧化亚铁(FeO)在空气中加热容易被氧气氧化为氧化铁(Fe2O3)
C.氢氧化亚铁是一种还原性很强的白色难溶物质
D.FeO和Fe2O2不与水反应,但都是碱性氧化物
答案 B
解析 自然界中的铁单质主要来自陨石中的陨铁,A正确;氧化亚铁(FeO)在空气中加热容易被氧气氧化为四氧化三铁,化学式为Fe3O4,B错误;氢氧化亚铁是一种白色难溶物质,Fe元素化合价为+2价,具有强的还原性,很容易被空气中的氧气氧化产生红褐色的Fe(OH)3,C正确;FeO和Fe2O3能和酸反应生成对应的盐和水,故FeO和Fe2O3是碱性氧化物,D正确。
3.有关铁的氧化物的说法中,不正确的是( )
A.赤铁矿主要成分是Fe2O3,Fe2O3是红棕色的,常用作红色油漆和涂料
B.Fe3O4是黑色晶体,其中的铁显+2价,的铁显+3价
C.FeO、Fe2O3、Fe3O4都不溶于水,但都能和盐酸反应生成相应的盐
D.将Fe(OH)2露置在空气中加热灼烧所得的产物为Fe3O4
答案 D
解析 Fe(OH)2露置在空气中易被氧化为Fe(OH)3,所以Fe(OH)2露置在空气中加热产生Fe(OH)3,灼烧Fe(OH)3分解所得的产物为Fe2O3。
4.在一定条件下铁粉和水蒸气反应,可以得到铁的氧化物。实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。根据图示判断下列说法不正确的是( )
A.实验进行时试管A中应加入的试剂是铁粉
B.烧瓶B的作用是防止倒吸,烧瓶C的作用是产生水蒸气
C.试管D中收集到的是H2
D.A、B装置都需要酒精灯加热
答案 B
解析 发生固体与水蒸气的反应,则试管A中应加入的试剂是普通铁粉,故A正确;B为产生水蒸气的装置,C为安全瓶起防止倒吸的作用,故B错误;铁与水蒸气高温反应生成四氧化三铁和氢气,D中排水法收集的气体为氢气,故C正确;由题意可知,加热烧瓶B产生水蒸气,加热试管A使铁粉与水蒸气发生反应,故D正确。
5.下列说法正确的是( )
A.Fe比Al活泼
B.Fe与盐酸反应的离子方程式为2Fe+6H+===2Fe3++3H2↑
C.铁与CuSO4溶液反应可置换出铜
D.Fe不能与H2O反应
答案 C
解析 在金属活动性顺序中Al排在Fe的前面,故Al比Fe活泼,A错误;Fe与盐酸反应的离子方程式应为Fe+2H+===Fe2++H2↑,B错误;铁可置换出铜盐溶液中的铜,如:Fe+CuSO4===FeSO4+Cu,C正确;Fe在高温下可以与H2O(g)发生反应而生成Fe3O4和H2,D错误。
6.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是( )
A.①②③ B.①②④
C.①②③④ D.②③④
答案 B
解析 因为Fe(OH)2在空气中很容易被氧化为红褐色的Fe(OH)3,即发生4Fe(OH)2+O2+2H2O===4Fe(OH)3。因此要较长时间看到Fe(OH)2白色沉淀,就要排除装置中的氧气或空气。①、②原理一样,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;③由于空气中的氧气能迅速将Fe(OH)2氧化,因而不能较长时间看到白色沉淀;④中液面加苯阻止了空气进入,能较长时间看到白色沉淀。答案选B。
7.为探究铁与水的反应(已知:3Fe+4H2O(g)Fe3O4+4H2),某同学设计并进行了下列实验,虚线框处用来检验生成的气体。下列说法正确的是( )
A.实验后,装置B中生成红棕色固体
B.虚线框C处应该选择装置甲,试管中是灼热的铜丝
C.虚线框C处应该选择装置乙,试管中是灼热的表面覆盖氧化铜的铜丝
D.实验后,将装置B中的固体呈红棕色
答案 C
解析 由实验装置可知,A中加热提供水蒸气,B中Fe与水蒸气高温下反应生成四氧化三铁和氢气,且氢气不纯加热易发生爆炸,利用氢气将空气排出后加热。反应产生四氧化三铁,颜色为黑色,所以实验后,装置B中生成黑色固体,故A错误;由于氢气的密度较小,虚线框C处应该选择装置乙,试管中是灼热的表面覆盖氧化铜的铜丝,氢气还原CuO可以观察到黑色铜丝变为红色,检验产生的氢气,故B错误、C正确;四氧化三铁为黑色,故D错误。
8.许多富脂糕点的包装盒内都装有一小包黑色的还原性铁粉,长时间放置的糕点,其包装盒内的还原性铁粉往往会变成红棕色(主要成分是Fe2O3)。下列说法正确的是( )
A.还原性铁粉变成红棕色的过程中铁粉发生了氧化反应
B.富脂食品长时间放置易被还原
C.还原性铁粉溶入稀盐酸中得到的溶液可以腐蚀铜制线路板
D.如果在包装盒内放入Fe2(SO4)3,也可起到与铁粉同样的作用
答案 A
解析 还原Fe粉与食品包装袋中的O2反应产生红棕色的Fe2O3,在反应过程中Fe元素化合价升高,失去电子,被氧化,因此铁粉发生了氧化反应,A正确;富脂食品长时间放置易被包装袋中的残留的氧气氧化,而不是被还原,B错误;还原性铁粉溶入稀盐酸中,二者反应产生FeCl2,FeCl2的氧化性比较弱,不能与Cu反应,因此得到的溶液不能作铜制线路板的腐蚀液,C错误;Fe2(SO4)3只有氧化性,不具有还原性,因此若包装盒内放入Fe2(SO4)3,不能起到与铁粉同样的作用,D错误。
9.实验室用FeCl2和烧碱制备Fe(OH)2,为使生成的产物不被氧化,下列说法错误的是( )
A.配制FeCl2溶液和烧碱溶液所用的蒸馏水要煮沸
B.可在FeCl2溶液的上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管中
D.产生Fe(OH)2沉淀后,不能振荡试管
答案 C
解析 A项,FeCl2和烧碱溶液要现用现配,且配制溶液的蒸馏水要煮沸以除去氧气,确保Fe(OH)2在无氧环境中生成,正确;B项,在FeCl2溶液的上面加一层苯,以隔绝空气,防止氧气溶入,正确;C项,向FeCl2溶液中滴加烧碱溶液时,要将胶头滴管的尖嘴伸入到FeCl2溶液中,防止氢氧化钠溶液在滴入时溶有氧气,错误;D项,产生Fe(OH)2沉淀后,若振荡试管,会增大沉淀与空气接触的机会,使沉淀更易被氧化,正确。
10.有FeO、Fe2O3的混合物若干克,在CO气流中加热充分反应,冷却后称量剩余固体比原混合物质量减轻1.6 g,若将同质量的混合物与盐酸反应,欲使其完全溶解需1 mol·L-1盐酸的体积为( )
A.200 mL B.100 mL
C.50 mL D.无法计算
答案 A
解析 FeO、Fe2O3的混合物若干克,在CO气流中加热充分反应,生成Fe,冷却后称量剩余固体比原混合物质量减轻1.6 g,则减少的质量为氧元素的质量为氧原子的,物质的量是0.1 mol。将FeO、Fe2O3的混合物与盐酸反应生成FeCl2、FeCl3的混合物,相当于其中的O被Cl代替,1个O被2个Cl代替,所以需1 mol·L-1盐酸的体积V(HCl)=0.2 mol÷1 mol·L-1=0.2 L=200 mL。
11.金属单质A可发生以下反应。试判断:
(1)A、B、C、D、E分别是(写化学式,B写主要成分)
A________、B________、C________、
D________、E________。
(2)写出反应③和⑤的离子方程式:
③___________________________________________________________;
⑤___________________________________________________________。
答案 (1)Fe Fe2O3 Fe3O4 Cu H2 (2)Fe+Cu2+===Fe2++Cu Fe+2H+===Fe2++H2↑
解析 推断题的解题思路:根据物质的物理性质(特别是色、态)和化学性质(相互转化关系、反应条件等),找出具有特征条件的物质,再由相互转化关系逐步推断。如本题中结合B、C的颜色及与CuCl2溶液、稀盐酸反应的性质可推知A为Fe。
12.铁及其重要化合物之间的部分转化关系如图所示。
(1)下列金属矿物中用于冶炼金属铁的是________(填序号)。
a.金红石(TiO2)
b..赤铁矿(Fe2O3)
c.辉铜矿(Cu2S)
(2)实现Fe转化为Fe2+可选用足量的________(填序号)。
a.稀盐酸
b.氢氧化钠溶液
c.稀硫酸
(3)在点燃的条件下,Fe与足量Cl2剧烈反应,该反应的化学方程式为___________________________________________________________
___________________________________________________________。
(4)某同学将FeSO4溶液与NaOH溶液混合,未观察到白色沉淀,分析原因是生成的Fe(OH)2易被空气中的O2氧化,请你设计一个防止Fe(OH)2被O2氧化的实验方案___________________________________________________________。
答案 (1)b (2)ac (3)2Fe+3Cl22FeCl3
(4)在FeSO4溶液表面加入适量的煤油,隔绝空气,在硫酸亚铁溶液的液面下挤出胶头滴管中的NaOH溶液
解析 (1)用于冶炼金属铁,可知化合物含Fe元素,只有赤铁矿符合;(2)Fe转化为Fe2+,Fe与弱氧化剂反应,稀硫酸、稀盐酸符合,与NaOH不反应;(3)氯气具有强氧化性,与Fe反应生成氯化铁,该反应的化学方程式为2Fe+3Cl22FeCl3;(4)防止Fe(OH)2被O2氧化的实验方案为在FeSO4溶液表面加入适量的煤油,隔绝空气,在硫酸亚铁溶液的液面下挤出胶头滴管中的NaOH溶液。
13.某学习小组进行了如图所示的实验,实验后组员之间的交流不合理的是( )
A.甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色的火焰
B.乙同学认为试管a中生成的黑色固体可能为四氧化三铁
C.丙同学认为将少量还原性铁粉放入试管中,加适量的水,加热也可实现该反应
D.丁同学认为用盐酸溶解固体生成物所得溶液有颜色
答案 C
解析 在高温下铁与水蒸气反应生成氢气和四氧化三铁。甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色火焰,正确;乙同学认为试管a中生成的黑色固体可能为四氧化三铁,正确;铁与水不反应,应该是铁与水蒸气在高温下反应,丙同学的观点错误;丁同学认为用盐酸溶解固体生成物得到氯化亚铁和氯化铁的混合溶液,溶液带有颜色,正确。
14.某同学对铁的氧化物具有浓厚兴趣,查阅资料后制成以下卡片:
在空气中把铁灼烧到500 ℃就形成Fe3O4;温度再升高,可形成Fe2O3;在更高的温度下加热Fe2O3(约1 400 ℃)时,可失去氧,又得到Fe3O4,即:
FeFe3O4Fe2O3
下列说法不正确的是( )
A.FeO和Fe3O4均为黑色固体
B.反应①②③均为氧化还原反应
C.热稳定性顺序为:FeO>Fe2O3>Fe3O4
D.Fe3O4若写成氧化物的形式则化学式可写为FeO·Fe2O3,若视Fe3O4为一种盐则其化学式可写为Fe(FeO2)2
答案 C
解析 FeO、Fe3O4均为黑色固体,故A正确;反应①②③中铁元素的化合价均发生了变化,均为氧化还原反应,故B正确;FeO不稳定,能被氧化为Fe3O4,故C错误;Fe3O4中铁有两种化合价:+2、+3,FeO·Fe2O3和Fe(FeO2)2的形式均符合,故D正确。
15.某化学学习小组设计了下列方法探究氢氧化亚铁的制备等相关问题。
(1)用NaOH溶液和FeSO4溶液直接反应,方法如图。该方法能观察到白色的Fe(OH)2沉淀,但沉淀颜色快速发生变化。请分析沉淀颜色变化的原因:___________________________________________________________
___________________________________________________________(用化学方程式表示)。
(2)该小组为探究反应物浓度对Fe(OH)2制备效果的影响,以Fe(OH)2沉淀白色持续时间(t)为指标,t越大,实验效果越好。部分实验数据如表(w代表质量分数):
实验 序号 w(FeSO4)/% w(NaOH)/% t/s
i 2.5 15 149
ii 5 15 138
iii 10 15 93
iv 5 25 142
v 5 35 180
①实验i、ii、iii的目的是______________________________________
___________________________________________________________
___________________________________________________________。
②该小组同学通过实验推断:其他条件不变时,所用NaOH溶液的浓度越大,实验效果越好。推断的证据是_______________________________________。
③由绿矾晶体(FeSO4·7H2O)配制250 mL 0.10 mol·L-1 FeSO4溶液,需要用到的仪器有药匙、玻璃棒、烧杯、托盘天平、250 mL容量瓶、________。以下操作会导致所配溶液浓度偏低的是________。
A.容量瓶中原有少量蒸馏水
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
(3)若向FeSO4溶液中加入足量Na2O2,观察到的现象是___________________________________________________________。
答案 (1)4Fe(OH)2+O2+2H2O===4Fe(OH)3 (2)①探究其他条件相同时,FeSO4溶液浓度对Fe(OH)2制备效果的影响 ②沉淀持续时间t:v>iv>ii ③胶头滴管 BD (3)有红褐色沉淀生成,有气体放出
解析 (1)FeSO4和NaOH发生复分解反应生成Fe(OH)2,Fe(OH)2被空气中的氧气氧化生成Fe(OH)3,化学方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3;(2)①实验i、ii、iii的变量是FeSO4溶液浓度,目的是:探究其他条件相同时,FeSO4溶液浓度对Fe(OH)2制备效果的影响;②实验v、iv、ii的变量是NaOH溶液浓度,其他条件不变时,所用NaOH溶液的浓度越大,沉淀持续时间越长,实验效果越好,则证据是:沉淀持续时间t:v>iv>ii;③配制一定物质的量浓度溶液配制的步骤:计算、称量、溶解、移液、洗涤、定容等,用到的仪器:药匙、玻璃棒、烧杯、托盘天平、250 mL容量瓶、胶头滴管;定容时还需要加入蒸馏水,容量瓶中原有少量蒸馏水对所配溶液浓度无影响,A不选;洗涤烧杯和玻璃棒的溶液未转入容量瓶中,则残留在杯壁上的溶质没有完全转移到容量瓶,导致所配溶液浓度偏低,B选;定容时俯视刻度线导致溶液体积偏小,依据c=可知溶液浓度偏高,C不选;定容摇匀后发现溶液凹面低于刻度线,再补加少量蒸馏水至刻度线,导致加入水的体积增大,溶液浓度偏低,D选;故选:BD;(3)Na2O2和水反应生成NaOH和O2,NaOH再和FeSO4溶液反应生成Fe(OH)2,由于Na2O2过量,则Fe(OH)2被氧化为Fe(OH)3,观察到的现象是有红褐色沉淀生成,有气体放出。
