第二章第二节 氯及其化合物 第二课时 氯气的实验室制法 氯离子的检验 课后巩固训练(含合格过关练+素养培优练 解析版)
文档属性
| 名称 | 第二章第二节 氯及其化合物 第二课时 氯气的实验室制法 氯离子的检验 课后巩固训练(含合格过关练+素养培优练 解析版) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-07 17:06:20 | ||
图片预览

文档简介
第二课时 氯气的实验室制法 氯离子的检验 课后巩固训练
1.下列关于实验室用二氧化锰制取氯气的叙述不正确的是( )
A.二氧化锰与浓盐酸共热
B.缓慢加热反应
C.用向下排空气法收集氯气
D.多余氯气常用较浓的碱液吸收
2.在实验室利用浓盐酸和二氧化锰制氯气,制备装置中应使用分液漏斗而不能使用长颈漏斗,下列有关理由叙述错误的是( )
A.防止氯气扩散到空气中造成污染
B.便于控制加入盐酸的量
C.长颈漏斗便于添加液体
D.尽量避免氯化氢挥发到空气中
3.能证明某溶液中含有NaCl的是( )
A.焰色试验是黄色
B.溶液有咸味
C.取少量溶液于试管中,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀
D.焰色试验是黄色,同时又能与硝酸酸化的硝酸银溶液反应生成白色沉淀
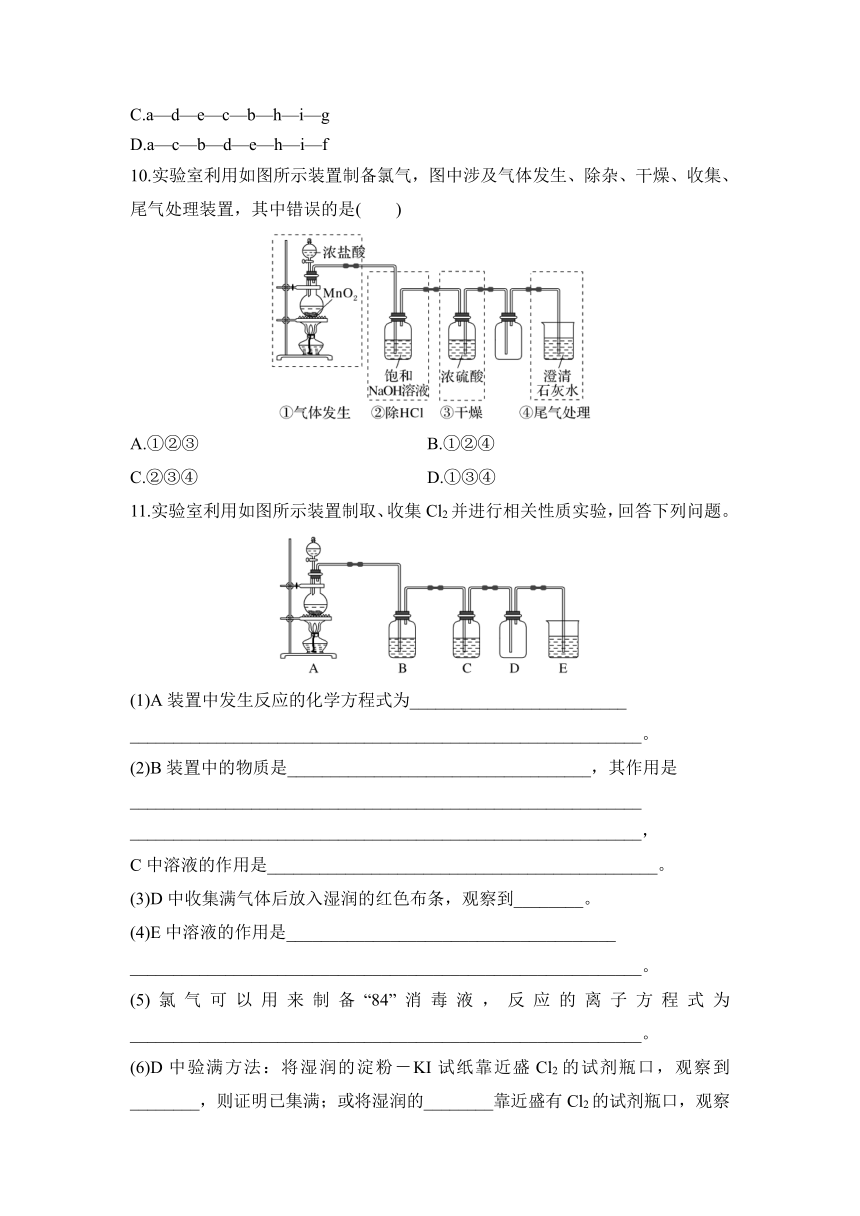
4.在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的正确装置是( )
5.下列关于实验室制取氯气的说法正确的是( )
A.浓盐酸可用稀盐酸代替
B.为了便于学生观察实验操作过程,可在讲台上直接做氯气的制备实验
C.可用饱和食盐水吸收尾气
D.可在集气瓶口放一张湿润的淀粉碘化钾试纸,观察氯气是否收集满
6.已知KMnO4在常温下与浓盐酸反应生成Cl2,如图是用KMnO4与浓盐酸反应制取Cl2的简易装置,下列叙述不正确的是( )
A.在试管①中盛有饱和食盐水,用试管②收集Cl2
B.用试管①收集Cl2,试管②可防止NaOH溶液倒吸入试管①中
C.③用于吸收多余的Cl2,防止污染环境
D.用该装置收集到的Cl2中会混有HCl气体和水蒸气
7.下列描述正确的是( )
A.将Cl2与HCl混合气体通过饱和食盐水可得到纯净干燥的Cl2
B.将浓盐酸与MnO2共热产生的气体先通过浓H2SO4,后通过饱和食盐水来制备纯净干燥的Cl2
C.过量浓盐酸与一定量二氧化锰反应,MnO2能完全反应
D.除去氯气中的HCl气体,装置如图
8.用下列两种方法制取氯气:
①用含氯化氢146 g的浓盐酸与足量的二氧化锰反应;②用87 g二氧化锰与足量的浓盐酸反应。则所得氯气( )
A.②比①多 B.①比②多
C.一样多 D.无法比较
9.下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )
A.a—b—c—d—e—f—g—h
B.a—e—d—c—b—h—i—g
C.a—d—e—c—b—h—i—g
D.a—c—b—d—e—h—i—f
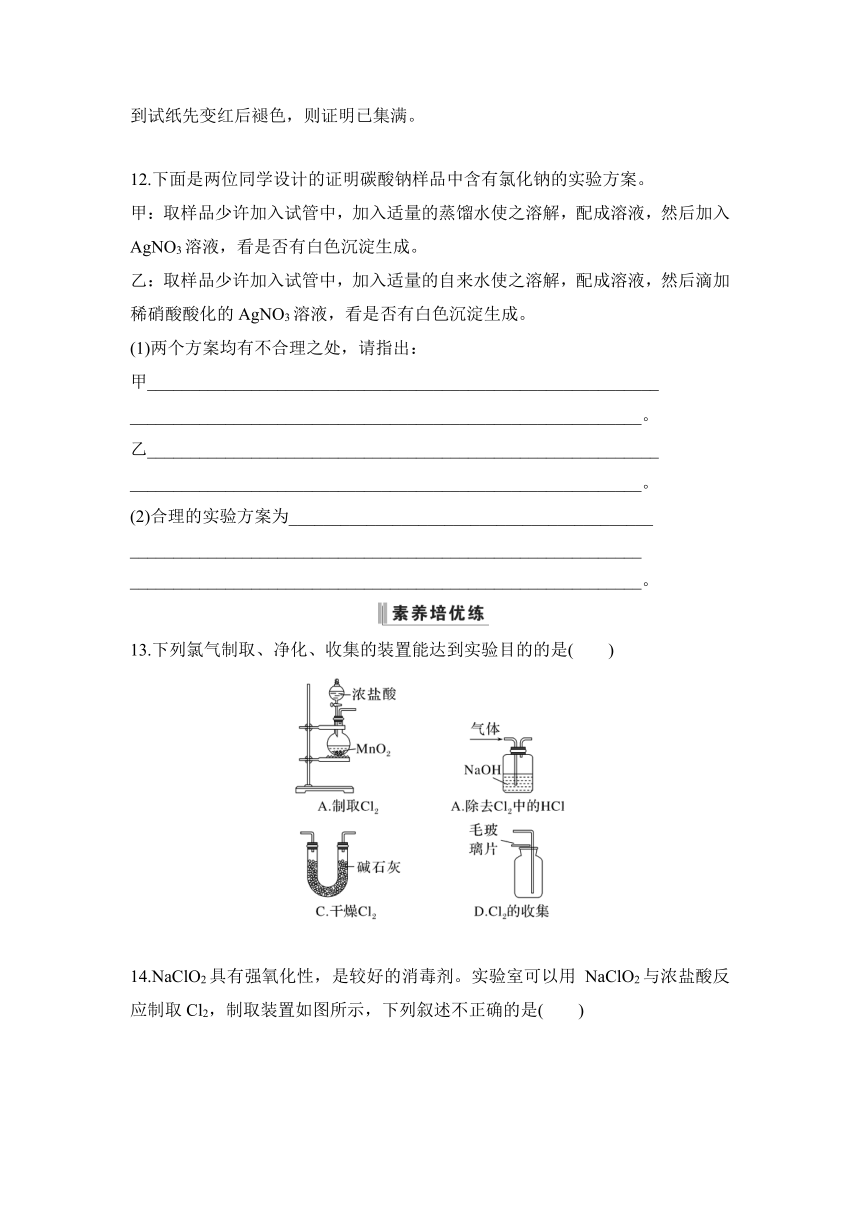
10.实验室利用如图所示装置制备氯气,图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是( )
A.①②③ B.①②④
C.②③④ D.①③④
11.实验室利用如图所示装置制取、收集Cl2并进行相关性质实验,回答下列问题。
(1)A装置中发生反应的化学方程式为_________________________
___________________________________________________________。
(2)B装置中的物质是___________________________________,其作用是
___________________________________________________________
___________________________________________________________,
C中溶液的作用是_____________________________________________。
(3)D中收集满气体后放入湿润的红色布条,观察到________。
(4)E中溶液的作用是______________________________________
___________________________________________________________。
(5)氯气可以用来制备“84”消毒液,反应的离子方程式为___________________________________________________________。
(6)D中验满方法:将湿润的淀粉-KI试纸靠近盛Cl2的试剂瓶口,观察到________,则证明已集满;或将湿润的________靠近盛有Cl2的试剂瓶口,观察到试纸先变红后褪色,则证明已集满。
12.下面是两位同学设计的证明碳酸钠样品中含有氯化钠的实验方案。
甲:取样品少许加入试管中,加入适量的蒸馏水使之溶解,配成溶液,然后加入AgNO3溶液,看是否有白色沉淀生成。
乙:取样品少许加入试管中,加入适量的自来水使之溶解,配成溶液,然后滴加稀硝酸酸化的AgNO3溶液,看是否有白色沉淀生成。
(1)两个方案均有不合理之处,请指出:
甲___________________________________________________________
___________________________________________________________。
乙___________________________________________________________
___________________________________________________________。
(2)合理的实验方案为__________________________________________
___________________________________________________________
___________________________________________________________。
13.下列氯气制取、净化、收集的装置能达到实验目的的是( )
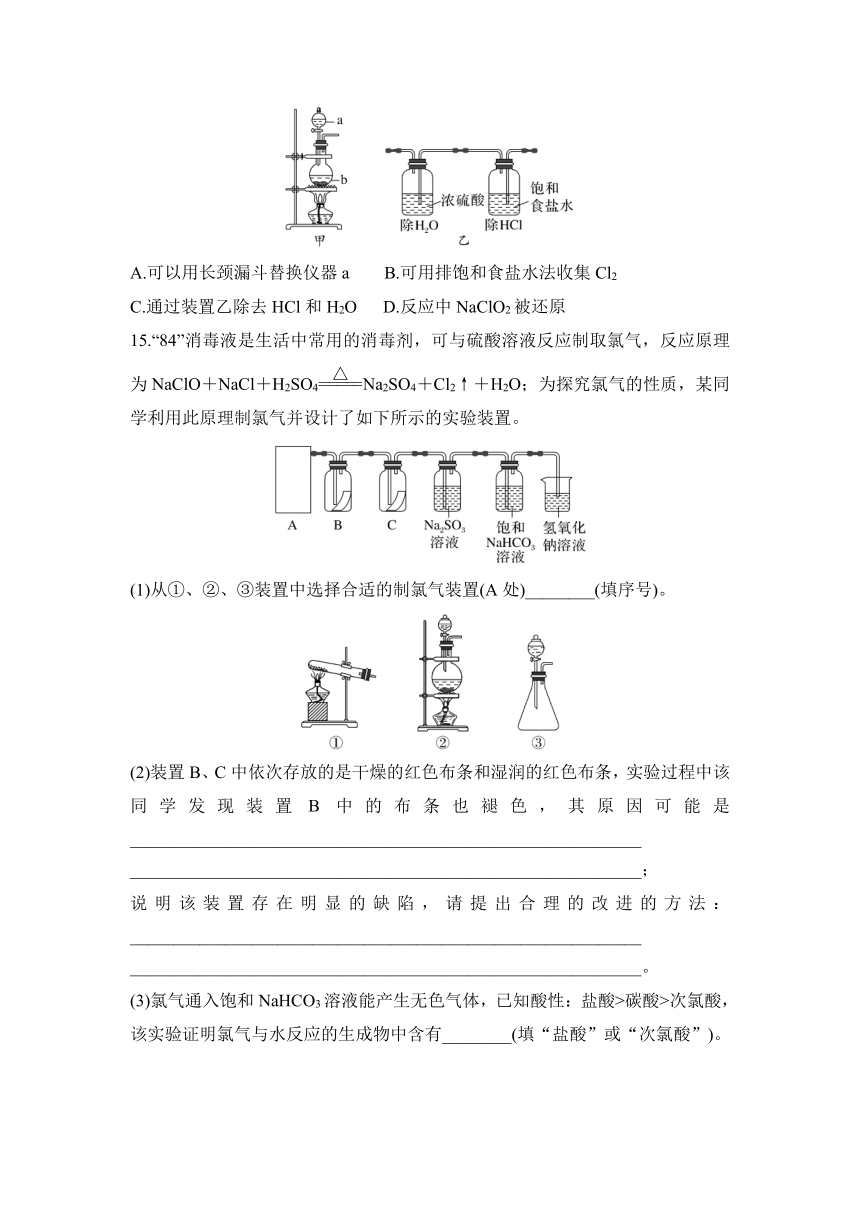
14.NaClO2具有强氧化性,是较好的消毒剂。实验室可以用 NaClO2与浓盐酸反应制取Cl2,制取装置如图所示,下列叙述不正确的是( )
A.可以用长颈漏斗替换仪器a B.可用排饱和食盐水法收集Cl2
C.通过装置乙除去HCl和H2O D.反应中NaClO2被还原
15.“84”消毒液是生活中常用的消毒剂,可与硫酸溶液反应制取氯气,反应原理为NaClO+NaCl+H2SO4Na2SO4+Cl2↑+H2O;为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置。
(1)从①、②、③装置中选择合适的制氯气装置(A处)________(填序号)。
(2)装置B、C中依次存放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是___________________________________________________________
___________________________________________________________;
说明该装置存在明显的缺陷,请提出合理的改进的方法:___________________________________________________________
___________________________________________________________。
(3)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有________(填“盐酸”或“次氯酸”)。
第二课时 氯气的实验室制法 氯离子的检验 课后巩固训练
1.下列关于实验室用二氧化锰制取氯气的叙述不正确的是( )
A.二氧化锰与浓盐酸共热
B.缓慢加热反应
C.用向下排空气法收集氯气
D.多余氯气常用较浓的碱液吸收
答案 C
解析 氯气的密度比空气大,应选择向上排空气法收集。
2.在实验室利用浓盐酸和二氧化锰制氯气,制备装置中应使用分液漏斗而不能使用长颈漏斗,下列有关理由叙述错误的是( )
A.防止氯气扩散到空气中造成污染
B.便于控制加入盐酸的量
C.长颈漏斗便于添加液体
D.尽量避免氯化氢挥发到空气中
答案 C
解析 用分液漏斗既可防止氯化氢气体和氯气挥发,污染环境,同时又可控制滴加盐酸的量和快慢,从而控制反应速率,提高盐酸的利用率。
3.能证明某溶液中含有NaCl的是( )
A.焰色试验是黄色
B.溶液有咸味
C.取少量溶液于试管中,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀
D.焰色试验是黄色,同时又能与硝酸酸化的硝酸银溶液反应生成白色沉淀
答案 D
解析 要证明含有Na+,则焰色试验为黄色;要证明含有Cl-,则加入稀硝酸酸化的AgNO3溶液后生成白色沉淀。
4.在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的正确装置是( )
答案 C
解析 集气瓶中使用单孔橡胶塞塞紧,只能进气,不能排气,则瓶内压强增大到一定程度,可能将橡胶塞压出,A项错误;因为Cl2比空气的密度大,Cl2应短管进,B项错误;该装置既能收集Cl2,又能进行尾气处理且防倒吸,C项正确;由于Cl2和NaOH反应,所以不能收集到Cl2,D项错误。
5.下列关于实验室制取氯气的说法正确的是( )
A.浓盐酸可用稀盐酸代替
B.为了便于学生观察实验操作过程,可在讲台上直接做氯气的制备实验
C.可用饱和食盐水吸收尾气
D.可在集气瓶口放一张湿润的淀粉碘化钾试纸,观察氯气是否收集满
答案 D
解析 稀盐酸与MnO2不反应,A错误;在讲台上直接做氯气的制备实验,没有在通风橱中进行,容易造成中毒事件,B错误;饱和食盐水不能与氯气反应,不能用于吸收尾气,C错误;可在集气瓶口放一张湿润的淀粉碘化钾试纸,若试纸变蓝,则氯气集满,D正确。
6.已知KMnO4在常温下与浓盐酸反应生成Cl2,如图是用KMnO4与浓盐酸反应制取Cl2的简易装置,下列叙述不正确的是( )
A.在试管①中盛有饱和食盐水,用试管②收集Cl2
B.用试管①收集Cl2,试管②可防止NaOH溶液倒吸入试管①中
C.③用于吸收多余的Cl2,防止污染环境
D.用该装置收集到的Cl2中会混有HCl气体和水蒸气
答案 A
解析 根据导管的长短可知试管①用于收集Cl2,试管②用于防止NaOH溶液倒吸入试管①中,A错误,B正确;NaOH溶液吸收多余的Cl2,防止污染环境,C正确;浓盐酸易挥发,①中收集到的Cl2中混有HCl和水蒸气,D正确。
7.下列描述正确的是( )
A.将Cl2与HCl混合气体通过饱和食盐水可得到纯净干燥的Cl2
B.将浓盐酸与MnO2共热产生的气体先通过浓H2SO4,后通过饱和食盐水来制备纯净干燥的Cl2
C.过量浓盐酸与一定量二氧化锰反应,MnO2能完全反应
D.除去氯气中的HCl气体,装置如图
答案 C
解析 HCl极易溶于水,食盐水吸收HCl同时抑制氯气的溶解,还需浓硫酸干燥氯气,故A错误;浓盐酸易挥发,应先通过饱和食盐水除去HCl,后经过浓硫酸干燥,故B错误;浓盐酸与二氧化锰反应,浓盐酸需过量,能使MnO2完全反应,故C正确;Cl2和HCl二者均与碳酸氢钠溶液反应,且生成新杂质CO2气体,故D错误。
8.用下列两种方法制取氯气:
①用含氯化氢146 g的浓盐酸与足量的二氧化锰反应;②用87 g二氧化锰与足量的浓盐酸反应。则所得氯气( )
A.②比①多 B.①比②多
C.一样多 D.无法比较
答案 A
解析 浓盐酸与MnO2反应的化学方程式为4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O,随着反应进行,盐酸浓度逐渐减小,变为稀盐酸后不再与MnO2反应。①中HCl不能完全反应,产生的Cl2少,②中MnO2能完全反应,制得Cl2多。故产生Cl2②>①。
9.下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )
A.a—b—c—d—e—f—g—h
B.a—e—d—c—b—h—i—g
C.a—d—e—c—b—h—i—g
D.a—c—b—d—e—h—i—f
答案 B
解析 按制气→除HCl→除H2O→制备FeCl3→吸收Cl2顺序连接。
10.实验室利用如图所示装置制备氯气,图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是( )
A.①②③ B.①②④
C.②③④ D.①③④
答案 C
解析 应选饱和食盐水除去氯化氢,不能用氢氧化钠,因为氢氧化钠可以与氯气反应,故②错误;干燥装置应长导管进气,否则浓硫酸会被压入其右侧装置中,故③错误;澄清石灰水浓度较低,无法完全吸收氯气;应用氢氧化钠溶液吸收氯气,故④错误;图中只有①合理。
11.实验室利用如图所示装置制取、收集Cl2并进行相关性质实验,回答下列问题。
(1)A装置中发生反应的化学方程式为_________________________
___________________________________________________________。
(2)B装置中的物质是___________________________________,其作用是
___________________________________________________________
___________________________________________________________,
C中溶液的作用是_____________________________________________。
(3)D中收集满气体后放入湿润的红色布条,观察到________。
(4)E中溶液的作用是______________________________________
___________________________________________________________。
(5)氯气可以用来制备“84”消毒液,反应的离子方程式为___________________________________________________________。
(6)D中验满方法:将湿润的淀粉-KI试纸靠近盛Cl2的试剂瓶口,观察到________,则证明已集满;或将湿润的________靠近盛有Cl2的试剂瓶口,观察到试纸先变红后褪色,则证明已集满。
答案 (1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (2)饱和食盐水 除去氯气中的氯化氢 干燥氯气 (3)红色布条褪色 (4)吸收尾气,防止污染空气 (5)Cl2+2OH-===Cl-+ClO-+H2O (6)试纸变蓝 蓝色石蕊试纸
解析 (1)MnO2与浓盐酸共热生成MnCl2、Cl2和H2O。(2)盐酸易挥发,故氯气中含氯化氢,氯化氢极易溶于水,而氯气难溶于饱和食盐水,故用饱和食盐水洗气后用浓硫酸干燥氯气。(3)干燥的氯气没有漂白性,但氯气与水反应生成盐酸和次氯酸,次氯酸有漂白性,故氯气中放入湿润的红色布条,观察到红色布条褪色。(4)氯气有毒,E中的氢氧化钠溶液吸收尾气防止污染空气。(5)“84”消毒液的主要成分为氯化钠、次氯酸钠,有效成分为次氯酸钠。(6)D中验满方法:将湿润的淀粉-KI试纸靠近盛Cl2的试剂瓶口,氯气置换出碘后与淀粉发生反应变蓝色,故观察到试纸变蓝,则证明已集满;或将湿润的蓝色石蕊试纸靠近盛有Cl2的试剂瓶口,观察到试纸变红后褪色,则证明已集满。
12.下面是两位同学设计的证明碳酸钠样品中含有氯化钠的实验方案。
甲:取样品少许加入试管中,加入适量的蒸馏水使之溶解,配成溶液,然后加入AgNO3溶液,看是否有白色沉淀生成。
乙:取样品少许加入试管中,加入适量的自来水使之溶解,配成溶液,然后滴加稀硝酸酸化的AgNO3溶液,看是否有白色沉淀生成。
(1)两个方案均有不合理之处,请指出:
甲___________________________________________________________
___________________________________________________________。
乙___________________________________________________________
___________________________________________________________。
(2)合理的实验方案为__________________________________________
___________________________________________________________
___________________________________________________________。
答案 (1)AgNO3溶液没有用稀硝酸酸化,不能排除CO的干扰 用自来水配制溶液会引入Cl-,影响Cl-的检验
(2)取少许样品加入试管中,加入适量的蒸馏水配成溶液,然后加入稀硝酸酸化的AgNO3溶液,看是否有白色沉淀生成
解析 甲方案中没有用稀硝酸排除CO的干扰,Ag2CO3也是白色沉淀。乙方案中用自来水配制溶液,自来水中含有Cl-,影响Cl-的检验。
13.下列氯气制取、净化、收集的装置能达到实验目的的是( )
答案 D
解析 浓盐酸与二氧化锰共热发生氧化还原反应生成氯气,装置中缺酒精灯,无法制得氯气,故A错误;氯气和氯化氢均能与氢氧化钠溶液反应,不能用氢氧化钠溶液除去氯气中混有的氯化氢气体,应选用饱和食盐水,故B错误;氯气能与碱石灰反应,不能用碱石灰干燥氯气,应选用硅胶或五氧化二磷,故C错误;氯气的密度比空气的大,应选用向上排空气法收集氯气,故D正确。
14.NaClO2具有强氧化性,是较好的消毒剂。实验室可以用 NaClO2与浓盐酸反应制取Cl2,制取装置如图所示,下列叙述不正确的是( )
A.可以用长颈漏斗替换仪器a
B.可用排饱和食盐水法收集Cl2
C.通过装置乙除去HCl和H2O
D.反应中NaClO2被还原
答案 A
解析 不能选用长颈漏斗代替或替换仪器a,生成的氯气易从长颈漏斗逸出,故A错误;可用排饱和食盐水法收集Cl2,故B正确;除杂时先通过饱和食盐水除去HCl,后经浓硫酸干燥,图乙能除杂,故C正确;反应中NaClO2得到电子被还原,故D正确。
15.“84”消毒液是生活中常用的消毒剂,可与硫酸溶液反应制取氯气,反应原理为NaClO+NaCl+H2SO4Na2SO4+Cl2↑+H2O;为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置。
(1)从①、②、③装置中选择合适的制氯气装置(A处)________(填序号)。
(2)装置B、C中依次存放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是___________________________________________________________
___________________________________________________________;
说明该装置存在明显的缺陷,请提出合理的改进的方法:___________________________________________________________
___________________________________________________________。
(3)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有________(填“盐酸”或“次氯酸”)。
答案 (1)② (2)产生的氯气中含有水蒸气,会反应生成次氯酸 在装置A、B之间增加盛有浓硫酸的洗气瓶(或干燥装置) (3)盐酸
解析 (1)由NaClO+NaCl+H2SO4Na2SO4+Cl2↑+H2O可知,反应有液体参加,需要在加热条件下进行,故选装置②。(2)装置B中干燥的有色布条褪色,说明氯气中可能混有少量的水蒸气,氯气与水反应生成次氯酸而漂白,因此应在A和B之间增加盛有浓H2SO4的洗气瓶,除去Cl2中的水蒸气。(3)氯气通入水溶液会反应生成盐酸和次氯酸,酸性:盐酸>碳酸>次氯酸,氯气通入饱和NaHCO3溶液能产生无色气体,证明氯气与水反应的生成物中含有盐酸。
1.下列关于实验室用二氧化锰制取氯气的叙述不正确的是( )
A.二氧化锰与浓盐酸共热
B.缓慢加热反应
C.用向下排空气法收集氯气
D.多余氯气常用较浓的碱液吸收
2.在实验室利用浓盐酸和二氧化锰制氯气,制备装置中应使用分液漏斗而不能使用长颈漏斗,下列有关理由叙述错误的是( )
A.防止氯气扩散到空气中造成污染
B.便于控制加入盐酸的量
C.长颈漏斗便于添加液体
D.尽量避免氯化氢挥发到空气中
3.能证明某溶液中含有NaCl的是( )
A.焰色试验是黄色
B.溶液有咸味
C.取少量溶液于试管中,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀
D.焰色试验是黄色,同时又能与硝酸酸化的硝酸银溶液反应生成白色沉淀
4.在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的正确装置是( )
5.下列关于实验室制取氯气的说法正确的是( )
A.浓盐酸可用稀盐酸代替
B.为了便于学生观察实验操作过程,可在讲台上直接做氯气的制备实验
C.可用饱和食盐水吸收尾气
D.可在集气瓶口放一张湿润的淀粉碘化钾试纸,观察氯气是否收集满
6.已知KMnO4在常温下与浓盐酸反应生成Cl2,如图是用KMnO4与浓盐酸反应制取Cl2的简易装置,下列叙述不正确的是( )
A.在试管①中盛有饱和食盐水,用试管②收集Cl2
B.用试管①收集Cl2,试管②可防止NaOH溶液倒吸入试管①中
C.③用于吸收多余的Cl2,防止污染环境
D.用该装置收集到的Cl2中会混有HCl气体和水蒸气
7.下列描述正确的是( )
A.将Cl2与HCl混合气体通过饱和食盐水可得到纯净干燥的Cl2
B.将浓盐酸与MnO2共热产生的气体先通过浓H2SO4,后通过饱和食盐水来制备纯净干燥的Cl2
C.过量浓盐酸与一定量二氧化锰反应,MnO2能完全反应
D.除去氯气中的HCl气体,装置如图
8.用下列两种方法制取氯气:
①用含氯化氢146 g的浓盐酸与足量的二氧化锰反应;②用87 g二氧化锰与足量的浓盐酸反应。则所得氯气( )
A.②比①多 B.①比②多
C.一样多 D.无法比较
9.下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )
A.a—b—c—d—e—f—g—h
B.a—e—d—c—b—h—i—g
C.a—d—e—c—b—h—i—g
D.a—c—b—d—e—h—i—f
10.实验室利用如图所示装置制备氯气,图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是( )
A.①②③ B.①②④
C.②③④ D.①③④
11.实验室利用如图所示装置制取、收集Cl2并进行相关性质实验,回答下列问题。
(1)A装置中发生反应的化学方程式为_________________________
___________________________________________________________。
(2)B装置中的物质是___________________________________,其作用是
___________________________________________________________
___________________________________________________________,
C中溶液的作用是_____________________________________________。
(3)D中收集满气体后放入湿润的红色布条,观察到________。
(4)E中溶液的作用是______________________________________
___________________________________________________________。
(5)氯气可以用来制备“84”消毒液,反应的离子方程式为___________________________________________________________。
(6)D中验满方法:将湿润的淀粉-KI试纸靠近盛Cl2的试剂瓶口,观察到________,则证明已集满;或将湿润的________靠近盛有Cl2的试剂瓶口,观察到试纸先变红后褪色,则证明已集满。
12.下面是两位同学设计的证明碳酸钠样品中含有氯化钠的实验方案。
甲:取样品少许加入试管中,加入适量的蒸馏水使之溶解,配成溶液,然后加入AgNO3溶液,看是否有白色沉淀生成。
乙:取样品少许加入试管中,加入适量的自来水使之溶解,配成溶液,然后滴加稀硝酸酸化的AgNO3溶液,看是否有白色沉淀生成。
(1)两个方案均有不合理之处,请指出:
甲___________________________________________________________
___________________________________________________________。
乙___________________________________________________________
___________________________________________________________。
(2)合理的实验方案为__________________________________________
___________________________________________________________
___________________________________________________________。
13.下列氯气制取、净化、收集的装置能达到实验目的的是( )
14.NaClO2具有强氧化性,是较好的消毒剂。实验室可以用 NaClO2与浓盐酸反应制取Cl2,制取装置如图所示,下列叙述不正确的是( )
A.可以用长颈漏斗替换仪器a B.可用排饱和食盐水法收集Cl2
C.通过装置乙除去HCl和H2O D.反应中NaClO2被还原
15.“84”消毒液是生活中常用的消毒剂,可与硫酸溶液反应制取氯气,反应原理为NaClO+NaCl+H2SO4Na2SO4+Cl2↑+H2O;为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置。
(1)从①、②、③装置中选择合适的制氯气装置(A处)________(填序号)。
(2)装置B、C中依次存放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是___________________________________________________________
___________________________________________________________;
说明该装置存在明显的缺陷,请提出合理的改进的方法:___________________________________________________________
___________________________________________________________。
(3)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有________(填“盐酸”或“次氯酸”)。
第二课时 氯气的实验室制法 氯离子的检验 课后巩固训练
1.下列关于实验室用二氧化锰制取氯气的叙述不正确的是( )
A.二氧化锰与浓盐酸共热
B.缓慢加热反应
C.用向下排空气法收集氯气
D.多余氯气常用较浓的碱液吸收
答案 C
解析 氯气的密度比空气大,应选择向上排空气法收集。
2.在实验室利用浓盐酸和二氧化锰制氯气,制备装置中应使用分液漏斗而不能使用长颈漏斗,下列有关理由叙述错误的是( )
A.防止氯气扩散到空气中造成污染
B.便于控制加入盐酸的量
C.长颈漏斗便于添加液体
D.尽量避免氯化氢挥发到空气中
答案 C
解析 用分液漏斗既可防止氯化氢气体和氯气挥发,污染环境,同时又可控制滴加盐酸的量和快慢,从而控制反应速率,提高盐酸的利用率。
3.能证明某溶液中含有NaCl的是( )
A.焰色试验是黄色
B.溶液有咸味
C.取少量溶液于试管中,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀
D.焰色试验是黄色,同时又能与硝酸酸化的硝酸银溶液反应生成白色沉淀
答案 D
解析 要证明含有Na+,则焰色试验为黄色;要证明含有Cl-,则加入稀硝酸酸化的AgNO3溶液后生成白色沉淀。
4.在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的正确装置是( )
答案 C
解析 集气瓶中使用单孔橡胶塞塞紧,只能进气,不能排气,则瓶内压强增大到一定程度,可能将橡胶塞压出,A项错误;因为Cl2比空气的密度大,Cl2应短管进,B项错误;该装置既能收集Cl2,又能进行尾气处理且防倒吸,C项正确;由于Cl2和NaOH反应,所以不能收集到Cl2,D项错误。
5.下列关于实验室制取氯气的说法正确的是( )
A.浓盐酸可用稀盐酸代替
B.为了便于学生观察实验操作过程,可在讲台上直接做氯气的制备实验
C.可用饱和食盐水吸收尾气
D.可在集气瓶口放一张湿润的淀粉碘化钾试纸,观察氯气是否收集满
答案 D
解析 稀盐酸与MnO2不反应,A错误;在讲台上直接做氯气的制备实验,没有在通风橱中进行,容易造成中毒事件,B错误;饱和食盐水不能与氯气反应,不能用于吸收尾气,C错误;可在集气瓶口放一张湿润的淀粉碘化钾试纸,若试纸变蓝,则氯气集满,D正确。
6.已知KMnO4在常温下与浓盐酸反应生成Cl2,如图是用KMnO4与浓盐酸反应制取Cl2的简易装置,下列叙述不正确的是( )
A.在试管①中盛有饱和食盐水,用试管②收集Cl2
B.用试管①收集Cl2,试管②可防止NaOH溶液倒吸入试管①中
C.③用于吸收多余的Cl2,防止污染环境
D.用该装置收集到的Cl2中会混有HCl气体和水蒸气
答案 A
解析 根据导管的长短可知试管①用于收集Cl2,试管②用于防止NaOH溶液倒吸入试管①中,A错误,B正确;NaOH溶液吸收多余的Cl2,防止污染环境,C正确;浓盐酸易挥发,①中收集到的Cl2中混有HCl和水蒸气,D正确。
7.下列描述正确的是( )
A.将Cl2与HCl混合气体通过饱和食盐水可得到纯净干燥的Cl2
B.将浓盐酸与MnO2共热产生的气体先通过浓H2SO4,后通过饱和食盐水来制备纯净干燥的Cl2
C.过量浓盐酸与一定量二氧化锰反应,MnO2能完全反应
D.除去氯气中的HCl气体,装置如图
答案 C
解析 HCl极易溶于水,食盐水吸收HCl同时抑制氯气的溶解,还需浓硫酸干燥氯气,故A错误;浓盐酸易挥发,应先通过饱和食盐水除去HCl,后经过浓硫酸干燥,故B错误;浓盐酸与二氧化锰反应,浓盐酸需过量,能使MnO2完全反应,故C正确;Cl2和HCl二者均与碳酸氢钠溶液反应,且生成新杂质CO2气体,故D错误。
8.用下列两种方法制取氯气:
①用含氯化氢146 g的浓盐酸与足量的二氧化锰反应;②用87 g二氧化锰与足量的浓盐酸反应。则所得氯气( )
A.②比①多 B.①比②多
C.一样多 D.无法比较
答案 A
解析 浓盐酸与MnO2反应的化学方程式为4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O,随着反应进行,盐酸浓度逐渐减小,变为稀盐酸后不再与MnO2反应。①中HCl不能完全反应,产生的Cl2少,②中MnO2能完全反应,制得Cl2多。故产生Cl2②>①。
9.下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )
A.a—b—c—d—e—f—g—h
B.a—e—d—c—b—h—i—g
C.a—d—e—c—b—h—i—g
D.a—c—b—d—e—h—i—f
答案 B
解析 按制气→除HCl→除H2O→制备FeCl3→吸收Cl2顺序连接。
10.实验室利用如图所示装置制备氯气,图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是( )
A.①②③ B.①②④
C.②③④ D.①③④
答案 C
解析 应选饱和食盐水除去氯化氢,不能用氢氧化钠,因为氢氧化钠可以与氯气反应,故②错误;干燥装置应长导管进气,否则浓硫酸会被压入其右侧装置中,故③错误;澄清石灰水浓度较低,无法完全吸收氯气;应用氢氧化钠溶液吸收氯气,故④错误;图中只有①合理。
11.实验室利用如图所示装置制取、收集Cl2并进行相关性质实验,回答下列问题。
(1)A装置中发生反应的化学方程式为_________________________
___________________________________________________________。
(2)B装置中的物质是___________________________________,其作用是
___________________________________________________________
___________________________________________________________,
C中溶液的作用是_____________________________________________。
(3)D中收集满气体后放入湿润的红色布条,观察到________。
(4)E中溶液的作用是______________________________________
___________________________________________________________。
(5)氯气可以用来制备“84”消毒液,反应的离子方程式为___________________________________________________________。
(6)D中验满方法:将湿润的淀粉-KI试纸靠近盛Cl2的试剂瓶口,观察到________,则证明已集满;或将湿润的________靠近盛有Cl2的试剂瓶口,观察到试纸先变红后褪色,则证明已集满。
答案 (1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (2)饱和食盐水 除去氯气中的氯化氢 干燥氯气 (3)红色布条褪色 (4)吸收尾气,防止污染空气 (5)Cl2+2OH-===Cl-+ClO-+H2O (6)试纸变蓝 蓝色石蕊试纸
解析 (1)MnO2与浓盐酸共热生成MnCl2、Cl2和H2O。(2)盐酸易挥发,故氯气中含氯化氢,氯化氢极易溶于水,而氯气难溶于饱和食盐水,故用饱和食盐水洗气后用浓硫酸干燥氯气。(3)干燥的氯气没有漂白性,但氯气与水反应生成盐酸和次氯酸,次氯酸有漂白性,故氯气中放入湿润的红色布条,观察到红色布条褪色。(4)氯气有毒,E中的氢氧化钠溶液吸收尾气防止污染空气。(5)“84”消毒液的主要成分为氯化钠、次氯酸钠,有效成分为次氯酸钠。(6)D中验满方法:将湿润的淀粉-KI试纸靠近盛Cl2的试剂瓶口,氯气置换出碘后与淀粉发生反应变蓝色,故观察到试纸变蓝,则证明已集满;或将湿润的蓝色石蕊试纸靠近盛有Cl2的试剂瓶口,观察到试纸变红后褪色,则证明已集满。
12.下面是两位同学设计的证明碳酸钠样品中含有氯化钠的实验方案。
甲:取样品少许加入试管中,加入适量的蒸馏水使之溶解,配成溶液,然后加入AgNO3溶液,看是否有白色沉淀生成。
乙:取样品少许加入试管中,加入适量的自来水使之溶解,配成溶液,然后滴加稀硝酸酸化的AgNO3溶液,看是否有白色沉淀生成。
(1)两个方案均有不合理之处,请指出:
甲___________________________________________________________
___________________________________________________________。
乙___________________________________________________________
___________________________________________________________。
(2)合理的实验方案为__________________________________________
___________________________________________________________
___________________________________________________________。
答案 (1)AgNO3溶液没有用稀硝酸酸化,不能排除CO的干扰 用自来水配制溶液会引入Cl-,影响Cl-的检验
(2)取少许样品加入试管中,加入适量的蒸馏水配成溶液,然后加入稀硝酸酸化的AgNO3溶液,看是否有白色沉淀生成
解析 甲方案中没有用稀硝酸排除CO的干扰,Ag2CO3也是白色沉淀。乙方案中用自来水配制溶液,自来水中含有Cl-,影响Cl-的检验。
13.下列氯气制取、净化、收集的装置能达到实验目的的是( )
答案 D
解析 浓盐酸与二氧化锰共热发生氧化还原反应生成氯气,装置中缺酒精灯,无法制得氯气,故A错误;氯气和氯化氢均能与氢氧化钠溶液反应,不能用氢氧化钠溶液除去氯气中混有的氯化氢气体,应选用饱和食盐水,故B错误;氯气能与碱石灰反应,不能用碱石灰干燥氯气,应选用硅胶或五氧化二磷,故C错误;氯气的密度比空气的大,应选用向上排空气法收集氯气,故D正确。
14.NaClO2具有强氧化性,是较好的消毒剂。实验室可以用 NaClO2与浓盐酸反应制取Cl2,制取装置如图所示,下列叙述不正确的是( )
A.可以用长颈漏斗替换仪器a
B.可用排饱和食盐水法收集Cl2
C.通过装置乙除去HCl和H2O
D.反应中NaClO2被还原
答案 A
解析 不能选用长颈漏斗代替或替换仪器a,生成的氯气易从长颈漏斗逸出,故A错误;可用排饱和食盐水法收集Cl2,故B正确;除杂时先通过饱和食盐水除去HCl,后经浓硫酸干燥,图乙能除杂,故C正确;反应中NaClO2得到电子被还原,故D正确。
15.“84”消毒液是生活中常用的消毒剂,可与硫酸溶液反应制取氯气,反应原理为NaClO+NaCl+H2SO4Na2SO4+Cl2↑+H2O;为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置。
(1)从①、②、③装置中选择合适的制氯气装置(A处)________(填序号)。
(2)装置B、C中依次存放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是___________________________________________________________
___________________________________________________________;
说明该装置存在明显的缺陷,请提出合理的改进的方法:___________________________________________________________
___________________________________________________________。
(3)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有________(填“盐酸”或“次氯酸”)。
答案 (1)② (2)产生的氯气中含有水蒸气,会反应生成次氯酸 在装置A、B之间增加盛有浓硫酸的洗气瓶(或干燥装置) (3)盐酸
解析 (1)由NaClO+NaCl+H2SO4Na2SO4+Cl2↑+H2O可知,反应有液体参加,需要在加热条件下进行,故选装置②。(2)装置B中干燥的有色布条褪色,说明氯气中可能混有少量的水蒸气,氯气与水反应生成次氯酸而漂白,因此应在A和B之间增加盛有浓H2SO4的洗气瓶,除去Cl2中的水蒸气。(3)氯气通入水溶液会反应生成盐酸和次氯酸,酸性:盐酸>碳酸>次氯酸,氯气通入饱和NaHCO3溶液能产生无色气体,证明氯气与水反应的生成物中含有盐酸。
