人教版九年级化学下册第九单元《溶解度》课件(40页)
文档属性
| 名称 | 人教版九年级化学下册第九单元《溶解度》课件(40页) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-08 16:20:12 | ||
图片预览





文档简介
(共40张PPT)
课题2 溶解度
我国北方有许多盐碱湖,湖水中溶有大量的食盐(NaCl)和纯碱(Na2CO3),那里的农民冬天捞碱,夏天晒盐,你知道为什么吗?
吸热或放热现象
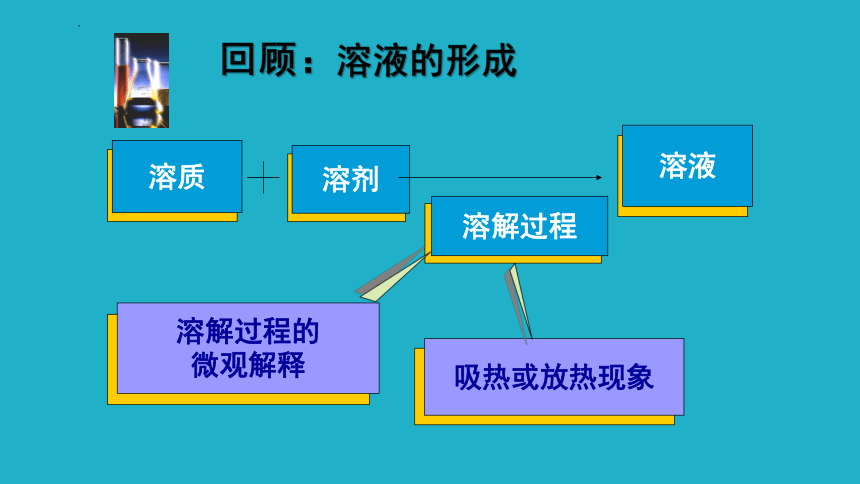
溶质
溶剂
溶液
溶解过程
溶解过程的
微观解释
回顾:溶液的形成
1、不同物质在同一种溶剂中的
溶解性( )。
知道:溶解性的大小与溶质和溶剂的性质有关。
不同
不同
回顾
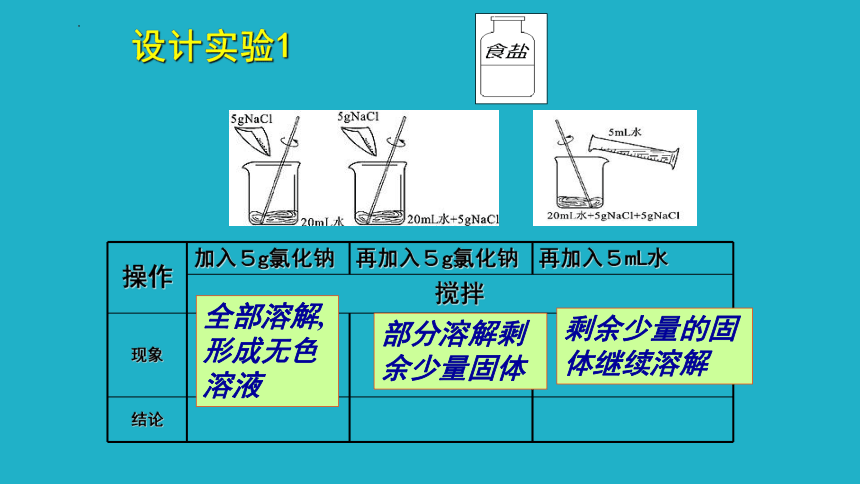
设计实验1
操作 加入5g氯化钠 再加入5g氯化钠 再加入5mL水
搅拌 现象
结论
全部溶解,形成无色溶液
部分溶解剩余少量固体
剩余少量的固体继续溶解
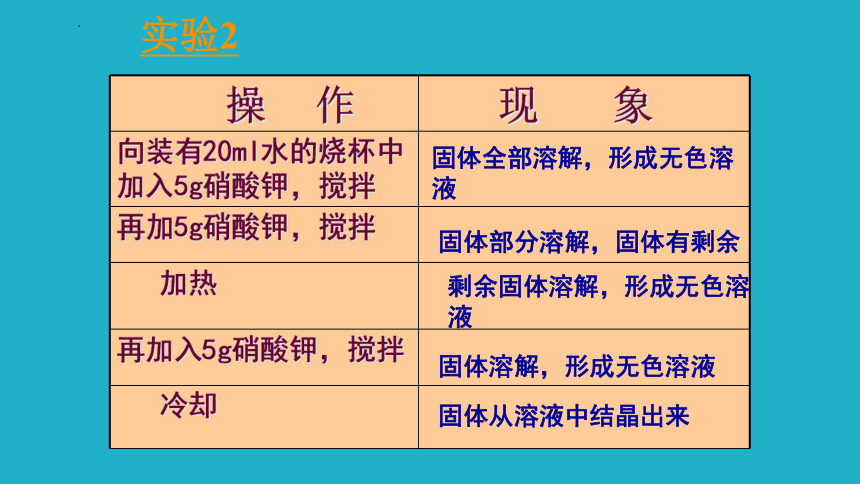
操 作 现 象
向装有20ml水的烧杯中加入5g硝酸钾,搅拌
再加5g硝酸钾,搅拌
加热
再加入5g硝酸钾,搅拌
冷却
实验2
固体全部溶解,形成无色溶液
固体部分溶解,固体有剩余
剩余固体溶解,形成无色溶液
固体溶解,形成无色溶液
固体从溶液中结晶出来
饱和溶液
在一定温度、一定量的溶剂中,溶质不能继续溶解的溶液。
饱和溶液和不饱和溶液的定义
在一定温度、一定量的溶剂中,溶质还能继续溶解的溶液。
不饱和溶液
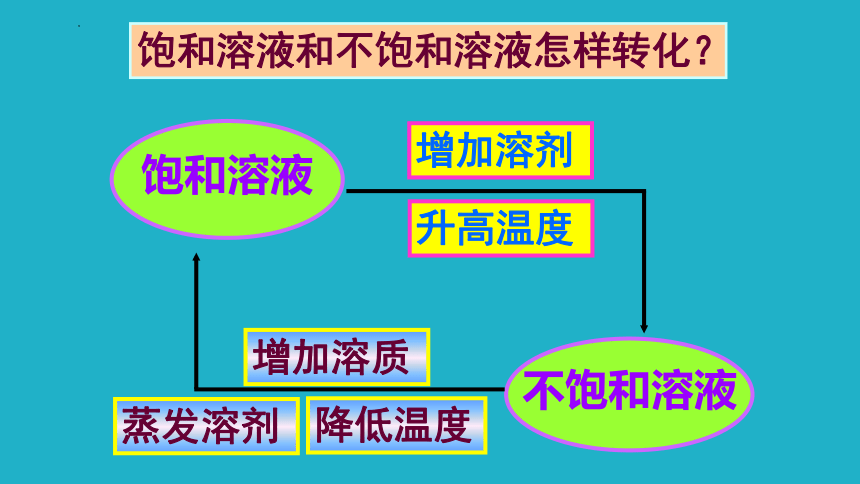
饱和溶液和不饱和溶液怎样转化?
饱和溶液
不饱和溶液
增加溶剂
升高温度
增加溶质
降低温度
蒸发溶剂
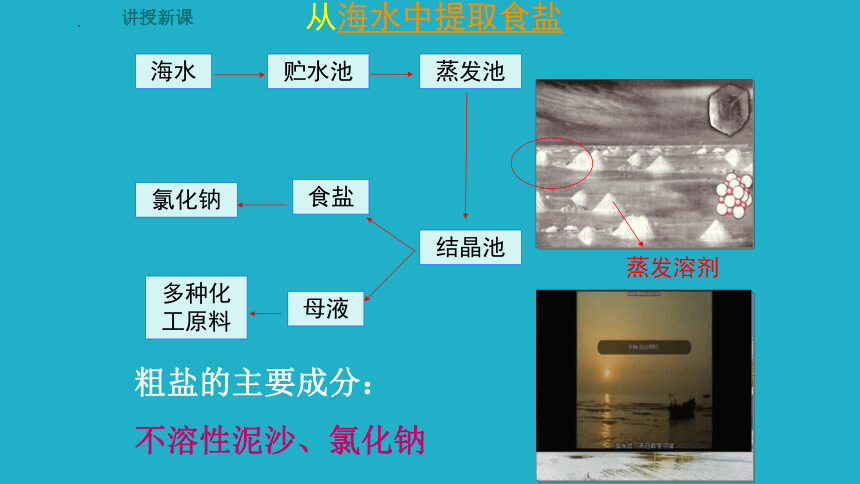
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工原料
从海水中提取食盐
蒸发溶剂
讲授新课
粗盐的主要成分:
不溶性泥沙、氯化钠
若将海水中的盐结晶后平铺于陆地上,地球将增高153米
海水中的盐是如何结晶的?
你知道么
茶卡盐湖,别称茶卡或达布逊淖尔,是位于青海省海西蒙古族藏族自治州乌兰县茶卡镇的天然结晶盐湖,是柴达木盆地四大盐湖之一。"茶卡"是藏语,意即盐池,也就是青海的盐;"达布逊淖尔"是蒙古语,也是盐湖之意
2019年
饱和溶液
不饱和溶液
浓溶液
稀溶液
溶液在一定条件下可分为饱和溶液和不饱和溶液
不给定条件可分为浓溶液和稀溶液。
总结:
这样行吗?
20 ℃
40 ℃
不行
食盐
红糖
应该在同一温度下
探究:如何定量地比较物质的溶解能力?
食盐
红糖
应该用相同量的溶剂
这样行吗?
不行
探究:如何定量地比较物质的溶解能力?
20 ℃
20 ℃
0.5g食盐
100g水
应该达到饱和状态
这样行吗?
0.5g红糖
不行
探究:如何定量地比较物质的溶解能力?
这样行吗?
20 ℃
20 ℃
温度一定
达到饱和状态
100g水
20℃
20℃
食盐
红糖
溶剂质量一定
探究:如何定量地比较物质的溶解能力?
标准:100克溶剂中
状态:饱和状态
单位:克
分
析
条件:在一定温度下
1、阅读36页:固体溶解度
20℃时,硝酸钾的溶解度是31.6g”的含义是什么?
20℃时,把40克硝酸钾放到100克水中,是否所有硝酸钾都溶解?所得溶液的质量是____
20℃时,100g水里最多能溶解31.6克硝酸钾
2、溶解度与溶解性关系(20℃)
溶解度/g 一般称为
<0.01 难溶
0.01~~1 微溶
1~~10 可溶
>10 易溶
注:上表只适用于固体物质
2、溶解度与溶解性的关系
练习: 1、不溶物就是绝对不溶于水的物质。此话是否正确? 2、20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是___溶物质。 3、20℃时氯化钠的溶解度是36g,则氯化钠属于( )
A.易溶 物质 B.可溶物质 C.微溶物质 D.难溶物质
难
A
.
.
.
0.01g
1g
10g
易溶
可溶
微溶
难(不)溶
溶解度(克)
温度t(℃)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
固体溶解度曲线
找一找50℃各物质的溶解度
氢氧化钙(熟石灰)
的溶解度曲线图
溶解度曲线获取的信息:
2.查某物质在不同温度时的溶解度
3.不同物质的溶解度受温度变化影响的大小
大多数固体物质的溶解度随温度的升高而增大
如:KNO3
少数固体物质的溶解度受温度变化影响很小
如:NaCl
极少数固体物质的溶解度随温度的升高而减小
如:Ca(OH)2
4.交点:表示两物质在交点所示温度下的溶解度相同(都为 g)
5.比较不同物质在同一温度时的溶解度
1.曲线上任意一点表示某温度下该物质的溶解度
6.确定结晶方法:
蒸发结晶:溶解度受温度变化影响不大的——NaCl
降温结晶:溶解度受温度变化影响大的——KNO3
7.混合物分离:
(提纯)
KNO3中含少量NaCl ——降温结晶 A
(A) (B)
NaCl中含少量 KNO3 ——蒸发结晶 A
(A) (B)
溶解度曲线的应用
结晶:冷却热饱和
溶液时,硝酸钾晶
体从溶液中析出
有规则的几何外形
硝酸钾晶体
混合物
适量水
加热
KNO3热饱和溶液
降温
结晶
过滤
滤纸上:KNO3固体
滤液中:
大部分NaCl 少量KNO3
硝酸钾固体中含有少量氯化钠,如何提纯硝酸钾?
降温结晶法提纯硝酸钾
(又叫冷却热饱和溶液法)
升
温
结
晶
思考:给熟石灰的饱和溶液升高温度会有什么现象?为什么?
答:变浑浊(或有白色沉淀),因为熟石灰的溶解度随温度升高而减小,升温后会有熟石灰固体析出
氢氧化钙(熟石灰)的溶解度曲线
想一想:
二、用什么方法可以确定汽水中溶解的气体是 二氧化碳?
一、影响气体溶解度的因素:
气体溶解度
1、气体溶解度一般随压强增大而增大,压强
减小而减小。
2、气体溶解度一般随温度升高而减小,温度
降低而增大。
结论一:温度不同,不能比较它们的溶解性大小。
结论二:溶剂的量不同,不能比较它们的溶解性大小。
结论三:溶液没有达到饱和状态,不能比较它们的溶解性大小。
启发:
例1、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。
解:20℃时食盐饱和溶液的溶质质量分数为
=26.5%
36g
100g+36g
答:略
[例题] :200C时,氯化钠溶解度为36克,
(1)若将32克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少?
(2)若将36克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少?
(3)若将38克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少?
从上面例题中你得到什么启示?说明什么问题?
[题型]:要考虑溶解度的溶质质量分数的计算
计算的依据 :
对于某温度下的饱和(或过饱和)溶液
实际溶解的溶质质量
实际形成的溶液质量
100%
溶质质量分数=
对于某温度下的不饱和溶液
溶质质量
溶液质量
100%
溶质质量分数=
(未溶解的固体不能当成溶质来计算)
学完本课题应该知道
溶液
不饱和溶液
饱和溶液
溶解度
结晶
固体溶解度
气体溶解度
2017
想一想:下列说法正确吗?
A.20℃时,20g硝酸钾溶在100g水里,所以20℃时硝酸钾的溶解度是20g
B.20℃时,把20g硝酸钾溶在水里制成饱和溶液,所以20℃时硝酸钾的溶解度是20g
C.把31.6g硝酸钾溶在100g水里,形成饱和溶液,所以20℃时硝酸钾的溶解度是31.6g
D.20℃时,把31.6g硝酸钾溶在100g水里,形成饱和溶液,所以20℃时硝酸钾的溶解度是31.6g
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
固体溶解度曲线
1:同种物质在不同温度下的溶解度不同。
2:曲线的交点表示这两种物质在该温度下的溶解度相同。
3:曲线越陡,该物质的溶解度受温度影响越大。
找一找50度各物质的溶解度
氢氧化钙(熟石灰)的溶解度曲线图
饱和石灰水
不饱和石灰水
降温.加溶剂
升温.减少溶剂.加溶质
探究3:如何定量地比较物质的溶解能力?
2、溶解度与溶解性的关系
溶解性
溶解度/g (20℃)
易溶
可溶
微溶
难(不)溶
练习: 1、不溶物就是绝对不溶于水的物质。此话是否正确? 2、20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是___溶物质。 3、20℃时氯化钠的溶解度是36g,则氯化钠属于( )
A.易溶 物质 B.可溶物质 C.微溶物质 D.难溶物质
难
>10
1-10
0.01-1
<0.01
A
.
.
.
0.01g
1g
10g
易溶
可溶
微溶
难(不)溶
0.10
0.20
70
40
0
10
20
50
60
80
100
30
温度/℃
熟石灰的溶解度曲线:
溶解度/
g
3、升温结晶
给熟石灰的饱和溶液升高温度会有什么现象?为什么?
变浑浊(或有白色沉淀),因为熟石灰的溶解度随温度升高而减小,升温后会有熟石灰固体析出
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
课题2 溶解度
我国北方有许多盐碱湖,湖水中溶有大量的食盐(NaCl)和纯碱(Na2CO3),那里的农民冬天捞碱,夏天晒盐,你知道为什么吗?
吸热或放热现象
溶质
溶剂
溶液
溶解过程
溶解过程的
微观解释
回顾:溶液的形成
1、不同物质在同一种溶剂中的
溶解性( )。
知道:溶解性的大小与溶质和溶剂的性质有关。
不同
不同
回顾
设计实验1
操作 加入5g氯化钠 再加入5g氯化钠 再加入5mL水
搅拌 现象
结论
全部溶解,形成无色溶液
部分溶解剩余少量固体
剩余少量的固体继续溶解
操 作 现 象
向装有20ml水的烧杯中加入5g硝酸钾,搅拌
再加5g硝酸钾,搅拌
加热
再加入5g硝酸钾,搅拌
冷却
实验2
固体全部溶解,形成无色溶液
固体部分溶解,固体有剩余
剩余固体溶解,形成无色溶液
固体溶解,形成无色溶液
固体从溶液中结晶出来
饱和溶液
在一定温度、一定量的溶剂中,溶质不能继续溶解的溶液。
饱和溶液和不饱和溶液的定义
在一定温度、一定量的溶剂中,溶质还能继续溶解的溶液。
不饱和溶液
饱和溶液和不饱和溶液怎样转化?
饱和溶液
不饱和溶液
增加溶剂
升高温度
增加溶质
降低温度
蒸发溶剂
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工原料
从海水中提取食盐
蒸发溶剂
讲授新课
粗盐的主要成分:
不溶性泥沙、氯化钠
若将海水中的盐结晶后平铺于陆地上,地球将增高153米
海水中的盐是如何结晶的?
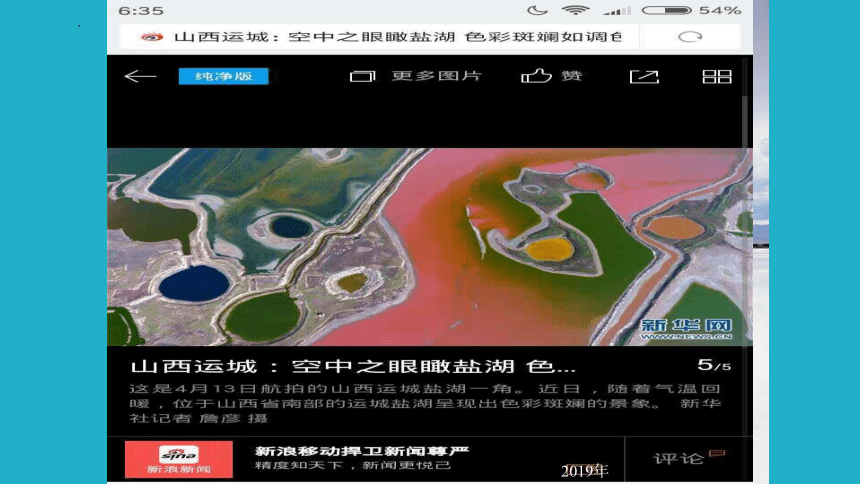
你知道么
茶卡盐湖,别称茶卡或达布逊淖尔,是位于青海省海西蒙古族藏族自治州乌兰县茶卡镇的天然结晶盐湖,是柴达木盆地四大盐湖之一。"茶卡"是藏语,意即盐池,也就是青海的盐;"达布逊淖尔"是蒙古语,也是盐湖之意
2019年
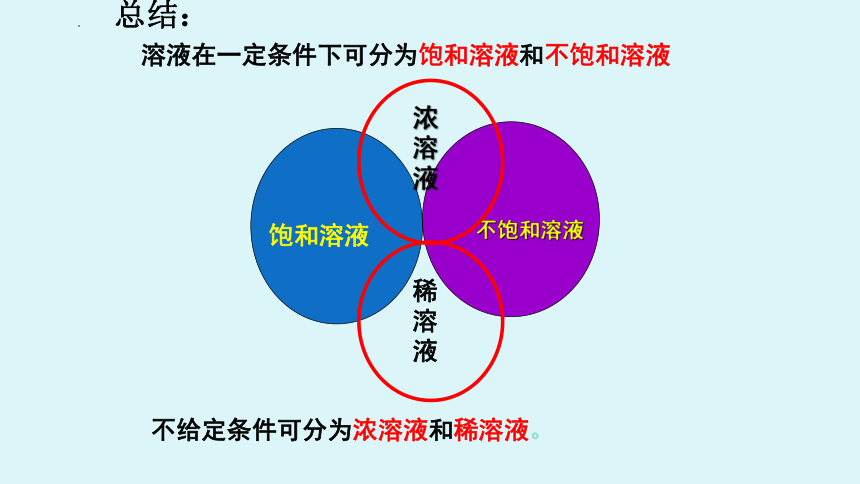
饱和溶液
不饱和溶液
浓溶液
稀溶液
溶液在一定条件下可分为饱和溶液和不饱和溶液
不给定条件可分为浓溶液和稀溶液。
总结:
这样行吗?
20 ℃
40 ℃
不行
食盐
红糖
应该在同一温度下
探究:如何定量地比较物质的溶解能力?
食盐
红糖
应该用相同量的溶剂
这样行吗?
不行
探究:如何定量地比较物质的溶解能力?
20 ℃
20 ℃
0.5g食盐
100g水
应该达到饱和状态
这样行吗?
0.5g红糖
不行
探究:如何定量地比较物质的溶解能力?
这样行吗?
20 ℃
20 ℃
温度一定
达到饱和状态
100g水
20℃
20℃
食盐
红糖
溶剂质量一定
探究:如何定量地比较物质的溶解能力?
标准:100克溶剂中
状态:饱和状态
单位:克
分
析
条件:在一定温度下
1、阅读36页:固体溶解度
20℃时,硝酸钾的溶解度是31.6g”的含义是什么?
20℃时,把40克硝酸钾放到100克水中,是否所有硝酸钾都溶解?所得溶液的质量是____
20℃时,100g水里最多能溶解31.6克硝酸钾
2、溶解度与溶解性关系(20℃)
溶解度/g 一般称为
<0.01 难溶
0.01~~1 微溶
1~~10 可溶
>10 易溶
注:上表只适用于固体物质
2、溶解度与溶解性的关系
练习: 1、不溶物就是绝对不溶于水的物质。此话是否正确? 2、20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是___溶物质。 3、20℃时氯化钠的溶解度是36g,则氯化钠属于( )
A.易溶 物质 B.可溶物质 C.微溶物质 D.难溶物质
难
A
.
.
.
0.01g
1g
10g
易溶
可溶
微溶
难(不)溶
溶解度(克)
温度t(℃)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
固体溶解度曲线
找一找50℃各物质的溶解度
氢氧化钙(熟石灰)
的溶解度曲线图
溶解度曲线获取的信息:
2.查某物质在不同温度时的溶解度
3.不同物质的溶解度受温度变化影响的大小
大多数固体物质的溶解度随温度的升高而增大
如:KNO3
少数固体物质的溶解度受温度变化影响很小
如:NaCl
极少数固体物质的溶解度随温度的升高而减小
如:Ca(OH)2
4.交点:表示两物质在交点所示温度下的溶解度相同(都为 g)
5.比较不同物质在同一温度时的溶解度
1.曲线上任意一点表示某温度下该物质的溶解度
6.确定结晶方法:
蒸发结晶:溶解度受温度变化影响不大的——NaCl
降温结晶:溶解度受温度变化影响大的——KNO3
7.混合物分离:
(提纯)
KNO3中含少量NaCl ——降温结晶 A
(A) (B)
NaCl中含少量 KNO3 ——蒸发结晶 A
(A) (B)
溶解度曲线的应用
结晶:冷却热饱和
溶液时,硝酸钾晶
体从溶液中析出
有规则的几何外形
硝酸钾晶体
混合物
适量水
加热
KNO3热饱和溶液
降温
结晶
过滤
滤纸上:KNO3固体
滤液中:
大部分NaCl 少量KNO3
硝酸钾固体中含有少量氯化钠,如何提纯硝酸钾?
降温结晶法提纯硝酸钾
(又叫冷却热饱和溶液法)
升
温
结
晶
思考:给熟石灰的饱和溶液升高温度会有什么现象?为什么?
答:变浑浊(或有白色沉淀),因为熟石灰的溶解度随温度升高而减小,升温后会有熟石灰固体析出
氢氧化钙(熟石灰)的溶解度曲线
想一想:
二、用什么方法可以确定汽水中溶解的气体是 二氧化碳?
一、影响气体溶解度的因素:
气体溶解度
1、气体溶解度一般随压强增大而增大,压强
减小而减小。
2、气体溶解度一般随温度升高而减小,温度
降低而增大。
结论一:温度不同,不能比较它们的溶解性大小。
结论二:溶剂的量不同,不能比较它们的溶解性大小。
结论三:溶液没有达到饱和状态,不能比较它们的溶解性大小。
启发:
例1、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。
解:20℃时食盐饱和溶液的溶质质量分数为
=26.5%
36g
100g+36g
答:略
[例题] :200C时,氯化钠溶解度为36克,
(1)若将32克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少?
(2)若将36克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少?
(3)若将38克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少?
从上面例题中你得到什么启示?说明什么问题?
[题型]:要考虑溶解度的溶质质量分数的计算
计算的依据 :
对于某温度下的饱和(或过饱和)溶液
实际溶解的溶质质量
实际形成的溶液质量
100%
溶质质量分数=
对于某温度下的不饱和溶液
溶质质量
溶液质量
100%
溶质质量分数=
(未溶解的固体不能当成溶质来计算)
学完本课题应该知道
溶液
不饱和溶液
饱和溶液
溶解度
结晶
固体溶解度
气体溶解度
2017
想一想:下列说法正确吗?
A.20℃时,20g硝酸钾溶在100g水里,所以20℃时硝酸钾的溶解度是20g
B.20℃时,把20g硝酸钾溶在水里制成饱和溶液,所以20℃时硝酸钾的溶解度是20g
C.把31.6g硝酸钾溶在100g水里,形成饱和溶液,所以20℃时硝酸钾的溶解度是31.6g
D.20℃时,把31.6g硝酸钾溶在100g水里,形成饱和溶液,所以20℃时硝酸钾的溶解度是31.6g
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
固体溶解度曲线
1:同种物质在不同温度下的溶解度不同。
2:曲线的交点表示这两种物质在该温度下的溶解度相同。
3:曲线越陡,该物质的溶解度受温度影响越大。
找一找50度各物质的溶解度
氢氧化钙(熟石灰)的溶解度曲线图
饱和石灰水
不饱和石灰水
降温.加溶剂
升温.减少溶剂.加溶质
探究3:如何定量地比较物质的溶解能力?
2、溶解度与溶解性的关系
溶解性
溶解度/g (20℃)
易溶
可溶
微溶
难(不)溶
练习: 1、不溶物就是绝对不溶于水的物质。此话是否正确? 2、20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是___溶物质。 3、20℃时氯化钠的溶解度是36g,则氯化钠属于( )
A.易溶 物质 B.可溶物质 C.微溶物质 D.难溶物质
难
>10
1-10
0.01-1
<0.01
A
.
.
.
0.01g
1g
10g
易溶
可溶
微溶
难(不)溶
0.10
0.20
70
40
0
10
20
50
60
80
100
30
温度/℃
熟石灰的溶解度曲线:
溶解度/
g
3、升温结晶
给熟石灰的饱和溶液升高温度会有什么现象?为什么?
变浑浊(或有白色沉淀),因为熟石灰的溶解度随温度升高而减小,升温后会有熟石灰固体析出
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
