化学人教版(2019)选择性必修2 1.1.2构造原理与电子排布式(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 1.1.2构造原理与电子排布式(共30张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-07 22:26:26 | ||
图片预览







文档简介
(共30张PPT)
1、知道原子核外电子的能级高低顺序,了解原子核外电子排布的构造原理。
2、能根据构造原理,写出1 36号元素的基态原子的电子排布式。
2
1
本节重点
本节难点
构造原理
电子排布式
构造原理
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序被称为构造原理。
电子排布式
按照构造原理,写出基态原子核外电子排布的表示式。
价电子排布式
简化的电子排布式。
基态原子是处于最低能量状态的原子。电子如何填入核外的不同能级以保证原子处于基态呢?有可遵循的填入顺序吗?
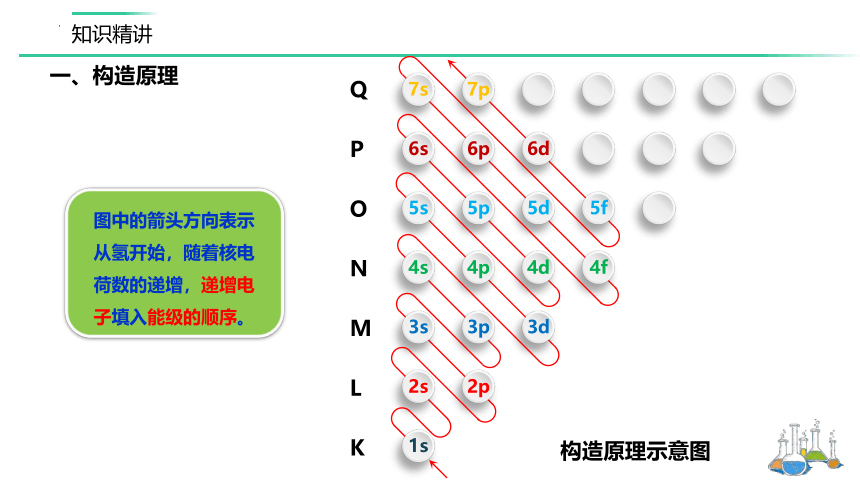
一、构造原理
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
5s
5p
5d
5f
6s
6p
6d
7s
7p
K
L
M
N
O
P
Q
构造原理示意图
图中的箭头方向表示从氢开始,随着核电荷数的递增,递增电子填入能级的顺序。
例1、根据构造原理,试比较下列能级的能量高低(填“>”或“<”)。
①4s____3d; ②6s____4f____5d。
<
< <
例2、构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( )
A、E(5s)>E(4f)>E(4s)>E(3d) B、E(3d)>E(4s)>E(3p)>E(3s)
C、E(4s)E(4s)>E(4f)>E(3d)
B
ns<(n-1)d
n=4、5
ns<(n-2)f
n=6、7
按照构造原理,电子填满一个能级,开始填入下一个能级。将 上所容纳的电子数标在该能级符号 ,按能层由低到高书写电子排布式。
能级
右上角
例如:碳原子的电子排布式
6
C
碳
1s22s22p2
14.01
1s2 2s2 2p2
二、电子排布式
能层
能级
能级上容纳的电子数
二、电子排布式
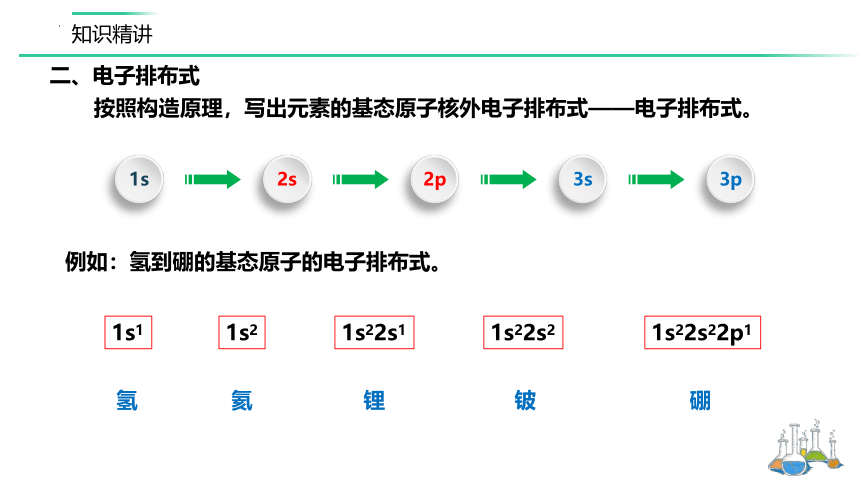
按照构造原理,写出元素的基态原子核外电子排布式——电子排布式。
1s
2s
2p
3s
3p
例如:氢到硼的基态原子的电子排布式。
1s1
氢
1s22s22p1
1s22s2
1s22s1
1s2
硼
铍
锂
氦
二、电子排布式
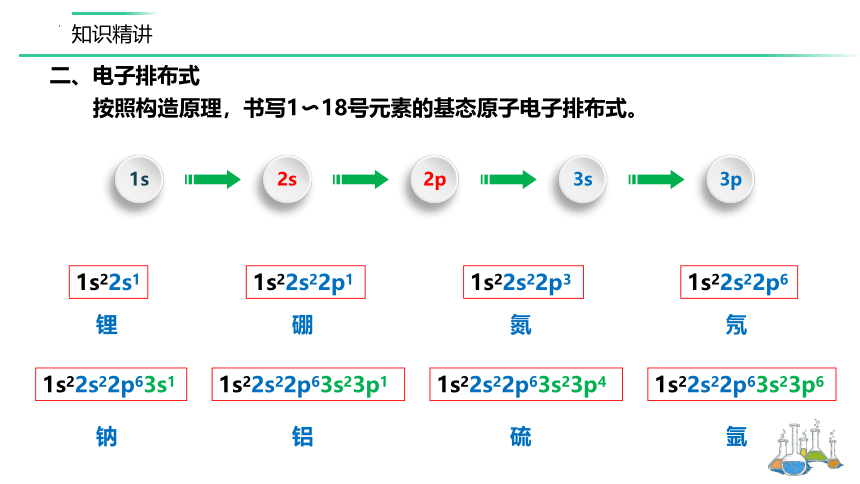
按照构造原理,书写1 18号元素的基态原子电子排布式。
1s22s22p63s1
钠
硫
铝
氩
1s22s22p63s23p6
1s22s22p63s23p1
1s22s22p63s23p4
1s22s1
1s22s22p6
1s22s22p1
1s22s22p3
锂
氮
硼
氖
1s
2s
2p
3s
3p
例3、某基态原子的电子排布式为1s22s22p63s23p63d54s2,下列说法不正确的是( )
A、该元素原子中共有25个电子
B、该元素原子核外有4个能层
C、该元素原子最外层共有2个电子
D、该元素原子M能层共有8个电子
D
二、电子排布式
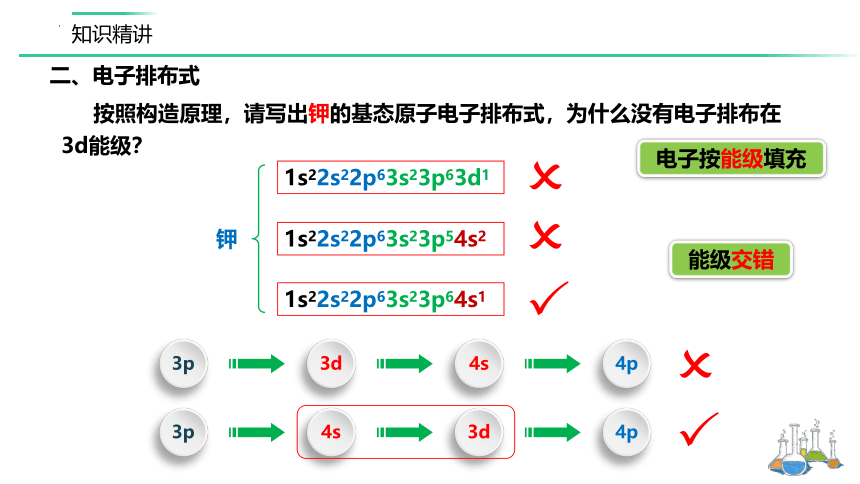
按照构造原理,请写出钾的基态原子电子排布式,为什么没有电子排布在3d能级?
钾
1s22s22p63s23p63d1
1s22s22p63s23p64s1
1s22s22p63s23p54s2
3p
3d
4s
4p
3p
4s
3d
4p
能级交错
电子按能级填充
二、电子排布式
按照构造原理,请写出钙和钪的基态原子电子排布式。
钙
1s22s22p63s23p64s2
钪
1s22s22p63s23p64s23d1
1s22s22p63s23p63d14s2
电子排布式
按能层顺序书写
构造原理告诉我们,随着核电荷数的递增,电子是按能级填充,电子排布式按能层顺序书写。构造原理呈现的能级交错是基于光谱学事实。构造原理是一个思维模型,是个假想过程。
例4、某元素原子3d轨道上有5个电子,则该原子最外层电子的排布可能是( )
A、4s1 B、4s24p1 C、4s24p3 D、3s23p63d5
A
思考与讨论
1、按照构造原理写出稀有气体氦、氖、氩、氪、氙、氡和气的基态原子的最外层电子排布;除氦外它们的通式是什么?
奥
氦:
氖:
氩:
氪:
氙:
氡:
气:
奥
2s22p6
1s2
3s23p6
4s24p6
5s25p6
6s26p6
7s27p6
ns2np6
思考与讨论
2、随着核电荷数的增加,基态原子的电子排布式越来越长,太不方便了。我们该怎么办呢?
表示内层电子已经达到稀有气体结构的部分,可称为原子实。
1s22s22p63s1
钠
简化
[Ne]3s1
1s22s22p63s23p64s1
钾
简化
[Ar]4s1
1s22s22p63s23p63d14s2
钪
简化
[Ar]3d14s2
思考与讨论
3、请仿照钠原子的简化电子排布式,写出第8号元素氧、第14号元素硅和第30号元素锌的简化电子排布式?
1s22s22p4
氧
简化
[He]2s22p4
1s22s22p63s23p2
硅
简化
[Ne]3s23p2
1s22s22p63s23p63d104s2
锌
简化
[Ar]3d104s2
思考与讨论
4、钠和镁的基态原子的电子排布式分别为[Ne]3s1和[Ne]3s2,请找出与它们的化合价相关的电子。
钠:[Ne]3s1
镁:[Ne]3s2
与化合价有关
我们把在化学反应中可能发生电子变动的能级称为价电子层,简称价层。
钪:[Ar]3d14s2
价层电子排布式:3d14s2
5、请同学们写出25Mn、26Fe、32Ge、35Br的简化电子排布式和价层电子排布式。主族元素和过渡元素的价电子层有什么特征?
思考与讨论
铁
[Ar]3d64s2
3d64s2
锰
[Ar]3d54s2
3d54s2
锗
[Ar]3d104s24p2
4s24p2
溴
[Ar]3d104s24p5
4s24p5
例5、电子排布式也可以用于表示离子的核外电子排布,试写出Na+、Cl-和Fe2+的电子排布式。
Na+:1s22s22p6
Cl- :1s22s22p63s23p6
Na:1s22s22p63s1
Cl:1s22s22p63s23p5
Fe:1s22s22p63s23p63d64s2
Fe2+:1s22s22p63s23p63d6
Fe2+:[Ar]3d6
Fe3+
?
6、通常在元素周期表中,只给出价层电子排布式。请大家找出24Cr和29Cu的价层电子排布式。这样的电子排布式符合构造原理吗?
思考与讨论
1s22s22p63s23p63d54s1
铬
3d54s1
1s22s22p63s23p63d104s1
铜
3d104s1
这样的电子排布源于光谱学事实,是从实验事实得到的,不符合构造原理。这也说明构造原理是被理想化的。理想化是许多科学原理的共同点,理想化常常是建立模型所必需的。
例6、以下电子排布式是基态原子的电子排布的是( )
①1s12s1 ②1s22s12p1 ③1s22s22p63s2 ④1s22s22p63s23p1
A、①② B、①③ C、②③ D、③④
D
量子&量子化
一个物理量如果存在最小的不可分割的基本单位,则这个物理量是量子化的,并把最小单位称为量子。在物理学中常用到量子的概念,指一个不可分割的基本个体。例如:“光的量子”(光子)是一定频率的光的基本能量单位。而延伸出的量子力学、量子光学等成为不同的专业研究领域。其基本概念为所有的有形性质是“可量子化的”。“量子化”指其物理量的数值是离散的,而不是连续地任意取值。例如:在原子中,电子的能量是可量子化的,这决定了原子的稳定性和发射光谱等一般问题。
马克斯·卡尔·恩斯特·路德维希·普朗克
原子结构
能级交错
构造原理
含义
简化电子排布式
电子排布式
核外电子在能级中的排布规律
价层电子排布式
练习1、表示一个原子在M能层上有10个电子,可以写成( )
A、3p6 B、3d10
C、3s23p63d24s2 D、3s23p64s2
C
练习2、下列说法中正确的是( )
A、1s22s12p1表示的是激发态原子的核外电子排布
B、3p2表示3p能级有两个原子轨道
C、同一原子中,1s、2s、3s电子的能量逐渐减小
D、同一原子中,2p、3p、4p能级中的轨道数依次增多
A
练习3、下列电子排布式中,表示的是激发态原子的是( )
A、1s22s22p6
B、1s22s22p63s23p63d104s2
C、1s22s22p33s1
D、1s22s22p63s23p63d54s1
C
练习4、写出下列原子的电子排布式:
(1)11Na:________________________________
(2)16S: ________________________________
(3)34Se: ________________________________
(4)20Ca: ________________________________
(5)26Fe: ________________________________
(6)30Zn: ________________________________
1s22s22p63s1
1s22s22p63s23p4
1s22s22p63s23p63d104s24p4
1s22s22p63s23p64s2
1s22s22p63s23p63d64s2
1s22s22p63s23p63d104s2
练习5、A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为 ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)A为_________ (写出元素符号,下同);
(2)B为_________,简化电子排布式是_________________;
(3)C为_________,核外电子排布式是___________________;
(4)D为_________,价层电子排布式是_________________;
(5)E原子结构示意图是__________________。
Si
Na
[Ne]3s1
P
1s22s22p63s23p3
N
2s22p3
例1、根据构造原理试写出下列基态原子的电子排布式和简化电子排布式
①24Cr:______________________________,______________________。
②29Cu:______________________________,______________________。
③33As:______________________________,______________________。
④35Br:______________________________,_______________________。
1s22s22p63s23p63d54s1 [Ar]3d54s1
1s22s22p63s23p63d104s1 [Ar]3d104s1
1s22s22p63s23p63d104s24p3 [Ar]3d104s24p3
1s22s22p63s23p63d104s24p5 [Ar]3d104s24p5
例2、根据构造原理,写出下列基态原子的核外电子排布式
① 8O:________________;
②14Si:_____________________;
③19K:________________________;
④21Sc:_________________________;
⑤26Fe:__________________________。
1s22s22p4
1s22s22p63s23p2
1s22s22p63s23p64s1
1s22s22p63s23p63d14s2
1s22s22p63s23p63d64s2
1、知道原子核外电子的能级高低顺序,了解原子核外电子排布的构造原理。
2、能根据构造原理,写出1 36号元素的基态原子的电子排布式。
2
1
本节重点
本节难点
构造原理
电子排布式
构造原理
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序被称为构造原理。
电子排布式
按照构造原理,写出基态原子核外电子排布的表示式。
价电子排布式
简化的电子排布式。
基态原子是处于最低能量状态的原子。电子如何填入核外的不同能级以保证原子处于基态呢?有可遵循的填入顺序吗?
一、构造原理
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
5s
5p
5d
5f
6s
6p
6d
7s
7p
K
L
M
N
O
P
Q
构造原理示意图
图中的箭头方向表示从氢开始,随着核电荷数的递增,递增电子填入能级的顺序。
例1、根据构造原理,试比较下列能级的能量高低(填“>”或“<”)。
①4s____3d; ②6s____4f____5d。
<
< <
例2、构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( )
A、E(5s)>E(4f)>E(4s)>E(3d) B、E(3d)>E(4s)>E(3p)>E(3s)
C、E(4s)
B
ns<(n-1)d
n=4、5
ns<(n-2)f
n=6、7
按照构造原理,电子填满一个能级,开始填入下一个能级。将 上所容纳的电子数标在该能级符号 ,按能层由低到高书写电子排布式。
能级
右上角
例如:碳原子的电子排布式
6
C
碳
1s22s22p2
14.01
1s2 2s2 2p2
二、电子排布式
能层
能级
能级上容纳的电子数
二、电子排布式
按照构造原理,写出元素的基态原子核外电子排布式——电子排布式。
1s
2s
2p
3s
3p
例如:氢到硼的基态原子的电子排布式。
1s1
氢
1s22s22p1
1s22s2
1s22s1
1s2
硼
铍
锂
氦
二、电子排布式
按照构造原理,书写1 18号元素的基态原子电子排布式。
1s22s22p63s1
钠
硫
铝
氩
1s22s22p63s23p6
1s22s22p63s23p1
1s22s22p63s23p4
1s22s1
1s22s22p6
1s22s22p1
1s22s22p3
锂
氮
硼
氖
1s
2s
2p
3s
3p
例3、某基态原子的电子排布式为1s22s22p63s23p63d54s2,下列说法不正确的是( )
A、该元素原子中共有25个电子
B、该元素原子核外有4个能层
C、该元素原子最外层共有2个电子
D、该元素原子M能层共有8个电子
D
二、电子排布式
按照构造原理,请写出钾的基态原子电子排布式,为什么没有电子排布在3d能级?
钾
1s22s22p63s23p63d1
1s22s22p63s23p64s1
1s22s22p63s23p54s2
3p
3d
4s
4p
3p
4s
3d
4p
能级交错
电子按能级填充
二、电子排布式
按照构造原理,请写出钙和钪的基态原子电子排布式。
钙
1s22s22p63s23p64s2
钪
1s22s22p63s23p64s23d1
1s22s22p63s23p63d14s2
电子排布式
按能层顺序书写
构造原理告诉我们,随着核电荷数的递增,电子是按能级填充,电子排布式按能层顺序书写。构造原理呈现的能级交错是基于光谱学事实。构造原理是一个思维模型,是个假想过程。
例4、某元素原子3d轨道上有5个电子,则该原子最外层电子的排布可能是( )
A、4s1 B、4s24p1 C、4s24p3 D、3s23p63d5
A
思考与讨论
1、按照构造原理写出稀有气体氦、氖、氩、氪、氙、氡和气的基态原子的最外层电子排布;除氦外它们的通式是什么?
奥
氦:
氖:
氩:
氪:
氙:
氡:
气:
奥
2s22p6
1s2
3s23p6
4s24p6
5s25p6
6s26p6
7s27p6
ns2np6
思考与讨论
2、随着核电荷数的增加,基态原子的电子排布式越来越长,太不方便了。我们该怎么办呢?
表示内层电子已经达到稀有气体结构的部分,可称为原子实。
1s22s22p63s1
钠
简化
[Ne]3s1
1s22s22p63s23p64s1
钾
简化
[Ar]4s1
1s22s22p63s23p63d14s2
钪
简化
[Ar]3d14s2
思考与讨论
3、请仿照钠原子的简化电子排布式,写出第8号元素氧、第14号元素硅和第30号元素锌的简化电子排布式?
1s22s22p4
氧
简化
[He]2s22p4
1s22s22p63s23p2
硅
简化
[Ne]3s23p2
1s22s22p63s23p63d104s2
锌
简化
[Ar]3d104s2
思考与讨论
4、钠和镁的基态原子的电子排布式分别为[Ne]3s1和[Ne]3s2,请找出与它们的化合价相关的电子。
钠:[Ne]3s1
镁:[Ne]3s2
与化合价有关
我们把在化学反应中可能发生电子变动的能级称为价电子层,简称价层。
钪:[Ar]3d14s2
价层电子排布式:3d14s2
5、请同学们写出25Mn、26Fe、32Ge、35Br的简化电子排布式和价层电子排布式。主族元素和过渡元素的价电子层有什么特征?
思考与讨论
铁
[Ar]3d64s2
3d64s2
锰
[Ar]3d54s2
3d54s2
锗
[Ar]3d104s24p2
4s24p2
溴
[Ar]3d104s24p5
4s24p5
例5、电子排布式也可以用于表示离子的核外电子排布,试写出Na+、Cl-和Fe2+的电子排布式。
Na+:1s22s22p6
Cl- :1s22s22p63s23p6
Na:1s22s22p63s1
Cl:1s22s22p63s23p5
Fe:1s22s22p63s23p63d64s2
Fe2+:1s22s22p63s23p63d6
Fe2+:[Ar]3d6
Fe3+
?
6、通常在元素周期表中,只给出价层电子排布式。请大家找出24Cr和29Cu的价层电子排布式。这样的电子排布式符合构造原理吗?
思考与讨论
1s22s22p63s23p63d54s1
铬
3d54s1
1s22s22p63s23p63d104s1
铜
3d104s1
这样的电子排布源于光谱学事实,是从实验事实得到的,不符合构造原理。这也说明构造原理是被理想化的。理想化是许多科学原理的共同点,理想化常常是建立模型所必需的。
例6、以下电子排布式是基态原子的电子排布的是( )
①1s12s1 ②1s22s12p1 ③1s22s22p63s2 ④1s22s22p63s23p1
A、①② B、①③ C、②③ D、③④
D
量子&量子化
一个物理量如果存在最小的不可分割的基本单位,则这个物理量是量子化的,并把最小单位称为量子。在物理学中常用到量子的概念,指一个不可分割的基本个体。例如:“光的量子”(光子)是一定频率的光的基本能量单位。而延伸出的量子力学、量子光学等成为不同的专业研究领域。其基本概念为所有的有形性质是“可量子化的”。“量子化”指其物理量的数值是离散的,而不是连续地任意取值。例如:在原子中,电子的能量是可量子化的,这决定了原子的稳定性和发射光谱等一般问题。
马克斯·卡尔·恩斯特·路德维希·普朗克
原子结构
能级交错
构造原理
含义
简化电子排布式
电子排布式
核外电子在能级中的排布规律
价层电子排布式
练习1、表示一个原子在M能层上有10个电子,可以写成( )
A、3p6 B、3d10
C、3s23p63d24s2 D、3s23p64s2
C
练习2、下列说法中正确的是( )
A、1s22s12p1表示的是激发态原子的核外电子排布
B、3p2表示3p能级有两个原子轨道
C、同一原子中,1s、2s、3s电子的能量逐渐减小
D、同一原子中,2p、3p、4p能级中的轨道数依次增多
A
练习3、下列电子排布式中,表示的是激发态原子的是( )
A、1s22s22p6
B、1s22s22p63s23p63d104s2
C、1s22s22p33s1
D、1s22s22p63s23p63d54s1
C
练习4、写出下列原子的电子排布式:
(1)11Na:________________________________
(2)16S: ________________________________
(3)34Se: ________________________________
(4)20Ca: ________________________________
(5)26Fe: ________________________________
(6)30Zn: ________________________________
1s22s22p63s1
1s22s22p63s23p4
1s22s22p63s23p63d104s24p4
1s22s22p63s23p64s2
1s22s22p63s23p63d64s2
1s22s22p63s23p63d104s2
练习5、A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为 ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)A为_________ (写出元素符号,下同);
(2)B为_________,简化电子排布式是_________________;
(3)C为_________,核外电子排布式是___________________;
(4)D为_________,价层电子排布式是_________________;
(5)E原子结构示意图是__________________。
Si
Na
[Ne]3s1
P
1s22s22p63s23p3
N
2s22p3
例1、根据构造原理试写出下列基态原子的电子排布式和简化电子排布式
①24Cr:______________________________,______________________。
②29Cu:______________________________,______________________。
③33As:______________________________,______________________。
④35Br:______________________________,_______________________。
1s22s22p63s23p63d54s1 [Ar]3d54s1
1s22s22p63s23p63d104s1 [Ar]3d104s1
1s22s22p63s23p63d104s24p3 [Ar]3d104s24p3
1s22s22p63s23p63d104s24p5 [Ar]3d104s24p5
例2、根据构造原理,写出下列基态原子的核外电子排布式
① 8O:________________;
②14Si:_____________________;
③19K:________________________;
④21Sc:_________________________;
⑤26Fe:__________________________。
1s22s22p4
1s22s22p63s23p2
1s22s22p63s23p64s1
1s22s22p63s23p63d14s2
1s22s22p63s23p63d64s2
