课题3 溶质的浓度(课件53页)
图片预览








文档简介
(共53张PPT)
第九单元 溶液
课题3 溶质的浓度
学习目标
1.掌握一种溶液组成的表示方法─
─溶质的质量分数
2.能进行溶质质量分数的简单计算
3.初步学会配制一定溶质质量分数的溶液
仪器:试管 滴管
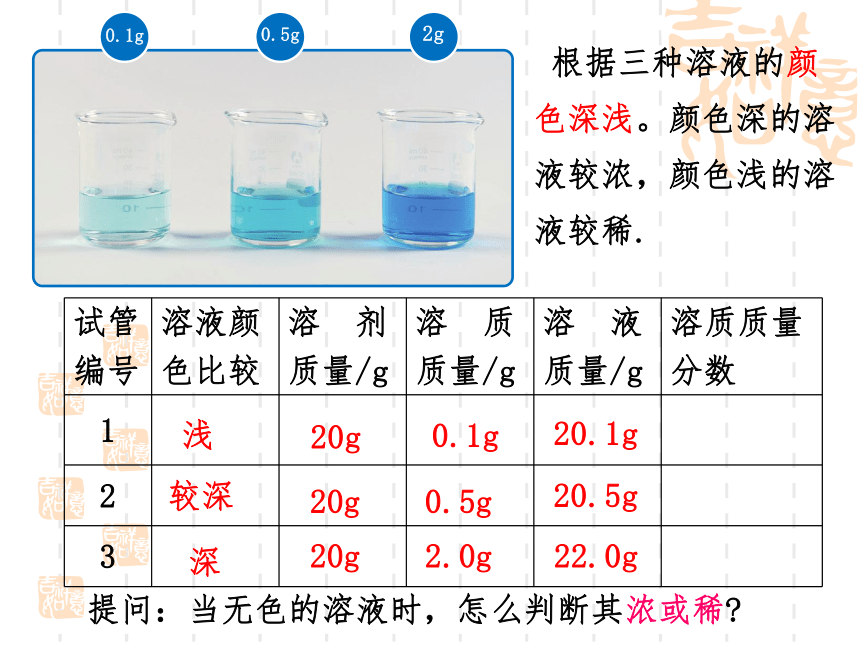
在三支试管中各加入20mL水,然后分别加入约0.1g、0.5g、2g固体硫酸铜。比较三种溶液的颜色。
实验9-7
0.1g
0.5g
2.0g
试管 编号 溶液颜 色比较 溶 剂 质量/g 溶 质 质量/g 溶 液 质量/g 溶质质量
分数
1
2
3
浅
较深
深
20g
20g
20g
0.1g
0.5g
2.0g
20.1g
20.5g
22.0g
提问:当无色的溶液时,怎么判断其浓或稀
0.1g
0.5g
2g
根据三种溶液的颜色深浅。颜色深的溶液较浓,颜色浅的溶液较稀.
表示溶液浓度的方法很多,这里主要介绍 溶质的质量分数。
在实际应用中,常常要准确知道一定量的溶液里所含溶质的量,即溶液的浓度。
0.9%的生理盐水
75%的消毒酒精
3%的双氧水
1.概念:
W(溶质)= ×100%
m(溶质)
m(溶液)
=
m(溶质)
m(溶质)+m(溶剂)
×100%
3.推导式:
m(溶质)= m(溶液)×w
2.公式:
溶质质量与溶液质量之比。
一、溶质质量分数
(溶液的浓度,用w表示)
(以百分数表示)
例如:溶质质量分数为10%的NaCl溶液,是指每100份质量的溶液中含溶质质量为10份。
4.意义:溶质的质量分数越大,表示一定温度下,一定量的溶剂中所溶解的溶质越 ,浓度越 。
多
大
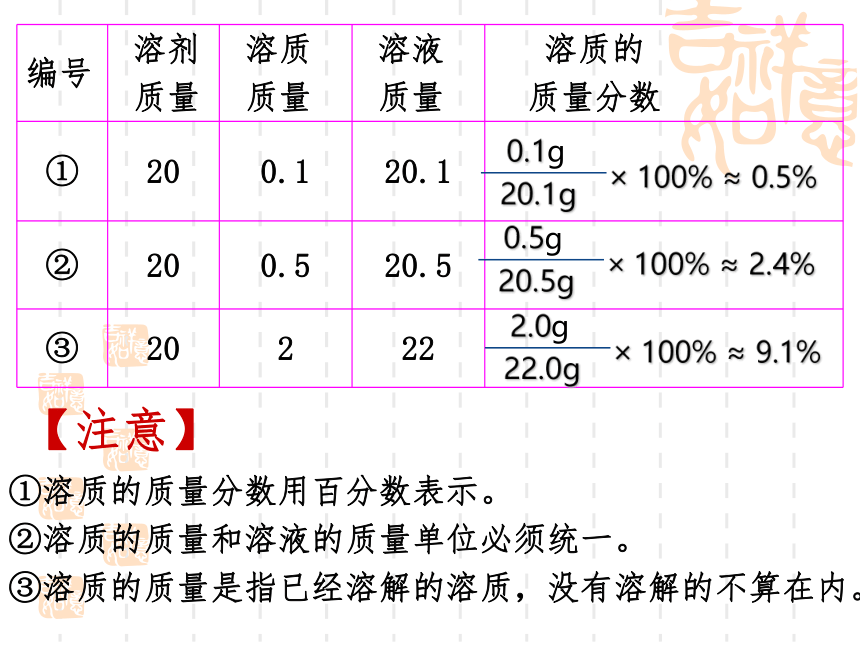
编号 溶剂 质量 溶质 质量 溶液 质量 溶质的
质量分数
① 20 0.1 20.1
② 20 0.5 20.5
③ 20 2 22
①溶质的质量分数用百分数表示。
②溶质的质量和溶液的质量单位必须统一。
③溶质的质量是指已经溶解的溶质,没有溶解的不算在内。
【注意】
0.1g
20.1g
×
100% ≈ 0.5%
0.5g
20.5g
×
100% ≈ 2.4%
2.0g
22.0g
×
100% ≈ 9.1%
溶质质量/g 溶剂质量/g 溶液质量/g 溶质质量分数
10 200
96 100
150 16%
20 80
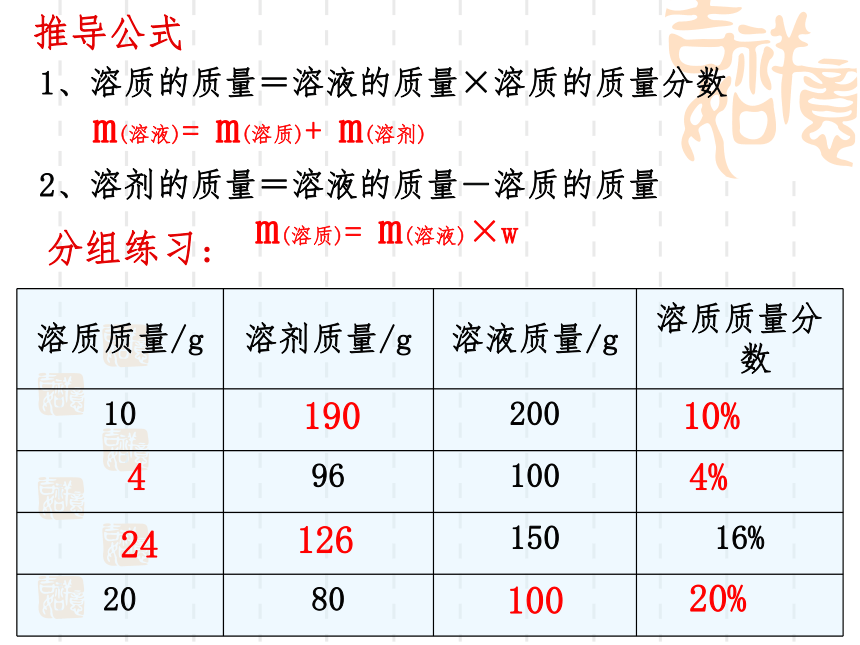
推导公式
1、溶质的质量=溶液的质量×溶质的质量分数
2、溶剂的质量=溶液的质量-溶质的质量
分组练习:
10%
4
4%
24
126
100
20%
190
m(溶质)= m(溶液)×w
m(溶液)= m(溶质)+ m(溶剂)
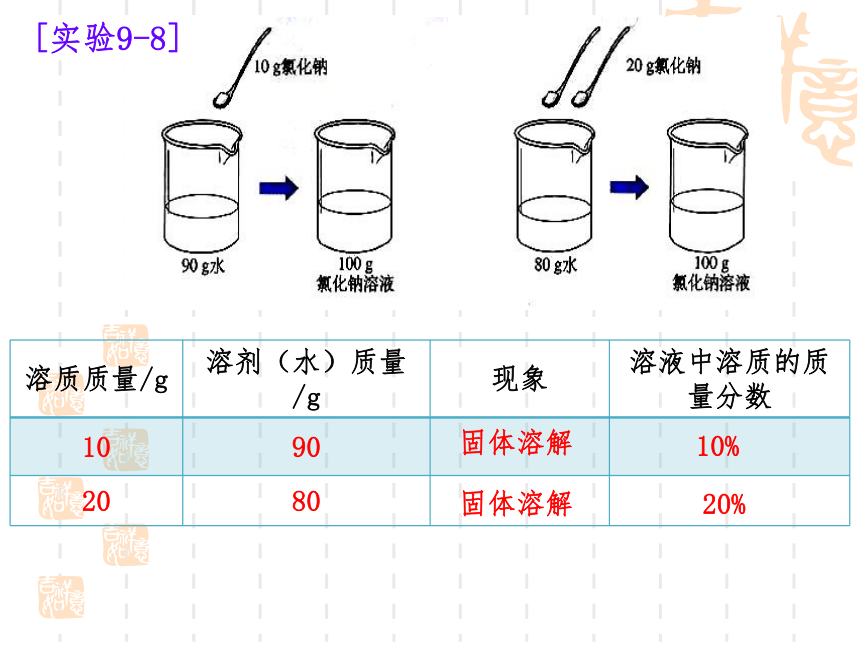
[实验9-8]
溶质质量/g 溶剂(水)质量/g 现象 溶液中溶质的质量分数
10 90
20 80
固体溶解
固体溶解
10%
20%
思考交流
200C时,36gNaCl溶解到100g水中恰好形成NaCl的饱和溶液,氯化钠饱和溶液中溶质的质量分数是多少
36g
136g
×
100% ≈ 26.5%
200C,用NaCl、水能配出36%的NaCl溶液吗?
26.5%<36%
问 题
溶质质量分数=
溶质的质量
溶液的质量
×100%
在一定温度下的饱和溶液是最浓的溶液。
区别 溶解度 溶质的质量分数
概念 一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量 任意溶液中,溶质质量与溶液质量之比
表示意义 某物质溶解能力的大小 任一溶液的浓度大小
条件 一定温度 不定温度
状态 饱和状态 可饱和,可不饱和
单位 g 无单位
饱和溶液中:
溶质质量分数
=
S
100+S
×100%
5.溶质质量分数与溶解度的比较
例.20℃时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数。
解析:先利用溶解度判断溶液是否饱和,未溶解不计入
【推导】
t℃时,某饱和溶液中溶质的质量分数可利用S来求:
(与饱和溶液的质量没有关系)
即m溶质=18g,m溶液=68g
同温度、同溶剂、同为饱和溶液,则溶质的质量分数也相同。
练习、(课本P45)在20℃时,将40g硝酸钾固体加入100g水中,充分搅拌后,仍有8.4g硝酸钾固体未溶解。请填写下列空白:
①、所得溶液是20℃时硝酸钾的 溶液;(填“饱和”或“不饱”)
②、20℃时硝酸钾的溶解度为 ;
③、所得溶液中硝酸钾的质量分数为 。
24%
31.6g
饱和
(未溶解的固体不能当成溶质来计算)
题型1.一定温度时,比较物质溶解度的大小
1.t4℃时,A、B、C的溶解度由大到小为:_________。
2.P点的意义:_______________________________。
技巧一:比较溶解度时,必须指明__________。
A>B>C
t3℃时,A、B两种物质的溶解度相同
一定温度
t4℃时,分别用100g水配制
A、B、C的饱和溶液,
需溶质质量大小为:_______;
t4℃时,分别用等质量的A、B、C
配制成饱和溶液,需溶剂质量大小为________;
t4℃时,等质量的A、B、C的饱和溶液,所含溶剂的质量大小为:_______。
技巧二:1.t℃时,等质量的两种溶质恰好完全溶解,溶解度___的用水多。形成的溶液的质量越_____。
2.t℃时,等质量的两种饱和溶液,溶解度___的含水多。
A>B>C
C>B>A
C>B>A
小
大
小
题型2.溶质和溶剂质量的比较
1.t4℃时,将15gA物质加入到50g水中,
充分溶解,得到A的_________(饱和
/不饱和)溶液_____g。溶液的溶质
的质量分数为________。(只列算式)
2.t4℃时,将25gA物质加入到50g水中,充分溶解,得到A的______(饱和/不饱和)溶液_____g。溶液的溶质的质量分数为________。(只列算式)
技巧三:计算溶液质量或浓度时,应先利用_______判断溶质是否完全溶解,未溶解或析出的不算作溶质质量,不能计入溶液总质量。
不饱和
65
15/65
饱和
70
20/70
溶解度
题型3.饱和溶液和不饱和溶液的判断
1.t4℃时,A、B、C三种物质的
饱和溶液的浓度大→小为:__________。
2.t3℃时,A、B、C三种物质的
饱和溶液的浓度大→小为:__________。
技巧四:相同温度时的饱和溶液,溶解度越___,浓度越大。
A>B>C
A=B>C
大
题型4.t℃,利用溶解度比较
饱和溶液浓度大小
讨论交流
a
b
c
t1
t2
温度/℃
溶解度/g
①t1时,a、b、c三种物质的饱和溶液,溶质的质量分数由大到小为:
②a、b、c的饱和溶液从t1升温至t2,溶质的质量分数由大到小为:
①t2时,a、b、c三种物质的饱和溶液,溶质的质量分数由大到小为:
②a、b、c的饱和溶液从t2降温至t1,溶质的质量分数由大到小为:
b>a=c
b>a>c
a>b>c
b>a>c
课堂精练
1.对“10%的氯化钠溶液”的含义理解错误的是( )
A. 100g水中溶解了10g氯化钠
B. 将氯化钠与水按质量比1:9配成的溶液
C. 将10g氯化钠溶解在90g水中所得到的溶液
D. 100g氯化钠溶液中溶解有10g氯化钠
A
2.现有一杯60℃的硝酸钾饱和溶液,下列操作会导致硝酸钾的质量分数减小的是( )
A. 升温至80℃
B. 恒温蒸发部分溶剂
C. 加入一定量的硝酸钾
D. 加入一定量的氯化钠
D
3.有一瓶溶质的质量分数为10%的葡萄糖注射液,关于该溶液的说法正确的是 ( )
B
A
溶质质量:溶剂质量=1:10
B
溶质质量:溶液质量=1:10
C
溶质质量:溶液质量=1:11
D
溶剂质量:溶液质量=10:11
4.A、B、C三种物质的溶解度下图
t2 ℃时,A物质的饱和溶液中溶质的质量分数为 .
(2) t2 ℃时,把15g A物质放到50g水中,充分溶解后,溶液中溶质的质量分数为 .
20%
20%
(3)t2 ℃时,A、B、C三种物质的饱和溶液中溶质的质量分数由大到小的顺序为________.
饱和溶液,S越大,ω(溶质)越大
比较溶解度大小即可
A>B>C
5.图为a,b,c三种物质的溶解度曲线,下列不正确的是( )
A.t2℃时,a、b、c的溶解度a>b>c
B.t2℃时,将50g a物质放入100g水
中充分溶解得到a的饱和溶液
C.将t2℃时a,b,c三种物质的
饱和溶液降温至t1℃时,所得溶液溶质质量分数b>a=c
D.将c的饱和溶液变为不饱和,可用降温方法
C
变温后比较溶液的溶度:一招秒杀:小小大不变(大前小后)
溶解度减小(有溶质析出),浓度减小(看t后);
溶解度增大(无溶质析出),浓度不变(看t前)。
例1:在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制50 Kg这种溶液,需要氯化钠和水的质量各是多少?
二、有关溶质质量分数的计算
解:溶质质量 = 溶液质量×溶质的质量分数
= 150 kg × 16%
= 24kg
溶剂质量 = 溶液质量 - 溶质质量
= 150 kg - 24 kg
= 126 kg
答:需要24 kg氯化钠和126 kg水。
练习1、20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数。
练习2、20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。
剩余溶液的溶质质量分数不变,仍是 10 %
解:
20g X 10%
加水:
20g + 2g
= 9.1%
加盐:
20g X 10% + 2g
20g + 2g
= 18.2%
【解】溶液质量 = 溶液体积 × 溶液密度
= 500mL ×1.1g/cm3 = 550g
溶质质量 = 550g ×10% = 55g
溶剂质量 = 550g — 55g = 495g
答:需要氢氧化钠55g,水495g。
练习4、(课本P45)配制500mL质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),需要氢氧化钠和水的质量各是多少?
练习3、(课本P45)某温度时,蒸干35g氯化钾溶液,得到7g氯化钾,求该溶液中溶质的质量分数。
【解】
溶质的质量分数= ×100%
溶质质量
溶液质量
溶质的质量分数 = × 100% = 20%
7g
35g
答:该溶液中溶质的质量分数为20%
溶质的质量 溶剂的质量 溶液的质量 溶质的质量分数
分成三份
加水
加入溶质
蒸发少量水
减少
减少
减少
不变
不变
增加
增加
变稀
增加
不变
增加
变浓
不变
减少
减少
变浓
加水
加硫酸铜
将硫酸铜溶液进行下列变化,填表
2、公式
m(溶液)=ρV
2.关于溶液稀释或浓缩的计算
1、原理:
稀释前溶质质量 = 稀释后溶质质量
稀释或浓缩前后溶质的质量不变
浓缩前溶质质量 = 浓缩后溶质质量
加水
加稀溶液
m(加水) = m(稀溶液) – m(浓溶液)
m浓ω浓 = m稀ω稀
例1:把50g硫酸溶液溶质质量分数为98%的稀释成20%的硫酸溶液,得到20%溶液多少克 需要水的体积是多少?
解:设稀释后溶液质量为x,可以列出下式:
50g×98% = x×20%
x=245g
稀释加水的质量:
稀释前溶液中溶质质量
稀释后溶液中溶质质量
答:得到20%溶液245克,需要水195ml.
245 g– 50g = 195g
例2:配制1000毫升溶质的质量分数为10%的稀硫酸,需要质量分数为98%的浓硫酸多少毫升
设:需98%的硫酸的体积为x。
x = 59.3cm3
题中需要加多少毫升的水?
1000cm3×1.07g/cm3
×10%
x×1.84g/cm3
×98%
=
1000cm3×1.07g/cm3
59.3cm3×1.84g/cm3
-
=960.9g
答:略
硫酸的密度(g/cm3)和硫酸溶液中溶质的质量分数(%)对照表(20℃) 密度 1.01 1.07 1.14 1.22 1.30 1.40 1.50 1.61 1.73 1.81 1.84
质量分数 1% 10% 20% 30% 40% 50% 60% 70% 80% 90% 98%
试计算:
蒸发掉 g水、加入 g氯化钾、加入 g 质量分数为30%的氯化钾溶液,都可使氯化钾溶液的质量分数变成20%。
交流讨论
现有10%的氯化钾溶液100g,要使氯化钾的质量分数变成20%,有哪些方法?
1.蒸发水
2.加入氯化钾
3.加入浓度大于20%的氯化钾溶液
50
12.5
100
1.在溶液中进行的反应,实际反应的是溶质!
带入计算的量应为溶质的质量!
求反应后所得溶液的溶质质量分数时,计算反应后的溶液质量时,一般根据质量守恒定律进行计算比较简单。应注意的是:当生成物中有气体或沉淀生成时,气体或沉淀的质量不可算在溶液中,应减去!
3.化学方程式与溶质质量分数相结合的简单计算
注意要点:
.生成物中只有溶质和溶剂
20g 10% NaOH溶液与30g 稀盐酸恰好完全反应,生成
氯化钠和水。( 已知:NaOH+HCl=NaCl+H2O )
反应后溶液中的溶质是: ;
反应后溶液的质量为 。
求反应后溶液中溶质的质量分数?
20g+30g=50g
NaCl
反应后溶液的质量=反应物溶液的质量和
.生成物中有气体
6.5g Zn与100g稀硫酸恰好完全反应,生成0.2gH2 。
(已知:Zn+H2SO4=ZnSO4+H2↑)
反应后溶液中的溶质是: ;
反应后溶液的质量为: 。
求反应后溶液中溶质的质量分数?(计算结果精确到0.1%)
6.5g+100g-0.2g=106.3g
ZnSO4
反应后溶液的质量=
参加反应的固体的质量+溶液的质量-生成气体的质量
.生成物中有沉淀
20g CaCl2溶液与50g Na2CO3溶液恰好完全反应,生成
碳酸钙的质量为5g。
(已知:Na2CO3+CaCl2=2NaCl+CaCO3↓)
反应后溶液中溶质是: ;
反应后溶液的质量为: 。
求反应后溶液中溶质的质量分数?(计算结果精确到0.1%)
NaCl
20g+50g-5g=65g
反应后溶液的质量
=反应物溶液的质量和-生成沉淀的质量
.反应物中有不溶于水也不参加反应的杂质
25g石灰石样品(杂质不溶于水,也不与盐酸反应)与200g稀盐酸恰好完全反应,生成8.8gCO2 。
(已知:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑)
反应后溶液中溶质是: ;
反应后溶液的质量为: 。
求反应后溶液中溶质的质量分数?(计算结果精确到0.1%)
CaCl2
20g + 200g - 8.8g = 211.2g
反应后溶液的质量=
参加反应的固体的质量+溶液的质量-生成气体的质量
1、硫酸钠是一种重要的化工
原料,其溶解度曲线如图所示。
下列说法正确的是【 】
A、硫酸钠的溶解度随温度升高而增大
B、30℃时硫酸钠饱和溶液的质量分数为40%
C、40℃时硫酸钠的溶解度为50g
D、50℃时硫酸钠饱和溶液降温后一定饱和
C
练习
2、已知KNO3的溶解度随温度的升高而增大。下列各图是某KNO3饱和溶液的浓度随温度升高而变化的图像 (不考虑溶剂的质量变化),其中正确的是[ ]
C
3、“食盐加碘”通常是在氯化钠中加入碘酸钾。右图是氯化钠和碘酸钾的溶解度曲线图。下列说法错误的是[ ]
A.氯化钠易溶于水
B.碘酸钾的溶解度随温度升高而增大
C.20℃时不可能制得相同质量分数的碘酸钾溶液和氯化钠溶液
D.20℃时两者的饱和溶液,氯化钠的质量分数大
C
4、KCl是一种常用钾肥,其溶解度如下表。下列说
法正确的是( )
温度/℃ 0 20 40 60
溶解度/g 27.6 34.0 40.0 45.5]
A.KCI饱和溶液中不能再溶解其他物质
B.20℃时,100 g KCl饱和溶液中含KCI 34.0 g
C.40℃时,KCl饱和溶液的质量分数为40.0%
D.60℃的KCl饱和溶液降温至20℃,有晶体析出
D
5、蔗糖是生活中常用的调味品,
其溶解度曲线如下图。
下列说法正确的是【 】
A、蔗糖在热水中的溶解度比在
冷水中的小
B、将蔗糖饱和溶液蒸发溶剂后恢复至原温度,有结晶现象
C、温度升高,溶液中蔗糖的质量分数一定增大
D、t1℃和t2℃时的两份蔗糖溶液,所含溶质的质量不可能相等
B
课堂小结
1.表示溶液浓度的方法:
2.计算反应后溶液中溶质质量分数
溶质的质量分数= ×100%
溶质质量
溶液质量
①判断反应后溶液中的溶质,并计算其质量
②反应后溶液的质量=
总质量-生成的沉淀(或气体)的质量- 不溶于水也不反应的杂质的质量
生理盐水的溶质质量分数是0.9%,太浓或者太稀都会带来生命危险。
那么,如何配制一定溶质质量分数的溶液?
【实验用品】
【实验目的】
1、练习配制一定溶质质量分数的溶液。
2、加深对溶质的质量分数概念的理解。
三、一定溶质质量分数的氯化钠溶液的配制
配制50 g质量分数为6%的氯化钠溶液
仪器:
托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒
实验 仪器
实验 步骤 计算 所需氯化钠的质量分别为:_____g;所需水的体积为:_____mL。
称量 用托盘天平称量所需的氯化钠,放入烧杯中。
量取 用量筒量取,倒入盛有氯化钠的烧杯中。
溶解 用玻璃棒搅拌,___________。
装瓶 把配好的溶液装入试剂瓶,盖好瓶塞并贴上标签,注明试剂的_____、__________。
托盘天平、药匙、烧杯、量筒、胶头滴管、玻璃棒
3
47
加速溶解
名称 质量分数
6%
氯化钠
配制的主要步骤,仪器:
计算
称量
溶解
烧杯、玻璃棒
称:托盘天平、药匙
量:量筒、胶头滴管
你学会归纳整理了
若用液体配制呢?
练习:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。
误差 分析 浓度偏大 浓度偏小 无影响
溶质 偏大 砝码生锈或沾有污渍 溶质 偏小 药品中含有杂质 药品和砝码位置颠倒,且使用了游码(会使药品质量减小) 药品没有完全溶解就转移 转移过程中有少量溶液洒出
W(溶质)= ×100%
m(溶质)
m(溶液)
=
m(溶质)
m(溶质)+m(溶剂)
×100%
误差 分析 浓度偏大 浓度偏小 无影响
溶剂 偏小 量取水的体积时____(填“仰”或“俯”)视读数量取的水没有完全转移 溶剂 偏大 量取水的体积时 (填“仰”或“俯”)视读数 烧杯或试剂瓶内原来有少量的水 转移过程中有少量溶液洒出
俯
仰
W(溶质)= ×100%
m(溶质)
m(溶液)
=
m(溶质)
m(溶质)+m(溶剂)
×100%
若俯视则读数偏高,液体的
实际体积<读数
仰视,读数偏低,液体的
实际体积>读数
1.在进行“一定溶质质量分数的氯化钠溶液的配制”实验活动中常出现以下错误操作。
俯视读数,读取数值大于实际数值,会导致量取水的体积偏小,溶液质量偏小,溶质质量分数偏大
(1)其中不影响所配溶液浓度的操作是______(填序号,下同)。
(2)造成所配溶液浓度偏大的操作为_______,其原因是______。
D
C
2.如图是配制50g质量分数为5%的氯化钠溶液的操作,试回答:
(1)正确的操作顺序是___ ____(填序号)。
(2)操作⑤中称量氯化钠时,若指针左偏,应进行的操作_______。
(3)操作②应选用_______量筒(50mL或100mL);量水时,若仰视读数,配得溶液的质量分数会_______(“偏大”或“偏小”)。
(4)操作③中玻璃棒的作用是_______。
(5)若用已配好的50g溶质质量分数为5%的氯化钠溶液配制溶质质量分数为2%的氯化钠溶液,需要加水的质量为_______。
75g
④⑤①②③
取出氯化钠直至天平平衡
50mL
偏小
搅拌,加快溶解速率
3.图1是甲,乙、丙三种物质的溶解度曲线,R是其中一种物质。现取50gR如图2进行有关实验,观察到①②中没有固体析出,③中有固体析出。下列说法正确的是( )
B
A.从图2的实验结合图1分析,
R是丙物质
B.①和②的溶液中,溶质的
质量分数不相等
C.①②③中,只有③的上层
清液是饱和溶液
D.①②③中,①的溶液中溶质的质量分数最大
第九单元 溶液
课题3 溶质的浓度
学习目标
1.掌握一种溶液组成的表示方法─
─溶质的质量分数
2.能进行溶质质量分数的简单计算
3.初步学会配制一定溶质质量分数的溶液
仪器:试管 滴管
在三支试管中各加入20mL水,然后分别加入约0.1g、0.5g、2g固体硫酸铜。比较三种溶液的颜色。
实验9-7
0.1g
0.5g
2.0g
试管 编号 溶液颜 色比较 溶 剂 质量/g 溶 质 质量/g 溶 液 质量/g 溶质质量
分数
1
2
3
浅
较深
深
20g
20g
20g
0.1g
0.5g
2.0g
20.1g
20.5g
22.0g
提问:当无色的溶液时,怎么判断其浓或稀
0.1g
0.5g
2g
根据三种溶液的颜色深浅。颜色深的溶液较浓,颜色浅的溶液较稀.
表示溶液浓度的方法很多,这里主要介绍 溶质的质量分数。
在实际应用中,常常要准确知道一定量的溶液里所含溶质的量,即溶液的浓度。
0.9%的生理盐水
75%的消毒酒精
3%的双氧水
1.概念:
W(溶质)= ×100%
m(溶质)
m(溶液)
=
m(溶质)
m(溶质)+m(溶剂)
×100%
3.推导式:
m(溶质)= m(溶液)×w
2.公式:
溶质质量与溶液质量之比。
一、溶质质量分数
(溶液的浓度,用w表示)
(以百分数表示)
例如:溶质质量分数为10%的NaCl溶液,是指每100份质量的溶液中含溶质质量为10份。
4.意义:溶质的质量分数越大,表示一定温度下,一定量的溶剂中所溶解的溶质越 ,浓度越 。
多
大
编号 溶剂 质量 溶质 质量 溶液 质量 溶质的
质量分数
① 20 0.1 20.1
② 20 0.5 20.5
③ 20 2 22
①溶质的质量分数用百分数表示。
②溶质的质量和溶液的质量单位必须统一。
③溶质的质量是指已经溶解的溶质,没有溶解的不算在内。
【注意】
0.1g
20.1g
×
100% ≈ 0.5%
0.5g
20.5g
×
100% ≈ 2.4%
2.0g
22.0g
×
100% ≈ 9.1%
溶质质量/g 溶剂质量/g 溶液质量/g 溶质质量分数
10 200
96 100
150 16%
20 80
推导公式
1、溶质的质量=溶液的质量×溶质的质量分数
2、溶剂的质量=溶液的质量-溶质的质量
分组练习:
10%
4
4%
24
126
100
20%
190
m(溶质)= m(溶液)×w
m(溶液)= m(溶质)+ m(溶剂)
[实验9-8]
溶质质量/g 溶剂(水)质量/g 现象 溶液中溶质的质量分数
10 90
20 80
固体溶解
固体溶解
10%
20%
思考交流
200C时,36gNaCl溶解到100g水中恰好形成NaCl的饱和溶液,氯化钠饱和溶液中溶质的质量分数是多少
36g
136g
×
100% ≈ 26.5%
200C,用NaCl、水能配出36%的NaCl溶液吗?
26.5%<36%
问 题
溶质质量分数=
溶质的质量
溶液的质量
×100%
在一定温度下的饱和溶液是最浓的溶液。
区别 溶解度 溶质的质量分数
概念 一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量 任意溶液中,溶质质量与溶液质量之比
表示意义 某物质溶解能力的大小 任一溶液的浓度大小
条件 一定温度 不定温度
状态 饱和状态 可饱和,可不饱和
单位 g 无单位
饱和溶液中:
溶质质量分数
=
S
100+S
×100%
5.溶质质量分数与溶解度的比较
例.20℃时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数。
解析:先利用溶解度判断溶液是否饱和,未溶解不计入
【推导】
t℃时,某饱和溶液中溶质的质量分数可利用S来求:
(与饱和溶液的质量没有关系)
即m溶质=18g,m溶液=68g
同温度、同溶剂、同为饱和溶液,则溶质的质量分数也相同。
练习、(课本P45)在20℃时,将40g硝酸钾固体加入100g水中,充分搅拌后,仍有8.4g硝酸钾固体未溶解。请填写下列空白:
①、所得溶液是20℃时硝酸钾的 溶液;(填“饱和”或“不饱”)
②、20℃时硝酸钾的溶解度为 ;
③、所得溶液中硝酸钾的质量分数为 。
24%
31.6g
饱和
(未溶解的固体不能当成溶质来计算)
题型1.一定温度时,比较物质溶解度的大小
1.t4℃时,A、B、C的溶解度由大到小为:_________。
2.P点的意义:_______________________________。
技巧一:比较溶解度时,必须指明__________。
A>B>C
t3℃时,A、B两种物质的溶解度相同
一定温度
t4℃时,分别用100g水配制
A、B、C的饱和溶液,
需溶质质量大小为:_______;
t4℃时,分别用等质量的A、B、C
配制成饱和溶液,需溶剂质量大小为________;
t4℃时,等质量的A、B、C的饱和溶液,所含溶剂的质量大小为:_______。
技巧二:1.t℃时,等质量的两种溶质恰好完全溶解,溶解度___的用水多。形成的溶液的质量越_____。
2.t℃时,等质量的两种饱和溶液,溶解度___的含水多。
A>B>C
C>B>A
C>B>A
小
大
小
题型2.溶质和溶剂质量的比较
1.t4℃时,将15gA物质加入到50g水中,
充分溶解,得到A的_________(饱和
/不饱和)溶液_____g。溶液的溶质
的质量分数为________。(只列算式)
2.t4℃时,将25gA物质加入到50g水中,充分溶解,得到A的______(饱和/不饱和)溶液_____g。溶液的溶质的质量分数为________。(只列算式)
技巧三:计算溶液质量或浓度时,应先利用_______判断溶质是否完全溶解,未溶解或析出的不算作溶质质量,不能计入溶液总质量。
不饱和
65
15/65
饱和
70
20/70
溶解度
题型3.饱和溶液和不饱和溶液的判断
1.t4℃时,A、B、C三种物质的
饱和溶液的浓度大→小为:__________。
2.t3℃时,A、B、C三种物质的
饱和溶液的浓度大→小为:__________。
技巧四:相同温度时的饱和溶液,溶解度越___,浓度越大。
A>B>C
A=B>C
大
题型4.t℃,利用溶解度比较
饱和溶液浓度大小
讨论交流
a
b
c
t1
t2
温度/℃
溶解度/g
①t1时,a、b、c三种物质的饱和溶液,溶质的质量分数由大到小为:
②a、b、c的饱和溶液从t1升温至t2,溶质的质量分数由大到小为:
①t2时,a、b、c三种物质的饱和溶液,溶质的质量分数由大到小为:
②a、b、c的饱和溶液从t2降温至t1,溶质的质量分数由大到小为:
b>a=c
b>a>c
a>b>c
b>a>c
课堂精练
1.对“10%的氯化钠溶液”的含义理解错误的是( )
A. 100g水中溶解了10g氯化钠
B. 将氯化钠与水按质量比1:9配成的溶液
C. 将10g氯化钠溶解在90g水中所得到的溶液
D. 100g氯化钠溶液中溶解有10g氯化钠
A
2.现有一杯60℃的硝酸钾饱和溶液,下列操作会导致硝酸钾的质量分数减小的是( )
A. 升温至80℃
B. 恒温蒸发部分溶剂
C. 加入一定量的硝酸钾
D. 加入一定量的氯化钠
D
3.有一瓶溶质的质量分数为10%的葡萄糖注射液,关于该溶液的说法正确的是 ( )
B
A
溶质质量:溶剂质量=1:10
B
溶质质量:溶液质量=1:10
C
溶质质量:溶液质量=1:11
D
溶剂质量:溶液质量=10:11
4.A、B、C三种物质的溶解度下图
t2 ℃时,A物质的饱和溶液中溶质的质量分数为 .
(2) t2 ℃时,把15g A物质放到50g水中,充分溶解后,溶液中溶质的质量分数为 .
20%
20%
(3)t2 ℃时,A、B、C三种物质的饱和溶液中溶质的质量分数由大到小的顺序为________.
饱和溶液,S越大,ω(溶质)越大
比较溶解度大小即可
A>B>C
5.图为a,b,c三种物质的溶解度曲线,下列不正确的是( )
A.t2℃时,a、b、c的溶解度a>b>c
B.t2℃时,将50g a物质放入100g水
中充分溶解得到a的饱和溶液
C.将t2℃时a,b,c三种物质的
饱和溶液降温至t1℃时,所得溶液溶质质量分数b>a=c
D.将c的饱和溶液变为不饱和,可用降温方法
C
变温后比较溶液的溶度:一招秒杀:小小大不变(大前小后)
溶解度减小(有溶质析出),浓度减小(看t后);
溶解度增大(无溶质析出),浓度不变(看t前)。
例1:在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制50 Kg这种溶液,需要氯化钠和水的质量各是多少?
二、有关溶质质量分数的计算
解:溶质质量 = 溶液质量×溶质的质量分数
= 150 kg × 16%
= 24kg
溶剂质量 = 溶液质量 - 溶质质量
= 150 kg - 24 kg
= 126 kg
答:需要24 kg氯化钠和126 kg水。
练习1、20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数。
练习2、20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。
剩余溶液的溶质质量分数不变,仍是 10 %
解:
20g X 10%
加水:
20g + 2g
= 9.1%
加盐:
20g X 10% + 2g
20g + 2g
= 18.2%
【解】溶液质量 = 溶液体积 × 溶液密度
= 500mL ×1.1g/cm3 = 550g
溶质质量 = 550g ×10% = 55g
溶剂质量 = 550g — 55g = 495g
答:需要氢氧化钠55g,水495g。
练习4、(课本P45)配制500mL质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),需要氢氧化钠和水的质量各是多少?
练习3、(课本P45)某温度时,蒸干35g氯化钾溶液,得到7g氯化钾,求该溶液中溶质的质量分数。
【解】
溶质的质量分数= ×100%
溶质质量
溶液质量
溶质的质量分数 = × 100% = 20%
7g
35g
答:该溶液中溶质的质量分数为20%
溶质的质量 溶剂的质量 溶液的质量 溶质的质量分数
分成三份
加水
加入溶质
蒸发少量水
减少
减少
减少
不变
不变
增加
增加
变稀
增加
不变
增加
变浓
不变
减少
减少
变浓
加水
加硫酸铜
将硫酸铜溶液进行下列变化,填表
2、公式
m(溶液)=ρV
2.关于溶液稀释或浓缩的计算
1、原理:
稀释前溶质质量 = 稀释后溶质质量
稀释或浓缩前后溶质的质量不变
浓缩前溶质质量 = 浓缩后溶质质量
加水
加稀溶液
m(加水) = m(稀溶液) – m(浓溶液)
m浓ω浓 = m稀ω稀
例1:把50g硫酸溶液溶质质量分数为98%的稀释成20%的硫酸溶液,得到20%溶液多少克 需要水的体积是多少?
解:设稀释后溶液质量为x,可以列出下式:
50g×98% = x×20%
x=245g
稀释加水的质量:
稀释前溶液中溶质质量
稀释后溶液中溶质质量
答:得到20%溶液245克,需要水195ml.
245 g– 50g = 195g
例2:配制1000毫升溶质的质量分数为10%的稀硫酸,需要质量分数为98%的浓硫酸多少毫升
设:需98%的硫酸的体积为x。
x = 59.3cm3
题中需要加多少毫升的水?
1000cm3×1.07g/cm3
×10%
x×1.84g/cm3
×98%
=
1000cm3×1.07g/cm3
59.3cm3×1.84g/cm3
-
=960.9g
答:略
硫酸的密度(g/cm3)和硫酸溶液中溶质的质量分数(%)对照表(20℃) 密度 1.01 1.07 1.14 1.22 1.30 1.40 1.50 1.61 1.73 1.81 1.84
质量分数 1% 10% 20% 30% 40% 50% 60% 70% 80% 90% 98%
试计算:
蒸发掉 g水、加入 g氯化钾、加入 g 质量分数为30%的氯化钾溶液,都可使氯化钾溶液的质量分数变成20%。
交流讨论
现有10%的氯化钾溶液100g,要使氯化钾的质量分数变成20%,有哪些方法?
1.蒸发水
2.加入氯化钾
3.加入浓度大于20%的氯化钾溶液
50
12.5
100
1.在溶液中进行的反应,实际反应的是溶质!
带入计算的量应为溶质的质量!
求反应后所得溶液的溶质质量分数时,计算反应后的溶液质量时,一般根据质量守恒定律进行计算比较简单。应注意的是:当生成物中有气体或沉淀生成时,气体或沉淀的质量不可算在溶液中,应减去!
3.化学方程式与溶质质量分数相结合的简单计算
注意要点:
.生成物中只有溶质和溶剂
20g 10% NaOH溶液与30g 稀盐酸恰好完全反应,生成
氯化钠和水。( 已知:NaOH+HCl=NaCl+H2O )
反应后溶液中的溶质是: ;
反应后溶液的质量为 。
求反应后溶液中溶质的质量分数?
20g+30g=50g
NaCl
反应后溶液的质量=反应物溶液的质量和
.生成物中有气体
6.5g Zn与100g稀硫酸恰好完全反应,生成0.2gH2 。
(已知:Zn+H2SO4=ZnSO4+H2↑)
反应后溶液中的溶质是: ;
反应后溶液的质量为: 。
求反应后溶液中溶质的质量分数?(计算结果精确到0.1%)
6.5g+100g-0.2g=106.3g
ZnSO4
反应后溶液的质量=
参加反应的固体的质量+溶液的质量-生成气体的质量
.生成物中有沉淀
20g CaCl2溶液与50g Na2CO3溶液恰好完全反应,生成
碳酸钙的质量为5g。
(已知:Na2CO3+CaCl2=2NaCl+CaCO3↓)
反应后溶液中溶质是: ;
反应后溶液的质量为: 。
求反应后溶液中溶质的质量分数?(计算结果精确到0.1%)
NaCl
20g+50g-5g=65g
反应后溶液的质量
=反应物溶液的质量和-生成沉淀的质量
.反应物中有不溶于水也不参加反应的杂质
25g石灰石样品(杂质不溶于水,也不与盐酸反应)与200g稀盐酸恰好完全反应,生成8.8gCO2 。
(已知:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑)
反应后溶液中溶质是: ;
反应后溶液的质量为: 。
求反应后溶液中溶质的质量分数?(计算结果精确到0.1%)
CaCl2
20g + 200g - 8.8g = 211.2g
反应后溶液的质量=
参加反应的固体的质量+溶液的质量-生成气体的质量
1、硫酸钠是一种重要的化工
原料,其溶解度曲线如图所示。
下列说法正确的是【 】
A、硫酸钠的溶解度随温度升高而增大
B、30℃时硫酸钠饱和溶液的质量分数为40%
C、40℃时硫酸钠的溶解度为50g
D、50℃时硫酸钠饱和溶液降温后一定饱和
C
练习
2、已知KNO3的溶解度随温度的升高而增大。下列各图是某KNO3饱和溶液的浓度随温度升高而变化的图像 (不考虑溶剂的质量变化),其中正确的是[ ]
C
3、“食盐加碘”通常是在氯化钠中加入碘酸钾。右图是氯化钠和碘酸钾的溶解度曲线图。下列说法错误的是[ ]
A.氯化钠易溶于水
B.碘酸钾的溶解度随温度升高而增大
C.20℃时不可能制得相同质量分数的碘酸钾溶液和氯化钠溶液
D.20℃时两者的饱和溶液,氯化钠的质量分数大
C
4、KCl是一种常用钾肥,其溶解度如下表。下列说
法正确的是( )
温度/℃ 0 20 40 60
溶解度/g 27.6 34.0 40.0 45.5]
A.KCI饱和溶液中不能再溶解其他物质
B.20℃时,100 g KCl饱和溶液中含KCI 34.0 g
C.40℃时,KCl饱和溶液的质量分数为40.0%
D.60℃的KCl饱和溶液降温至20℃,有晶体析出
D
5、蔗糖是生活中常用的调味品,
其溶解度曲线如下图。
下列说法正确的是【 】
A、蔗糖在热水中的溶解度比在
冷水中的小
B、将蔗糖饱和溶液蒸发溶剂后恢复至原温度,有结晶现象
C、温度升高,溶液中蔗糖的质量分数一定增大
D、t1℃和t2℃时的两份蔗糖溶液,所含溶质的质量不可能相等
B
课堂小结
1.表示溶液浓度的方法:
2.计算反应后溶液中溶质质量分数
溶质的质量分数= ×100%
溶质质量
溶液质量
①判断反应后溶液中的溶质,并计算其质量
②反应后溶液的质量=
总质量-生成的沉淀(或气体)的质量- 不溶于水也不反应的杂质的质量
生理盐水的溶质质量分数是0.9%,太浓或者太稀都会带来生命危险。
那么,如何配制一定溶质质量分数的溶液?
【实验用品】
【实验目的】
1、练习配制一定溶质质量分数的溶液。
2、加深对溶质的质量分数概念的理解。
三、一定溶质质量分数的氯化钠溶液的配制
配制50 g质量分数为6%的氯化钠溶液
仪器:
托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒
实验 仪器
实验 步骤 计算 所需氯化钠的质量分别为:_____g;所需水的体积为:_____mL。
称量 用托盘天平称量所需的氯化钠,放入烧杯中。
量取 用量筒量取,倒入盛有氯化钠的烧杯中。
溶解 用玻璃棒搅拌,___________。
装瓶 把配好的溶液装入试剂瓶,盖好瓶塞并贴上标签,注明试剂的_____、__________。
托盘天平、药匙、烧杯、量筒、胶头滴管、玻璃棒
3
47
加速溶解
名称 质量分数
6%
氯化钠
配制的主要步骤,仪器:
计算
称量
溶解
烧杯、玻璃棒
称:托盘天平、药匙
量:量筒、胶头滴管
你学会归纳整理了
若用液体配制呢?
练习:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。
误差 分析 浓度偏大 浓度偏小 无影响
溶质 偏大 砝码生锈或沾有污渍 溶质 偏小 药品中含有杂质 药品和砝码位置颠倒,且使用了游码(会使药品质量减小) 药品没有完全溶解就转移 转移过程中有少量溶液洒出
W(溶质)= ×100%
m(溶质)
m(溶液)
=
m(溶质)
m(溶质)+m(溶剂)
×100%
误差 分析 浓度偏大 浓度偏小 无影响
溶剂 偏小 量取水的体积时____(填“仰”或“俯”)视读数量取的水没有完全转移 溶剂 偏大 量取水的体积时 (填“仰”或“俯”)视读数 烧杯或试剂瓶内原来有少量的水 转移过程中有少量溶液洒出
俯
仰
W(溶质)= ×100%
m(溶质)
m(溶液)
=
m(溶质)
m(溶质)+m(溶剂)
×100%
若俯视则读数偏高,液体的
实际体积<读数
仰视,读数偏低,液体的
实际体积>读数
1.在进行“一定溶质质量分数的氯化钠溶液的配制”实验活动中常出现以下错误操作。
俯视读数,读取数值大于实际数值,会导致量取水的体积偏小,溶液质量偏小,溶质质量分数偏大
(1)其中不影响所配溶液浓度的操作是______(填序号,下同)。
(2)造成所配溶液浓度偏大的操作为_______,其原因是______。
D
C
2.如图是配制50g质量分数为5%的氯化钠溶液的操作,试回答:
(1)正确的操作顺序是___ ____(填序号)。
(2)操作⑤中称量氯化钠时,若指针左偏,应进行的操作_______。
(3)操作②应选用_______量筒(50mL或100mL);量水时,若仰视读数,配得溶液的质量分数会_______(“偏大”或“偏小”)。
(4)操作③中玻璃棒的作用是_______。
(5)若用已配好的50g溶质质量分数为5%的氯化钠溶液配制溶质质量分数为2%的氯化钠溶液,需要加水的质量为_______。
75g
④⑤①②③
取出氯化钠直至天平平衡
50mL
偏小
搅拌,加快溶解速率
3.图1是甲,乙、丙三种物质的溶解度曲线,R是其中一种物质。现取50gR如图2进行有关实验,观察到①②中没有固体析出,③中有固体析出。下列说法正确的是( )
B
A.从图2的实验结合图1分析,
R是丙物质
B.①和②的溶液中,溶质的
质量分数不相等
C.①②③中,只有③的上层
清液是饱和溶液
D.①②③中,①的溶液中溶质的质量分数最大
同课章节目录
