【快人一步】浙教版2022-2023学年寒假八(下)科学讲义(十二):表示元素的符号【wrod,含答案】
文档属性
| 名称 | 【快人一步】浙教版2022-2023学年寒假八(下)科学讲义(十二):表示元素的符号【wrod,含答案】 |  | |
| 格式 | doc | ||
| 文件大小 | 565.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-12-08 09:08:33 | ||
图片预览



文档简介
一、元素符号
(一)元素符号的写法
元素符号是国际上统-采用的符号,通常用该元素拉丁文的第一个字母大写来表示。当两种元素的第1个字母相同时,则再附上一个小写字母作为该元素符号,以示区别,即由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写。如Ne (氖)、Na (钠)、Cu (铜)、Ca(钙)等。元素符号书写口诀:一大二小。
(二)常见元素的元素符号
(三)元素符号表示的意义
(1)宏观上:表示一种元素,如“N”表示氮元素,“O”表示氧元素。每种元素只能有一种元素符号 。
(2)微观上:表示这种元素的1个原子, 如“N”表示1个氮原子,“O”表示1个氧原子。
(3)如果物质直接由原子构成,则该元素符号还表示一种物质,如“Fe”表示铁这种物质。
【能力拓展】若元素符号前面有数字,则只能表示该元素的几个原子(即只有微观含义,不再表示一种元素)。如“3H”只能表示3个氢原子,“6Fe”只能表示6个铁原子。
二、元素周期表
为了便于研究元素的性质和用途,科学家把人们已知的110多种元素按核电荷数科学有序地排列起来,这样就得到了元素周期表。在元素周期表中,用不同的颜色对金属元素、非金属元素做了区分。
(一)编排结构
(1)横行(周期)
元素周期表每一横行代表一个周期,共有7个横行,表示7个周期,同一周期从左到右,原子的质子数逐渐增加。每个周期开头的是金属元素(第一周期除外),靠近尾部的是非金属元素,结尾的是稀有气体元素,这正是“周期性”的具体表现。
(2)纵列(族)
元素周期表每个纵列叫做一个族,共有18个纵列,16个族(其中8、9、10三个纵列共同组成一个族),同族元素的化学性质相似。
(3)每一格
在元素周期表中,每一种元素均占据一格,每格均包括元素的原子序数元素符号、元素名称、相对原子质量等内容。其中,对于原子而言:原子序数=核电荷数=质子数=核外电子数。
(4)从元素周期表中可获得的信息
①根据元素所处的位置可知该元素原子的质子数(核电荷数)、核外电子数、元素的化学性质等。
②从元素周期表的排列可知元素单质的物理状态;元素是人工合成的还是自然存在的;元素是金属元素、非金属元素还是稀有气体元素等。
(二)元素周期表的意义
(1)它是学习和研究科学的重要工具,为寻找新元素提供理论依据。(2)由于元素周期表中位置越靠近的元素性质越相似,启发人们在元素周期表的一定区域内寻找新物质(如半导体材料、农药、催化剂等)。
【能力拓展】决定元素化学性质的是最外层电子数,同一族的元素最外层电子数相同,因此化学性质相似。
例1、科学家发现一种新元素。该元素原子核外电子数为117,中子数为174,相对原子质量为291,元素名称Ununseptium,符号Uus。请模仿图甲,将该元素对应信息编写到图乙中相应位置,则“①"处应填( )
A.291 B.174 C.117 D.57
例2、维生素B12是人体不可或缺的物质,其中所含的元素钴,也能促使血红蛋白合成及红细胞数目的增加。已知钴是第27号元素,常见化合价为+2和+3。以下关于这种元素认识正确的是( )
A.钴元素属于非金属元素
B.符号Co同时可以表示一氧化碳
C.一个Co3+中含有24个电子
D.用放大镜能观察到元素钴促进红细胞增加的过程
例3、如表是元素周期表的一部分,请回答下列问题
(1)周期表中的①②③代表三种不同的元素,③是 元素(填名称),属于非金属的是 ,属于同一周期的元素是 (填序号)。
(2)氕、氘、氚都属于表中的氢元素,原因是其原子的 相同,但 不同。
(3)最近,科学家用大量高速钙原子轰击锫原子,形成了核电核数为117的元素的原子,该原子的核外电子数是 。
例4、如图所示是1-18号元素中某些元素的部分化合价,回答下列问题。
1 H 2He
3Li 4Be 5B 6C 7N 8O 9F 10Ne
11Na+1 12Mg+2 13Al+3 14 Si+4 -4 15P 16S+6 -2 17Cl 18Ar
(1)3号元素属于 (选填“金属元素”或“非金属元素”)。
(2)13号元素与8号元素组成的化合物为 (填化学式)。
1.下列关于符号“K”所表示的意义,正确的是( )
①钾元素 ②钾的原子核 ③一个钾元素 ④一个钾原子 ⑤金属钾
A.①②⑤ B.②③④⑤ C.①④⑤ D.①③④⑤
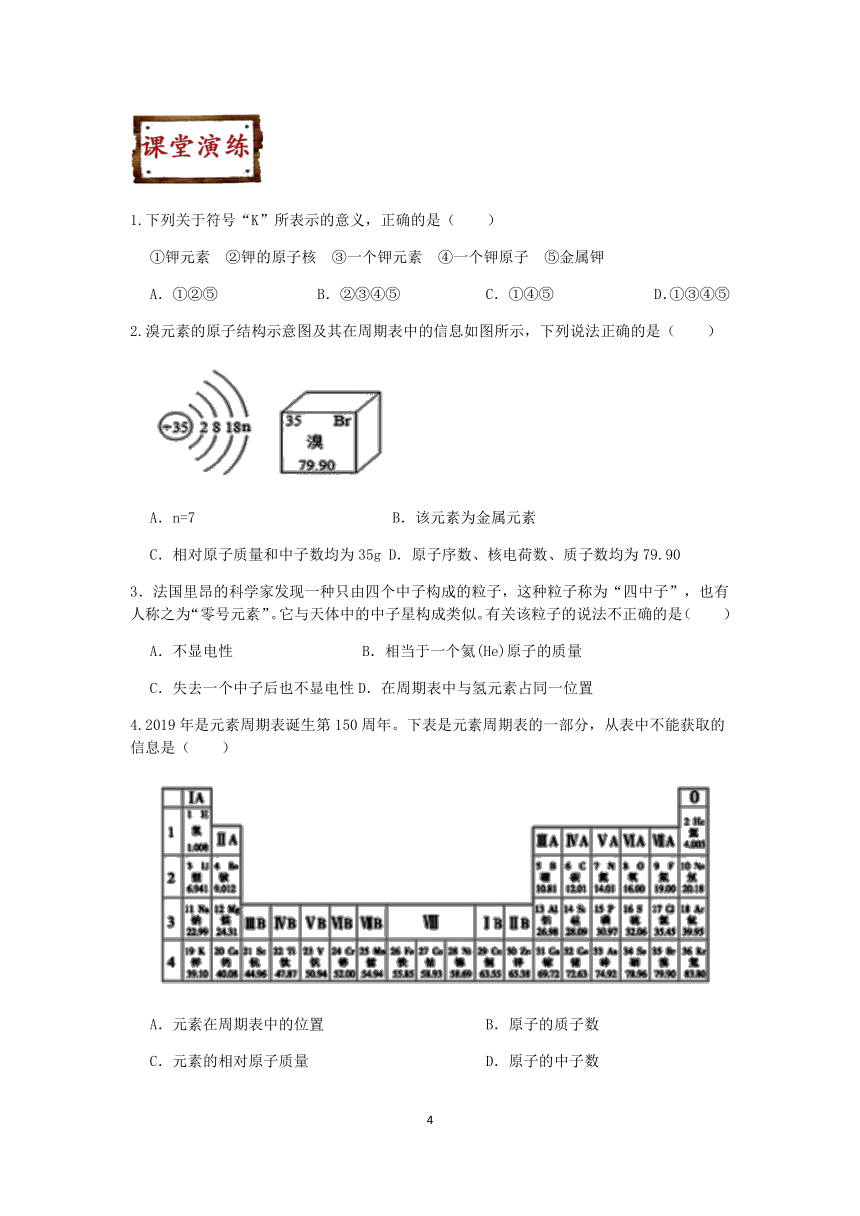
2.溴元素的原子结构示意图及其在周期表中的信息如图所示,下列说法正确的是( )
A.n=7 B.该元素为金属元素
C.相对原子质量和中子数均为35g D.原子序数、核电荷数、质子数均为79.90
3.法国里昂的科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。它与天体中的中子星构成类似。有关该粒子的说法不正确的是( )
A.不显电性 B.相当于一个氦(He)原子的质量
C.失去一个中子后也不显电性D.在周期表中与氢元素占同一位置
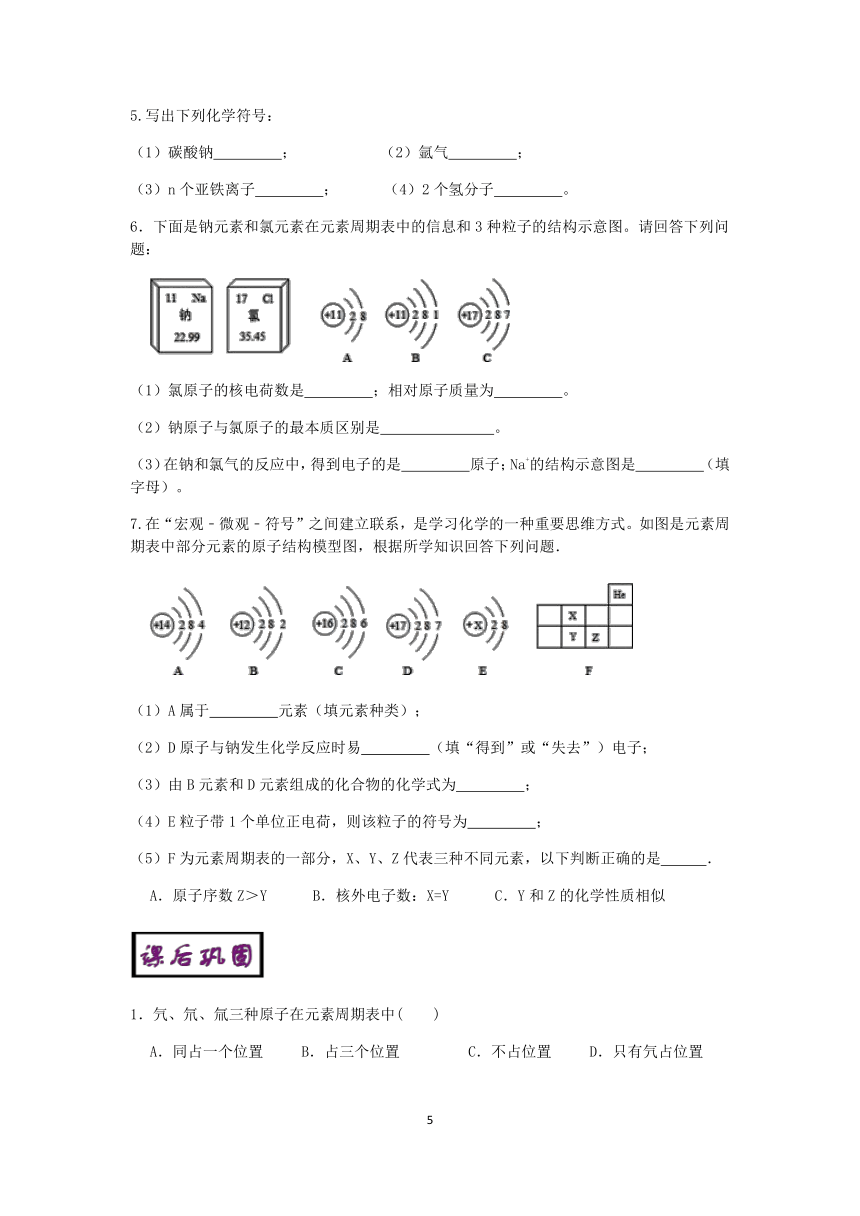
4.2019年是元素周期表诞生第150周年。下表是元素周期表的一部分,从表中不能获取的信息是( )
A.元素在周期表中的位置 B.原子的质子数
C.元素的相对原子质量 D.原子的中子数
5.写出下列化学符号:
(1)碳酸钠 ; (2)氩气 ;
(3)n个亚铁离子 ; (4)2个氢分子 。
6.下面是钠元素和氯元素在元素周期表中的信息和3种粒子的结构示意图。请回答下列问题:
(1)氯原子的核电荷数是 ;相对原子质量为 。
(2)钠原子与氯原子的最本质区别是 。
(3)在钠和氯气的反应中,得到电子的是 原子;Na+的结构示意图是 (填字母)。
7.在“宏观﹣微观﹣符号”之间建立联系,是学习化学的一种重要思维方式。如图是元素周期表中部分元素的原子结构模型图,根据所学知识回答下列问题.
(1)A属于 元素(填元素种类);
(2)D原子与钠发生化学反应时易 (填“得到”或“失去”)电子;
(3)由B元素和D元素组成的化合物的化学式为 ;
(4)E粒子带1个单位正电荷,则该粒子的符号为 ;
(5)F为元素周期表的一部分,X、Y、Z代表三种不同元素,以下判断正确的是 .
A.原子序数Z>Y B.核外电子数:X=Y C.Y和Z的化学性质相似
1.氕、氘、氚三种原子在元素周期表中( )
A.同占一个位置 B.占三个位置 C.不占位置 D.只有氕占位置
2.元素周期表是学习和研究化学的重要工具。如表是元素周期表的一部分,A~F代表六种不同短周期元素。下列说法中不正确的是( )
A.原子序数:EC.A、B同周期,且原子序数:A3.写出下列符号的意义或相应的符号
(1)N: .
(2)n个二氧化碳分子: .
(3)4个硫酸根离子: .
(4)铝离子: .
(5)氧化铁中铁元素为+3价 .
4.元素周期表是学习和研究化学的一种重要工具。如图是元素周 期表的一部分。请回答下列问题:
(1)如图中的元素都属于 (填“金属”或“非金属”)元素。
(2)在周期表中查找硫元素,知道硫元素的原子序数是 16, 它的相对原子质量为 。在化学反应中硫原子容易得到电子,形成带 (填“正电荷”或“负电荷”)的硫离子。
5.化学元素组成万物。人们很早就意识到物质都是由几种亘古不变的基本成分——“元素"组成的。
(1)古人曾认为水是组成物质的元素之一。在你学过的知识中能说明“水不是元素“的实验事实是 。
(2)现代化学对“元素"做了科学定义,图甲是两个微粒的结构模型示意图,小科认为这两个微粒不属于同种元素,你认为他的依据是 。
(3)1869年,俄国化学家门捷列夫在前人研究的基础上制作出第一张元素周期表,图乙是元素周期表的部分内容,表中空白格处元素原子的质子数为 。
6.元素周期表是学习科学的重要工具。下表是元素周期表的一部分,请回答下列问题:
(1)第3号元素属于 (填“金属”或“非金属”)元素,它在化学反应中容易 (填“得到”或“失去”)电子;
(2)第13号元素和第17号元素组成化合物的化学式是 ;
(3)每一周期结尾的是稀有气体元素,它们的化学性质 (填“活泼”或“稳定”);
(4)一个2H216O分子所含的中子数为 (元素符号左上角的数字代表该原子中质子数和中子数之和)
7.在元素周期表中,每一横行被称为一个周期.下表为元素周期表中某一周期元素的原子结构示意图.
(1)表中氧原子最外层电子数x= .
(2)表中不同种元素最本质的区别是原子中 不同.
(3)上述元素在周期表中处于同一周期的原因是 .
(4)氟元素和氢元素形成的化合物的水溶液氢氟酸(HF),可用于玻璃雕刻,其主要原因是氢氟酸与玻璃的主要成分二氧化硅(SiO2)发生反应,生成四氟化硅(SiF4)气体和水,该反应的化学方程式为 .
答案及解析
例1、C
【解析】根据对元素周期表的认识和理解分析解答。
【解答】在元素周期表中,中间的汉字为元素名称,左上角的数字为质子数,右上角的字母为元素符号,正下方的数值为相对原子质量,则①应该为质子数,等于核外电子数117;②为元素名称,即Uus;③为相对原子质量,即238,故C正确,而A、B、D错误。
例2、C
【解析】根据名称还“钅”的为金属元素、阳离子是原子失电子形成及构成物质的粒子很小分析。
【解答】A、 钴元素属于金属元素 ,不符合题意;
B、 符号Co表示钴元素,一氧化碳表示为CO ,不符合题意;
C、 一个Co3+中质子数为27,其原子失去了3个电子,所以含有24个电子 ,符合题意;
D、钴原子很少,不能观察到,不符合题意;
例3、(1)镁;②;①② (2)质子数;中子数 (3)117
【解析】(1)在元素周期表中,每行中,从左到右,质子数逐次加1;当最外层电子数达到8后,再开始下面一行的排列。一般情况下,元素名称中有金字旁的为金属元素。在同一行的元素,处在同一周期。 (2)具有相同的质子数和不同中子数的原子叫同位素原子;
(3)根据在原子中,质子数=核电荷数=核外电子数=原子序数解答。
【解答】(1)根据元素周期表中的元素排序,①号元素是锂元素,②号元素是氟元素,③号元素是镁元素,其中①③名字中含有金字旁,是金属元素,②是非金属元素;①②在同一行,位于同一周期。
(2)元素是指据有相同质子数(或核电荷数)的同一类原子的总称,因此氕、氘、氚的质子数相同,中子数不同;
(3)在原子中,质子数=核电荷数=核外电子数,则原子的核外电子数是117。
例4、(1)金属元素(2)Al2O3
【解析】由元素的中文汉字偏旁部首来确定物质是金属还是非金属,以及物质的常见物理状态。
(1)3号元素为锂元素,金子旁为金属元素。
(2)13号元素为铝,8号元素为氧,组成物质为氧化铝。
1.C
【解析】“K”可以表示钾元素,也可以表示一个钾原子,还能表示金属钾这种物质,即①④⑤正确,故C符合题意,而A、B、D不合题意。
2.A
【解析】(1)在原子中,质子数=核外电子数;
(2)一般情况下,如果元素名称中含有金字旁,则为金属元素;
(3)(4)在元素周期表中,中间的汉字为元素名称,左上角的数字为质子数,右上角的字母为元素符号,正下方的数值为相对原子质量。
【解答】A.根据质子数=核外电子数得到:35=2+8+18+n,则n=7,故A正确;
B.元素名称为溴,不含金字旁,不是金属元素,故B错误;
C.相对原子质量为79.9,中子数为:79.9-38=34.9,故C错误;
D.原子序数=质子数=核电荷数=35,故D错误。
3.D
【解析】A、中子呈中性, 只由四个中子构成的粒子也呈中性,不符合题意;
B、 氦的相对原子质量为4,该粒子的相对原子质量也为4,所以质量当于一个氦原子的质量,不符合题意;
C、 中子呈中性,失去一个中子后也不显电性 ,不符合题意;
D、 该元素为零号元素,在周期表中与氢元素不占同一位置 ,符合题意;
4.D
【解析】A.根据元素周期表,我们可以知道它处于哪个周期和哪个族,故A正确不合题意;
在每个方格中,中间的汉字为元素名称,右上角的字母为元素符号,左上角的数字为质子数,正下方的数值为相对原子质量,故B、C正确不合题意;
元素周期表不能直接反映原子的中子数,故D错误符合题意。
5.(1)Na2CO3 (2)Ar (3)nFe2+ (4)2H2
【解析】(1)(2)根据物质的名称确定组成分子的原子种类和个数,然后写出对应的化学式;
(3)离子的写法:元素符号的右上角写上数字和正负号,表示所带的电荷数和电性,前面的数字表示原子团的个数;
(4)如果气体由双原子分子构成,那么可以用元素符号,并在右下角加上数字2表示;如果为单原子分子,直接用元素符号表示。
【解答】(1)碳酸钠分子有两个钠离子和一个碳酸根离子构成,写作: Na2CO3 ;
(2)氩气是单原子分子,用它的元素符号表示,写作:Ar;
(3)亚铁离子带两个单位的正电荷,在它的元素符号右上角写上2和“+”,在最前面写n表示亚铁离子的个数,即nFe2+;
(2)氢分子为双原子分子,在氢元素符号的右下角写2表示氢分子,最后在最前面写2表示氢分子的个数,即2H2。
6.(1)17;35.5(2)质子数不同(3)氯;A
【解析】(1)在元素周期表中,中间的汉字为元素名称,右上角的字母是元素的符号,左上角的数字是元素的质子数,正下方的数值是元素的相对原子质量;
(2)元素是具有相同核电荷数的同一类原子的统称,元素不同,核电荷数不同,即质子数不同;
(3)原子的最外层电子多余4个时,容易得到电子带负电荷;最外层电子小于4个时,容易失去电子带正电荷,据此分析判断。
【解答】(1)根据第二个图可知,氯原子的核电荷数是17;相对原子质量为35.5。
(2)钠原子与氯原子的最本质区别是:质子数不同;
(3)在钠和氯气的反应中,氯原子的最外层电子数为7,很容易得到一个电子形成带一个负电荷的氯离子。Na原子的最外层电子数为1,很容易失去这个电子形成带一个单位正电荷的钠离子,即图,
7.(1)非金属(2)得到(3)MgCl2(4)Na+(5)A
【解析】(1)根据原子序数确定元素名称,根据名称中是否有金字旁判断它是否属于金属元素;
(2)最外层电子数大于4的容易得到电子,小于4的容易失去电子;
(3)根据质子数确定元素种类,然后写出对应的化学式;
(4)失去电子带正电荷,据此确定E原子的电子数,进而确定质子数,从而确定元素种类,并写出离子符号;
(5)①在元素周期表中,在每一行中,右边的元素比左边元素的原子序数大;在每一列中,下边的元素比上边的元素原子序数大;
②核外电子数=原子序数=质子数;
③在每一列中,具有相同的最外层电子数,因此具有相同的化学性质。
【解答】(1)A的质子数为14,那么它为硅元素,由于不含有金字旁,所以属于非金属元素;
(2)D原子的最外层电子数为7>4,因此与钠反应时容易得到电子;
(3)B的质子数为12,则为镁元素;D的质子数为17,则为氯元素,二者组成的化合物为氯化镁,化学式为MgCl2。
(4)E带1个单位的正电荷,那么E原子的核外电子数为:10+1=11,那么E为钠元素,则带一个单位正电荷的钠离子写作Na+。
(5)A.Y和Z在同一行,且Z在右边,因此原子序数Z>Y,故A正确;
B.X和Y在同一列,因此具有相同的最外层电子数,但是Y比X多一个电子层,因此二者的核外电子数肯定不同,故B错误;
C.Y和Z在同一行,最外层电子数不同,那么它们的化学性质不同,故C错误。
1.A
【解析】氕、氘、氚三种原子,具有相同的质子数和不同的中子数,因此三者的原子序数相同,因此在周期表中占据同一位置,故A正确,而B、C、D错误。
2.A
【解析】在元素周期表中,将具有相同电子层数的原子,按照原子半径从小到大的顺序依次排列成一行,称为一个周期。将最外层电子数相同的原子,按照原子半径从上到下依次增大的顺序排成一列,称为一个主族,据此分析判断。
【解答】A.根据图片可知,E在C的下面一个周期,则E的原子序数肯定大于C,故A错误符合题意;
B.A、D在同一列,肯定同族,故B正确不合题意;
C.AB在同一行,肯定为同一周期;A在B的左侧,则原子序数AD.C、F在同一列,即同族,具有相同的化学性质,故D正确不合题意。
3.(1)一个氮原子 (2)nCO2 (3) (4) (5)
【解析】(1)元素符号的含义:①元素;①一个原子;
(2)根据物质的名称确定所含原子的种类和个数,据此写出分子的化学式,然后在分子符号前面加数字表示分子的个数;
(3)(4)原子团的右上角写上数字和正负号,表示所带的电荷数和电性,前面的数字表示原子团的个数
(5)在化学式中元素符号的正上方写上正负号和数字,表示该元素的化合价。
【解答】(1)N代表一个氮原子;
(2)n个二氧化碳分子写作:nCO2;
(3)4个硫酸根离子写作: ;
(4)铝离子写作 ;
(5)氧化铁中铁元素为+3价,写作: 。
4.(1)非金属(2)32.06;负电荷
【解析】(1)一般情况下,元素名称中含有金字旁的为金属元素,否则为非金属元素;
(2)在元素周期表中,中间的汉字为元素名称,左上角的数字为原子序数,右上角的字母为元素符号,正下方的数值为相对原子质量。得到电子,带负电荷;失去电子,带正电荷,据此分析解答。
【解答】(1)根据图片可知,图片中的五种元素名字中都没有金字旁,则都属于非金属元素。
(2)在周期表中查找硫元素,知道硫元素的原子序数是 16, 它的相对原子质量为32.06。在化学反应中硫原子容易得到电子,形成带负电荷的硫离子。
5.(1)水电解生成氢气和氧气 (2)质子数不同 (3)31
【解析】(1)能够证明“水不是元素”的实验事实为:水电解生成氢气和氧气;
(2)元素是具有相同核电荷数的同一类原子的统称,而质子数等于核电荷数,所以区别是否是同种元素的关键是质子数。我认为它的依据是:质子数不同;
(3)在元素周期表中,元素名称左上角的数字为该元素的原子序数,因此表格中元素锗的原子序数为32,那么它左边的元素原子的原子序数为:32-1=31。因为质子数=原子序数,所以空白格处原子的质子数为31。
6.(1)金属;失去(2)AlCl3(3)稳定(4)10
【解析】(1)如果元素名称中含有金字旁,则为金属元素;否则,为非金属元素。最外层电子数少于4的,容易失去电子;最外层电子数多余4的,容易得到电子。
(2)首先确定两种元素的名称,再确定组成化合物的名称和化学式;
(3)稀有气体的最外层电子数为2或8,已经达到最大状态,则化学性质比较稳定。
(4)根据化学式,首先计算出质子数和中子数的总和,再计算出质子数的总和,最后二者相减即可。
【解答】(1)第3号元素为锂,含有金字旁,为金属元素。它的最外层电子数为1,容易失去电子。
(2)第13号元素为Al,最外层电子数为3,容易失去3个电子带三个单位的正电荷;第17号元素为Cl,最外层电子数为7,容易得到一个电子带一个单位的负电荷,根据电荷守恒得到化学式为:AlCl3。
(3)每一周期结尾的是稀有气体元素,它们的化学性质稳定;
(4)一个 2H216O 分子所含的质子数和中子数之和为:2×2+16=20;
它的质子数之和为:1×2+8×1=10; 则所含中子数为:20-10=10。
7.(1)6
(2)质子数(或核电荷数)
(3)都具有两个电子层(或电子层数都为两层;电子层数相同)
(4)4HF+SiO2=SiF4↑+2H2O
【解析】(1)在原子中,原子核所带的正电荷数等于核外电子所在的负电荷数;
(2)元素是具有相同核电荷数(质子数)的同一类原子的统称;
(3)根据表格,比较这些原子的电子层数之间的关系;
(4)确定反应物、反应条件和生成物,据此写出反应的方程式。
【解答】(1)根据表格可知,氧原子的质子数为8,则最外层电子数为:8-2=6;
(2)表中不同种元素最本质的区别是原子中质子数(或核电荷数)不同.
(3)上述元素在周期表中处于同一周期原因是:都具有两个电子层(或电子层数都为两层;电子层数相同)。
(4)氢氟酸与二氧化硅反应,生成四氯化硅和水,反应的方程式为: 4HF+SiO2=SiF4↑+2H2O 。
浙教版寒假“快人一步”八(下)科学讲义(十二)
表示元素的符号
(一)元素符号的写法
元素符号是国际上统-采用的符号,通常用该元素拉丁文的第一个字母大写来表示。当两种元素的第1个字母相同时,则再附上一个小写字母作为该元素符号,以示区别,即由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写。如Ne (氖)、Na (钠)、Cu (铜)、Ca(钙)等。元素符号书写口诀:一大二小。
(二)常见元素的元素符号
(三)元素符号表示的意义
(1)宏观上:表示一种元素,如“N”表示氮元素,“O”表示氧元素。每种元素只能有一种元素符号 。
(2)微观上:表示这种元素的1个原子, 如“N”表示1个氮原子,“O”表示1个氧原子。
(3)如果物质直接由原子构成,则该元素符号还表示一种物质,如“Fe”表示铁这种物质。
【能力拓展】若元素符号前面有数字,则只能表示该元素的几个原子(即只有微观含义,不再表示一种元素)。如“3H”只能表示3个氢原子,“6Fe”只能表示6个铁原子。
二、元素周期表
为了便于研究元素的性质和用途,科学家把人们已知的110多种元素按核电荷数科学有序地排列起来,这样就得到了元素周期表。在元素周期表中,用不同的颜色对金属元素、非金属元素做了区分。
(一)编排结构
(1)横行(周期)
元素周期表每一横行代表一个周期,共有7个横行,表示7个周期,同一周期从左到右,原子的质子数逐渐增加。每个周期开头的是金属元素(第一周期除外),靠近尾部的是非金属元素,结尾的是稀有气体元素,这正是“周期性”的具体表现。
(2)纵列(族)
元素周期表每个纵列叫做一个族,共有18个纵列,16个族(其中8、9、10三个纵列共同组成一个族),同族元素的化学性质相似。
(3)每一格
在元素周期表中,每一种元素均占据一格,每格均包括元素的原子序数元素符号、元素名称、相对原子质量等内容。其中,对于原子而言:原子序数=核电荷数=质子数=核外电子数。
(4)从元素周期表中可获得的信息
①根据元素所处的位置可知该元素原子的质子数(核电荷数)、核外电子数、元素的化学性质等。
②从元素周期表的排列可知元素单质的物理状态;元素是人工合成的还是自然存在的;元素是金属元素、非金属元素还是稀有气体元素等。
(二)元素周期表的意义
(1)它是学习和研究科学的重要工具,为寻找新元素提供理论依据。(2)由于元素周期表中位置越靠近的元素性质越相似,启发人们在元素周期表的一定区域内寻找新物质(如半导体材料、农药、催化剂等)。
【能力拓展】决定元素化学性质的是最外层电子数,同一族的元素最外层电子数相同,因此化学性质相似。
例1、科学家发现一种新元素。该元素原子核外电子数为117,中子数为174,相对原子质量为291,元素名称Ununseptium,符号Uus。请模仿图甲,将该元素对应信息编写到图乙中相应位置,则“①"处应填( )
A.291 B.174 C.117 D.57
例2、维生素B12是人体不可或缺的物质,其中所含的元素钴,也能促使血红蛋白合成及红细胞数目的增加。已知钴是第27号元素,常见化合价为+2和+3。以下关于这种元素认识正确的是( )
A.钴元素属于非金属元素
B.符号Co同时可以表示一氧化碳
C.一个Co3+中含有24个电子
D.用放大镜能观察到元素钴促进红细胞增加的过程
例3、如表是元素周期表的一部分,请回答下列问题
(1)周期表中的①②③代表三种不同的元素,③是 元素(填名称),属于非金属的是 ,属于同一周期的元素是 (填序号)。
(2)氕、氘、氚都属于表中的氢元素,原因是其原子的 相同,但 不同。
(3)最近,科学家用大量高速钙原子轰击锫原子,形成了核电核数为117的元素的原子,该原子的核外电子数是 。
例4、如图所示是1-18号元素中某些元素的部分化合价,回答下列问题。
1 H 2He
3Li 4Be 5B 6C 7N 8O 9F 10Ne
11Na+1 12Mg+2 13Al+3 14 Si+4 -4 15P 16S+6 -2 17Cl 18Ar
(1)3号元素属于 (选填“金属元素”或“非金属元素”)。
(2)13号元素与8号元素组成的化合物为 (填化学式)。
1.下列关于符号“K”所表示的意义,正确的是( )
①钾元素 ②钾的原子核 ③一个钾元素 ④一个钾原子 ⑤金属钾
A.①②⑤ B.②③④⑤ C.①④⑤ D.①③④⑤
2.溴元素的原子结构示意图及其在周期表中的信息如图所示,下列说法正确的是( )
A.n=7 B.该元素为金属元素
C.相对原子质量和中子数均为35g D.原子序数、核电荷数、质子数均为79.90
3.法国里昂的科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。它与天体中的中子星构成类似。有关该粒子的说法不正确的是( )
A.不显电性 B.相当于一个氦(He)原子的质量
C.失去一个中子后也不显电性D.在周期表中与氢元素占同一位置
4.2019年是元素周期表诞生第150周年。下表是元素周期表的一部分,从表中不能获取的信息是( )
A.元素在周期表中的位置 B.原子的质子数
C.元素的相对原子质量 D.原子的中子数
5.写出下列化学符号:
(1)碳酸钠 ; (2)氩气 ;
(3)n个亚铁离子 ; (4)2个氢分子 。
6.下面是钠元素和氯元素在元素周期表中的信息和3种粒子的结构示意图。请回答下列问题:
(1)氯原子的核电荷数是 ;相对原子质量为 。
(2)钠原子与氯原子的最本质区别是 。
(3)在钠和氯气的反应中,得到电子的是 原子;Na+的结构示意图是 (填字母)。
7.在“宏观﹣微观﹣符号”之间建立联系,是学习化学的一种重要思维方式。如图是元素周期表中部分元素的原子结构模型图,根据所学知识回答下列问题.
(1)A属于 元素(填元素种类);
(2)D原子与钠发生化学反应时易 (填“得到”或“失去”)电子;
(3)由B元素和D元素组成的化合物的化学式为 ;
(4)E粒子带1个单位正电荷,则该粒子的符号为 ;
(5)F为元素周期表的一部分,X、Y、Z代表三种不同元素,以下判断正确的是 .
A.原子序数Z>Y B.核外电子数:X=Y C.Y和Z的化学性质相似
1.氕、氘、氚三种原子在元素周期表中( )
A.同占一个位置 B.占三个位置 C.不占位置 D.只有氕占位置
2.元素周期表是学习和研究化学的重要工具。如表是元素周期表的一部分,A~F代表六种不同短周期元素。下列说法中不正确的是( )
A.原子序数:E
(1)N: .
(2)n个二氧化碳分子: .
(3)4个硫酸根离子: .
(4)铝离子: .
(5)氧化铁中铁元素为+3价 .
4.元素周期表是学习和研究化学的一种重要工具。如图是元素周 期表的一部分。请回答下列问题:
(1)如图中的元素都属于 (填“金属”或“非金属”)元素。
(2)在周期表中查找硫元素,知道硫元素的原子序数是 16, 它的相对原子质量为 。在化学反应中硫原子容易得到电子,形成带 (填“正电荷”或“负电荷”)的硫离子。
5.化学元素组成万物。人们很早就意识到物质都是由几种亘古不变的基本成分——“元素"组成的。
(1)古人曾认为水是组成物质的元素之一。在你学过的知识中能说明“水不是元素“的实验事实是 。
(2)现代化学对“元素"做了科学定义,图甲是两个微粒的结构模型示意图,小科认为这两个微粒不属于同种元素,你认为他的依据是 。
(3)1869年,俄国化学家门捷列夫在前人研究的基础上制作出第一张元素周期表,图乙是元素周期表的部分内容,表中空白格处元素原子的质子数为 。
6.元素周期表是学习科学的重要工具。下表是元素周期表的一部分,请回答下列问题:
(1)第3号元素属于 (填“金属”或“非金属”)元素,它在化学反应中容易 (填“得到”或“失去”)电子;
(2)第13号元素和第17号元素组成化合物的化学式是 ;
(3)每一周期结尾的是稀有气体元素,它们的化学性质 (填“活泼”或“稳定”);
(4)一个2H216O分子所含的中子数为 (元素符号左上角的数字代表该原子中质子数和中子数之和)
7.在元素周期表中,每一横行被称为一个周期.下表为元素周期表中某一周期元素的原子结构示意图.
(1)表中氧原子最外层电子数x= .
(2)表中不同种元素最本质的区别是原子中 不同.
(3)上述元素在周期表中处于同一周期的原因是 .
(4)氟元素和氢元素形成的化合物的水溶液氢氟酸(HF),可用于玻璃雕刻,其主要原因是氢氟酸与玻璃的主要成分二氧化硅(SiO2)发生反应,生成四氟化硅(SiF4)气体和水,该反应的化学方程式为 .
答案及解析
例1、C
【解析】根据对元素周期表的认识和理解分析解答。
【解答】在元素周期表中,中间的汉字为元素名称,左上角的数字为质子数,右上角的字母为元素符号,正下方的数值为相对原子质量,则①应该为质子数,等于核外电子数117;②为元素名称,即Uus;③为相对原子质量,即238,故C正确,而A、B、D错误。
例2、C
【解析】根据名称还“钅”的为金属元素、阳离子是原子失电子形成及构成物质的粒子很小分析。
【解答】A、 钴元素属于金属元素 ,不符合题意;
B、 符号Co表示钴元素,一氧化碳表示为CO ,不符合题意;
C、 一个Co3+中质子数为27,其原子失去了3个电子,所以含有24个电子 ,符合题意;
D、钴原子很少,不能观察到,不符合题意;
例3、(1)镁;②;①② (2)质子数;中子数 (3)117
【解析】(1)在元素周期表中,每行中,从左到右,质子数逐次加1;当最外层电子数达到8后,再开始下面一行的排列。一般情况下,元素名称中有金字旁的为金属元素。在同一行的元素,处在同一周期。 (2)具有相同的质子数和不同中子数的原子叫同位素原子;
(3)根据在原子中,质子数=核电荷数=核外电子数=原子序数解答。
【解答】(1)根据元素周期表中的元素排序,①号元素是锂元素,②号元素是氟元素,③号元素是镁元素,其中①③名字中含有金字旁,是金属元素,②是非金属元素;①②在同一行,位于同一周期。
(2)元素是指据有相同质子数(或核电荷数)的同一类原子的总称,因此氕、氘、氚的质子数相同,中子数不同;
(3)在原子中,质子数=核电荷数=核外电子数,则原子的核外电子数是117。
例4、(1)金属元素(2)Al2O3
【解析】由元素的中文汉字偏旁部首来确定物质是金属还是非金属,以及物质的常见物理状态。
(1)3号元素为锂元素,金子旁为金属元素。
(2)13号元素为铝,8号元素为氧,组成物质为氧化铝。
1.C
【解析】“K”可以表示钾元素,也可以表示一个钾原子,还能表示金属钾这种物质,即①④⑤正确,故C符合题意,而A、B、D不合题意。
2.A
【解析】(1)在原子中,质子数=核外电子数;
(2)一般情况下,如果元素名称中含有金字旁,则为金属元素;
(3)(4)在元素周期表中,中间的汉字为元素名称,左上角的数字为质子数,右上角的字母为元素符号,正下方的数值为相对原子质量。
【解答】A.根据质子数=核外电子数得到:35=2+8+18+n,则n=7,故A正确;
B.元素名称为溴,不含金字旁,不是金属元素,故B错误;
C.相对原子质量为79.9,中子数为:79.9-38=34.9,故C错误;
D.原子序数=质子数=核电荷数=35,故D错误。
3.D
【解析】A、中子呈中性, 只由四个中子构成的粒子也呈中性,不符合题意;
B、 氦的相对原子质量为4,该粒子的相对原子质量也为4,所以质量当于一个氦原子的质量,不符合题意;
C、 中子呈中性,失去一个中子后也不显电性 ,不符合题意;
D、 该元素为零号元素,在周期表中与氢元素不占同一位置 ,符合题意;
4.D
【解析】A.根据元素周期表,我们可以知道它处于哪个周期和哪个族,故A正确不合题意;
在每个方格中,中间的汉字为元素名称,右上角的字母为元素符号,左上角的数字为质子数,正下方的数值为相对原子质量,故B、C正确不合题意;
元素周期表不能直接反映原子的中子数,故D错误符合题意。
5.(1)Na2CO3 (2)Ar (3)nFe2+ (4)2H2
【解析】(1)(2)根据物质的名称确定组成分子的原子种类和个数,然后写出对应的化学式;
(3)离子的写法:元素符号的右上角写上数字和正负号,表示所带的电荷数和电性,前面的数字表示原子团的个数;
(4)如果气体由双原子分子构成,那么可以用元素符号,并在右下角加上数字2表示;如果为单原子分子,直接用元素符号表示。
【解答】(1)碳酸钠分子有两个钠离子和一个碳酸根离子构成,写作: Na2CO3 ;
(2)氩气是单原子分子,用它的元素符号表示,写作:Ar;
(3)亚铁离子带两个单位的正电荷,在它的元素符号右上角写上2和“+”,在最前面写n表示亚铁离子的个数,即nFe2+;
(2)氢分子为双原子分子,在氢元素符号的右下角写2表示氢分子,最后在最前面写2表示氢分子的个数,即2H2。
6.(1)17;35.5(2)质子数不同(3)氯;A
【解析】(1)在元素周期表中,中间的汉字为元素名称,右上角的字母是元素的符号,左上角的数字是元素的质子数,正下方的数值是元素的相对原子质量;
(2)元素是具有相同核电荷数的同一类原子的统称,元素不同,核电荷数不同,即质子数不同;
(3)原子的最外层电子多余4个时,容易得到电子带负电荷;最外层电子小于4个时,容易失去电子带正电荷,据此分析判断。
【解答】(1)根据第二个图可知,氯原子的核电荷数是17;相对原子质量为35.5。
(2)钠原子与氯原子的最本质区别是:质子数不同;
(3)在钠和氯气的反应中,氯原子的最外层电子数为7,很容易得到一个电子形成带一个负电荷的氯离子。Na原子的最外层电子数为1,很容易失去这个电子形成带一个单位正电荷的钠离子,即图,
7.(1)非金属(2)得到(3)MgCl2(4)Na+(5)A
【解析】(1)根据原子序数确定元素名称,根据名称中是否有金字旁判断它是否属于金属元素;
(2)最外层电子数大于4的容易得到电子,小于4的容易失去电子;
(3)根据质子数确定元素种类,然后写出对应的化学式;
(4)失去电子带正电荷,据此确定E原子的电子数,进而确定质子数,从而确定元素种类,并写出离子符号;
(5)①在元素周期表中,在每一行中,右边的元素比左边元素的原子序数大;在每一列中,下边的元素比上边的元素原子序数大;
②核外电子数=原子序数=质子数;
③在每一列中,具有相同的最外层电子数,因此具有相同的化学性质。
【解答】(1)A的质子数为14,那么它为硅元素,由于不含有金字旁,所以属于非金属元素;
(2)D原子的最外层电子数为7>4,因此与钠反应时容易得到电子;
(3)B的质子数为12,则为镁元素;D的质子数为17,则为氯元素,二者组成的化合物为氯化镁,化学式为MgCl2。
(4)E带1个单位的正电荷,那么E原子的核外电子数为:10+1=11,那么E为钠元素,则带一个单位正电荷的钠离子写作Na+。
(5)A.Y和Z在同一行,且Z在右边,因此原子序数Z>Y,故A正确;
B.X和Y在同一列,因此具有相同的最外层电子数,但是Y比X多一个电子层,因此二者的核外电子数肯定不同,故B错误;
C.Y和Z在同一行,最外层电子数不同,那么它们的化学性质不同,故C错误。
1.A
【解析】氕、氘、氚三种原子,具有相同的质子数和不同的中子数,因此三者的原子序数相同,因此在周期表中占据同一位置,故A正确,而B、C、D错误。
2.A
【解析】在元素周期表中,将具有相同电子层数的原子,按照原子半径从小到大的顺序依次排列成一行,称为一个周期。将最外层电子数相同的原子,按照原子半径从上到下依次增大的顺序排成一列,称为一个主族,据此分析判断。
【解答】A.根据图片可知,E在C的下面一个周期,则E的原子序数肯定大于C,故A错误符合题意;
B.A、D在同一列,肯定同族,故B正确不合题意;
C.AB在同一行,肯定为同一周期;A在B的左侧,则原子序数A
3.(1)一个氮原子 (2)nCO2 (3) (4) (5)
【解析】(1)元素符号的含义:①元素;①一个原子;
(2)根据物质的名称确定所含原子的种类和个数,据此写出分子的化学式,然后在分子符号前面加数字表示分子的个数;
(3)(4)原子团的右上角写上数字和正负号,表示所带的电荷数和电性,前面的数字表示原子团的个数
(5)在化学式中元素符号的正上方写上正负号和数字,表示该元素的化合价。
【解答】(1)N代表一个氮原子;
(2)n个二氧化碳分子写作:nCO2;
(3)4个硫酸根离子写作: ;
(4)铝离子写作 ;
(5)氧化铁中铁元素为+3价,写作: 。
4.(1)非金属(2)32.06;负电荷
【解析】(1)一般情况下,元素名称中含有金字旁的为金属元素,否则为非金属元素;
(2)在元素周期表中,中间的汉字为元素名称,左上角的数字为原子序数,右上角的字母为元素符号,正下方的数值为相对原子质量。得到电子,带负电荷;失去电子,带正电荷,据此分析解答。
【解答】(1)根据图片可知,图片中的五种元素名字中都没有金字旁,则都属于非金属元素。
(2)在周期表中查找硫元素,知道硫元素的原子序数是 16, 它的相对原子质量为32.06。在化学反应中硫原子容易得到电子,形成带负电荷的硫离子。
5.(1)水电解生成氢气和氧气 (2)质子数不同 (3)31
【解析】(1)能够证明“水不是元素”的实验事实为:水电解生成氢气和氧气;
(2)元素是具有相同核电荷数的同一类原子的统称,而质子数等于核电荷数,所以区别是否是同种元素的关键是质子数。我认为它的依据是:质子数不同;
(3)在元素周期表中,元素名称左上角的数字为该元素的原子序数,因此表格中元素锗的原子序数为32,那么它左边的元素原子的原子序数为:32-1=31。因为质子数=原子序数,所以空白格处原子的质子数为31。
6.(1)金属;失去(2)AlCl3(3)稳定(4)10
【解析】(1)如果元素名称中含有金字旁,则为金属元素;否则,为非金属元素。最外层电子数少于4的,容易失去电子;最外层电子数多余4的,容易得到电子。
(2)首先确定两种元素的名称,再确定组成化合物的名称和化学式;
(3)稀有气体的最外层电子数为2或8,已经达到最大状态,则化学性质比较稳定。
(4)根据化学式,首先计算出质子数和中子数的总和,再计算出质子数的总和,最后二者相减即可。
【解答】(1)第3号元素为锂,含有金字旁,为金属元素。它的最外层电子数为1,容易失去电子。
(2)第13号元素为Al,最外层电子数为3,容易失去3个电子带三个单位的正电荷;第17号元素为Cl,最外层电子数为7,容易得到一个电子带一个单位的负电荷,根据电荷守恒得到化学式为:AlCl3。
(3)每一周期结尾的是稀有气体元素,它们的化学性质稳定;
(4)一个 2H216O 分子所含的质子数和中子数之和为:2×2+16=20;
它的质子数之和为:1×2+8×1=10; 则所含中子数为:20-10=10。
7.(1)6
(2)质子数(或核电荷数)
(3)都具有两个电子层(或电子层数都为两层;电子层数相同)
(4)4HF+SiO2=SiF4↑+2H2O
【解析】(1)在原子中,原子核所带的正电荷数等于核外电子所在的负电荷数;
(2)元素是具有相同核电荷数(质子数)的同一类原子的统称;
(3)根据表格,比较这些原子的电子层数之间的关系;
(4)确定反应物、反应条件和生成物,据此写出反应的方程式。
【解答】(1)根据表格可知,氧原子的质子数为8,则最外层电子数为:8-2=6;
(2)表中不同种元素最本质的区别是原子中质子数(或核电荷数)不同.
(3)上述元素在周期表中处于同一周期原因是:都具有两个电子层(或电子层数都为两层;电子层数相同)。
(4)氢氟酸与二氧化硅反应,生成四氯化硅和水,反应的方程式为: 4HF+SiO2=SiF4↑+2H2O 。
浙教版寒假“快人一步”八(下)科学讲义(十二)
表示元素的符号
同课章节目录
