2022-2023学年化学人教版 第八单元 金属和金属材料 单元练习 (含答案)
文档属性
| 名称 | 2022-2023学年化学人教版 第八单元 金属和金属材料 单元练习 (含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 689.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-08 16:38:53 | ||
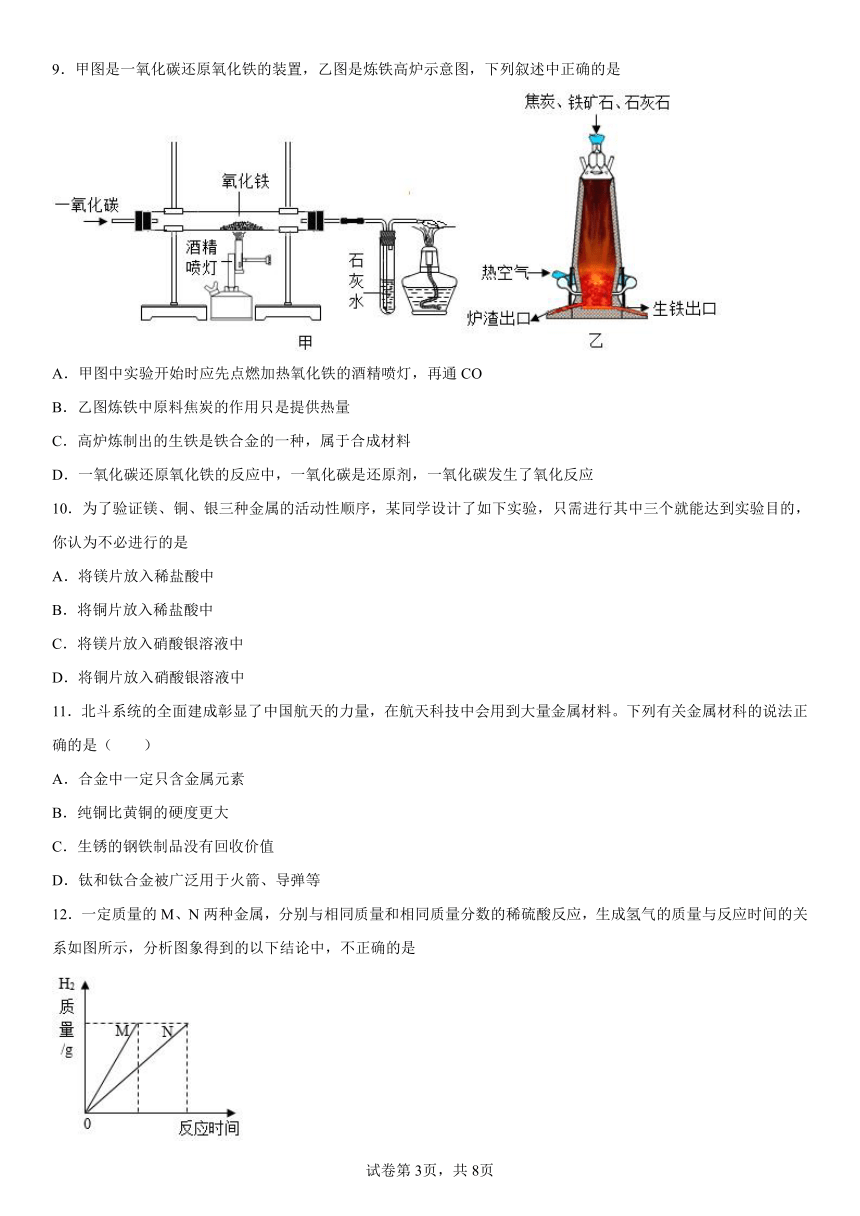
图片预览




文档简介
2022-2023学年化学人教版--金属和金属材料
一、单选题
1.利用甲酸( HCOOH)与浓硫酸制备CO,并用如下实验装置验证CO的有关性质。已知: ,下列说法不正确的是
A.操作时,先点燃乙处酒精灯,再滴加 HCOOH
B.装置丙的作用是防止倒吸
C.装置丁既可检验CO2,又可收集CO
D.随着反应进行,浓硫酸浓度降低,产生CO气体速率减小
2.5月15日,中国天问一号探测器成功着陆火星。火星上有峡谷山群、尘埃风暴,昼夜温差较大。安全着陆无需考虑的因素是
A.火星地形地貌 B.探测器金属硬度 C.火星岩石成分 D.探测器外壳熔点
3.下列图示实验中能明显观察到发生化学变化的是
A. B.
C. D.
4.为验证Mg、Cu、Sn的金属活动性顺序,不可选用的一组物质是
A.MgCl2溶液、Cu、Sn
B.Mg、Cu、SnCl2溶液
C.Mg、Sn、Cu、盐酸
D.MgCl2溶液、Sn、CuCl2溶液
5.坚持低碳生活、绿色发展,促进人与自然和谐共生,下列做法与这一理念不相符的是
A.限制燃放烟花 B.发展燃煤发电 C.分类处理垃圾 D.倡导公交出行
6.金属M与AgNO3溶液发生反应:,下列说法中正确的是
A.在金属活动性顺序里,M一定排在氢的前面
B.M的金属活动性比Ag弱
C.M可能是铝
D.反应前后M元素的化合价发生了改变
7.硬铝常用于制造火箭、飞机的外壳,铝元素的相关信息如图所示,下列说法正确的是
A.铝元素的相对原子质量为13 B.Al2O3中Al为+2价
C.硬铝的强度和硬度比铝的大 D.铝是地壳中含量最多的元素
8.下图是探究铁钉锈蚀条件的4个实验,一段时间后观察现象。下列说法不正确的是
A.①中甲、乙、丙三处比较,生锈最明显的地方是甲
B.①②对比说明铁生锈需要空气,①③对比说明铁生锈需要水
C.③中附着在棉花上的氯化钙的作用是作干燥剂
D.四个实验中,生锈最快的是④中的铁钉
9.甲图是一氧化碳还原氧化铁的装置,乙图是炼铁高炉示意图,下列叙述中正确的是
A.甲图中实验开始时应先点燃加热氧化铁的酒精喷灯,再通CO
B.乙图炼铁中原料焦炭的作用只是提供热量
C.高炉炼制出的生铁是铁合金的一种,属于合成材料
D.一氧化碳还原氧化铁的反应中,一氧化碳是还原剂,一氧化碳发生了氧化反应
10.为了验证镁、铜、银三种金属的活动性顺序,某同学设计了如下实验,只需进行其中三个就能达到实验目的,你认为不必进行的是
A.将镁片放入稀盐酸中
B.将铜片放入稀盐酸中
C.将镁片放入硝酸银溶液中
D.将铜片放入硝酸银溶液中
11.北斗系统的全面建成彰显了中国航天的力量,在航天科技中会用到大量金属材料。下列有关金属材科的说法正确的是( )
A.合金中一定只含金属元素
B.纯铜比黄铜的硬度更大
C.生锈的钢铁制品没有回收价值
D.钛和钛合金被广泛用于火箭、导弹等
12.一定质量的M、N两种金属,分别与相同质量和相同质量分数的稀硫酸反应,生成氢气的质量与反应时间的关系如图所示,分析图象得到的以下结论中,不正确的是
A.两种金属的活动性:M>N
B.两种金属生成氢气的质量:M=N
C.两种金属消耗稀硫酸的质量:M=N
D.充分反应后,得到溶液的质量:M=N
13.下列有关金属资源的利用与防护解释不合理的是
A.在001A型国产航母金属外壳覆盖涂料,主要是为了美观
B.用“烤蓝”的方法处理钢铁表面,可减缓钢铁的腐蚀
C.用铝合金制造国产大飞机C919机壳,是利用铝合金强度大、质量轻、抗腐蚀
D.切菜后的菜刀用清水洗净擦干,可减缓菜刀生锈
14.下列化学方程式正确的是
A.点燃天然气:CH4+2O22H2O+CO2↑
B.铁粉溶于稀盐酸:2Fe+6HCl═2FeCl3+3H2↑
C.硫在空气中燃烧:S+O2SO2
D.高炉炼铁:Fe2O3+CO2Fe+CO2
15.若研究温度对食盐溶解快慢的影响,在图中应选用哪两个装置进行对照实验( )
A.甲和乙 B.乙和丙 C.甲和丙 D.丙和丁
二、填空题
16.我国首艘国产航母已经开始海试,制造航母使用了大量的金属材料。
(1)金属材料包括纯金属以及它们的_____。
(2)航母的航电系统使用铜作导线,利用了铜的延展性和_____性。
(3)制造航母使用锰钢而不用纯铁,是因为锰钢比纯铁_____。
(4)航母外壳用涂料覆盖是为了防止其与_____接触而锈蚀。
(5)为了探究航母材料中锌、铁、铜三种金属的活动性顺序,除Fe和ZnSO4溶液外,还需选用的试剂是_____。
17.《天工开物》中记载了采矿和冶炼金属锡的场景。
(1)采矿(图1) “水锡……其质黑色……愈经淘取”。水中淘取锡砂(指锡矿石)时,所用容器的孔径需_____(选填“大于”或“小于”)锡砂颗粒大小。锡砂主要成分为SnO2,_____(选填“易”或“难)溶于水。
(2)治炼(图2) “凡煎炼亦用洪炉,入砂数百斤,丛架木炭亦数百斤,鼓鞴(指鼓入空气)熔化。”
①鼓入足量空气能使木炭_______从而提高炉温。
②炼锡时,有关键的一步“点铅勾锡”,即加铅能使锡较易熔化流出,其原因是________。
(3)使用
①锡往往与其它金属制成合金使用,目的是_______(选填 “增大”或“减小”)硬度。
②古代锡器常用来饮酒喝茶,很少装酸性物质,原因是___________。
18.2018年世界权威期刊《自然》,连刊两文报道石墨烯超导重大发现,论文的第一作者是四川成都籍中科大年轻博士曹原。下面让我们一起重走“超导材料”发现的神奇之路。请回答相关问题。
(1)1911年荷兰物理学家海克·卡莫林·昂内斯经过无数次实验确认,汞在温度接近-273℃时几乎处于“零电阻状态”,称之为“超导电性”。汞属于_________元素(填“金属”或“非金属”),其导电的原因是含有自由移动的_________。
(2)1980年有人发现了铜氧化合物的“超导电性”,将温度提高到约为-140℃。YBa2Cu3O5为其代表之一,其中Cu为+1价,O为-2价,则Y为_________价。
(3)2017年曹原团队发现了石墨烯中的非规“超导电性”,石墨烯是一层碳原子(如图,黑球代表碳原子)。
①曹原推测,当两层石墨烯叠在一起,若彼此之间发生轻微偏移时,有可能产生超导现象,经过不懈努力,困扰世界107年的常温超导难题,终于被曹原团队突破!石墨烯属于___________(填“单质”或“化合物”),两层石墨烯叠在一起轻微偏移时发生的是__________变化(填“物理”或“化学”)。
②曹原小时候就喜欢动手研究,在家里弄了个实验室,曾经把银放入稀硝酸中,自己“合成”实验所需硝酸银。该实验是否产生了氢气?_________(填“是”或“否”),原因是_________。我们坚信未来的中国,必定有十个、百个乃至成千上万个“曹原”,用自己的科技之梦去推动中华民族的伟大复兴。
19.金属具有广泛的应用。
(1)下列金属制品中,利用金属导热性的是________(填字母)。
(2)波尔多液是一种农业上常用的杀菌剂,它由硫酸铜、生石灰加水配制而成,不能用铁质容器配制波尔多液的原因是__________________________________________(用化学方程式表示)。
(3)防止金属锈蚀是保护金属资源的有效途径之一。洁净的铁钉在下列情况下容易生锈的是________(填字母)。
A.在干燥的空气中
B.在潮湿的空气中
C.浸没在植物油中
(4)铝具有良好的抗腐蚀性能,原因是铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化。氧化铝难溶于水,却能溶于酸。写出氧化铝与稀硫酸反应生成硫酸铝和水的化学方程式:____________________________________________。
(5)向铁粉和氧化铜粉末的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,得滤渣和滤液,向滤液中加一洁净铁片,未看到铁片有任何变化。则滤液中含有的溶质是______________(填化学式,下同),滤渣中一定含有的物质是__________。
20.金属材料在国防建设中起着重要的作用。如图为歼﹣15战斗机在辽宁舰上起飞。
(1)铝合金用于制造飞机的外壳,铝合金材质的主要优点是 _____ 、 _____ 。
(2)改装前的辽宁舰舰身锈迹斑斑,钢铁的锈蚀主要是铁与空气中的 _____ 共同作用的结果。
三、实验题
21.利用铁粉、炭粉、氯化钠进行铁的锈蚀实验,实验装置如图所示。
(1)铁的锈蚀是______反应(选填“吸热”或“放热”)。
(2)氯化钠的作用是______。
22.认识金属的性质。如图是关于金属的几个实验。
(1)实验一中能证明铁生锈与水有关的现象是______。铁在潮湿的空气中会生锈,而在纯氧中可以燃烧,其燃烧的化学方程式为______。
(2)实验二是先向试管中加入一小段打磨过的镁条,然后加入______,待反应停止后再向试管中加入铜片,发现铜片表面没有变化,由此可证明活动性顺序是Mg>H>Cu。
四、计算题
23.某铁矿粉,主要成分为铁的氧化物(FeXOy),一学生利用实验作进一步分析,过程及数据如下。(注:铁矿粉中杂质不参与下列过程中的反应)
Ⅰ.取30g该铁矿粉在CO气流中充分加热,将反应后的气体用烧碱溶液充分吸收,烧碱溶液增重17.6g
Ⅱ.将上述加热后的固体取出后,再向固体逐滴加入稀硫酸,测得产生气体与滴入稀硫酸的质量关系如图:
通过计算回答下列问题:
(1)30g铁矿粉所含铁的氧化物中,铁元素的质量为______g,氧元素的质量为______g。
(2)该铁的氧化物化学式中,x、y的最简整数比x:y=______。
24.用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?_______
25.白铜(Cu-Ni)是工业上常用的一种合金,金属镍(Ni)的金属活泼性与铁相似,且化合价显+2价。为测定20g某白铜样品中镍的质量,设计了如下实验:
试问:(1)将白铜研碎的目的是 。
(2)白铜样品中镍的质量 g。
(3)所用稀硫酸中溶质的质量分数?试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.C
4.A
5.B
6.D
7.C
8.A
9.D
10.C
11.D
12.D
13.A
14.C
15.C
16. 合金 导电 硬度大 水和氧气 硫酸铜
17.(1) 小于 难
(2) 完全燃烧 形成合金熔点降低
(3) 增大 锡器会与酸性物质反应
18.(1) 金属 电子
(2)+3
(3) 单质 物理 否 银的金属活动性弱于氢
19. C Fe+CuSO4=FeSO4+Cu B
Al2O3+3H2SO4=Al2(SO4)3+3H2O FeSO4 Cu
20. 密度小; 抗腐蚀性强; 氧气和水。
21.(1)放热
(2)加快铁生锈
22.(1) 试管①中铁钉不生锈,试管③中铁钉生锈
(2)足量的稀盐酸(或稀硫酸)
23. 16.8 6.4 3:4
24.583t
25.(1)增大白铜与稀硫酸的接触面积,使反应更快、更充分(2)2.95(3)9.8%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.利用甲酸( HCOOH)与浓硫酸制备CO,并用如下实验装置验证CO的有关性质。已知: ,下列说法不正确的是
A.操作时,先点燃乙处酒精灯,再滴加 HCOOH
B.装置丙的作用是防止倒吸
C.装置丁既可检验CO2,又可收集CO
D.随着反应进行,浓硫酸浓度降低,产生CO气体速率减小
2.5月15日,中国天问一号探测器成功着陆火星。火星上有峡谷山群、尘埃风暴,昼夜温差较大。安全着陆无需考虑的因素是
A.火星地形地貌 B.探测器金属硬度 C.火星岩石成分 D.探测器外壳熔点
3.下列图示实验中能明显观察到发生化学变化的是
A. B.
C. D.
4.为验证Mg、Cu、Sn的金属活动性顺序,不可选用的一组物质是
A.MgCl2溶液、Cu、Sn
B.Mg、Cu、SnCl2溶液
C.Mg、Sn、Cu、盐酸
D.MgCl2溶液、Sn、CuCl2溶液
5.坚持低碳生活、绿色发展,促进人与自然和谐共生,下列做法与这一理念不相符的是
A.限制燃放烟花 B.发展燃煤发电 C.分类处理垃圾 D.倡导公交出行
6.金属M与AgNO3溶液发生反应:,下列说法中正确的是
A.在金属活动性顺序里,M一定排在氢的前面
B.M的金属活动性比Ag弱
C.M可能是铝
D.反应前后M元素的化合价发生了改变
7.硬铝常用于制造火箭、飞机的外壳,铝元素的相关信息如图所示,下列说法正确的是
A.铝元素的相对原子质量为13 B.Al2O3中Al为+2价
C.硬铝的强度和硬度比铝的大 D.铝是地壳中含量最多的元素
8.下图是探究铁钉锈蚀条件的4个实验,一段时间后观察现象。下列说法不正确的是
A.①中甲、乙、丙三处比较,生锈最明显的地方是甲
B.①②对比说明铁生锈需要空气,①③对比说明铁生锈需要水
C.③中附着在棉花上的氯化钙的作用是作干燥剂
D.四个实验中,生锈最快的是④中的铁钉
9.甲图是一氧化碳还原氧化铁的装置,乙图是炼铁高炉示意图,下列叙述中正确的是
A.甲图中实验开始时应先点燃加热氧化铁的酒精喷灯,再通CO
B.乙图炼铁中原料焦炭的作用只是提供热量
C.高炉炼制出的生铁是铁合金的一种,属于合成材料
D.一氧化碳还原氧化铁的反应中,一氧化碳是还原剂,一氧化碳发生了氧化反应
10.为了验证镁、铜、银三种金属的活动性顺序,某同学设计了如下实验,只需进行其中三个就能达到实验目的,你认为不必进行的是
A.将镁片放入稀盐酸中
B.将铜片放入稀盐酸中
C.将镁片放入硝酸银溶液中
D.将铜片放入硝酸银溶液中
11.北斗系统的全面建成彰显了中国航天的力量,在航天科技中会用到大量金属材料。下列有关金属材科的说法正确的是( )
A.合金中一定只含金属元素
B.纯铜比黄铜的硬度更大
C.生锈的钢铁制品没有回收价值
D.钛和钛合金被广泛用于火箭、导弹等
12.一定质量的M、N两种金属,分别与相同质量和相同质量分数的稀硫酸反应,生成氢气的质量与反应时间的关系如图所示,分析图象得到的以下结论中,不正确的是
A.两种金属的活动性:M>N
B.两种金属生成氢气的质量:M=N
C.两种金属消耗稀硫酸的质量:M=N
D.充分反应后,得到溶液的质量:M=N
13.下列有关金属资源的利用与防护解释不合理的是
A.在001A型国产航母金属外壳覆盖涂料,主要是为了美观
B.用“烤蓝”的方法处理钢铁表面,可减缓钢铁的腐蚀
C.用铝合金制造国产大飞机C919机壳,是利用铝合金强度大、质量轻、抗腐蚀
D.切菜后的菜刀用清水洗净擦干,可减缓菜刀生锈
14.下列化学方程式正确的是
A.点燃天然气:CH4+2O22H2O+CO2↑
B.铁粉溶于稀盐酸:2Fe+6HCl═2FeCl3+3H2↑
C.硫在空气中燃烧:S+O2SO2
D.高炉炼铁:Fe2O3+CO2Fe+CO2
15.若研究温度对食盐溶解快慢的影响,在图中应选用哪两个装置进行对照实验( )
A.甲和乙 B.乙和丙 C.甲和丙 D.丙和丁
二、填空题
16.我国首艘国产航母已经开始海试,制造航母使用了大量的金属材料。
(1)金属材料包括纯金属以及它们的_____。
(2)航母的航电系统使用铜作导线,利用了铜的延展性和_____性。
(3)制造航母使用锰钢而不用纯铁,是因为锰钢比纯铁_____。
(4)航母外壳用涂料覆盖是为了防止其与_____接触而锈蚀。
(5)为了探究航母材料中锌、铁、铜三种金属的活动性顺序,除Fe和ZnSO4溶液外,还需选用的试剂是_____。
17.《天工开物》中记载了采矿和冶炼金属锡的场景。
(1)采矿(图1) “水锡……其质黑色……愈经淘取”。水中淘取锡砂(指锡矿石)时,所用容器的孔径需_____(选填“大于”或“小于”)锡砂颗粒大小。锡砂主要成分为SnO2,_____(选填“易”或“难)溶于水。
(2)治炼(图2) “凡煎炼亦用洪炉,入砂数百斤,丛架木炭亦数百斤,鼓鞴(指鼓入空气)熔化。”
①鼓入足量空气能使木炭_______从而提高炉温。
②炼锡时,有关键的一步“点铅勾锡”,即加铅能使锡较易熔化流出,其原因是________。
(3)使用
①锡往往与其它金属制成合金使用,目的是_______(选填 “增大”或“减小”)硬度。
②古代锡器常用来饮酒喝茶,很少装酸性物质,原因是___________。
18.2018年世界权威期刊《自然》,连刊两文报道石墨烯超导重大发现,论文的第一作者是四川成都籍中科大年轻博士曹原。下面让我们一起重走“超导材料”发现的神奇之路。请回答相关问题。
(1)1911年荷兰物理学家海克·卡莫林·昂内斯经过无数次实验确认,汞在温度接近-273℃时几乎处于“零电阻状态”,称之为“超导电性”。汞属于_________元素(填“金属”或“非金属”),其导电的原因是含有自由移动的_________。
(2)1980年有人发现了铜氧化合物的“超导电性”,将温度提高到约为-140℃。YBa2Cu3O5为其代表之一,其中Cu为+1价,O为-2价,则Y为_________价。
(3)2017年曹原团队发现了石墨烯中的非规“超导电性”,石墨烯是一层碳原子(如图,黑球代表碳原子)。
①曹原推测,当两层石墨烯叠在一起,若彼此之间发生轻微偏移时,有可能产生超导现象,经过不懈努力,困扰世界107年的常温超导难题,终于被曹原团队突破!石墨烯属于___________(填“单质”或“化合物”),两层石墨烯叠在一起轻微偏移时发生的是__________变化(填“物理”或“化学”)。
②曹原小时候就喜欢动手研究,在家里弄了个实验室,曾经把银放入稀硝酸中,自己“合成”实验所需硝酸银。该实验是否产生了氢气?_________(填“是”或“否”),原因是_________。我们坚信未来的中国,必定有十个、百个乃至成千上万个“曹原”,用自己的科技之梦去推动中华民族的伟大复兴。
19.金属具有广泛的应用。
(1)下列金属制品中,利用金属导热性的是________(填字母)。
(2)波尔多液是一种农业上常用的杀菌剂,它由硫酸铜、生石灰加水配制而成,不能用铁质容器配制波尔多液的原因是__________________________________________(用化学方程式表示)。
(3)防止金属锈蚀是保护金属资源的有效途径之一。洁净的铁钉在下列情况下容易生锈的是________(填字母)。
A.在干燥的空气中
B.在潮湿的空气中
C.浸没在植物油中
(4)铝具有良好的抗腐蚀性能,原因是铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化。氧化铝难溶于水,却能溶于酸。写出氧化铝与稀硫酸反应生成硫酸铝和水的化学方程式:____________________________________________。
(5)向铁粉和氧化铜粉末的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,得滤渣和滤液,向滤液中加一洁净铁片,未看到铁片有任何变化。则滤液中含有的溶质是______________(填化学式,下同),滤渣中一定含有的物质是__________。
20.金属材料在国防建设中起着重要的作用。如图为歼﹣15战斗机在辽宁舰上起飞。
(1)铝合金用于制造飞机的外壳,铝合金材质的主要优点是 _____ 、 _____ 。
(2)改装前的辽宁舰舰身锈迹斑斑,钢铁的锈蚀主要是铁与空气中的 _____ 共同作用的结果。
三、实验题
21.利用铁粉、炭粉、氯化钠进行铁的锈蚀实验,实验装置如图所示。
(1)铁的锈蚀是______反应(选填“吸热”或“放热”)。
(2)氯化钠的作用是______。
22.认识金属的性质。如图是关于金属的几个实验。
(1)实验一中能证明铁生锈与水有关的现象是______。铁在潮湿的空气中会生锈,而在纯氧中可以燃烧,其燃烧的化学方程式为______。
(2)实验二是先向试管中加入一小段打磨过的镁条,然后加入______,待反应停止后再向试管中加入铜片,发现铜片表面没有变化,由此可证明活动性顺序是Mg>H>Cu。
四、计算题
23.某铁矿粉,主要成分为铁的氧化物(FeXOy),一学生利用实验作进一步分析,过程及数据如下。(注:铁矿粉中杂质不参与下列过程中的反应)
Ⅰ.取30g该铁矿粉在CO气流中充分加热,将反应后的气体用烧碱溶液充分吸收,烧碱溶液增重17.6g
Ⅱ.将上述加热后的固体取出后,再向固体逐滴加入稀硫酸,测得产生气体与滴入稀硫酸的质量关系如图:
通过计算回答下列问题:
(1)30g铁矿粉所含铁的氧化物中,铁元素的质量为______g,氧元素的质量为______g。
(2)该铁的氧化物化学式中,x、y的最简整数比x:y=______。
24.用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?_______
25.白铜(Cu-Ni)是工业上常用的一种合金,金属镍(Ni)的金属活泼性与铁相似,且化合价显+2价。为测定20g某白铜样品中镍的质量,设计了如下实验:
试问:(1)将白铜研碎的目的是 。
(2)白铜样品中镍的质量 g。
(3)所用稀硫酸中溶质的质量分数?试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.C
4.A
5.B
6.D
7.C
8.A
9.D
10.C
11.D
12.D
13.A
14.C
15.C
16. 合金 导电 硬度大 水和氧气 硫酸铜
17.(1) 小于 难
(2) 完全燃烧 形成合金熔点降低
(3) 增大 锡器会与酸性物质反应
18.(1) 金属 电子
(2)+3
(3) 单质 物理 否 银的金属活动性弱于氢
19. C Fe+CuSO4=FeSO4+Cu B
Al2O3+3H2SO4=Al2(SO4)3+3H2O FeSO4 Cu
20. 密度小; 抗腐蚀性强; 氧气和水。
21.(1)放热
(2)加快铁生锈
22.(1) 试管①中铁钉不生锈,试管③中铁钉生锈
(2)足量的稀盐酸(或稀硫酸)
23. 16.8 6.4 3:4
24.583t
25.(1)增大白铜与稀硫酸的接触面积,使反应更快、更充分(2)2.95(3)9.8%
答案第1页,共2页
答案第1页,共2页
同课章节目录
