高中化学 人教版(2019)必修一 第三章 铁 金属材料 单元梳理总结 课件.pptx
文档属性
| 名称 | 高中化学 人教版(2019)必修一 第三章 铁 金属材料 单元梳理总结 课件.pptx |  | |
| 格式 | zip | ||
| 文件大小 | 30.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-14 10:25:36 | ||
图片预览



文档简介
(共16张PPT)
吴 彦
探索生产生活中的铁及其化合物
第三章 铁 金属材料
一、创设真实问题情境
如何判断这种铁的氧化物是什么 有多少
某品牌的打印机墨粉成分如下:表面改性剂、电荷调节剂、流动化剂 SiO2、炭粉、某一种铁的氧化物(占20%-30%)等。
Fe的氧化物
Fe3+或Fe2+
H+
?
二、墨粉中铁的氧化物定性检验
(说明:墨粉中其他成分与酸不反应。)
请大家用化学方法检验确定墨粉中铁的氧化物的种类。
FeO
Fe2O3
Fe3+
Fe2+
Fe(OH)3
Fe(OH)2
Fe3O4
酸溶
酸溶
酸溶
氯水
H2O2
酸性KMnO4
NaOH溶液
NaOH溶液
变红色
+3
+2
氧化物
盐
碱
是否在任何情况下用常见的盐酸和硫酸溶解氧化物都可行呢
KSCN溶液
酸性条件下KMnO4和H2O2能氧化氯离子
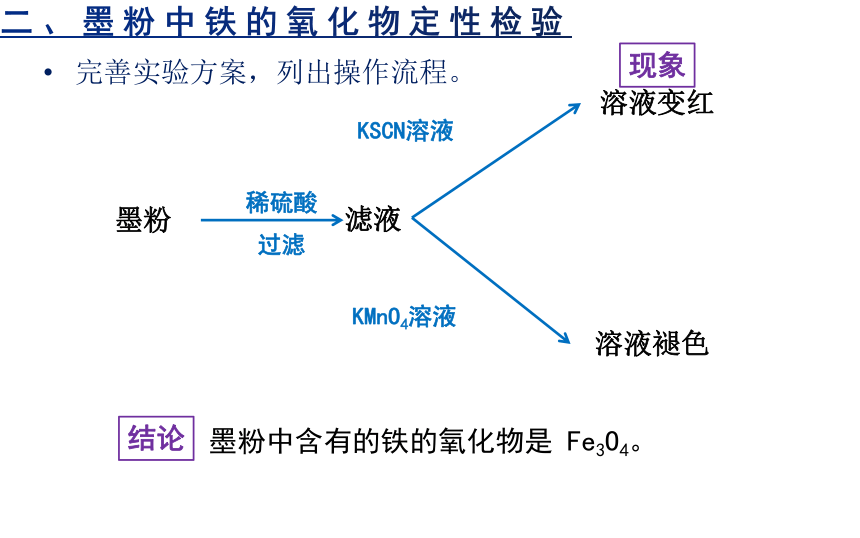
二、墨粉中铁的氧化物定性检验
完善实验方案,列出操作流程。
滤液
溶液变红
溶液褪色
墨粉
稀硫酸
KSCN溶液
KMnO4溶液
过滤
墨粉中含有的铁的氧化物是 Fe3O4。
现象
结论
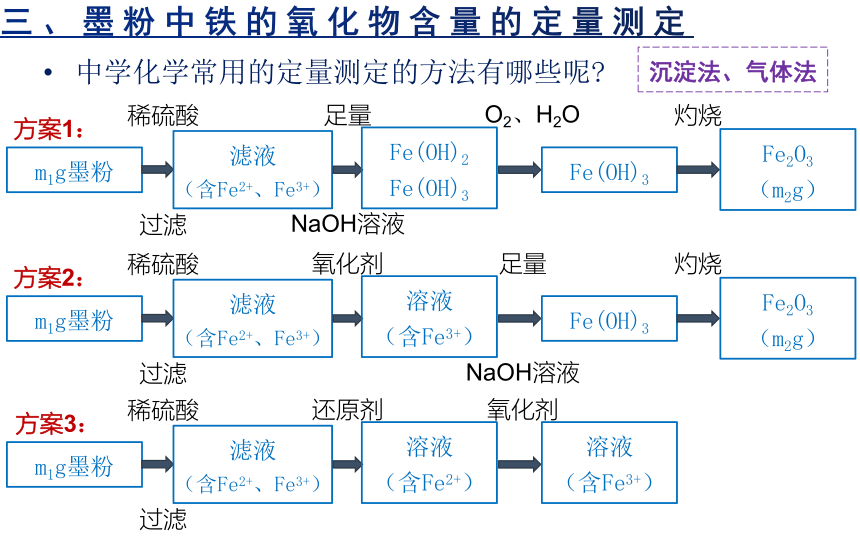
三、墨粉中铁的氧化物含量的定量测定
中学化学常用的定量测定的方法有哪些呢
m1g墨粉
滤液
(含Fe2+、Fe3+)
Fe(OH)2
Fe(OH)3
Fe(OH)3
Fe2O3
(m2g)
稀硫酸
足量
NaOH溶液
灼烧
过滤
O2、H2O
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe3+)
Fe(OH)3
Fe2O3
(m2g)
稀硫酸
氧化剂
灼烧
过滤
足量
NaOH溶液
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe2+)
稀硫酸
还原剂
过滤
氧化剂
溶液
(含Fe3+)
方案1:
方案2:
方案3:
沉淀法、气体法
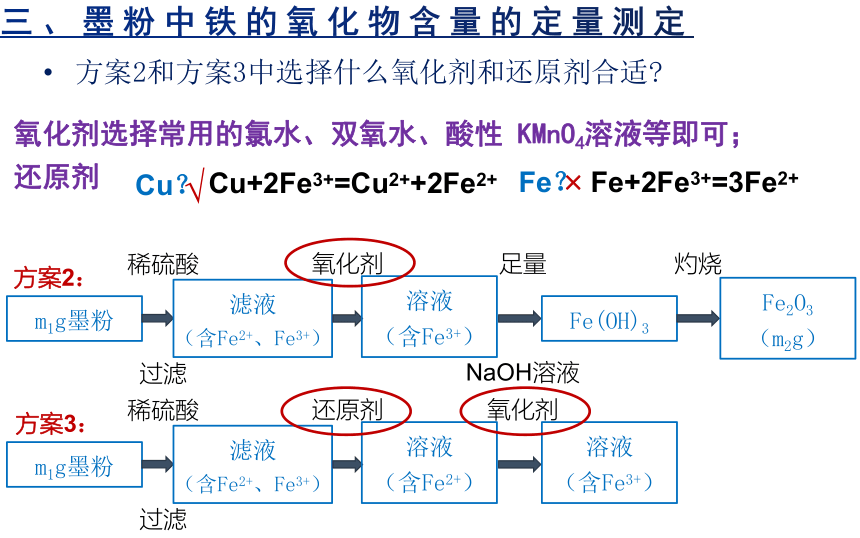
三、墨粉中铁的氧化物含量的定量测定
方案2和方案3中选择什么氧化剂和还原剂合适
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe3+)
Fe(OH)3
Fe2O3
(m2g)
稀硫酸
氧化剂
灼烧
过滤
足量
NaOH溶液
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe2+)
稀硫酸
还原剂
过滤
氧化剂
溶液
(含Fe3+)
方案2:
方案3:
氧化剂选择常用的氯水、双氧水、酸性 KMnO4溶液等即可;
还原剂
Cu?
√
×
Cu+2Fe3+=Cu2++2Fe2+
Fe?
Fe+2Fe3+=3Fe2+
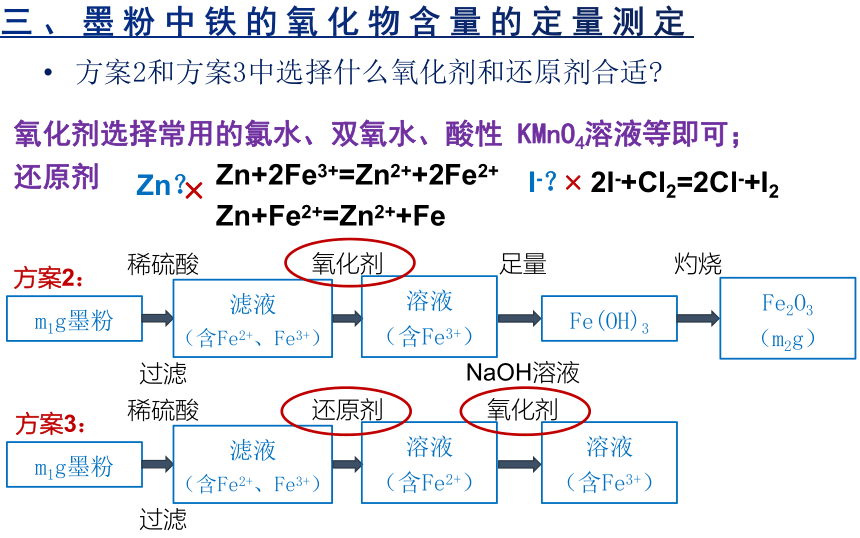
三、墨粉中铁的氧化物含量的定量测定
方案2和方案3中选择什么氧化剂和还原剂合适
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe3+)
Fe(OH)3
Fe2O3
(m2g)
稀硫酸
氧化剂
灼烧
过滤
足量
NaOH溶液
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe2+)
稀硫酸
还原剂
过滤
氧化剂
溶液
(含Fe3+)
方案2:
方案3:
氧化剂选择常用的氯水、双氧水、酸性 KMnO4溶液等即可;
还原剂
Zn?
×
×
Zn+2Fe3+=Zn2++2Fe2+
I-?
2I-+Cl2=2Cl-+I2
Zn+Fe2+=Zn2++Fe
三、墨粉中铁的氧化物含量的定量测定
方案2和方案3中选择什么氧化剂和还原剂合适
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe3+)
Fe(OH)3
Fe2O3
(m2g)
稀硫酸
氧化剂
灼烧
过滤
足量
NaOH溶液
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe2+)
稀硫酸
还原剂
过滤
氧化剂
溶液
(含Fe3+)
方案2:
方案3:
氧化剂选择常用的氯水、双氧水、酸性 KMnO4溶液等即可;
还原剂选择铜粉合适,不能选择 Fe、Zn、I-等,以确保没有干扰。
三、墨粉中铁的氧化物含量的定量测定
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe2+)
稀硫酸
还原剂
过滤
氧化剂
溶液
(含Fe3+)
方案3:
方案3中,如何确定铜粉已将Fe3+全部转化
滴入 KSCN溶液,若不变红色,证明已全部转化。
方案3一定需要将 Fe3+继续转化为最终的 Fe2O3吗
(信息:KMnO4溶液呈现紫红色,还原产物一般为无色的 Mn2+。)
利用KMnO4溶液反应前后的颜色变化,设法测出消耗的溶液的体积即可以求算铁的含量。
三、墨粉中铁的氧化物含量的定量测定
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe2+)
稀硫酸
还原剂
过滤
氧化剂
溶液
(含Fe3+)
方案3:
称取墨粉的质量为m1g,通过方案3的转化过程,最终消耗浓度为c mol/L的酸性 KMnO4溶液的体积为VmL,请计算墨粉中所含Fe3O4的质量分数。
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
n(Fe3O4)=1/3n(Fe)
n(Fe)=5n(KMnO4)
n(Fe3O4)=5/3n(KMnO4)
四、Fe3O4的制备
你知道哪些制备 Fe3O4的方法
铁粉与水蒸气在高温下反应是否可以用于工业生产
资料:沉淀法由于其工艺操作简单成本较低,产品纯度高,组成均匀,适合于大规模生产,成为最常用的纳米磁性 Fe3O4颗粒的制备方法:将亚铁盐和铁盐按照一定的比例混合,加入碱性沉淀剂,快速搅拌反应。
你认为该反应属于氧化还原反应吗
你能尝试推断出 Fe2+、Fe3+和OH-的理论物质的量之比吗
Fe2++2Fe3++8OH-=Fe3O4+4H2O
电荷守恒
质量守恒
五、拓展提升
寒潮来袭,温度骤降,市面上有一种产品叫作“暖宝宝”,贴在衣物上可以持续产生热量,产品信息如右图所示(蛭石为一种硅酸盐矿物)。
名 称:暧宝宝即贴10片装
产地:上海
产品尺寸:100*130mm(未包装尺寸)
123*164mm(包装尺寸)
产品成分:铁粉、水、活性炭、蛭石、吸水性树脂、食盐
产品特征:持续发热10小时以上
产品用途:保暖取暖
保质期 4年
五、拓展提升
“暖宝宝”的发热原理是利用铁和氧气反应放出热量。打开一包已使用过的“暖宝宝”,发现有少量红色物质,猜测红色物质的成分,并设计实验。
取少量固体,加入足量盐酸溶解,再滴加 KSCN溶液,若出现血红色,证明是氧化铁,若没有出现血红色,则证明没有氧化铁。
可行吗?
Fe3+可能被过量 Fe粉还原。
五、拓展提升
“暖宝宝”的发热原理是利用铁和氧气反应放出热量。打开一包已使用过的“暖宝宝”,发现有少量红色物质,猜测红色物质的成分,并设计实验。
评价以下方案。
A:用磁铁吸走铁粉,再加盐酸和KSCN 检验 B:将固体加到适量的硫酸铜溶液中,过滤后再加盐酸和 KSCN 检验 C:将固体加到适量的硝酸银溶液中,过滤后再加盐酸和 KSCN 检验
X
X
√
其它粉末可能一起吸上来。
置换出来的铜会与铁离子反应。
银的还原性弱。
五、拓展提升
例题:某铁矿石中含有Fe3O4、Fe2O3等,为测定铁元素的含量,科研工作者采用如下测定方法∶
溶解:准确称取试样 0.5600g于250 mL 锥形瓶中,加入足量浓 HCl充分溶解
还原:在一定条件下滴加 SnCl2溶液将Fe3+全部还原成 Fe2+,Sn2++Fe3+=Sn3++Fe2+
滴定:立即用 0.05000mol/L K2Cr2O7标准溶液滴定,共消耗标准液的体积20.00mL
反应:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
(1)计算试样中铁的含量(质量分数);
(2)某炼铁厂用这种铁矿石冶炼生铁,日消耗 10000t,计算该厂理论上年产含铁 96%生铁的质量(一年按360天计)。
60%
对于多步反应,可用"关系式法"建立已知量和未知量的联系,再利用物质的量进行相关计算,可以简化流程。
2.25×106t
课堂总结
今日作业
1.梳理课堂笔记;
2.3D笔记
单质
氧化物
盐
碱
0
+3
+2
FeO
Fe2O3
Fe3+
Fe2+
Fe(OH)3
Fe(OH)2
铁元素化合价
物质类别
Fe3O4
Fe
吴 彦
探索生产生活中的铁及其化合物
第三章 铁 金属材料
一、创设真实问题情境
如何判断这种铁的氧化物是什么 有多少
某品牌的打印机墨粉成分如下:表面改性剂、电荷调节剂、流动化剂 SiO2、炭粉、某一种铁的氧化物(占20%-30%)等。
Fe的氧化物
Fe3+或Fe2+
H+
?
二、墨粉中铁的氧化物定性检验
(说明:墨粉中其他成分与酸不反应。)
请大家用化学方法检验确定墨粉中铁的氧化物的种类。
FeO
Fe2O3
Fe3+
Fe2+
Fe(OH)3
Fe(OH)2
Fe3O4
酸溶
酸溶
酸溶
氯水
H2O2
酸性KMnO4
NaOH溶液
NaOH溶液
变红色
+3
+2
氧化物
盐
碱
是否在任何情况下用常见的盐酸和硫酸溶解氧化物都可行呢
KSCN溶液
酸性条件下KMnO4和H2O2能氧化氯离子
二、墨粉中铁的氧化物定性检验
完善实验方案,列出操作流程。
滤液
溶液变红
溶液褪色
墨粉
稀硫酸
KSCN溶液
KMnO4溶液
过滤
墨粉中含有的铁的氧化物是 Fe3O4。
现象
结论
三、墨粉中铁的氧化物含量的定量测定
中学化学常用的定量测定的方法有哪些呢
m1g墨粉
滤液
(含Fe2+、Fe3+)
Fe(OH)2
Fe(OH)3
Fe(OH)3
Fe2O3
(m2g)
稀硫酸
足量
NaOH溶液
灼烧
过滤
O2、H2O
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe3+)
Fe(OH)3
Fe2O3
(m2g)
稀硫酸
氧化剂
灼烧
过滤
足量
NaOH溶液
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe2+)
稀硫酸
还原剂
过滤
氧化剂
溶液
(含Fe3+)
方案1:
方案2:
方案3:
沉淀法、气体法
三、墨粉中铁的氧化物含量的定量测定
方案2和方案3中选择什么氧化剂和还原剂合适
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe3+)
Fe(OH)3
Fe2O3
(m2g)
稀硫酸
氧化剂
灼烧
过滤
足量
NaOH溶液
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe2+)
稀硫酸
还原剂
过滤
氧化剂
溶液
(含Fe3+)
方案2:
方案3:
氧化剂选择常用的氯水、双氧水、酸性 KMnO4溶液等即可;
还原剂
Cu?
√
×
Cu+2Fe3+=Cu2++2Fe2+
Fe?
Fe+2Fe3+=3Fe2+
三、墨粉中铁的氧化物含量的定量测定
方案2和方案3中选择什么氧化剂和还原剂合适
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe3+)
Fe(OH)3
Fe2O3
(m2g)
稀硫酸
氧化剂
灼烧
过滤
足量
NaOH溶液
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe2+)
稀硫酸
还原剂
过滤
氧化剂
溶液
(含Fe3+)
方案2:
方案3:
氧化剂选择常用的氯水、双氧水、酸性 KMnO4溶液等即可;
还原剂
Zn?
×
×
Zn+2Fe3+=Zn2++2Fe2+
I-?
2I-+Cl2=2Cl-+I2
Zn+Fe2+=Zn2++Fe
三、墨粉中铁的氧化物含量的定量测定
方案2和方案3中选择什么氧化剂和还原剂合适
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe3+)
Fe(OH)3
Fe2O3
(m2g)
稀硫酸
氧化剂
灼烧
过滤
足量
NaOH溶液
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe2+)
稀硫酸
还原剂
过滤
氧化剂
溶液
(含Fe3+)
方案2:
方案3:
氧化剂选择常用的氯水、双氧水、酸性 KMnO4溶液等即可;
还原剂选择铜粉合适,不能选择 Fe、Zn、I-等,以确保没有干扰。
三、墨粉中铁的氧化物含量的定量测定
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe2+)
稀硫酸
还原剂
过滤
氧化剂
溶液
(含Fe3+)
方案3:
方案3中,如何确定铜粉已将Fe3+全部转化
滴入 KSCN溶液,若不变红色,证明已全部转化。
方案3一定需要将 Fe3+继续转化为最终的 Fe2O3吗
(信息:KMnO4溶液呈现紫红色,还原产物一般为无色的 Mn2+。)
利用KMnO4溶液反应前后的颜色变化,设法测出消耗的溶液的体积即可以求算铁的含量。
三、墨粉中铁的氧化物含量的定量测定
m1g墨粉
滤液
(含Fe2+、Fe3+)
溶液
(含Fe2+)
稀硫酸
还原剂
过滤
氧化剂
溶液
(含Fe3+)
方案3:
称取墨粉的质量为m1g,通过方案3的转化过程,最终消耗浓度为c mol/L的酸性 KMnO4溶液的体积为VmL,请计算墨粉中所含Fe3O4的质量分数。
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
n(Fe3O4)=1/3n(Fe)
n(Fe)=5n(KMnO4)
n(Fe3O4)=5/3n(KMnO4)
四、Fe3O4的制备
你知道哪些制备 Fe3O4的方法
铁粉与水蒸气在高温下反应是否可以用于工业生产
资料:沉淀法由于其工艺操作简单成本较低,产品纯度高,组成均匀,适合于大规模生产,成为最常用的纳米磁性 Fe3O4颗粒的制备方法:将亚铁盐和铁盐按照一定的比例混合,加入碱性沉淀剂,快速搅拌反应。
你认为该反应属于氧化还原反应吗
你能尝试推断出 Fe2+、Fe3+和OH-的理论物质的量之比吗
Fe2++2Fe3++8OH-=Fe3O4+4H2O
电荷守恒
质量守恒
五、拓展提升
寒潮来袭,温度骤降,市面上有一种产品叫作“暖宝宝”,贴在衣物上可以持续产生热量,产品信息如右图所示(蛭石为一种硅酸盐矿物)。
名 称:暧宝宝即贴10片装
产地:上海
产品尺寸:100*130mm(未包装尺寸)
123*164mm(包装尺寸)
产品成分:铁粉、水、活性炭、蛭石、吸水性树脂、食盐
产品特征:持续发热10小时以上
产品用途:保暖取暖
保质期 4年
五、拓展提升
“暖宝宝”的发热原理是利用铁和氧气反应放出热量。打开一包已使用过的“暖宝宝”,发现有少量红色物质,猜测红色物质的成分,并设计实验。
取少量固体,加入足量盐酸溶解,再滴加 KSCN溶液,若出现血红色,证明是氧化铁,若没有出现血红色,则证明没有氧化铁。
可行吗?
Fe3+可能被过量 Fe粉还原。
五、拓展提升
“暖宝宝”的发热原理是利用铁和氧气反应放出热量。打开一包已使用过的“暖宝宝”,发现有少量红色物质,猜测红色物质的成分,并设计实验。
评价以下方案。
A:用磁铁吸走铁粉,再加盐酸和KSCN 检验 B:将固体加到适量的硫酸铜溶液中,过滤后再加盐酸和 KSCN 检验 C:将固体加到适量的硝酸银溶液中,过滤后再加盐酸和 KSCN 检验
X
X
√
其它粉末可能一起吸上来。
置换出来的铜会与铁离子反应。
银的还原性弱。
五、拓展提升
例题:某铁矿石中含有Fe3O4、Fe2O3等,为测定铁元素的含量,科研工作者采用如下测定方法∶
溶解:准确称取试样 0.5600g于250 mL 锥形瓶中,加入足量浓 HCl充分溶解
还原:在一定条件下滴加 SnCl2溶液将Fe3+全部还原成 Fe2+,Sn2++Fe3+=Sn3++Fe2+
滴定:立即用 0.05000mol/L K2Cr2O7标准溶液滴定,共消耗标准液的体积20.00mL
反应:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
(1)计算试样中铁的含量(质量分数);
(2)某炼铁厂用这种铁矿石冶炼生铁,日消耗 10000t,计算该厂理论上年产含铁 96%生铁的质量(一年按360天计)。
60%
对于多步反应,可用"关系式法"建立已知量和未知量的联系,再利用物质的量进行相关计算,可以简化流程。
2.25×106t
课堂总结
今日作业
1.梳理课堂笔记;
2.3D笔记
单质
氧化物
盐
碱
0
+3
+2
FeO
Fe2O3
Fe3+
Fe2+
Fe(OH)3
Fe(OH)2
铁元素化合价
物质类别
Fe3O4
Fe
