化学人教版(2019)必修第二册7.3.1乙醇(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.3.1乙醇(共22张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 7.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-09 11:10:46 | ||
图片预览






文档简介
(共22张PPT)
人教版高中化学必修二
第三节 乙醇与乙酸 第一课时
第七章 有机化合物
学习目标
1.掌握乙醇的分子结构和性质。
2.从微观角度理解乙醇发生化学反应的断键方式。
3.了解乙醇在生活中的作用。
重点:乙醇的分子结构和性质。
难点:乙醇的分子结构和化学性质,从微观角度理解乙醇发生化学反应的断键方式。
玉米
小麦
高粱
糯米
葡萄
苹果
发酵法制酒:将含淀粉的农产品加压蒸煮,加入酵母发酵制得乙醇。
新知探究
一、物理性质
颜 色 :
气 味 :
状 态:
密 度 :
溶解性:
挥发性:
无色透明
特殊香味
液体
比水小,200C时的密度是0.7893g/cm3
跟水以任意比互溶
重要的有机溶剂,能够溶解多种无机物和有机物
易挥发
乙醇俗称酒精
思考:如何分离水和酒精?
由于水和酒精是互溶的,所以通常用蒸馏
的方法分离水和酒精。
工业上如何制取无水的乙醇?
先加生石灰,生石灰与水反应生成氢氧化钙,然后加热蒸馏分离乙醇。
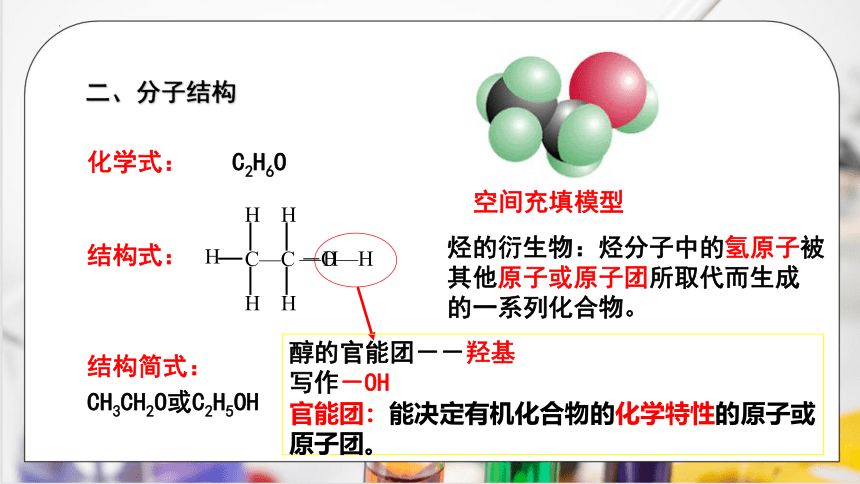
结构式:
CH3CH2O或C2H5OH
醇的官能团--羟基
写作-OH
官能团:能决定有机化合物的化学特性的原子或
原子团。
空间充填模型
化学式:
二、分子结构
C2H6O
结构简式:
烃的衍生物:烃分子中的氢原子被
其他原子或原子团所取代而生成
的一系列化合物。
C—C
H
H
H
H
H
H
—
—O—H
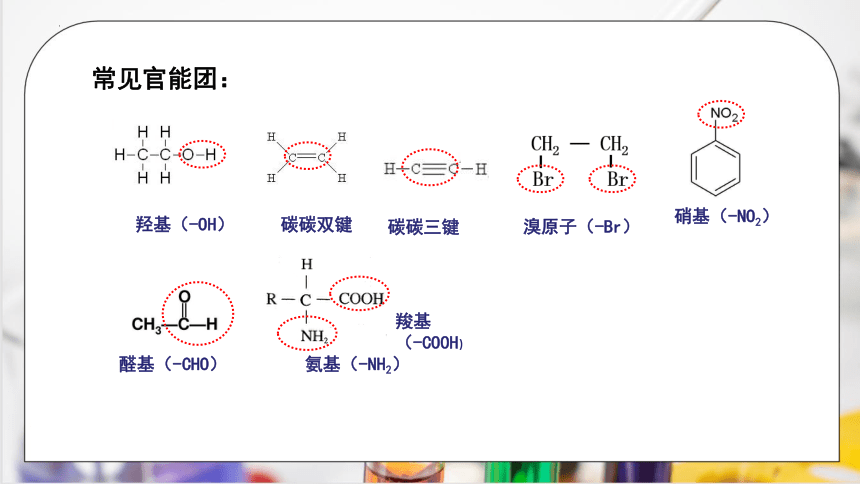
常见官能团:
硝基(-NO2)
溴原子(-Br)
碳碳双键
氨基(-NH2)
羧基
(-COOH)
羟基(-OH)
醛基(-CHO)
碳碳三键
三、化学性质
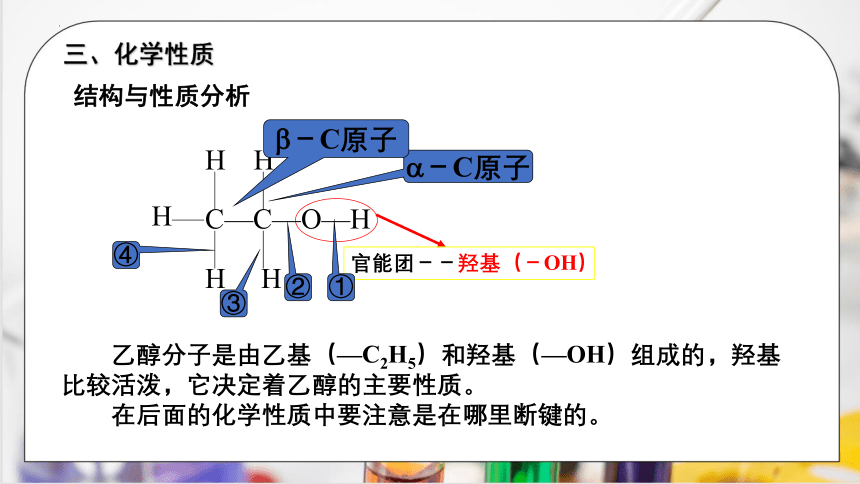
结构与性质分析
C—C—O—H
H
H
H
H
H
官能团--羟基(-OH)
-C原子
-C原子
乙醇分子是由乙基(—C2H5)和羟基(—OH)组成的,羟基比较活泼,它决定着乙醇的主要性质。
在后面的化学性质中要注意是在哪里断键的。
①
②
④
③
1、与活泼金属(如Na)反应
乙醇钠
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
H—C—C—O—H,
H H
H H
①
该反应属于 反应。
置换
注意:乙醇跟金属钠反应,生成乙醇钠,并放出氢气,H2中的H来自于羟基上的H。
其它活泼金属如钾、镁、铝等也能够把乙醇的羟基里的氢取代出来。思考:乙醇分子中等效氢有几种?
类比: 2Na+2H-O-H=2NaOH+H2↑
思考:为什么乙醇与钠反应不如钠与水反应剧烈
乙醇分子羟基中的氢原子不如水分子中的氢原子活泼。
H-O-H
项目 物质 金属钠 的变化 气体燃 烧现象 检验产物
水
乙醇
浮、游、熔、响
火焰呈
淡蓝色
火焰呈
淡蓝色
加入酚酞变红,有碱性物质生成
沉在底部,不熔成小球
烧杯内壁有水珠生成,加入澄清石灰水无变化
钠与水、乙醇反应的比较
结论:钠与乙醇的反应速率比钠与水的反应速率慢, 说明羟基中的H原子的活泼性:
乙醇<水
思考:多少mol乙醇与Na反应才能产生1molH2
2 mol乙醇与足量的Na反应得到1mol H2
说明:1mol-OH~1molNa~0.5molH2
2CH3CH2O-H + 2Na → 2CH3CH2ONa + H2↑
思考:能否通过此反应测定有机物的羟基数目?
A.6∶3∶2 B.1∶2∶3 C.3∶2∶1 D.4∶3∶2
A
练习:
2、氧化反应:
① 乙醇在空气里能够燃烧,发出淡蓝色的火焰,同时放出大量的热。
因此: 乙醇可用作内燃机的燃料,实验室里也常用它作为燃料。
资料:在有机化学中通常用反应物的得氧或得氢来判断氧化还原反应。 得氧或失氢叫做氧化反应;得氢或失氧叫做还原反应。
2CO2 +3H2O
C2H5OH + 3O2
点燃
思考:乙醇与氧气的反应,如果改变条件会发生怎样的变化?
分析: 乙醇在加热和有催化剂(Cu或Ag)存在的条件下,能够被空气氧化,生成乙醛。工业上根据这个原理,可以由乙醇制造乙醛。
现象:光亮的铜丝加热到变黑,将灼热的铜丝迅速插入在乙醇中,铜丝由黑变红,同时产生刺激性气味。
总反应:2CH3CH2OH + O2 2CH3CHO + 2H2O
催化剂
C—C—H
H
H
H
H
O—H
两个氢脱去与O结合成水
②乙醇的催化氧化
发生反应 ①2Cu+O2==2CuO
②CuO+CH3CH2OH Cu +CH3CHO+H2O
思考:当 --C上没有氢或只有一个氢的情况又如何氧化呢?
本质:断羟基氢和羟基碳上的氢,与-OH相连的碳原子必须有H才能被氧化。
规律:a、在 --C碳上有2个H时
b、在 --C碳上只有1个H时
RCH O RCH=O
H
H
Cu
生成醛
C O C=O
R
R
R
R
H
H
Cu
生成酮
c、在 --C碳上无H时:不能催化氧化
CH3OH
不能被催化氧化
CH3
CH
CH3
O
练习:判断以下醇分子能不能被催化氧化
HCHO
CH3CH2OH CH3COOH
酸性KMnO4溶液
酸性K2Cr2O7溶液
③被强氧化剂氧化:
被酸性KMnO4 、酸性K2Cr2O7 溶液氧化为乙酸。
KMnO4
(紫色)
MnSO4
(无色)
K2Cr2O7 Cr2(SO4)3
重铬酸钾(橙色) 硫酸铬 (绿色)
练习:下列反应可以用来检验司机是否酒后驾车
橙红色
绿色
上述反应中,被检测的气体是 ,氧化剂是________;氧化产物是__________。
2K2Cr2O7 + 3CH3CH2OH + 8H2SO4
K2Cr2O7
CH3COOH
CH3CH2OH
乙醇
乙醛
乙酸
CO2+H2O
Cu/Ag,加热
O2
O2
KMnO4(H+)/K2Cr2O4(H+)
O2(点燃)
条件控制在有机反应中的作用
四、用途
1、作内燃机的燃料,实验室里也常用它作为燃料
2、重要的有机化工原料和溶剂
3、医疗上常用75%(体积分数)的乙醇溶液作消毒剂
课堂小结
乙醇
物理性质
分子结构
化学性质
官能团─OH 羟基
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
CH3CH2OH → CH3COOH
CH3CH2OH + 3O2
2CO2 + 3H2O
点燃
2CH3CH2OH + O2
2CH3CHO + 2H2O
Cu或Ag
△
氧化
反应
用途
人教版高中化学必修二
第三节 乙醇与乙酸 第一课时
第七章 有机化合物
学习目标
1.掌握乙醇的分子结构和性质。
2.从微观角度理解乙醇发生化学反应的断键方式。
3.了解乙醇在生活中的作用。
重点:乙醇的分子结构和性质。
难点:乙醇的分子结构和化学性质,从微观角度理解乙醇发生化学反应的断键方式。
玉米
小麦
高粱
糯米
葡萄
苹果
发酵法制酒:将含淀粉的农产品加压蒸煮,加入酵母发酵制得乙醇。
新知探究
一、物理性质
颜 色 :
气 味 :
状 态:
密 度 :
溶解性:
挥发性:
无色透明
特殊香味
液体
比水小,200C时的密度是0.7893g/cm3
跟水以任意比互溶
重要的有机溶剂,能够溶解多种无机物和有机物
易挥发
乙醇俗称酒精
思考:如何分离水和酒精?
由于水和酒精是互溶的,所以通常用蒸馏
的方法分离水和酒精。
工业上如何制取无水的乙醇?
先加生石灰,生石灰与水反应生成氢氧化钙,然后加热蒸馏分离乙醇。
结构式:
CH3CH2O或C2H5OH
醇的官能团--羟基
写作-OH
官能团:能决定有机化合物的化学特性的原子或
原子团。
空间充填模型
化学式:
二、分子结构
C2H6O
结构简式:
烃的衍生物:烃分子中的氢原子被
其他原子或原子团所取代而生成
的一系列化合物。
C—C
H
H
H
H
H
H
—
—O—H
常见官能团:
硝基(-NO2)
溴原子(-Br)
碳碳双键
氨基(-NH2)
羧基
(-COOH)
羟基(-OH)
醛基(-CHO)
碳碳三键
三、化学性质
结构与性质分析
C—C—O—H
H
H
H
H
H
官能团--羟基(-OH)
-C原子
-C原子
乙醇分子是由乙基(—C2H5)和羟基(—OH)组成的,羟基比较活泼,它决定着乙醇的主要性质。
在后面的化学性质中要注意是在哪里断键的。
①
②
④
③
1、与活泼金属(如Na)反应
乙醇钠
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
H—C—C—O—H,
H H
H H
①
该反应属于 反应。
置换
注意:乙醇跟金属钠反应,生成乙醇钠,并放出氢气,H2中的H来自于羟基上的H。
其它活泼金属如钾、镁、铝等也能够把乙醇的羟基里的氢取代出来。思考:乙醇分子中等效氢有几种?
类比: 2Na+2H-O-H=2NaOH+H2↑
思考:为什么乙醇与钠反应不如钠与水反应剧烈
乙醇分子羟基中的氢原子不如水分子中的氢原子活泼。
H-O-H
项目 物质 金属钠 的变化 气体燃 烧现象 检验产物
水
乙醇
浮、游、熔、响
火焰呈
淡蓝色
火焰呈
淡蓝色
加入酚酞变红,有碱性物质生成
沉在底部,不熔成小球
烧杯内壁有水珠生成,加入澄清石灰水无变化
钠与水、乙醇反应的比较
结论:钠与乙醇的反应速率比钠与水的反应速率慢, 说明羟基中的H原子的活泼性:
乙醇<水
思考:多少mol乙醇与Na反应才能产生1molH2
2 mol乙醇与足量的Na反应得到1mol H2
说明:1mol-OH~1molNa~0.5molH2
2CH3CH2O-H + 2Na → 2CH3CH2ONa + H2↑
思考:能否通过此反应测定有机物的羟基数目?
A.6∶3∶2 B.1∶2∶3 C.3∶2∶1 D.4∶3∶2
A
练习:
2、氧化反应:
① 乙醇在空气里能够燃烧,发出淡蓝色的火焰,同时放出大量的热。
因此: 乙醇可用作内燃机的燃料,实验室里也常用它作为燃料。
资料:在有机化学中通常用反应物的得氧或得氢来判断氧化还原反应。 得氧或失氢叫做氧化反应;得氢或失氧叫做还原反应。
2CO2 +3H2O
C2H5OH + 3O2
点燃
思考:乙醇与氧气的反应,如果改变条件会发生怎样的变化?
分析: 乙醇在加热和有催化剂(Cu或Ag)存在的条件下,能够被空气氧化,生成乙醛。工业上根据这个原理,可以由乙醇制造乙醛。
现象:光亮的铜丝加热到变黑,将灼热的铜丝迅速插入在乙醇中,铜丝由黑变红,同时产生刺激性气味。
总反应:2CH3CH2OH + O2 2CH3CHO + 2H2O
催化剂
C—C—H
H
H
H
H
O—H
两个氢脱去与O结合成水
②乙醇的催化氧化
发生反应 ①2Cu+O2==2CuO
②CuO+CH3CH2OH Cu +CH3CHO+H2O
思考:当 --C上没有氢或只有一个氢的情况又如何氧化呢?
本质:断羟基氢和羟基碳上的氢,与-OH相连的碳原子必须有H才能被氧化。
规律:a、在 --C碳上有2个H时
b、在 --C碳上只有1个H时
RCH O RCH=O
H
H
Cu
生成醛
C O C=O
R
R
R
R
H
H
Cu
生成酮
c、在 --C碳上无H时:不能催化氧化
CH3OH
不能被催化氧化
CH3
CH
CH3
O
练习:判断以下醇分子能不能被催化氧化
HCHO
CH3CH2OH CH3COOH
酸性KMnO4溶液
酸性K2Cr2O7溶液
③被强氧化剂氧化:
被酸性KMnO4 、酸性K2Cr2O7 溶液氧化为乙酸。
KMnO4
(紫色)
MnSO4
(无色)
K2Cr2O7 Cr2(SO4)3
重铬酸钾(橙色) 硫酸铬 (绿色)
练习:下列反应可以用来检验司机是否酒后驾车
橙红色
绿色
上述反应中,被检测的气体是 ,氧化剂是________;氧化产物是__________。
2K2Cr2O7 + 3CH3CH2OH + 8H2SO4
K2Cr2O7
CH3COOH
CH3CH2OH
乙醇
乙醛
乙酸
CO2+H2O
Cu/Ag,加热
O2
O2
KMnO4(H+)/K2Cr2O4(H+)
O2(点燃)
条件控制在有机反应中的作用
四、用途
1、作内燃机的燃料,实验室里也常用它作为燃料
2、重要的有机化工原料和溶剂
3、医疗上常用75%(体积分数)的乙醇溶液作消毒剂
课堂小结
乙醇
物理性质
分子结构
化学性质
官能团─OH 羟基
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
CH3CH2OH → CH3COOH
CH3CH2OH + 3O2
2CO2 + 3H2O
点燃
2CH3CH2OH + O2
2CH3CHO + 2H2O
Cu或Ag
△
氧化
反应
用途
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
