2022-2023学年化学仁爱版 专题六 物质的溶解 单元练习(含答案)
文档属性
| 名称 | 2022-2023学年化学仁爱版 专题六 物质的溶解 单元练习(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 132.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-09 08:17:15 | ||
图片预览




文档简介
2022-2023学年化学仁爱版--物质的溶解
一、单选题
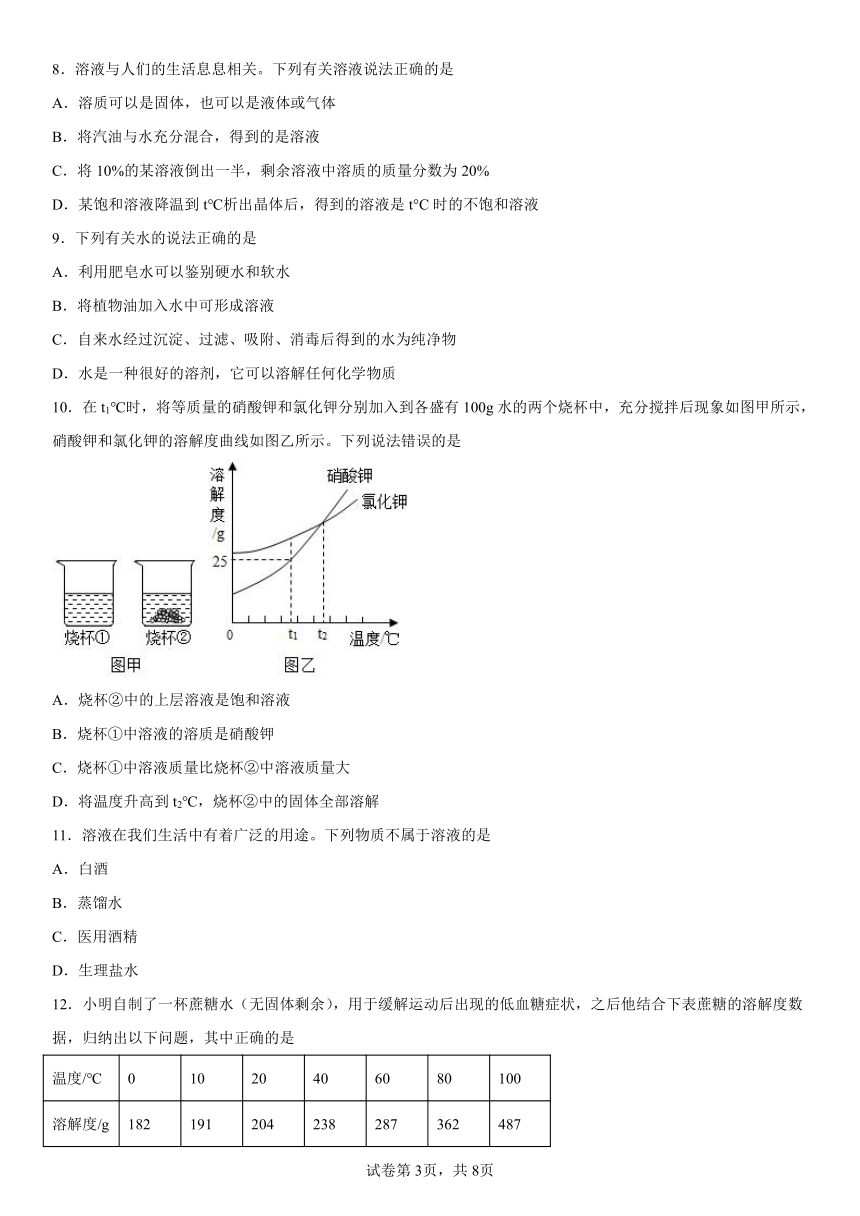
1.家用食醋是含醋酸质量分数为10%的水溶液,其中的“10%”的含义是( )
A.100 g醋酸中含醋为10 g B.100 g醋酸的水溶液中含醋酸10g
C.100 g水中含醋酸为10g D.100 g醋酸的水溶液中含水10g
2.若研究温度对食盐溶解快慢的影响,在图中应选用哪两个装置进行对照实验( )
A.甲和乙 B.乙和丙 C.甲和丙 D.丙和丁
3.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是
温度/℃ 0 20 40 60
NaCl的溶解度/g 35.7 36.0 36.6 37.3
KNO3的溶解度/g 13.3 31.6 63.9 110
A.20℃时,100gH2O最多能溶解36.0gNaCl
B.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
4.下列说法正确的是( )
A.均一、稳定的液体都是溶液
B.溶质均以离子形式分散到溶剂中
C.同一温度下,硝酸钾的饱和溶液比不饱和溶液浓
D.饱和溶液析出晶体后溶质质量分数一定变小
5.下列图像不能正确反映对应变化关系的是
A. 等体积等浓度的稀盐酸分别与足量铁粉和镁粉反应
B. 向一定量氢氧化钠溶液中逐滴加入稀硫酸
C. 向一定量硫酸铜溶液中加入过量铁粉
D. 加热一定量高锰酸钾固体制氧气
6.如图是MgCl2、KCl和MgSO4的溶解度曲线。下列说法错误的是( )
A.P点表示t2℃时KCl和MgSO4的溶解度相等
B.t1℃时三种物质的饱和溶液中,溶质质量分数最大的是MgCl2
C.将t2℃时的三种物质的饱和溶液分别升温至t3℃,会析出晶体的是MgSO4
D.t2℃时,将40g MgCl2加入50g水中充分搅拌,所得溶液质量为90g
7.把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
8.溶液与人们的生活息息相关。下列有关溶液说法正确的是
A.溶质可以是固体,也可以是液体或气体
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体后,得到的溶液是t°C时的不饱和溶液
9.下列有关水的说法正确的是
A.利用肥皂水可以鉴别硬水和软水
B.将植物油加入水中可形成溶液
C.自来水经过沉淀、过滤、吸附、消毒后得到的水为纯净物
D.水是一种很好的溶剂,它可以溶解任何化学物质
10.在t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图甲所示,硝酸钾和氯化钾的溶解度曲线如图乙所示。下列说法错误的是
A.烧杯②中的上层溶液是饱和溶液
B.烧杯①中溶液的溶质是硝酸钾
C.烧杯①中溶液质量比烧杯②中溶液质量大
D.将温度升高到t2℃,烧杯②中的固体全部溶解
11.溶液在我们生活中有着广泛的用途。下列物质不属于溶液的是
A.白酒
B.蒸馏水
C.医用酒精
D.生理盐水
12.小明自制了一杯蔗糖水(无固体剩余),用于缓解运动后出现的低血糖症状,之后他结合下表蔗糖的溶解度数据,归纳出以下问题,其中正确的是
温度/℃ 0 10 20 40 60 80 100
溶解度/g 182 191 204 238 287 362 487
A.配制的蔗糖溶液下层比上层甜
B.降温,糖水中一定有晶体析出
C.20℃时,蔗糖饱和溶液质量一定为304g
D.升温,糖水中蔗糖的质量分数不变
13.在“一定溶质质量分数的氯化钠溶液的配制”实验活动中,可能导致氯化钠溶液溶质质量分数偏大的是( )
A.量取水时量筒内事先有少量水
B.所用氯化钠固体不纯
C.称量时砝码和药品的位置放反
D.将量筒中的水倒入烧杯时有水溅出
14.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
15.下列关于溶液的说法正确的是
A.溶液一定是混合物
B.饱和溶液的浓度比不饱和溶液的浓度一定大
C.医用碘酒是碘的水溶液
D.添加溶质是不饱和溶液变成饱和溶液的唯一方法
二、填空题
16.如图为KNO3的溶解度曲线,a、b在溶解度曲线上。
(1)a点对应的溶液是_____溶液。(填“饱和”或者“不饱和”)
(2)a点对应的溶液的质量分数是_________。(只列计算式)
(3)将a点对应的溶液升温到70 ℃,其质量分数_____。(填写“变大”、“变小”或“不变”)
(4)欲使KNO3溶液的状态从b点转化为c点,可采取的措施是______。
17.控制变量法是科学探究中常用的方法之一。
(1)在探究固体物质的溶解度时,需要考虑的因素有:①溶质的种类; ②溶剂的种类;③溶质最多被溶解的质量; ④溶剂的质量; ⑤温度。
如测定“某物质在不同温度下的溶解度”,研究的是_________ (填序号)受温度的影响,这就需要控制其他因素保持不变。
(2)右表是利用控制变量法测得的氯化钠、硝酸钾在不同温度时的溶解度,请根据表格内容及实验现象回答下列问题。
温度(℃) 20 40 50
溶解度/g NaCl 36.0 36.6 37.0
KNO3 31.6 63.9 85.5
①从上表可知,两种物质的溶解度受温度变化影响较大的是____________;
②20℃时,将等质量的NaCl、KNO3分别放入盛有100 g水的两个烧杯中,充分溶解后如图1所示,升温到50℃时如图2所示。试判断:50℃时甲烧杯中的溶液一定是______(填“饱和溶液”、“不饱和溶液”或“不能确定”)。
18.根据如图所示的甲、乙、丙的溶解度曲线,回答以下问题:
(1)P点表示的意义______。
(2)乙中含有少量甲,要提纯乙可采用的方法是______。
(3)写出一种将丙的接近饱和的溶液变成饱和溶液的方法______。
(4)t3℃时,等质量的甲、乙、丙分别配成饱和溶液,需水的质量由多到少的顺序是______。
(5)下列说法错误的是______(填序号)。
①在t2℃时,将15g甲物质放入50g水中,所得到的溶液质量为65g
②将甲的溶液由t3℃降温到t2℃,一定有晶体析出
③将t3℃时等质量的甲、乙、丙三种物质的饱和溶液都降温到t2℃,三种溶液中溶质的质量分数由大到小的顺序为乙>甲=丙
19.写出下列溶液中溶质的化学式:
①石灰水_____;
②盐酸_____;
③食盐水_____;
④白磷的二硫化碳溶液_____;
⑤医用酒精_____;
⑥锌粒溶于硫酸中_____。
20.如图是实验室配制一定溶质质量分数的NaCl溶液的流程图。
请回答
(1) 应称量___________ gNaCl,需加水___________ mL。
(2)若称量NaCl固体时指针向右偏转 ,则应_____________________直到天平平衡。
(3)取上述溶液10g加水稀释到_______________g,可得到5%的NaCl溶液。
三、实验题
21.某同学配制50g9%的氯化钠溶液,整个操作过程如图所示,回答下列问题:
(1)配制溶液的正确操作顺序为__________(填序号),其中操作错误的是__________(填序号)
(2)图②中盛放氯化钠固体的仪器名称是__________,需称取氯化钠_________g。
(3)量水时选用的量筒的量程最合适的是______(填字母),读数时视线要与量筒内_______保持水平。
A.10mL B.25mL C.50mL D.100mL
22.正确的方案设计和规范的实验操作有助于达到实验目的,请分析或改进以下实验。
实验目的 实验过程及现象 分析或改进
铁丝在氧气中燃烧 画图表示你的改进方法:_____。
探究物质溶解性的影响因素 为达到实验目的,你的改进方法是_____。
通过氢气在氧气中燃烧证明水的组成 现象:氢气燃烧,发出_____色火焰, 瓶壁发热。 该实验不能达到实验目的的原因是_____。
23.如图所示是甲、乙两种固体物质的溶解度曲线,回答下列问题:
(1)甲中混有少量的乙,可采取________________的方法提纯甲。
(2)当0℃<t<t1℃时,配制等质量的甲乙两种饱和溶液需要水的质量:甲____乙(>;<;=)。
(3)t2℃时,将75g甲的饱和溶液的溶质质量分数稀释为溶质质量分数为20%的溶液,加水的质量是_________g。
四、计算题
24.汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米3。若要在实验室用溶质质量分数为98%的浓硫酸配制这种稀硫酸630克。求:
(1)630克稀硫酸的体积是多少毫升_____?
(2)需要浓硫酸多少克________?
25.实验室用含杂质的锌与稀硫酸反应制取氢气,取8g含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应),向其中加入74.2g稀硫酸,恰好完全反应后烧杯内剩余物质的质量为82g。计算:
(1)杂质的质量________g。
(2)反应后所得溶液的溶质质量分数?试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.C
3.C
4.C
5.B
6.D
7.C
8.A
9.A
10.B
11.B
12.D
13.D
14.D
15.A
16. 饱和 ×100% 不变 增加溶剂
17. ③ 硝酸钾(或KNO3) 不饱和溶液
18.(1)t2℃时,甲、丙物质的溶解度相等
(2)蒸发结晶
(3)增加溶质(或升高温度或蒸发溶剂)
(4)丙>乙>甲
(5)①②③
19. Ca(OH)2 HCl NaCl P C2H5OH ZnSO4
20. 7.5 42.5 往左盘中继续添加氯化钠固体 30
21. ②①⑤③④ ① 广口瓶 4.5 C 凹液面的最低处
22. 将氯化钠换成硝酸钾;或硝酸钾换成氯化钠;或酒精换成水等 淡蓝/蓝 用排水法收集,集气瓶内壁上有水珠,对生成的水的检验造成干扰
23. 冷却热饱和溶液(或降温结晶) > 50
24.(1)525毫升;(2)180克
25.(1)1.5;(2)20%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.家用食醋是含醋酸质量分数为10%的水溶液,其中的“10%”的含义是( )
A.100 g醋酸中含醋为10 g B.100 g醋酸的水溶液中含醋酸10g
C.100 g水中含醋酸为10g D.100 g醋酸的水溶液中含水10g
2.若研究温度对食盐溶解快慢的影响,在图中应选用哪两个装置进行对照实验( )
A.甲和乙 B.乙和丙 C.甲和丙 D.丙和丁
3.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是
温度/℃ 0 20 40 60
NaCl的溶解度/g 35.7 36.0 36.6 37.3
KNO3的溶解度/g 13.3 31.6 63.9 110
A.20℃时,100gH2O最多能溶解36.0gNaCl
B.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
4.下列说法正确的是( )
A.均一、稳定的液体都是溶液
B.溶质均以离子形式分散到溶剂中
C.同一温度下,硝酸钾的饱和溶液比不饱和溶液浓
D.饱和溶液析出晶体后溶质质量分数一定变小
5.下列图像不能正确反映对应变化关系的是
A. 等体积等浓度的稀盐酸分别与足量铁粉和镁粉反应
B. 向一定量氢氧化钠溶液中逐滴加入稀硫酸
C. 向一定量硫酸铜溶液中加入过量铁粉
D. 加热一定量高锰酸钾固体制氧气
6.如图是MgCl2、KCl和MgSO4的溶解度曲线。下列说法错误的是( )
A.P点表示t2℃时KCl和MgSO4的溶解度相等
B.t1℃时三种物质的饱和溶液中,溶质质量分数最大的是MgCl2
C.将t2℃时的三种物质的饱和溶液分别升温至t3℃,会析出晶体的是MgSO4
D.t2℃时,将40g MgCl2加入50g水中充分搅拌,所得溶液质量为90g
7.把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
8.溶液与人们的生活息息相关。下列有关溶液说法正确的是
A.溶质可以是固体,也可以是液体或气体
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体后,得到的溶液是t°C时的不饱和溶液
9.下列有关水的说法正确的是
A.利用肥皂水可以鉴别硬水和软水
B.将植物油加入水中可形成溶液
C.自来水经过沉淀、过滤、吸附、消毒后得到的水为纯净物
D.水是一种很好的溶剂,它可以溶解任何化学物质
10.在t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图甲所示,硝酸钾和氯化钾的溶解度曲线如图乙所示。下列说法错误的是
A.烧杯②中的上层溶液是饱和溶液
B.烧杯①中溶液的溶质是硝酸钾
C.烧杯①中溶液质量比烧杯②中溶液质量大
D.将温度升高到t2℃,烧杯②中的固体全部溶解
11.溶液在我们生活中有着广泛的用途。下列物质不属于溶液的是
A.白酒
B.蒸馏水
C.医用酒精
D.生理盐水
12.小明自制了一杯蔗糖水(无固体剩余),用于缓解运动后出现的低血糖症状,之后他结合下表蔗糖的溶解度数据,归纳出以下问题,其中正确的是
温度/℃ 0 10 20 40 60 80 100
溶解度/g 182 191 204 238 287 362 487
A.配制的蔗糖溶液下层比上层甜
B.降温,糖水中一定有晶体析出
C.20℃时,蔗糖饱和溶液质量一定为304g
D.升温,糖水中蔗糖的质量分数不变
13.在“一定溶质质量分数的氯化钠溶液的配制”实验活动中,可能导致氯化钠溶液溶质质量分数偏大的是( )
A.量取水时量筒内事先有少量水
B.所用氯化钠固体不纯
C.称量时砝码和药品的位置放反
D.将量筒中的水倒入烧杯时有水溅出
14.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
15.下列关于溶液的说法正确的是
A.溶液一定是混合物
B.饱和溶液的浓度比不饱和溶液的浓度一定大
C.医用碘酒是碘的水溶液
D.添加溶质是不饱和溶液变成饱和溶液的唯一方法
二、填空题
16.如图为KNO3的溶解度曲线,a、b在溶解度曲线上。
(1)a点对应的溶液是_____溶液。(填“饱和”或者“不饱和”)
(2)a点对应的溶液的质量分数是_________。(只列计算式)
(3)将a点对应的溶液升温到70 ℃,其质量分数_____。(填写“变大”、“变小”或“不变”)
(4)欲使KNO3溶液的状态从b点转化为c点,可采取的措施是______。
17.控制变量法是科学探究中常用的方法之一。
(1)在探究固体物质的溶解度时,需要考虑的因素有:①溶质的种类; ②溶剂的种类;③溶质最多被溶解的质量; ④溶剂的质量; ⑤温度。
如测定“某物质在不同温度下的溶解度”,研究的是_________ (填序号)受温度的影响,这就需要控制其他因素保持不变。
(2)右表是利用控制变量法测得的氯化钠、硝酸钾在不同温度时的溶解度,请根据表格内容及实验现象回答下列问题。
温度(℃) 20 40 50
溶解度/g NaCl 36.0 36.6 37.0
KNO3 31.6 63.9 85.5
①从上表可知,两种物质的溶解度受温度变化影响较大的是____________;
②20℃时,将等质量的NaCl、KNO3分别放入盛有100 g水的两个烧杯中,充分溶解后如图1所示,升温到50℃时如图2所示。试判断:50℃时甲烧杯中的溶液一定是______(填“饱和溶液”、“不饱和溶液”或“不能确定”)。
18.根据如图所示的甲、乙、丙的溶解度曲线,回答以下问题:
(1)P点表示的意义______。
(2)乙中含有少量甲,要提纯乙可采用的方法是______。
(3)写出一种将丙的接近饱和的溶液变成饱和溶液的方法______。
(4)t3℃时,等质量的甲、乙、丙分别配成饱和溶液,需水的质量由多到少的顺序是______。
(5)下列说法错误的是______(填序号)。
①在t2℃时,将15g甲物质放入50g水中,所得到的溶液质量为65g
②将甲的溶液由t3℃降温到t2℃,一定有晶体析出
③将t3℃时等质量的甲、乙、丙三种物质的饱和溶液都降温到t2℃,三种溶液中溶质的质量分数由大到小的顺序为乙>甲=丙
19.写出下列溶液中溶质的化学式:
①石灰水_____;
②盐酸_____;
③食盐水_____;
④白磷的二硫化碳溶液_____;
⑤医用酒精_____;
⑥锌粒溶于硫酸中_____。
20.如图是实验室配制一定溶质质量分数的NaCl溶液的流程图。
请回答
(1) 应称量___________ gNaCl,需加水___________ mL。
(2)若称量NaCl固体时指针向右偏转 ,则应_____________________直到天平平衡。
(3)取上述溶液10g加水稀释到_______________g,可得到5%的NaCl溶液。
三、实验题
21.某同学配制50g9%的氯化钠溶液,整个操作过程如图所示,回答下列问题:
(1)配制溶液的正确操作顺序为__________(填序号),其中操作错误的是__________(填序号)
(2)图②中盛放氯化钠固体的仪器名称是__________,需称取氯化钠_________g。
(3)量水时选用的量筒的量程最合适的是______(填字母),读数时视线要与量筒内_______保持水平。
A.10mL B.25mL C.50mL D.100mL
22.正确的方案设计和规范的实验操作有助于达到实验目的,请分析或改进以下实验。
实验目的 实验过程及现象 分析或改进
铁丝在氧气中燃烧 画图表示你的改进方法:_____。
探究物质溶解性的影响因素 为达到实验目的,你的改进方法是_____。
通过氢气在氧气中燃烧证明水的组成 现象:氢气燃烧,发出_____色火焰, 瓶壁发热。 该实验不能达到实验目的的原因是_____。
23.如图所示是甲、乙两种固体物质的溶解度曲线,回答下列问题:
(1)甲中混有少量的乙,可采取________________的方法提纯甲。
(2)当0℃<t<t1℃时,配制等质量的甲乙两种饱和溶液需要水的质量:甲____乙(>;<;=)。
(3)t2℃时,将75g甲的饱和溶液的溶质质量分数稀释为溶质质量分数为20%的溶液,加水的质量是_________g。
四、计算题
24.汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米3。若要在实验室用溶质质量分数为98%的浓硫酸配制这种稀硫酸630克。求:
(1)630克稀硫酸的体积是多少毫升_____?
(2)需要浓硫酸多少克________?
25.实验室用含杂质的锌与稀硫酸反应制取氢气,取8g含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应),向其中加入74.2g稀硫酸,恰好完全反应后烧杯内剩余物质的质量为82g。计算:
(1)杂质的质量________g。
(2)反应后所得溶液的溶质质量分数?试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.C
3.C
4.C
5.B
6.D
7.C
8.A
9.A
10.B
11.B
12.D
13.D
14.D
15.A
16. 饱和 ×100% 不变 增加溶剂
17. ③ 硝酸钾(或KNO3) 不饱和溶液
18.(1)t2℃时,甲、丙物质的溶解度相等
(2)蒸发结晶
(3)增加溶质(或升高温度或蒸发溶剂)
(4)丙>乙>甲
(5)①②③
19. Ca(OH)2 HCl NaCl P C2H5OH ZnSO4
20. 7.5 42.5 往左盘中继续添加氯化钠固体 30
21. ②①⑤③④ ① 广口瓶 4.5 C 凹液面的最低处
22. 将氯化钠换成硝酸钾;或硝酸钾换成氯化钠;或酒精换成水等 淡蓝/蓝 用排水法收集,集气瓶内壁上有水珠,对生成的水的检验造成干扰
23. 冷却热饱和溶液(或降温结晶) > 50
24.(1)525毫升;(2)180克
25.(1)1.5;(2)20%。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 专题一 走进化学殿堂
- 单元1 化学使生活更美好
- 单元2 如何学习化学
- 专题二 空气和水
- 单元1 多组分的空气
- 单元2 氧气
- 单元3 自然界的水
- 专题三 物质的构成
- 单元1 构成物质的微粒
- 单元2 组成物质的元素
- 单元3 纯净物组成的表示方法
- 专题四 燃料与燃烧
- 单元1 燃烧与灭火
- 单元2 碳及其化合物
- 单元3 化石燃料的利用
- 专题五 化学变化及其表示
- 单元1 化学变化是有条件的
- 单元2 质量守恒定律
- 单元3 化学方程式
- 专题六 物质的溶解
- 单元1 物质的溶解过程
- 单元2 物质的溶解性
- 单元3 物质的溶解性的改变
- 学生实验
- 实验1 实验基本操作
- 实验2 氧气的实验室制取与性质
- 实验3 燃烧的条件
- 实验4 二氧化碳的实验室制取与性质
- 实验5 一定浓度溶液的配置
