2022-2023学年化学仁爱版 专题五 化学变化及其表示 单元练习(含答案)
文档属性
| 名称 | 2022-2023学年化学仁爱版 专题五 化学变化及其表示 单元练习(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 121.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-09 00:00:00 | ||
图片预览




文档简介
2022-2023学年化学仁爱版--化学变化及其表示
一、单选题
1.将甲、乙、丙、丁四种物质置于一个完全密闭的容器中,在一定条件下反应,已知反应前后各物质的质量如下:
物质 甲 乙 丙 丁
反应前的质量/g 30 10 5 5
反应后的质量/g 2 4 m 39
下列有关说法正确的是
A.m=0
B.发生反应的甲、乙质量比为3:1
C.该反应是化合反应
D.丙一定作催化剂
2.“绿色化学”要求原料物质中所有的原子完全被利用,全部转入期望的产品中,即原子利用率为100%。一定条件下,CO和H2可以按照不同比例反应,只生成一种产物就能实现“绿色化学”,这种产物不可能是
A.甲醛(CH2O)
B.甲醇(CH4O)
C.乙醇(C2H6O)
D.乙酸(C2H4O2)
3.化学反应是在微观粒子间进行的。结合下图,下列说法正确的是
A.该反应为化合反应 B.该反应过程中原子数目减少
C.甲既是氧化物又是化合物 D.乙从液态变为气态化学性质改变
4.我国科研人员将二氧化碳高效合成为可供微生物直接利用的物质X,合成过程中主要物质向转化的微现示意图如下、下列说法错误的是
A.催化剂提高了合成效率 B.X的化学式为CH2O
C.CO2合成的过程中伴随能量变化 D.一定有含氢元素的物质参与合成反应
5.某物质1.6克在空气中充分燃烧共生成4.4克二氧化碳和3.6克水。则下列说法正确的是
①该物质中一定含有氧元素; ②该物质中一定不含氧元素; ③该物质中一定含有碳、氢元素; ④该物质的一个分子中碳、氢原子的个数比为1:4; ⑤该物质中氢元素的质量分数最大
A.①②③④⑤
B.②③④
C.③④⑤
D.②③④⑤
6.一定质量的某化合物完全燃烧,需要3.2g氧气,生成4.4g二氧化碳和1.8g水。下列判断错误的是
A.该化合物的质量为3.0g
B.该化合物一定含有碳、氢、氧三种元素
C.该化合物中碳、氢、氧的原子个数比为2:4:1
D.该化合物中碳元素的质量分数是40%
7.把一定质量的甲、乙、丙、丁四种物质放入密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如下表所示,下列说法正确的是
物质 甲 乙 丙 丁
反应前的质量/g 7 10 28 37
反应后的质量/g 14 10 33 x
A.x的值是25 B.乙一定是催化剂
C.甲和丁都是反应物 D.反应中,甲与丙发生改变的质量比是14:33
8.中国科学院首创室温制氢方案,其反应原理如图所示。下列说法错误的是
A.该反应的化学方程式是CO+H2OH2+CO2
B.该反应前后分子数目不变
C.该反应前后氢元素的化合价不变
D.反应物CO和H2O都是氧化物
9.科学家研制出一种新型的催化剂,可以去除装修残留的甲醛(CH2O),反应过程的微观示意图如下、下列说法错误的是
A.分子在化学变化中可再分 B.反应前后分子数目和原子数目均发生改变
C.反应物和生成物共有3种化合物 D.反应的化学方程式为
10.在实验室和化工生产中常用到硝酸。硝酸是一种强氧化剂,能与碳发生氧化还原反应,化学方程式为。则X是
A.NO2
B.CO
C.NO
D.N2O5
11.元素钴(Co)有多种化合价,将9.3gCo(OH)2在空气中加热至290℃时完全脱水,得到8.3g钴的氧化物,该氧化物的化学式是
A.CoO
B.CoO3
C.Co2O3
D.Co3O4
12.一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是
物质 甲 乙 丙 丁
反应前的质量/g 50 0.5 0 0
反应后的质量/g 23 X 24 3
A.X 的值等于 0
B.甲一定是化合物
C.丙和丁的质量变化比为 8:1
D.该反应是分解反应
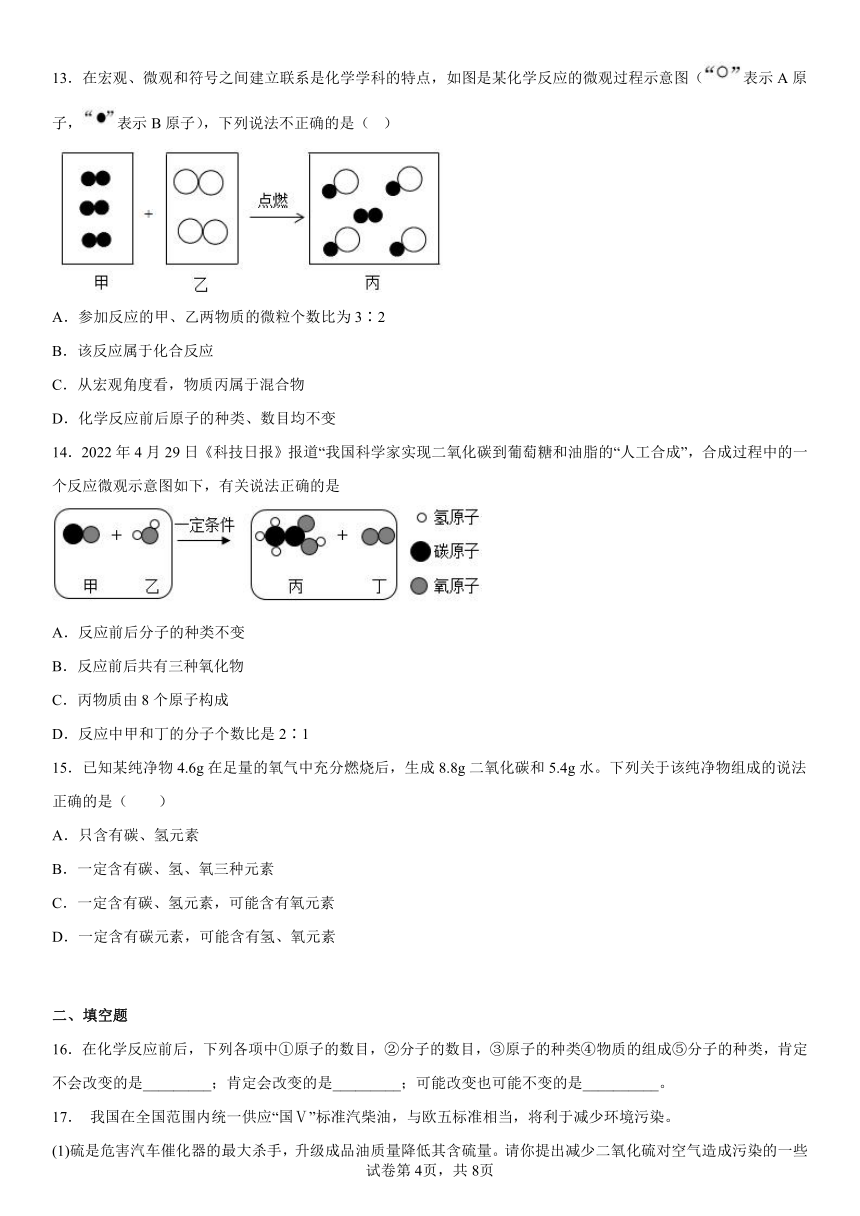
13.在宏观、微观和符号之间建立联系是化学学科的特点,如图是某化学反应的微观过程示意图(表示A原子,表示B原子),下列说法不正确的是( )
A.参加反应的甲、乙两物质的微粒个数比为3∶2
B.该反应属于化合反应
C.从宏观角度看,物质丙属于混合物
D.化学反应前后原子的种类、数目均不变
14.2022年4月29日《科技日报》报道“我国科学家实现二氧化碳到葡萄糖和油脂的“人工合成”,合成过程中的一个反应微观示意图如下,有关说法正确的是
A.反应前后分子的种类不变
B.反应前后共有三种氧化物
C.丙物质由8个原子构成
D.反应中甲和丁的分子个数比是2∶1
15.已知某纯净物4.6g在足量的氧气中充分燃烧后,生成8.8g二氧化碳和5.4g水。下列关于该纯净物组成的说法正确的是( )
A.只含有碳、氢元素
B.一定含有碳、氢、氧三种元素
C.一定含有碳、氢元素,可能含有氧元素
D.一定含有碳元素,可能含有氢、氧元素
二、填空题
16.在化学反应前后,下列各项中①原子的数目,②分子的数目,③原子的种类④物质的组成⑤分子的种类,肯定不会改变的是_________;肯定会改变的是_________;可能改变也可能不变的是__________。
17. 我国在全国范围内统一供应“国Ⅴ”标准汽柴油,与欧五标准相当,将利于减少环境污染。
(1)硫是危害汽车催化器的最大杀手,升级成品油质量降低其含硫量。请你提出减少二氧化硫对空气造成污染的一些措施有_____。
(2)空气污染监测仪是目前有关部门根据SO2和Br2在溶液中的定量反应,来监测空气中的二氧化硫含量,该反应中有氢溴酸(化学式为HBr)和硫酸生成,请写出相关的化学方程式:____。
(3)以柴油为燃料的汽车加装车用尿素溶液,使尿素溶液均匀喷入热的尾气中,并释放出氨气,其反应方程式为CO(NH2)2+X=CO2+2NH3,则X的化学式为____。喷入反应罐内的尿素溶液不能过多或过少。如果喷入过多,会造成_____。
(4)我国“国Ⅴ”标准油品中硫含量要求不大于0.001%(10ppm),油品硫含量指标限值由每千克50mg降低为每千克10mg,若一个家庭全年消耗汽油500kg,则全年二氧化硫排放量可以减少____克?(假设汽油中的硫燃烧后全部转化为二氧化硫)
18.绥中化学兴趣小组为了探究质量守恒定律,进行了如图所示的小实验。
在一根用细铜丝吊着的长玻璃管两端,分别绕上40cm长的粗铜丝,并使玻璃棒保持水平。然后用酒精灯给左边一端铜丝加热1~2分钟。停止加热后冷却,仔细观察发生的现象。冷却后,他观察到的现象是:
(1)______;
(2)______。
(3)写出下沉一端的原因______。
19.一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:
物质 A B C D
反应前质量/g 1.7 2.2 7.9 0.9
反应后质量/g 待测 6.6 0 2.7
则反应后A的质量为___________;该反应所属的基本反应类型是_____________;该反应中B和D两种物质变化的质量比为_________________。
20.下图是某反应的微观示意图。
请回答:
(1)B框中的物质属于___________(填序号:①化合物、②单质、③纯净物、④混合物)。
(2)此反应的化学方程式为_____________________________,此图说明化学反应前后发生改变的微粒是_________。
三、实验题
21.根据氧气的制取和性质的相关知识,回答下列问题:
(1)图甲装置中二氧化锰的作用是________。
(2)要获得一瓶干燥的氧气,图甲装置中导管的连接顺序为a→________。
(3)下列关于硫燃烧实验(如图乙)的相关描述合理的有________(填序号)。
①硫在空气中燃烧产生淡蓝色火焰
②硫燃烧是剧烈氧化的现象
③硫在空气和氧气中燃烧的产物不同
④集气瓶底部留有水可以减少燃烧产物对空气的污染
22.如图所示,它是通过测定白磷燃烧前后质量的变化情况来验证质量守恒定律的实验.请回答:
(1)白磷燃烧时可以观察到______;
(2)左盘锥形瓶在微热前后均要用瓶塞塞紧,原因是______;
(3)反应完成后,天平的指针______(选填“偏右”或“在分度盘中央”)。
23.某校化学兴趣小组在老师的引导下进行“化学反应中,反应物与生成物的质量关系”的实验探究。他们使用的实验装置和选用药品如图所示,现分别以A、B、C表示如下:
A、B、C三个实验分别由甲、 乙、丙三个组 的同学来完成,他们都进行了规范的操作、准确的称量和细致的观察。
(1) A实验:引燃白磷待反应结束:锥形瓶冷却后,重新放到托盘天平上称量,天平平衡。结论是:质量守恒。反应的化学方程式为_____。小气球的变化是_____。
(2)乙组同学认为B实验验证了质量守恒定律;此处反应的化学方程式是_____。
(3)丙组同学得到的错误结论是“C实验说明质量不守恒”。你认为C实验天平不平衡的原因是_____。该反应的化学方程式为_____。若用该反应验证质量守恒定律,则需将该反应置于_____容器中进行。
四、计算题
24.实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小科用相同溶质质量分数的稀盐酸和该混合物反应(所得溶液均为不饱和溶液),四组实验数据记录如下表,请分析计算:
实验组别 一 二 三 四
稀盐酸质量/g 100.0 100.0 100.0 100.0
混合物质量/g 3.0 6.0 9.0 12.0
所得溶液质量/g 101.9 103.8 105.0 a
剩余固体质量/g 0 0 m n
(1)反应后,稀盐酸还有剩余的是第________组;
(2)求混合物中碳酸钙和氯化钙的质量之比________;
(3)求表中a的值为________;
(4)求表中m的值____。
25.已知一定质量的纯净物A跟16g氧气进行充分的燃烧,恰好完全反应后,生成11g二氧化碳和9g水,请回答以下问题:
(1)参加反应的物质A的质量是_____;
(2)组成物质A的元素,一定有_____(填元素符号)
(3)物质A中各元素的质量比是多少? 试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.C
4.B
5.B
6.C
7.A
8.C
9.B
10.A
11.C
12.A
13.A
14.D
15.B
16. ①③ ④⑤ ②
17. 加强空气质量检测;限制汽车数量,大力发展公共交通;使用天然气清洁燃料等 H2O 生成多余的氨气若排入大气,会造成了新的污染 40g
18.(1)红色固体变为黑色
(2)玻璃棒向左侧倾斜
(3)铜与氧气反应后固体质量增加
19. 3.4g 分解反应 22:9
20. ② 2H2S+3O2 2SO2+2H2O 分子
21. 催化 d→e→b→c ①②④
22. 生成大量白烟。 防止空气进入锥形瓶,也防止锥形瓶中物质逸出。 在分度盘中央。
23. 先变大后变小 过氧化氢在二氧化锰催化作用下分解生成水和氧气,氧气逸出装置外导致天平不平衡 密闭
24.(1)一、二(2)5∶1(3)105.5(4)1.25 g
25.(1)4g(2)碳、氢(3)3:1
答案第1页,共2页
答案第1页,共2页
一、单选题
1.将甲、乙、丙、丁四种物质置于一个完全密闭的容器中,在一定条件下反应,已知反应前后各物质的质量如下:
物质 甲 乙 丙 丁
反应前的质量/g 30 10 5 5
反应后的质量/g 2 4 m 39
下列有关说法正确的是
A.m=0
B.发生反应的甲、乙质量比为3:1
C.该反应是化合反应
D.丙一定作催化剂
2.“绿色化学”要求原料物质中所有的原子完全被利用,全部转入期望的产品中,即原子利用率为100%。一定条件下,CO和H2可以按照不同比例反应,只生成一种产物就能实现“绿色化学”,这种产物不可能是
A.甲醛(CH2O)
B.甲醇(CH4O)
C.乙醇(C2H6O)
D.乙酸(C2H4O2)
3.化学反应是在微观粒子间进行的。结合下图,下列说法正确的是
A.该反应为化合反应 B.该反应过程中原子数目减少
C.甲既是氧化物又是化合物 D.乙从液态变为气态化学性质改变
4.我国科研人员将二氧化碳高效合成为可供微生物直接利用的物质X,合成过程中主要物质向转化的微现示意图如下、下列说法错误的是
A.催化剂提高了合成效率 B.X的化学式为CH2O
C.CO2合成的过程中伴随能量变化 D.一定有含氢元素的物质参与合成反应
5.某物质1.6克在空气中充分燃烧共生成4.4克二氧化碳和3.6克水。则下列说法正确的是
①该物质中一定含有氧元素; ②该物质中一定不含氧元素; ③该物质中一定含有碳、氢元素; ④该物质的一个分子中碳、氢原子的个数比为1:4; ⑤该物质中氢元素的质量分数最大
A.①②③④⑤
B.②③④
C.③④⑤
D.②③④⑤
6.一定质量的某化合物完全燃烧,需要3.2g氧气,生成4.4g二氧化碳和1.8g水。下列判断错误的是
A.该化合物的质量为3.0g
B.该化合物一定含有碳、氢、氧三种元素
C.该化合物中碳、氢、氧的原子个数比为2:4:1
D.该化合物中碳元素的质量分数是40%
7.把一定质量的甲、乙、丙、丁四种物质放入密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如下表所示,下列说法正确的是
物质 甲 乙 丙 丁
反应前的质量/g 7 10 28 37
反应后的质量/g 14 10 33 x
A.x的值是25 B.乙一定是催化剂
C.甲和丁都是反应物 D.反应中,甲与丙发生改变的质量比是14:33
8.中国科学院首创室温制氢方案,其反应原理如图所示。下列说法错误的是
A.该反应的化学方程式是CO+H2OH2+CO2
B.该反应前后分子数目不变
C.该反应前后氢元素的化合价不变
D.反应物CO和H2O都是氧化物
9.科学家研制出一种新型的催化剂,可以去除装修残留的甲醛(CH2O),反应过程的微观示意图如下、下列说法错误的是
A.分子在化学变化中可再分 B.反应前后分子数目和原子数目均发生改变
C.反应物和生成物共有3种化合物 D.反应的化学方程式为
10.在实验室和化工生产中常用到硝酸。硝酸是一种强氧化剂,能与碳发生氧化还原反应,化学方程式为。则X是
A.NO2
B.CO
C.NO
D.N2O5
11.元素钴(Co)有多种化合价,将9.3gCo(OH)2在空气中加热至290℃时完全脱水,得到8.3g钴的氧化物,该氧化物的化学式是
A.CoO
B.CoO3
C.Co2O3
D.Co3O4
12.一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是
物质 甲 乙 丙 丁
反应前的质量/g 50 0.5 0 0
反应后的质量/g 23 X 24 3
A.X 的值等于 0
B.甲一定是化合物
C.丙和丁的质量变化比为 8:1
D.该反应是分解反应
13.在宏观、微观和符号之间建立联系是化学学科的特点,如图是某化学反应的微观过程示意图(表示A原子,表示B原子),下列说法不正确的是( )
A.参加反应的甲、乙两物质的微粒个数比为3∶2
B.该反应属于化合反应
C.从宏观角度看,物质丙属于混合物
D.化学反应前后原子的种类、数目均不变
14.2022年4月29日《科技日报》报道“我国科学家实现二氧化碳到葡萄糖和油脂的“人工合成”,合成过程中的一个反应微观示意图如下,有关说法正确的是
A.反应前后分子的种类不变
B.反应前后共有三种氧化物
C.丙物质由8个原子构成
D.反应中甲和丁的分子个数比是2∶1
15.已知某纯净物4.6g在足量的氧气中充分燃烧后,生成8.8g二氧化碳和5.4g水。下列关于该纯净物组成的说法正确的是( )
A.只含有碳、氢元素
B.一定含有碳、氢、氧三种元素
C.一定含有碳、氢元素,可能含有氧元素
D.一定含有碳元素,可能含有氢、氧元素
二、填空题
16.在化学反应前后,下列各项中①原子的数目,②分子的数目,③原子的种类④物质的组成⑤分子的种类,肯定不会改变的是_________;肯定会改变的是_________;可能改变也可能不变的是__________。
17. 我国在全国范围内统一供应“国Ⅴ”标准汽柴油,与欧五标准相当,将利于减少环境污染。
(1)硫是危害汽车催化器的最大杀手,升级成品油质量降低其含硫量。请你提出减少二氧化硫对空气造成污染的一些措施有_____。
(2)空气污染监测仪是目前有关部门根据SO2和Br2在溶液中的定量反应,来监测空气中的二氧化硫含量,该反应中有氢溴酸(化学式为HBr)和硫酸生成,请写出相关的化学方程式:____。
(3)以柴油为燃料的汽车加装车用尿素溶液,使尿素溶液均匀喷入热的尾气中,并释放出氨气,其反应方程式为CO(NH2)2+X=CO2+2NH3,则X的化学式为____。喷入反应罐内的尿素溶液不能过多或过少。如果喷入过多,会造成_____。
(4)我国“国Ⅴ”标准油品中硫含量要求不大于0.001%(10ppm),油品硫含量指标限值由每千克50mg降低为每千克10mg,若一个家庭全年消耗汽油500kg,则全年二氧化硫排放量可以减少____克?(假设汽油中的硫燃烧后全部转化为二氧化硫)
18.绥中化学兴趣小组为了探究质量守恒定律,进行了如图所示的小实验。
在一根用细铜丝吊着的长玻璃管两端,分别绕上40cm长的粗铜丝,并使玻璃棒保持水平。然后用酒精灯给左边一端铜丝加热1~2分钟。停止加热后冷却,仔细观察发生的现象。冷却后,他观察到的现象是:
(1)______;
(2)______。
(3)写出下沉一端的原因______。
19.一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:
物质 A B C D
反应前质量/g 1.7 2.2 7.9 0.9
反应后质量/g 待测 6.6 0 2.7
则反应后A的质量为___________;该反应所属的基本反应类型是_____________;该反应中B和D两种物质变化的质量比为_________________。
20.下图是某反应的微观示意图。
请回答:
(1)B框中的物质属于___________(填序号:①化合物、②单质、③纯净物、④混合物)。
(2)此反应的化学方程式为_____________________________,此图说明化学反应前后发生改变的微粒是_________。
三、实验题
21.根据氧气的制取和性质的相关知识,回答下列问题:
(1)图甲装置中二氧化锰的作用是________。
(2)要获得一瓶干燥的氧气,图甲装置中导管的连接顺序为a→________。
(3)下列关于硫燃烧实验(如图乙)的相关描述合理的有________(填序号)。
①硫在空气中燃烧产生淡蓝色火焰
②硫燃烧是剧烈氧化的现象
③硫在空气和氧气中燃烧的产物不同
④集气瓶底部留有水可以减少燃烧产物对空气的污染
22.如图所示,它是通过测定白磷燃烧前后质量的变化情况来验证质量守恒定律的实验.请回答:
(1)白磷燃烧时可以观察到______;
(2)左盘锥形瓶在微热前后均要用瓶塞塞紧,原因是______;
(3)反应完成后,天平的指针______(选填“偏右”或“在分度盘中央”)。
23.某校化学兴趣小组在老师的引导下进行“化学反应中,反应物与生成物的质量关系”的实验探究。他们使用的实验装置和选用药品如图所示,现分别以A、B、C表示如下:
A、B、C三个实验分别由甲、 乙、丙三个组 的同学来完成,他们都进行了规范的操作、准确的称量和细致的观察。
(1) A实验:引燃白磷待反应结束:锥形瓶冷却后,重新放到托盘天平上称量,天平平衡。结论是:质量守恒。反应的化学方程式为_____。小气球的变化是_____。
(2)乙组同学认为B实验验证了质量守恒定律;此处反应的化学方程式是_____。
(3)丙组同学得到的错误结论是“C实验说明质量不守恒”。你认为C实验天平不平衡的原因是_____。该反应的化学方程式为_____。若用该反应验证质量守恒定律,则需将该反应置于_____容器中进行。
四、计算题
24.实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小科用相同溶质质量分数的稀盐酸和该混合物反应(所得溶液均为不饱和溶液),四组实验数据记录如下表,请分析计算:
实验组别 一 二 三 四
稀盐酸质量/g 100.0 100.0 100.0 100.0
混合物质量/g 3.0 6.0 9.0 12.0
所得溶液质量/g 101.9 103.8 105.0 a
剩余固体质量/g 0 0 m n
(1)反应后,稀盐酸还有剩余的是第________组;
(2)求混合物中碳酸钙和氯化钙的质量之比________;
(3)求表中a的值为________;
(4)求表中m的值____。
25.已知一定质量的纯净物A跟16g氧气进行充分的燃烧,恰好完全反应后,生成11g二氧化碳和9g水,请回答以下问题:
(1)参加反应的物质A的质量是_____;
(2)组成物质A的元素,一定有_____(填元素符号)
(3)物质A中各元素的质量比是多少? 试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.C
4.B
5.B
6.C
7.A
8.C
9.B
10.A
11.C
12.A
13.A
14.D
15.B
16. ①③ ④⑤ ②
17. 加强空气质量检测;限制汽车数量,大力发展公共交通;使用天然气清洁燃料等 H2O 生成多余的氨气若排入大气,会造成了新的污染 40g
18.(1)红色固体变为黑色
(2)玻璃棒向左侧倾斜
(3)铜与氧气反应后固体质量增加
19. 3.4g 分解反应 22:9
20. ② 2H2S+3O2 2SO2+2H2O 分子
21. 催化 d→e→b→c ①②④
22. 生成大量白烟。 防止空气进入锥形瓶,也防止锥形瓶中物质逸出。 在分度盘中央。
23. 先变大后变小 过氧化氢在二氧化锰催化作用下分解生成水和氧气,氧气逸出装置外导致天平不平衡 密闭
24.(1)一、二(2)5∶1(3)105.5(4)1.25 g
25.(1)4g(2)碳、氢(3)3:1
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 专题一 走进化学殿堂
- 单元1 化学使生活更美好
- 单元2 如何学习化学
- 专题二 空气和水
- 单元1 多组分的空气
- 单元2 氧气
- 单元3 自然界的水
- 专题三 物质的构成
- 单元1 构成物质的微粒
- 单元2 组成物质的元素
- 单元3 纯净物组成的表示方法
- 专题四 燃料与燃烧
- 单元1 燃烧与灭火
- 单元2 碳及其化合物
- 单元3 化石燃料的利用
- 专题五 化学变化及其表示
- 单元1 化学变化是有条件的
- 单元2 质量守恒定律
- 单元3 化学方程式
- 专题六 物质的溶解
- 单元1 物质的溶解过程
- 单元2 物质的溶解性
- 单元3 物质的溶解性的改变
- 学生实验
- 实验1 实验基本操作
- 实验2 氧气的实验室制取与性质
- 实验3 燃烧的条件
- 实验4 二氧化碳的实验室制取与性质
- 实验5 一定浓度溶液的配置
