2022-2023学年化学鲁教版--海水中的化学(word 含答案)
文档属性
| 名称 | 2022-2023学年化学鲁教版--海水中的化学(word 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 134.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-09 14:24:23 | ||
图片预览


文档简介
2022-2023学年化学鲁教版--海水中的化学
一、单选题
1.下列稀溶液,仅用酚酞及同组物质之间反应就能鉴别出来的一组是
A.NaOH H2SO4 HNO3 B.KOH HCI Ba (OH)2
C.NaOH NaCl Na2CO3 D.NaOH NaCl HNO3
2.下列物质的性质与用途具有对应关系的是
A.活性炭有吸附性,可用于净水 B.石墨有导电性,可用于生产铅笔芯
C.一氧化碳有可燃性,可用来炼铁 D.碳酸钙难溶于水,可用作补钙剂
3.20℃时,NaCl的溶解度为36g。配制此温度下20g质量分数为5%的NaCl溶液,下列说法正确的是( )
A.配制该溶液需要5g NaCl
B.该溶液为饱和溶液
C.将该溶液长时间敞口放置,最终有晶体析出
D.配溶液时,量取所需体积的水倒入烧杯,有少量水洒出,则所配溶液浓度小于5%
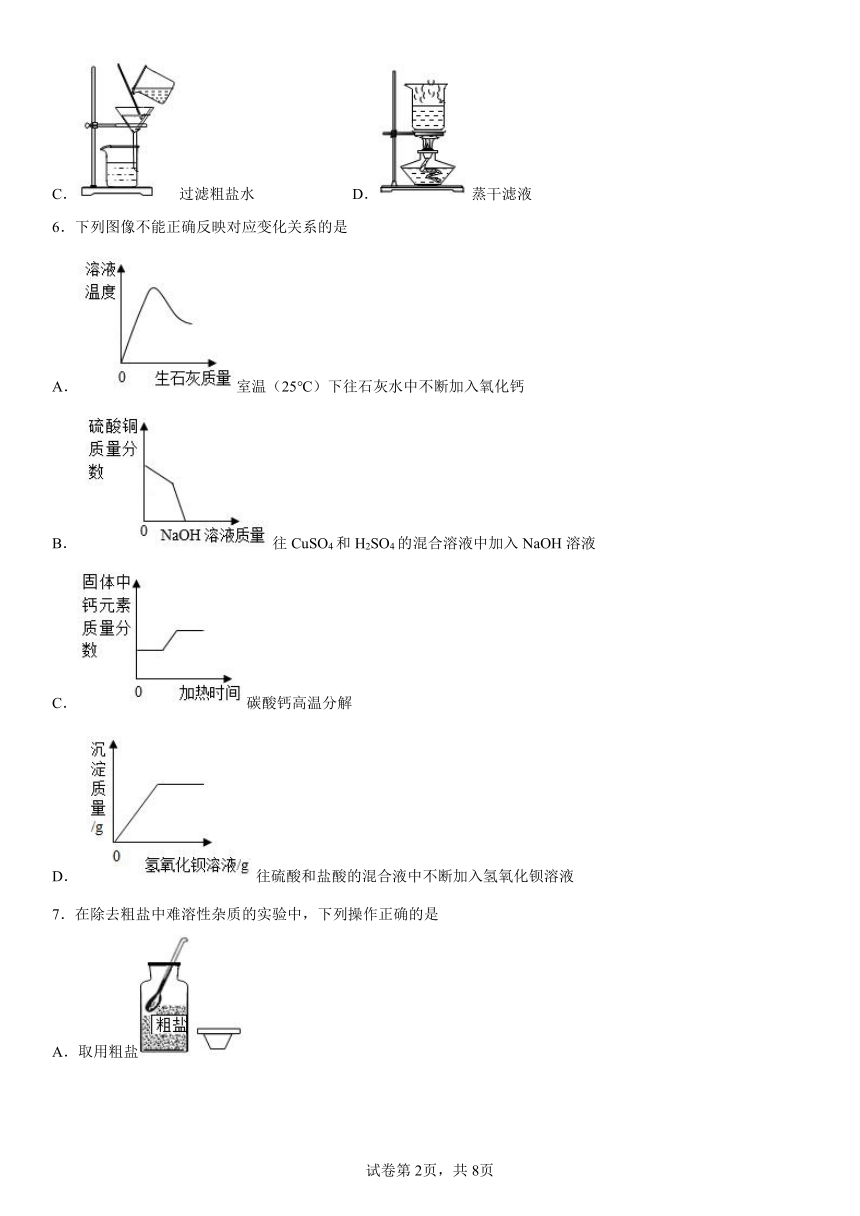
4.下图是某实验小组做粗盐提纯实验的部分操作示意图。下列有关实验叙述错误的是
A.④中缺少玻璃棒引流溶液
B.①中玻璃棒的作用是搅拌,加速粗盐溶解
C.上述操作顺序为③①②④
D.当②蒸发皿中出现较多固体时,停止加热
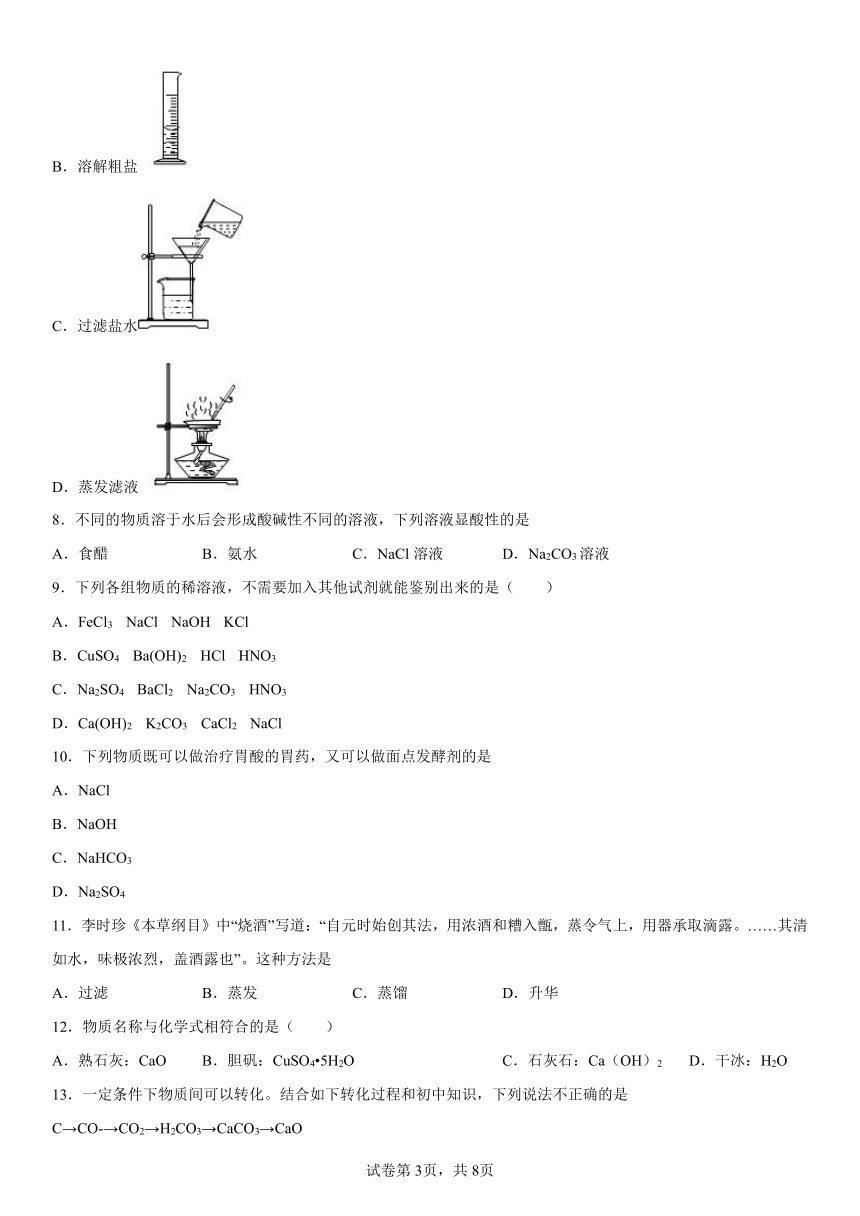
5.在“粗盐的初步提纯”实验中,下列操作正确的是( )
A.取用粗盐 B.溶解粗盐
C.过滤粗盐水 D.蒸干滤液
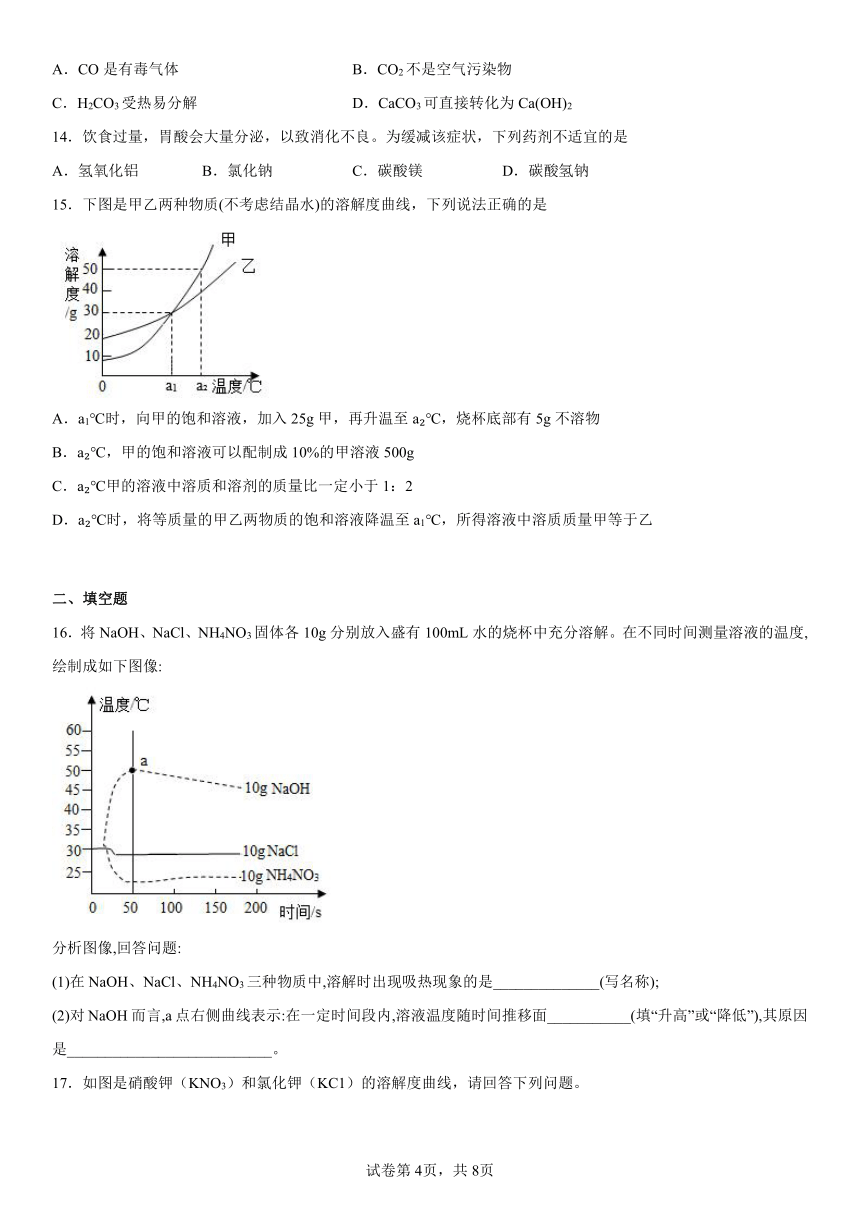
6.下列图像不能正确反映对应变化关系的是
A.室温(25℃)下往石灰水中不断加入氧化钙
B.往CuSO4和H2SO4的混合溶液中加入NaOH溶液
C.碳酸钙高温分解
D.往硫酸和盐酸的混合液中不断加入氢氧化钡溶液
7.在除去粗盐中难溶性杂质的实验中,下列操作正确的是
A.取用粗盐
B.溶解粗盐
C.过滤盐水
D.蒸发滤液
8.不同的物质溶于水后会形成酸碱性不同的溶液,下列溶液显酸性的是
A.食醋 B.氨水 C.NaCl溶液 D.Na2CO3溶液
9.下列各组物质的稀溶液,不需要加入其他试剂就能鉴别出来的是( )
A.FeCl3 NaCl NaOH KCl
B.CuSO4 Ba(OH)2 HCl HNO3
C.Na2SO4 BaCl2 Na2CO3 HNO3
D.Ca(OH)2 K2CO3 CaCl2 NaCl
10.下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是
A.NaCl
B.NaOH
C.NaHCO3
D.Na2SO4
11.李时珍《本草纲目》中“烧酒”写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上,用器承取滴露。……其清如水,味极浓烈,盖酒露也”。这种方法是
A.过滤 B.蒸发 C.蒸馏 D.升华
12.物质名称与化学式相符合的是( )
A.熟石灰:CaO B.胆矾:CuSO4 5H2O C.石灰石:Ca(OH)2 D.干冰:H2O
13.一定条件下物质间可以转化。结合如下转化过程和初中知识,下列说法不正确的是
C→CO-→CO2→H2CO3→CaCO3→CaO
A.CO是有毒气体 B.CO2不是空气污染物
C.H2CO3受热易分解 D.CaCO3可直接转化为Ca(OH)2
14.饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
15.下图是甲乙两种物质(不考虑结晶水)的溶解度曲线,下列说法正确的是
A.a1℃时,向甲的饱和溶液,加入25g甲,再升温至a ℃,烧杯底部有5g不溶物
B.a ℃,甲的饱和溶液可以配制成10%的甲溶液500g
C.a ℃甲的溶液中溶质和溶剂的质量比一定小于1:2
D.a ℃时,将等质量的甲乙两物质的饱和溶液降温至a1℃,所得溶液中溶质质量甲等于乙
二、填空题
16.将NaOH、NaCl、NH4NO3固体各10g分别放入盛有100mL水的烧杯中充分溶解。在不同时间测量溶液的温度,绘制成如下图像:
分析图像,回答问题:
(1)在NaOH、NaCl、NH4NO3三种物质中,溶解时出现吸热现象的是______________(写名称);
(2)对NaOH而言,a点右侧曲线表示:在一定时间段内,溶液温度随时间推移面___________(填“升高”或“降低”),其原因是___________________________。
17.如图是硝酸钾(KNO3)和氯化钾(KC1)的溶解度曲线,请回答下列问题。
(1)10℃时,KNO3和KCl的溶解度大小关系是:KNO3________KCl(填“>”“<”或“=”)。
(2)60℃时,将120g KNO3固体放入100g水中,充分溶解后,所得溶液的质量为________g。
(3)KNO3中混有少量的KCl,可用______________的方法提纯KNO3。
(4)据题图,下列有关说法正确的是______________。
a.KCl的不饱和溶液只能采用蒸发溶剂的方法才可变成饱和溶液
b.60℃时,KNO3溶液的溶质质量分数一定比KCl溶液的大
c.将60℃时KNO3和KC1两种溶液分别降温至10℃,析出晶体较多的是KNO3溶液
d.60℃时,从KNO3和KC1两种饱和溶液中获得等质量晶体,蒸发水较多的是KC1溶液
18.甲、乙两种物质的溶解度曲线如图所示,请回答下列问题:
(1)要使接近饱和的甲溶液变成饱和溶液,可采用的方法有_______(写一种)。
(2)将30℃时等质量的甲、乙的饱和溶液分别降温至t1℃,它们析出晶体(晶体中不含结晶水)的质量关系是_______(填“甲>乙”“甲<乙”或“甲=乙”)
19.如图是X、Y、Z三种物质的溶解度曲线图,认真阅读完成下列各小题
(1)在_____℃时,Y、Z两物质溶解度相等。
(2)t2℃时,将20gZ放入装有50g水的烧杯中,充分搅拌可能得到_______gZ的饱和溶液。
(3)在t1℃时把质量均为mg的X、Y、Z三种固体溶于水中形成饱和溶液,需水质量最多的是_。
(4)下列说法正确的有_______(只需填正确的选项序号)。
①Z物质有可能是气体
②若X中含有少量的Y,可用蒸发结晶提纯X
③将t3℃时等质量的X、Y饱和溶液同时降温到t1℃,析出晶体的质量是X>Y
④要将t1℃时接近饱和的X溶液变成饱和溶液,如不改变该溶液的组成,可选择降低温度的方法
⑤将t3℃时Z的饱和溶液降温至t2℃后,溶液的溶质质量分数会变大
(5)t2℃时,将X、Y、Z三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数由大到小的顺序是_______ 。
20.我们的胃液中含有盐酸,它有助于消化,但胃酸过多会引起胃部不适。有时可以用小苏打治疗,反应的方程式为________________,化学反应前后一定没有变化的离子是________________(离子符号表示)。
三、实验题
21.碳酸钙是一种常见的物质,在自然界中分布很广。
①检验甲、乙和丙三种均含钙元素的物质中是否含有碳酸钙。取三种物质各xg,分别进行如下实验。
现象 物质 甲 乙 丙
I中是否产生气体 否 是 是
II中是否产生沉淀 否 是 否
结论:含有碳酸钙的物质是______(选填“甲”、“乙”或“丙”)。
将xg丙磨成粉末,重复上述实验,观察到的现象是______(选填编号)。
a I中产生气体的量更多 b I中产生气泡的速率更快 c II中产生沉淀
②用石灰石为原料制取二氧化碳。
I实验室制取二氧化碳的化学方程式是______。
II搭建具有启普发生器功能的简易装置,除了长颈漏斗、多孔隔板、橡胶塞、导管、乳胶管、弹簧夹之外,下图可做反应容器的是______(选填编号)。
有同学搭建了如图装置,要使该装置也具有启普发生器的功能,需将块状石灰石放置在______(选填“A”或“B”)处。
III用向上排气法收集二氧化碳,是因为二氧化碳______。
22.下表是硝酸钾和氯化钠的部分溶解度数据,回答下列问题。
温度(℃) 0 20 40 60 80
溶解度(g/100g水) 氯化钠 35.7 36.0 36.6 37.3 38.4
硝酸钾 13.3 31.6 63.9 110.0 169.0
①60℃时,硝酸钾的溶解度是_______。
②20℃,50g水中加入30g硝酸钾,所得溶液的质量是_______g。
③若硝酸钾中混有少量的氯化钠,提纯硝酸钾可采取的方法是_______。
④在20℃时,将等质量的硝酸钾和氯化钠分别加入到各盛有100g水的甲、乙两个烧杯中,充分搅拌后如图,说法错误的是_______(填序号)。
A 烧杯甲中溶液一定是不饱和溶液
B 烧杯乙中溶液的溶质是硝酸钾
C 若使烧杯乙中固体全部溶解,其溶液浓度一定增大
D 将温度升高到50℃,烧杯乙中的固体一定全部溶解
⑤20℃时,在100g水中溶解NaCl和KNO3,进行以下实验:
Ⅰ.溶液c所含溶质为_______,固体a为_______g。
Ⅱ.对整个实验过程分析正确的是_______。
A 固体b是纯净物
B 溶液c、d中NaCl质量分数相等
C 溶液d中硝酸钾的质量小于氯化钠的质量
D 实验过程中硝酸钾溶液始终是不饱和溶液
四、计算题
23.高温煅烧贝壳(主要成分是碳酸钙)可以生成氧化钙和二氧化碳,现有10t贝壳煅烧后质量减少了2.2t,可制得氧化钙的质量是多少?(假设其它成分不参加反应)
24.把100克20℃时KNO3的饱和溶液蒸干,得到24克KNO3。则:
(1)若配制350克20℃的KNO3的饱和溶液,需KNO3_____克和H2O_____克
(2)若将78克KNO3配成20℃时的饱和溶液,需H2O多少克
25.巴中某超市卖的纯碱(Na2CO3)产品往往含有少量的氯化钠(NaCl),化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数,他们取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗盐酸100g,烧杯中没有残留不溶物,称得反应后溶液的质量为107.6g。
计算:
(1)生成二氧化碳 g。
(2)样品中纯碱的质量分数是多少?( 结果精确到0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.C
4.C
5.C
6.A
7.D
8.A
9.C
10.C
11.C
12.B
13.D
14.B
15.B
16. 氧化钠、硝酸铵 降低 溶液散失热量
17. < 210g 冷却结晶 d
18.(1)降低温度或加溶质或蒸发溶剂
(2)甲>乙
19.(1)t2
(2)65
(3)X
(4)①③④
(5)Z>Y>X
20. NaHCO3+HCl=NaCl+H2O+CO2↑ Na+ 、Cl-
21. 乙 b ac A 二氧化碳能溶于水、密度比空气大
22. 110.0g/100g水 65.8 降温结晶法 AC KNO3、NaCl 114 AD
23.可制得氧化钙的质量是2.8t。
24.(1) 84 266
(2)设加入水的质量为y,则有 。
答:需要加入水247g。
25.(1)4.4
(2)设样品中纯碱的质量为x
x=10.6g
所以样品中纯碱的质量分数是。
答:样品中纯碱的质量分数是88.3%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列稀溶液,仅用酚酞及同组物质之间反应就能鉴别出来的一组是
A.NaOH H2SO4 HNO3 B.KOH HCI Ba (OH)2
C.NaOH NaCl Na2CO3 D.NaOH NaCl HNO3
2.下列物质的性质与用途具有对应关系的是
A.活性炭有吸附性,可用于净水 B.石墨有导电性,可用于生产铅笔芯
C.一氧化碳有可燃性,可用来炼铁 D.碳酸钙难溶于水,可用作补钙剂
3.20℃时,NaCl的溶解度为36g。配制此温度下20g质量分数为5%的NaCl溶液,下列说法正确的是( )
A.配制该溶液需要5g NaCl
B.该溶液为饱和溶液
C.将该溶液长时间敞口放置,最终有晶体析出
D.配溶液时,量取所需体积的水倒入烧杯,有少量水洒出,则所配溶液浓度小于5%
4.下图是某实验小组做粗盐提纯实验的部分操作示意图。下列有关实验叙述错误的是
A.④中缺少玻璃棒引流溶液
B.①中玻璃棒的作用是搅拌,加速粗盐溶解
C.上述操作顺序为③①②④
D.当②蒸发皿中出现较多固体时,停止加热
5.在“粗盐的初步提纯”实验中,下列操作正确的是( )
A.取用粗盐 B.溶解粗盐
C.过滤粗盐水 D.蒸干滤液
6.下列图像不能正确反映对应变化关系的是
A.室温(25℃)下往石灰水中不断加入氧化钙
B.往CuSO4和H2SO4的混合溶液中加入NaOH溶液
C.碳酸钙高温分解
D.往硫酸和盐酸的混合液中不断加入氢氧化钡溶液
7.在除去粗盐中难溶性杂质的实验中,下列操作正确的是
A.取用粗盐
B.溶解粗盐
C.过滤盐水
D.蒸发滤液
8.不同的物质溶于水后会形成酸碱性不同的溶液,下列溶液显酸性的是
A.食醋 B.氨水 C.NaCl溶液 D.Na2CO3溶液
9.下列各组物质的稀溶液,不需要加入其他试剂就能鉴别出来的是( )
A.FeCl3 NaCl NaOH KCl
B.CuSO4 Ba(OH)2 HCl HNO3
C.Na2SO4 BaCl2 Na2CO3 HNO3
D.Ca(OH)2 K2CO3 CaCl2 NaCl
10.下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是
A.NaCl
B.NaOH
C.NaHCO3
D.Na2SO4
11.李时珍《本草纲目》中“烧酒”写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上,用器承取滴露。……其清如水,味极浓烈,盖酒露也”。这种方法是
A.过滤 B.蒸发 C.蒸馏 D.升华
12.物质名称与化学式相符合的是( )
A.熟石灰:CaO B.胆矾:CuSO4 5H2O C.石灰石:Ca(OH)2 D.干冰:H2O
13.一定条件下物质间可以转化。结合如下转化过程和初中知识,下列说法不正确的是
C→CO-→CO2→H2CO3→CaCO3→CaO
A.CO是有毒气体 B.CO2不是空气污染物
C.H2CO3受热易分解 D.CaCO3可直接转化为Ca(OH)2
14.饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
15.下图是甲乙两种物质(不考虑结晶水)的溶解度曲线,下列说法正确的是
A.a1℃时,向甲的饱和溶液,加入25g甲,再升温至a ℃,烧杯底部有5g不溶物
B.a ℃,甲的饱和溶液可以配制成10%的甲溶液500g
C.a ℃甲的溶液中溶质和溶剂的质量比一定小于1:2
D.a ℃时,将等质量的甲乙两物质的饱和溶液降温至a1℃,所得溶液中溶质质量甲等于乙
二、填空题
16.将NaOH、NaCl、NH4NO3固体各10g分别放入盛有100mL水的烧杯中充分溶解。在不同时间测量溶液的温度,绘制成如下图像:
分析图像,回答问题:
(1)在NaOH、NaCl、NH4NO3三种物质中,溶解时出现吸热现象的是______________(写名称);
(2)对NaOH而言,a点右侧曲线表示:在一定时间段内,溶液温度随时间推移面___________(填“升高”或“降低”),其原因是___________________________。
17.如图是硝酸钾(KNO3)和氯化钾(KC1)的溶解度曲线,请回答下列问题。
(1)10℃时,KNO3和KCl的溶解度大小关系是:KNO3________KCl(填“>”“<”或“=”)。
(2)60℃时,将120g KNO3固体放入100g水中,充分溶解后,所得溶液的质量为________g。
(3)KNO3中混有少量的KCl,可用______________的方法提纯KNO3。
(4)据题图,下列有关说法正确的是______________。
a.KCl的不饱和溶液只能采用蒸发溶剂的方法才可变成饱和溶液
b.60℃时,KNO3溶液的溶质质量分数一定比KCl溶液的大
c.将60℃时KNO3和KC1两种溶液分别降温至10℃,析出晶体较多的是KNO3溶液
d.60℃时,从KNO3和KC1两种饱和溶液中获得等质量晶体,蒸发水较多的是KC1溶液
18.甲、乙两种物质的溶解度曲线如图所示,请回答下列问题:
(1)要使接近饱和的甲溶液变成饱和溶液,可采用的方法有_______(写一种)。
(2)将30℃时等质量的甲、乙的饱和溶液分别降温至t1℃,它们析出晶体(晶体中不含结晶水)的质量关系是_______(填“甲>乙”“甲<乙”或“甲=乙”)
19.如图是X、Y、Z三种物质的溶解度曲线图,认真阅读完成下列各小题
(1)在_____℃时,Y、Z两物质溶解度相等。
(2)t2℃时,将20gZ放入装有50g水的烧杯中,充分搅拌可能得到_______gZ的饱和溶液。
(3)在t1℃时把质量均为mg的X、Y、Z三种固体溶于水中形成饱和溶液,需水质量最多的是_。
(4)下列说法正确的有_______(只需填正确的选项序号)。
①Z物质有可能是气体
②若X中含有少量的Y,可用蒸发结晶提纯X
③将t3℃时等质量的X、Y饱和溶液同时降温到t1℃,析出晶体的质量是X>Y
④要将t1℃时接近饱和的X溶液变成饱和溶液,如不改变该溶液的组成,可选择降低温度的方法
⑤将t3℃时Z的饱和溶液降温至t2℃后,溶液的溶质质量分数会变大
(5)t2℃时,将X、Y、Z三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数由大到小的顺序是_______ 。
20.我们的胃液中含有盐酸,它有助于消化,但胃酸过多会引起胃部不适。有时可以用小苏打治疗,反应的方程式为________________,化学反应前后一定没有变化的离子是________________(离子符号表示)。
三、实验题
21.碳酸钙是一种常见的物质,在自然界中分布很广。
①检验甲、乙和丙三种均含钙元素的物质中是否含有碳酸钙。取三种物质各xg,分别进行如下实验。
现象 物质 甲 乙 丙
I中是否产生气体 否 是 是
II中是否产生沉淀 否 是 否
结论:含有碳酸钙的物质是______(选填“甲”、“乙”或“丙”)。
将xg丙磨成粉末,重复上述实验,观察到的现象是______(选填编号)。
a I中产生气体的量更多 b I中产生气泡的速率更快 c II中产生沉淀
②用石灰石为原料制取二氧化碳。
I实验室制取二氧化碳的化学方程式是______。
II搭建具有启普发生器功能的简易装置,除了长颈漏斗、多孔隔板、橡胶塞、导管、乳胶管、弹簧夹之外,下图可做反应容器的是______(选填编号)。
有同学搭建了如图装置,要使该装置也具有启普发生器的功能,需将块状石灰石放置在______(选填“A”或“B”)处。
III用向上排气法收集二氧化碳,是因为二氧化碳______。
22.下表是硝酸钾和氯化钠的部分溶解度数据,回答下列问题。
温度(℃) 0 20 40 60 80
溶解度(g/100g水) 氯化钠 35.7 36.0 36.6 37.3 38.4
硝酸钾 13.3 31.6 63.9 110.0 169.0
①60℃时,硝酸钾的溶解度是_______。
②20℃,50g水中加入30g硝酸钾,所得溶液的质量是_______g。
③若硝酸钾中混有少量的氯化钠,提纯硝酸钾可采取的方法是_______。
④在20℃时,将等质量的硝酸钾和氯化钠分别加入到各盛有100g水的甲、乙两个烧杯中,充分搅拌后如图,说法错误的是_______(填序号)。
A 烧杯甲中溶液一定是不饱和溶液
B 烧杯乙中溶液的溶质是硝酸钾
C 若使烧杯乙中固体全部溶解,其溶液浓度一定增大
D 将温度升高到50℃,烧杯乙中的固体一定全部溶解
⑤20℃时,在100g水中溶解NaCl和KNO3,进行以下实验:
Ⅰ.溶液c所含溶质为_______,固体a为_______g。
Ⅱ.对整个实验过程分析正确的是_______。
A 固体b是纯净物
B 溶液c、d中NaCl质量分数相等
C 溶液d中硝酸钾的质量小于氯化钠的质量
D 实验过程中硝酸钾溶液始终是不饱和溶液
四、计算题
23.高温煅烧贝壳(主要成分是碳酸钙)可以生成氧化钙和二氧化碳,现有10t贝壳煅烧后质量减少了2.2t,可制得氧化钙的质量是多少?(假设其它成分不参加反应)
24.把100克20℃时KNO3的饱和溶液蒸干,得到24克KNO3。则:
(1)若配制350克20℃的KNO3的饱和溶液,需KNO3_____克和H2O_____克
(2)若将78克KNO3配成20℃时的饱和溶液,需H2O多少克
25.巴中某超市卖的纯碱(Na2CO3)产品往往含有少量的氯化钠(NaCl),化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数,他们取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗盐酸100g,烧杯中没有残留不溶物,称得反应后溶液的质量为107.6g。
计算:
(1)生成二氧化碳 g。
(2)样品中纯碱的质量分数是多少?( 结果精确到0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.C
4.C
5.C
6.A
7.D
8.A
9.C
10.C
11.C
12.B
13.D
14.B
15.B
16. 氧化钠、硝酸铵 降低 溶液散失热量
17. < 210g 冷却结晶 d
18.(1)降低温度或加溶质或蒸发溶剂
(2)甲>乙
19.(1)t2
(2)65
(3)X
(4)①③④
(5)Z>Y>X
20. NaHCO3+HCl=NaCl+H2O+CO2↑ Na+ 、Cl-
21. 乙 b ac A 二氧化碳能溶于水、密度比空气大
22. 110.0g/100g水 65.8 降温结晶法 AC KNO3、NaCl 114 AD
23.可制得氧化钙的质量是2.8t。
24.(1) 84 266
(2)设加入水的质量为y,则有 。
答:需要加入水247g。
25.(1)4.4
(2)设样品中纯碱的质量为x
x=10.6g
所以样品中纯碱的质量分数是。
答:样品中纯碱的质量分数是88.3%。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
