2022-2023学年化学鲁教版--常见的酸和碱(word 含答案)
文档属性
| 名称 | 2022-2023学年化学鲁教版--常见的酸和碱(word 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 126.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-09 14:14:58 | ||
图片预览



文档简介
2022-2023学年化学鲁教版-常见的酸和碱
一、单选题
1.下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的
2.如图表示稀盐酸和氢氧化钠溶液发生反应时,烧杯中溶液的pH随滴入液体体积的变化曲线及相关的实验操作,下列说法正确的是
A.该实验是将氢氧化钠溶液滴入盛有稀盐酸的烧杯中
B.当滴入液体体积为5mL时,烧杯内溶液呈酸性
C.当滴入液体体积为7mL时,盐酸和氢氧化钠恰好完全反应
D.当滴入液体体积为9mL时,烧杯内溶液中的微粒有2种
3.下列化学方程式与客观事实相符,且书写完全正确的是
A.用过氧化氢溶液制氧气:
B.铁丝在氧气中燃烧:
C.用稀硫酸除铁锈:
D.用澄清石灰水检验二氧化碳:
4.下列能使紫色石蕊试液和无色酚酞试液均变色的是
A.pH=1的盐酸
B.pH=3的硫酸
C.pH=7的氯化钠溶液
D.pH=14的氢氧化钾溶液
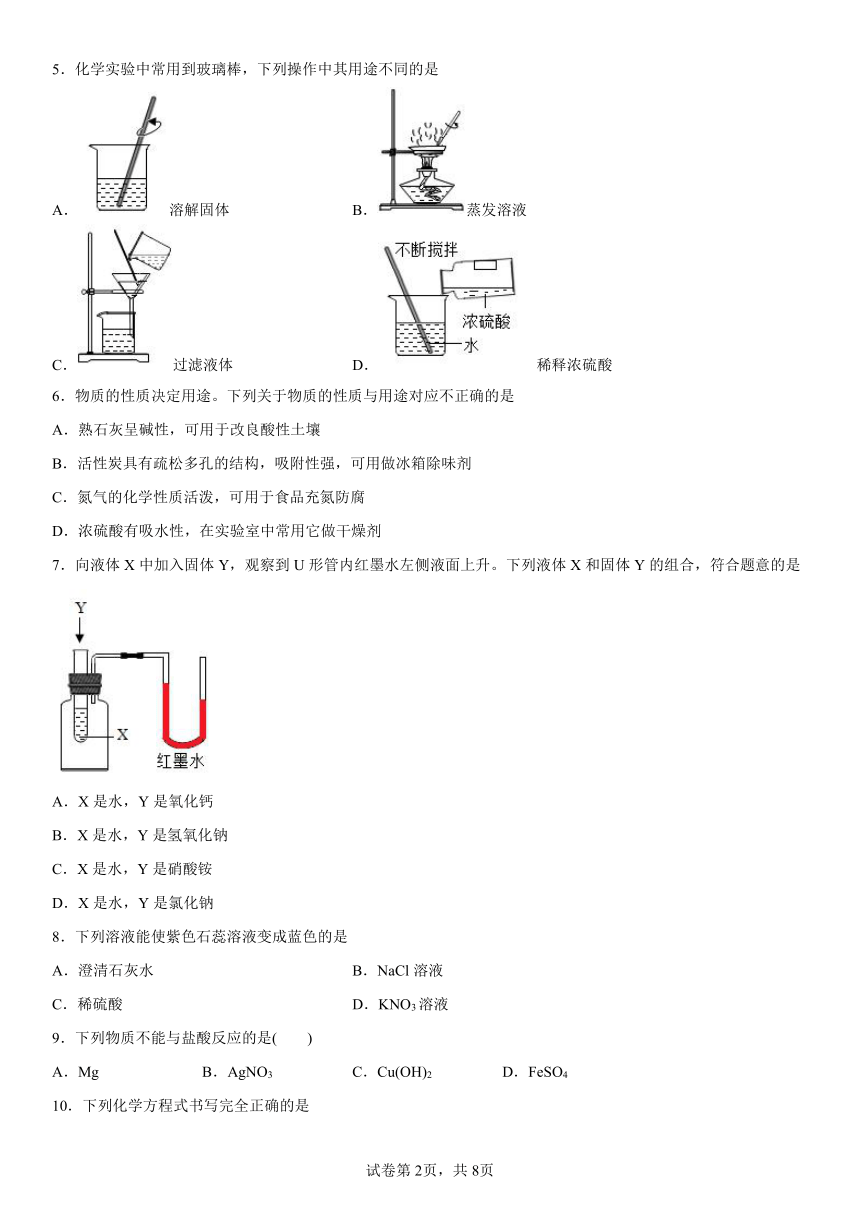
5.化学实验中常用到玻璃棒,下列操作中其用途不同的是
A.溶解固体 B.蒸发溶液
C.过滤液体 D.稀释浓硫酸
6.物质的性质决定用途。下列关于物质的性质与用途对应不正确的是
A.熟石灰呈碱性,可用于改良酸性土壤
B.活性炭具有疏松多孔的结构,吸附性强,可用做冰箱除味剂
C.氮气的化学性质活泼,可用于食品充氮防腐
D.浓硫酸有吸水性,在实验室中常用它做干燥剂
7.向液体X中加入固体Y,观察到U形管内红墨水左侧液面上升。下列液体X和固体Y的组合,符合题意的是
A.X是水,Y是氧化钙
B.X是水,Y是氢氧化钠
C.X是水,Y是硝酸铵
D.X是水,Y是氯化钠
8.下列溶液能使紫色石蕊溶液变成蓝色的是
A.澄清石灰水 B.NaCl溶液
C.稀硫酸 D.KNO3溶液
9.下列物质不能与盐酸反应的是( )
A.Mg B.AgNO3 C.Cu(OH)2 D.FeSO4
10.下列化学方程式书写完全正确的是
A.2S + 3O22SO3 B.HgOHg + O2↑
C.2NaOH + H2SO4=Na2SO4 + 2H2O D.CuSO4 + 2NaOH=Na2SO4 + Cu(OH)2
11.如图是室温下稀硫酸和氢氧化钠反应过程中的pH变化曲线。下列有关说法正确的是( )
A.图中X是氢氧化钠
B.图中a点的阴离子是OH-
C.向图中c点所示溶液中加入铁粉后,溶液中有气泡产生
D.稀硫酸与氢氧化钠溶液反应的化学方程式为:H2SO4+2NaOH═Na2SO4+H2O
12.下列现象从微观粒子的角度解释错误的是
选项 现象 解释
A 路过梨花园,闻到梨花香 分子在不停运动
B 100mL水与100mL酒精混合后体积小于200mL 分子之间有间隔
C 氢氧化钠溶液能导电 溶液中存在自由移动的钠离子、氢氧根离子
D 温度计水银球受热体积膨胀 温度升高汞原子体积变大
A.A B.B C.C D.D
13.正常情况下pH小于7的液体是
A.人体胃液 B.人体血液 C.纯碱溶液 D.生理盐水
二、填空题
14.将稀盐酸分别滴入如图所示盛有不同物质的试管中、请回答下列问题:
(1)有气泡产生的试管为______(填序号)。
(2)不与稀盐酸发生反应的物质是______。
(3)实验后试管②中溶液变为______色,该试管中发生反应的化学方程式为______。
15.学习了单质、氧化物、酸、碱、盐的性质后,发现有很多不同类别的物质在发生反应时都有盐生成(其他物质省略),如图所示。请回答:
(1)若盐是硫酸钾,则①中发生反应的化学方程式为____________。
(2)若盐是氯化亚铁,则在已显示的变化中可以通过置换反应来实现的有____________(填序号)。
(3)若盐是硝酸铜,则由⑦来实现的化学方程式为__________,属于___________(填基本反应类型)反应。
(4)图中⑤处应补充的文字是___________________(写一种,不能与图中已有信息重复)。
16.在学习“酸碱中和反应”时,老师给大家变了一个魔术一使“水”变色的杯子。操作过程及现象如图所示。
老师揭秘:“空”杯子底部事先涂抹了某种无色液体,无色的“水”是事先用两种无色溶液混合而成。请回答下列问题:
(1)“空”杯内涂抹的物质可能是_____________溶液。
(2)此过程中发生反应的化学方程式可能是_________________________________。
(3)最终溶液为无色,能否说明该溶液一定呈中性?_________(选填“能”或“不能”),理由是____________________________________________________。
17.经测定,在任何水溶液中,均存在一定数量的H+〔用n(H+)表示〕和一定数量的OH-〔用n(OH-)表示〕,n(H+)与n(OH-)的相对大小对应溶液的酸碱性如表所示:
n(H+)与n(OH-)的相对大小 溶液的酸碱性
n(H+)>n(OH-) 酸性
n(H+)=n(OH-) 中性
n(H+)<n(OH-) 碱性
据此分析
(1)常温下测得水中pH=7,可知水中n(H+)______n(OH-)(填“>”或“=”或“<”,下同)。
(2)向盛有碳酸钠溶液的试管中滴入几滴酚酞,现象是____________,原因是该溶液中n(H+)______n(OH-)。
(3)往上述试管中再滴入适量的硫酸氢钠溶液,溶液颜色褪去,说明硫酸氢钠溶液中n(H+)______n(OH-)。
18.自然界中存在的元素只有百余种,可这百余种元素构成了千万种物质。
(1)同种元素或不同种元素都能形成多种物质。
I.列举由同种元素组成的两种不同单质_______
II.由C、H元素组成的一类物质包含C2H4,C3H6,C4H8—CnH2n等多种物质,这类物质中C、H元素的质量比为_______(相对原子质量C—12 H—1)
(2)19世纪,俄国化学家雄勒和李比希发观下表中的两种物质。。
物质 主要性质
氰酸银AgCNO 白色晶体,难溶于水,密度4.0g/cm3 常温下稳定,受热会分解
雷酸银AgONC 白色晶体,不溶于水,密度4.0g/cm3 常温下稍微触碰即爆炸
I.请归纳出一例氰酸银的化学性质_______
II.氰酸银和雷酸银是否为同种物质?答:_______(填“是”或“不是”)判断理由是:_______
III.有一种反应类型,通过交换成分得到生成物,人们形象比喻成交换男女舞伴,两对男女跳交谊舞,中途交换男女舞伴,如氰酸银可由氰酸钾(KCNO)溶液与硝酸银溶液混合制得。该反应表达表达式为
三、推断题
19.初中化学常见物质A--F有如图所示转化关系(“一”表示一种物质转化为另一种物质,“一”表示相连的两种物质能发生反应)。其中A、C、D、E、F是五种不同类别的物质;B、C是由相同元素组成的氧化物;D常用于制玻璃、造纸、纺织等工业,E溶液能使紫色石蕊溶液变红,则请写出:
(1)C转化为D的化学方程式______。
(2)F与E发生反应的微观实质______。
(3)B和C化学性质不同的原因______。
20.A-F是初中化学常见的物质,常温下A、B都是无色液体,D、E是两种组成元素相同的气体,F是石灰水的主要成分。各物质之间的相互关系如图所示(“一”表示相连的物质能发生反应,“→”表示物质间的转化关系,部分反应物、生成物及反应条件已略去)。请回答。
(1)D物质的一种用途是______。
(2)C→B的转化不一定属于化合反应,例如:______(用反应物的化学式表示)。
(3)E→B反应的化学方程式:_________。
(4)B→F的反应过程中,____(填“吸收”或“放出”)热量。
四、流程题
21.水垢的主要成分是CaCO3、Mg(OH)2。从水垢中制备氯化钙的主要流程如图。
(1)滤渣的主要成分是 ______________ (填化学式),在物质分类中,该物质属于 ________ ;
(2)第③步之后加入盐酸目的是 ______________________ ,写出该反应的化学方程式: ____________________________________ ;
(3)检验软、硬水要用到 __________ ,生活中硬水软化常用的方法是 ________ 。
五、实验题
22.在学习了酸的化学性质之后,某实验小组选用稀盐酸做了如下图所示实验。
请回答下列问题:
(1)A烧杯中,铜不与稀盐酸发生反应的原因是_____。
(2)能产生气泡的是_____(填字母序号)。
(3)写出C烧杯中反应的化学方程式_____。
(4)D烧杯中,溶液由红色变为_____色,说明盐酸与氢氧化钠发生了反应。
23.有三瓶失去标签的溶质质量分数为15%、10%、5%的盐酸。选择下列仪器和药品,设计两种不同的方案,辨别出三瓶盐酸
实验仪器:温度计、量筒、秒表、烧杯、试管、剪刀、镊子
药品:镁条
提示:镁条和盐酸反应速度很快,通过观察放出气泡的速度很难准确判断盐酸浓度的大小。
(1)写出镁与盐酸反应的化学方程式:_______________。
(2)实验的关键是控制三个变量:
①在的环境温度下进行实验。
②取相同质量的镁条。
③取_____________________。
(3)你的方案是:
方案一:测定_________________。
方案—:测定____________________。
六、计算题
24.取含有MgCl2和HCl的混合溶液165.8g于烧杯中,向其中缓慢加入200g溶质质量分数为8%的NaOH溶液,恰好完全反应后过滤得到沉淀和滤液,其中滤液的质量为360g。请计算:
(1)生成沉淀的质量是多少克。
(2)原混合溶液中,MgCl2的质量是多少?
(3)恰好完全反应时,所得溶液的溶质质量分数是多少?(结果保留至0.1%)
25.欲测定某瓶稀硫酸的溶质质量分数,现取20g该样品于烧杯中,将质量分数为10%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。请回答下列问题:
(1)N点溶液中的溶质是___________(填化学式)。
(2)计算该稀硫酸的溶质质量分数。(结果精确到0.1%)
26.实验室配制了 50 g 溶质质量分数为 8%的氢氧化钠溶液,将上述配制好的溶液分成 5 份,向其中一份中加入稀硫酸,随着稀硫酸的滴加,溶液的温度变化如图所示。试回答:
(1)C 点溶液中的阴离子是______。
(2)恰好完全反应时所得溶液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.D
4.D
5.C
6.C
7.C
8.A
9.D
10.C
11.C
12.D
13.A
14.(1)③⑤
(2)铜片
(3) 黄色
15. ④⑥ 复分解 金属氧化物+酸(或非金属氧化物+碱)
16. NaOH(或氢氧化钠) NaOH +HCl=NaCl+H2O 不能 酚酞在酸性和中性条件下均显无色
17. = 溶液变红 < >
18.(1) 金刚石、石墨(O2 O3) 6:1
(2) 受热易分解 不是 物质不同,性质不同 D
19. 2NaOH+CO2===Na2CO3+H2O 氢离子和氢氧根离子结合成水分子 它们的分子构成不同
20.(1)作燃料(或治炼金属)
(2)CH4和O2
(3)
(4)放出
21. Mg(OH)2 碱 除去未反应的氢氧化钙
Ca(OH)2+2HCl=CaCl2+2H2O 肥皂水 煮沸
22. 在金属活动性顺序表中铜排在氢的后面 BE 无
23.(1)Mg+2HCl=MgCl2+H2↑
(2)相同体积的盐酸
(3) 不同浓度盐酸和镁条反应所需时间 不同浓度盐酸和镁条反应后所得溶液的温度
24.(1)5.8g;(2)9.5g;(3)6.5%
25.(1)Na2SO4、NaOH
(2)当pH值为7时,此时氢氧化钠和稀硫酸恰好完全反应,此时消耗的氢氧化钠溶液的质量为8g,则消耗NaOH溶液中的NaOH质量为8g×10%=0.8g,
设稀硫酸的溶质质量分数为x
x=4.9%
答:该稀硫酸的溶质质量分数为4.9%。
26.(1)SO42-
(2)恰好完全反应时所得溶液中溶质的质量分数为4.7 3%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的
2.如图表示稀盐酸和氢氧化钠溶液发生反应时,烧杯中溶液的pH随滴入液体体积的变化曲线及相关的实验操作,下列说法正确的是
A.该实验是将氢氧化钠溶液滴入盛有稀盐酸的烧杯中
B.当滴入液体体积为5mL时,烧杯内溶液呈酸性
C.当滴入液体体积为7mL时,盐酸和氢氧化钠恰好完全反应
D.当滴入液体体积为9mL时,烧杯内溶液中的微粒有2种
3.下列化学方程式与客观事实相符,且书写完全正确的是
A.用过氧化氢溶液制氧气:
B.铁丝在氧气中燃烧:
C.用稀硫酸除铁锈:
D.用澄清石灰水检验二氧化碳:
4.下列能使紫色石蕊试液和无色酚酞试液均变色的是
A.pH=1的盐酸
B.pH=3的硫酸
C.pH=7的氯化钠溶液
D.pH=14的氢氧化钾溶液
5.化学实验中常用到玻璃棒,下列操作中其用途不同的是
A.溶解固体 B.蒸发溶液
C.过滤液体 D.稀释浓硫酸
6.物质的性质决定用途。下列关于物质的性质与用途对应不正确的是
A.熟石灰呈碱性,可用于改良酸性土壤
B.活性炭具有疏松多孔的结构,吸附性强,可用做冰箱除味剂
C.氮气的化学性质活泼,可用于食品充氮防腐
D.浓硫酸有吸水性,在实验室中常用它做干燥剂
7.向液体X中加入固体Y,观察到U形管内红墨水左侧液面上升。下列液体X和固体Y的组合,符合题意的是
A.X是水,Y是氧化钙
B.X是水,Y是氢氧化钠
C.X是水,Y是硝酸铵
D.X是水,Y是氯化钠
8.下列溶液能使紫色石蕊溶液变成蓝色的是
A.澄清石灰水 B.NaCl溶液
C.稀硫酸 D.KNO3溶液
9.下列物质不能与盐酸反应的是( )
A.Mg B.AgNO3 C.Cu(OH)2 D.FeSO4
10.下列化学方程式书写完全正确的是
A.2S + 3O22SO3 B.HgOHg + O2↑
C.2NaOH + H2SO4=Na2SO4 + 2H2O D.CuSO4 + 2NaOH=Na2SO4 + Cu(OH)2
11.如图是室温下稀硫酸和氢氧化钠反应过程中的pH变化曲线。下列有关说法正确的是( )
A.图中X是氢氧化钠
B.图中a点的阴离子是OH-
C.向图中c点所示溶液中加入铁粉后,溶液中有气泡产生
D.稀硫酸与氢氧化钠溶液反应的化学方程式为:H2SO4+2NaOH═Na2SO4+H2O
12.下列现象从微观粒子的角度解释错误的是
选项 现象 解释
A 路过梨花园,闻到梨花香 分子在不停运动
B 100mL水与100mL酒精混合后体积小于200mL 分子之间有间隔
C 氢氧化钠溶液能导电 溶液中存在自由移动的钠离子、氢氧根离子
D 温度计水银球受热体积膨胀 温度升高汞原子体积变大
A.A B.B C.C D.D
13.正常情况下pH小于7的液体是
A.人体胃液 B.人体血液 C.纯碱溶液 D.生理盐水
二、填空题
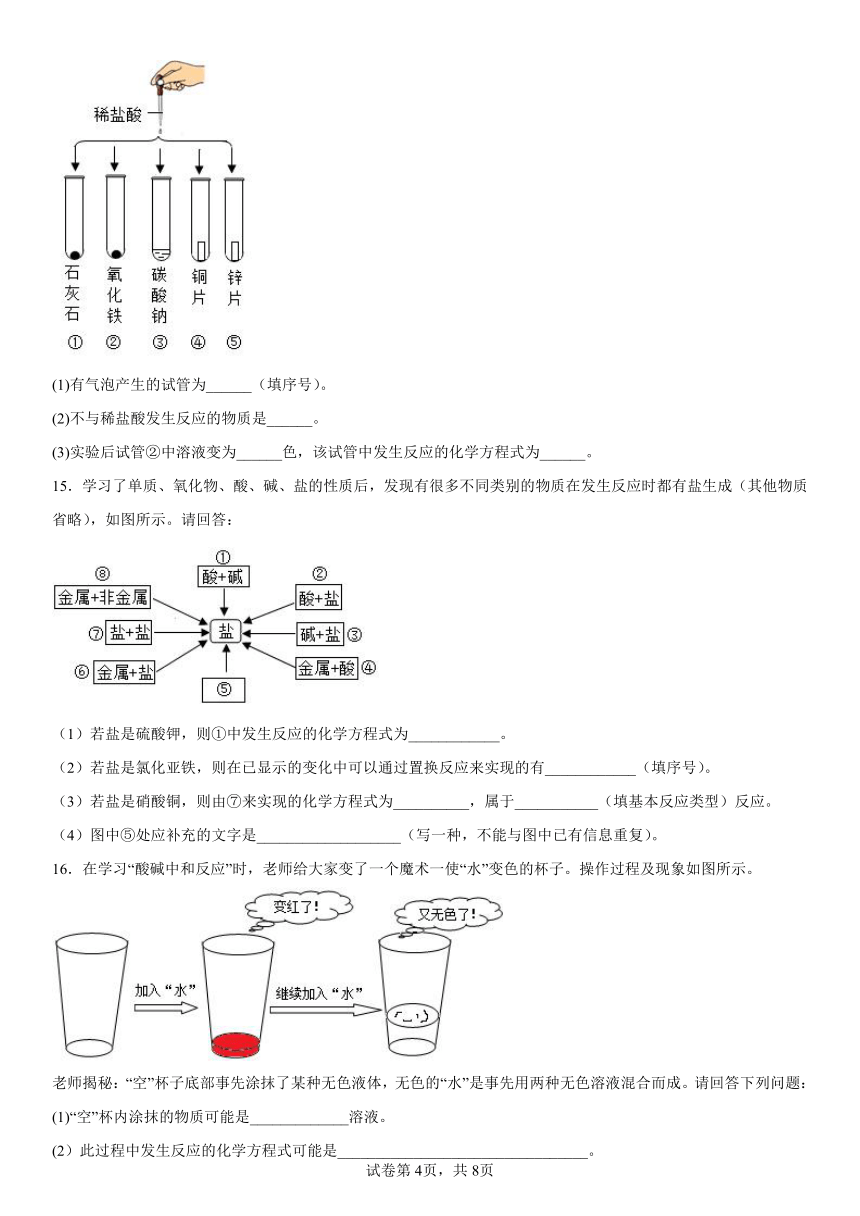
14.将稀盐酸分别滴入如图所示盛有不同物质的试管中、请回答下列问题:
(1)有气泡产生的试管为______(填序号)。
(2)不与稀盐酸发生反应的物质是______。
(3)实验后试管②中溶液变为______色,该试管中发生反应的化学方程式为______。
15.学习了单质、氧化物、酸、碱、盐的性质后,发现有很多不同类别的物质在发生反应时都有盐生成(其他物质省略),如图所示。请回答:
(1)若盐是硫酸钾,则①中发生反应的化学方程式为____________。
(2)若盐是氯化亚铁,则在已显示的变化中可以通过置换反应来实现的有____________(填序号)。
(3)若盐是硝酸铜,则由⑦来实现的化学方程式为__________,属于___________(填基本反应类型)反应。
(4)图中⑤处应补充的文字是___________________(写一种,不能与图中已有信息重复)。
16.在学习“酸碱中和反应”时,老师给大家变了一个魔术一使“水”变色的杯子。操作过程及现象如图所示。
老师揭秘:“空”杯子底部事先涂抹了某种无色液体,无色的“水”是事先用两种无色溶液混合而成。请回答下列问题:
(1)“空”杯内涂抹的物质可能是_____________溶液。
(2)此过程中发生反应的化学方程式可能是_________________________________。
(3)最终溶液为无色,能否说明该溶液一定呈中性?_________(选填“能”或“不能”),理由是____________________________________________________。
17.经测定,在任何水溶液中,均存在一定数量的H+〔用n(H+)表示〕和一定数量的OH-〔用n(OH-)表示〕,n(H+)与n(OH-)的相对大小对应溶液的酸碱性如表所示:
n(H+)与n(OH-)的相对大小 溶液的酸碱性
n(H+)>n(OH-) 酸性
n(H+)=n(OH-) 中性
n(H+)<n(OH-) 碱性
据此分析
(1)常温下测得水中pH=7,可知水中n(H+)______n(OH-)(填“>”或“=”或“<”,下同)。
(2)向盛有碳酸钠溶液的试管中滴入几滴酚酞,现象是____________,原因是该溶液中n(H+)______n(OH-)。
(3)往上述试管中再滴入适量的硫酸氢钠溶液,溶液颜色褪去,说明硫酸氢钠溶液中n(H+)______n(OH-)。
18.自然界中存在的元素只有百余种,可这百余种元素构成了千万种物质。
(1)同种元素或不同种元素都能形成多种物质。
I.列举由同种元素组成的两种不同单质_______
II.由C、H元素组成的一类物质包含C2H4,C3H6,C4H8—CnH2n等多种物质,这类物质中C、H元素的质量比为_______(相对原子质量C—12 H—1)
(2)19世纪,俄国化学家雄勒和李比希发观下表中的两种物质。。
物质 主要性质
氰酸银AgCNO 白色晶体,难溶于水,密度4.0g/cm3 常温下稳定,受热会分解
雷酸银AgONC 白色晶体,不溶于水,密度4.0g/cm3 常温下稍微触碰即爆炸
I.请归纳出一例氰酸银的化学性质_______
II.氰酸银和雷酸银是否为同种物质?答:_______(填“是”或“不是”)判断理由是:_______
III.有一种反应类型,通过交换成分得到生成物,人们形象比喻成交换男女舞伴,两对男女跳交谊舞,中途交换男女舞伴,如氰酸银可由氰酸钾(KCNO)溶液与硝酸银溶液混合制得。该反应表达表达式为
三、推断题
19.初中化学常见物质A--F有如图所示转化关系(“一”表示一种物质转化为另一种物质,“一”表示相连的两种物质能发生反应)。其中A、C、D、E、F是五种不同类别的物质;B、C是由相同元素组成的氧化物;D常用于制玻璃、造纸、纺织等工业,E溶液能使紫色石蕊溶液变红,则请写出:
(1)C转化为D的化学方程式______。
(2)F与E发生反应的微观实质______。
(3)B和C化学性质不同的原因______。
20.A-F是初中化学常见的物质,常温下A、B都是无色液体,D、E是两种组成元素相同的气体,F是石灰水的主要成分。各物质之间的相互关系如图所示(“一”表示相连的物质能发生反应,“→”表示物质间的转化关系,部分反应物、生成物及反应条件已略去)。请回答。
(1)D物质的一种用途是______。
(2)C→B的转化不一定属于化合反应,例如:______(用反应物的化学式表示)。
(3)E→B反应的化学方程式:_________。
(4)B→F的反应过程中,____(填“吸收”或“放出”)热量。
四、流程题
21.水垢的主要成分是CaCO3、Mg(OH)2。从水垢中制备氯化钙的主要流程如图。
(1)滤渣的主要成分是 ______________ (填化学式),在物质分类中,该物质属于 ________ ;
(2)第③步之后加入盐酸目的是 ______________________ ,写出该反应的化学方程式: ____________________________________ ;
(3)检验软、硬水要用到 __________ ,生活中硬水软化常用的方法是 ________ 。
五、实验题
22.在学习了酸的化学性质之后,某实验小组选用稀盐酸做了如下图所示实验。
请回答下列问题:
(1)A烧杯中,铜不与稀盐酸发生反应的原因是_____。
(2)能产生气泡的是_____(填字母序号)。
(3)写出C烧杯中反应的化学方程式_____。
(4)D烧杯中,溶液由红色变为_____色,说明盐酸与氢氧化钠发生了反应。
23.有三瓶失去标签的溶质质量分数为15%、10%、5%的盐酸。选择下列仪器和药品,设计两种不同的方案,辨别出三瓶盐酸
实验仪器:温度计、量筒、秒表、烧杯、试管、剪刀、镊子
药品:镁条
提示:镁条和盐酸反应速度很快,通过观察放出气泡的速度很难准确判断盐酸浓度的大小。
(1)写出镁与盐酸反应的化学方程式:_______________。
(2)实验的关键是控制三个变量:
①在的环境温度下进行实验。
②取相同质量的镁条。
③取_____________________。
(3)你的方案是:
方案一:测定_________________。
方案—:测定____________________。
六、计算题
24.取含有MgCl2和HCl的混合溶液165.8g于烧杯中,向其中缓慢加入200g溶质质量分数为8%的NaOH溶液,恰好完全反应后过滤得到沉淀和滤液,其中滤液的质量为360g。请计算:
(1)生成沉淀的质量是多少克。
(2)原混合溶液中,MgCl2的质量是多少?
(3)恰好完全反应时,所得溶液的溶质质量分数是多少?(结果保留至0.1%)
25.欲测定某瓶稀硫酸的溶质质量分数,现取20g该样品于烧杯中,将质量分数为10%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。请回答下列问题:
(1)N点溶液中的溶质是___________(填化学式)。
(2)计算该稀硫酸的溶质质量分数。(结果精确到0.1%)
26.实验室配制了 50 g 溶质质量分数为 8%的氢氧化钠溶液,将上述配制好的溶液分成 5 份,向其中一份中加入稀硫酸,随着稀硫酸的滴加,溶液的温度变化如图所示。试回答:
(1)C 点溶液中的阴离子是______。
(2)恰好完全反应时所得溶液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.D
4.D
5.C
6.C
7.C
8.A
9.D
10.C
11.C
12.D
13.A
14.(1)③⑤
(2)铜片
(3) 黄色
15. ④⑥ 复分解 金属氧化物+酸(或非金属氧化物+碱)
16. NaOH(或氢氧化钠) NaOH +HCl=NaCl+H2O 不能 酚酞在酸性和中性条件下均显无色
17. = 溶液变红 < >
18.(1) 金刚石、石墨(O2 O3) 6:1
(2) 受热易分解 不是 物质不同,性质不同 D
19. 2NaOH+CO2===Na2CO3+H2O 氢离子和氢氧根离子结合成水分子 它们的分子构成不同
20.(1)作燃料(或治炼金属)
(2)CH4和O2
(3)
(4)放出
21. Mg(OH)2 碱 除去未反应的氢氧化钙
Ca(OH)2+2HCl=CaCl2+2H2O 肥皂水 煮沸
22. 在金属活动性顺序表中铜排在氢的后面 BE 无
23.(1)Mg+2HCl=MgCl2+H2↑
(2)相同体积的盐酸
(3) 不同浓度盐酸和镁条反应所需时间 不同浓度盐酸和镁条反应后所得溶液的温度
24.(1)5.8g;(2)9.5g;(3)6.5%
25.(1)Na2SO4、NaOH
(2)当pH值为7时,此时氢氧化钠和稀硫酸恰好完全反应,此时消耗的氢氧化钠溶液的质量为8g,则消耗NaOH溶液中的NaOH质量为8g×10%=0.8g,
设稀硫酸的溶质质量分数为x
x=4.9%
答:该稀硫酸的溶质质量分数为4.9%。
26.(1)SO42-
(2)恰好完全反应时所得溶液中溶质的质量分数为4.7 3%。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
