化学人教版(2019)选择性必修3 1.2研究有机化合物的一般方法(共43张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 1.2研究有机化合物的一般方法(共43张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-09 19:47:26 | ||
图片预览







文档简介
(共43张PPT)
第1课时 有机化合物的分离、提纯
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
导入新课
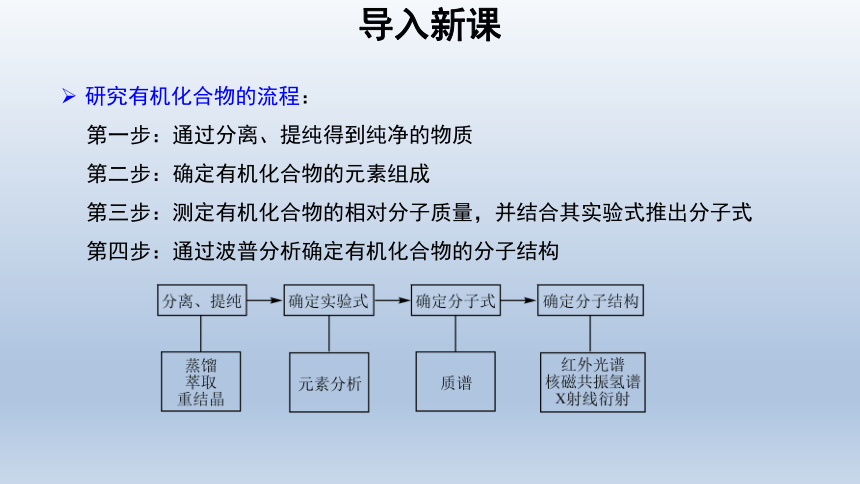
研究有机化合物的流程:
第一步:通过分离、提纯得到纯净的物质
第二步:确定有机化合物的元素组成
第三步:测定有机化合物的相对分子质量,并结合其实验式推出分子式
第四步:通过波普分析确定有机化合物的分子结构
1 .蒸馏
一、有机化合物的分离、提纯
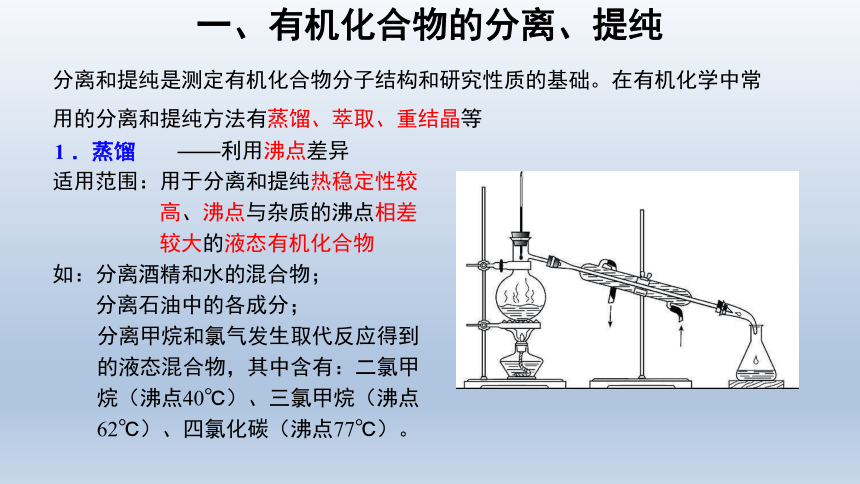
分离和提纯是测定有机化合物分子结构和研究性质的基础。在有机化学中常用的分离和提纯方法有蒸馏、萃取、重结晶等
适用范围:用于分离和提纯热稳定性较高、沸点与杂质的沸点相差较大的液态有机化合物
如:分离酒精和水的混合物;
分离石油中的各成分;
分离甲烷和氯气发生取代反应得到的液态混合物,其中含有:二氯甲烷(沸点40℃)、三氯甲烷(沸点62℃)、四氯化碳(沸点77℃)。
——利用沸点差异
一、有机化合物的分离、提纯
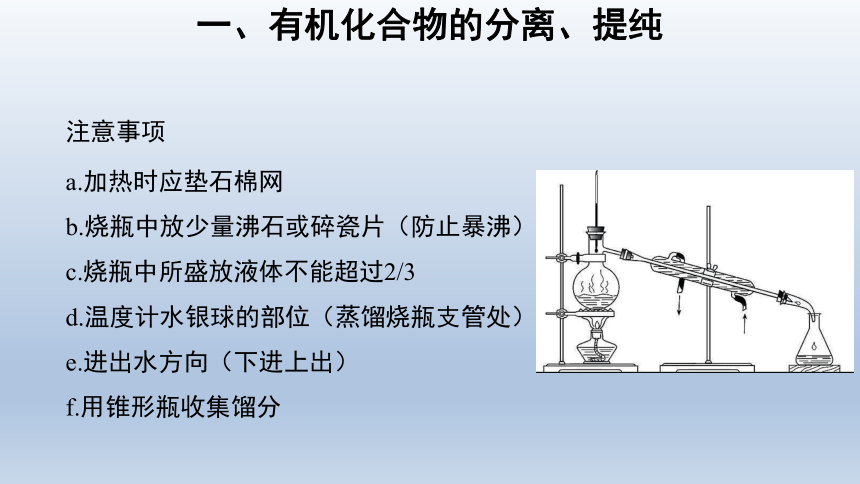
注意事项
a.加热时应垫石棉网
b.烧瓶中放少量沸石或碎瓷片(防止暴沸)
c.烧瓶中所盛放液体不能超过2/3
d.温度计水银球的部位(蒸馏烧瓶支管处)
e.进出水方向(下进上出)
f.用锥形瓶收集馏分
含杂质的工业乙醇
95.6%
工业乙醇
无水乙醇(99.5%以上)
蒸馏
加吸水剂
蒸馏
蒸馏的实际应用——无水乙醇的制取
一、有机化合物的分离、提纯
通过第一次蒸馏得到的酒精仍然含有少量水,要得到无水酒精需要加入CaO等吸水剂再蒸馏。
2 .萃取
一、有机化合物的分离、提纯
① 目的:先使有机物富集,便于后续分离提纯
② 分类:液-液萃取、固-液萃取
a.液-液萃取:利用待分离组分在两种不互溶的溶剂中的溶解性不同,将其从一种溶剂转移到另一种溶剂的过程。
萃取后用分液的方法将两层液体分开,所以萃取之后一般接着进行分液操作。
常用的萃取剂有:乙醚(C2H5OC2H5)、乙酸乙酯、二氯甲烷等
b.固-液萃取:用溶剂从固体物质中溶解出待分离组分的过程,如用酒精浸泡中药材
2 .萃取
一、有机化合物的分离、提纯
选取萃取剂的原则
① 萃取剂不能和被萃取的物质(溶质)及原溶液的溶剂发生反应
② 萃取剂和原溶液中的溶剂互不相溶
③ 萃取剂对被萃取的物质(溶质)的溶解度要远大于原溶剂
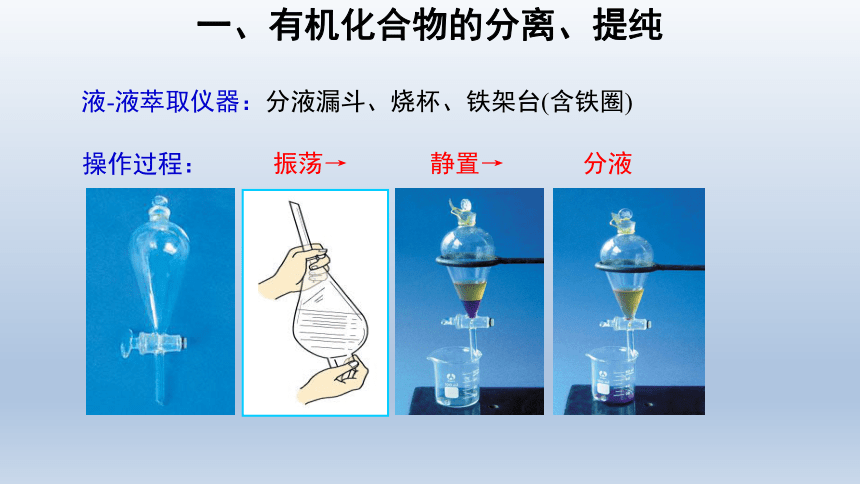
液-液萃取仪器:分液漏斗、烧杯、铁架台(含铁圈)
操作过程:
振荡→
静置→
分液
一、有机化合物的分离、提纯
一、有机化合物的分离、提纯
注意事项
a.使用前先检查分液漏斗是否漏液。
b.振荡时双手托住分液漏斗,右手按住玻璃塞,平放,用力振荡(振荡后注意放气)。
c.振荡后,使玻璃塞凹槽和小孔对齐,静置分层。
d.分液时,记住下层的为密度大的液体,从下面放出。上层的为密度相对小的液体,从上面倒出。
固-液萃取:是用有机溶剂从固体物质中溶解出有机物的过程 (专用仪器设备)
简介色谱法:阅读课本P14
利用吸附剂对不同有机物吸附作用的不同,分离、提纯有机物的方法。
例如:用粉笔分离色素……
一、有机化合物的分离、提纯
3.重结晶
一、有机化合物的分离、提纯
重结晶是提纯固体有机化合物常用的方法。
① 原理:利用被提纯物质与杂质在同一溶剂中的溶解度不同,使被提纯物质从过饱和溶液中析出,让杂质全部或大部分留在溶液中或过滤除去,从而达到提纯的目的。
② 溶剂选择要求:
对于杂质,要求溶解度很大或很小。
对于被提纯的有机化合物,要求在此溶剂中的溶解度受温度的影响较大(在较高温度时溶解度大,在低温时溶解度小),这样便于进行冷却结晶。
③ 若进行一次重结晶所得晶体纯度达不到要求,可多次进行重结晶,以提高产物的纯度。
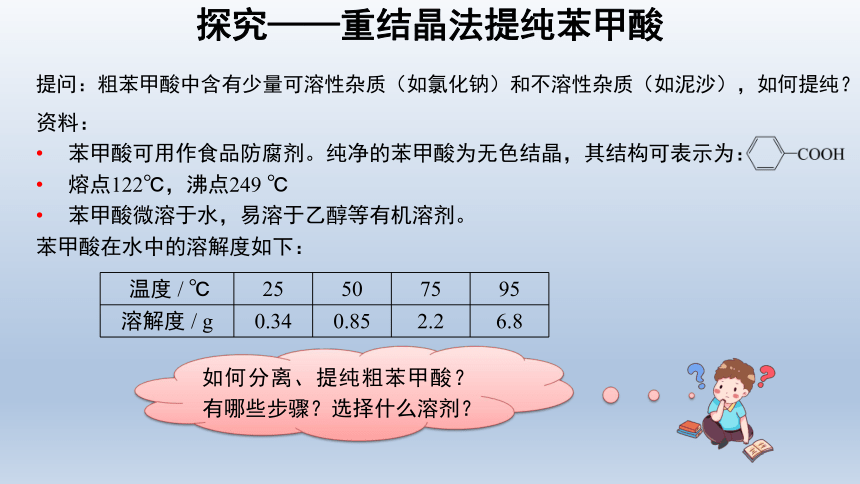
提问:粗苯甲酸中含有少量可溶性杂质(如氯化钠)和不溶性杂质(如泥沙),如何提纯?
资料:
苯甲酸可用作食品防腐剂。纯净的苯甲酸为无色结晶,其结构可表示为:
熔点122℃,沸点249 ℃
苯甲酸微溶于水,易溶于乙醇等有机溶剂。
温度 / ℃ 25 50 75 95
溶解度 / g 0.34 0.85 2.2 6.8
探究——重结晶法提纯苯甲酸
苯甲酸在水中的溶解度如下:
如何分离、提纯粗苯甲酸?有哪些步骤?选择什么溶剂?
实验步骤 加热溶解 趁热过滤 冷却结晶
实验装置
注意事项 除去不溶性杂质
除去可溶性杂质
探究——重结晶法提纯苯甲酸
趁热过滤的目的一方面是除去不溶性的杂质,另一方面是尽量减小因温度低导致过滤过程中被提纯物质析出而造成的损失
问题讨论
1.溶解粗苯甲酸时加热的作用是什么?
答:提高苯甲酸的溶解量,使其尽可能完全溶于水,同时可加快苯甲酸的溶解速率。
2.被溶解的粗苯甲酸为什么要趁热过滤?
答:防止冷却后苯甲酸提前结晶析出。
3.为什么滤液需在静置条件下缓慢结晶?
答:静置条件是为了得到均匀而较大晶体。急速冷却滤液形成的结晶小,表面积大,吸附的杂质多。
4.冷却结晶时,是不是温度越低越好?
答:不是,因为温度过低,杂质也有可能结晶出来。
5.过滤后如何洗涤苯甲酸晶体?
答:向漏斗中加入蒸馏水,至水面没过晶体,等水流完后,重复操作数次。
6.实验操作中多次使用了玻璃棒,分别起到了那些作用?
答:溶解时,搅拌,加速溶解
过滤时,引流
7.如何证明混在苯甲酸中的氯化钠已被除净?
答:用适量蒸馏水洗涤过滤器中的苯甲酸晶体,收集最后一次洗涤后的液体,滴加几滴硝酸银溶液,若无沉淀产生,则氯化钠被除尽。
问题讨论
结晶的两种方法
(1)蒸发结晶:将溶剂蒸发获取晶体,此法适用于溶解度随温度变化不大的物质,如粗盐的提纯。
(2)降温结晶:将热的饱和溶液慢慢冷却后析出晶体,此法适用于溶解度随温度变化较大的物质。如氯化钠和硝酸钾的分离。
课堂小结
常用的分离、提纯有机化合物的方法及适用范围:
方法 适用范围
分液 不互溶、密度不同的两种液体
萃取 相同温度下溶质在两种不互溶的溶剂中的溶解度相差很大
蒸馏 液态有机化合物的沸点与杂质的沸点相差较大且热稳定性较高
重结晶 固体混合物,被提纯的有机化合物在所选溶剂中的溶解度受温度的影响较大,杂质在所选溶剂中的溶解度要么很大,要么很小
课堂小结
根据给定混合物的状态、溶解性、熔沸点的差异等,选择与以上适用范围相匹配的方法即可。具体如下:
(1)
(2)
课堂小结
1.在蒸馏实验中,下列叙述不正确的是( )
A.在蒸馏烧瓶中放入几粒碎瓷片,防止液体暴沸
B.将温度计水银球放在蒸馏烧瓶支管口附近
C.冷水从冷凝管下口入,上口出
D.蒸馏烧瓶不用垫石棉网,可直接加热
D
课堂练习
2.下列说法中错误的是( )
A.用酒精萃取溴水中的溴的操作可选用分液漏斗,而后静置分液
B.进行分液时,分液漏斗中的下层液体从下口放出,上层液体则从上口倒出
C.密度不同、不互溶的液体混合物,可采用分液的方法将它们分离
D.对于热稳定性较高、沸点较高的液态有机化合物和沸点较低的杂质可用蒸馏法除杂
3.可以用分液漏斗分离的一组物质是( )
A.溴和四氯化碳 B.苯和溴苯 C.酒精和水 D.硝基苯和水
A
D
课堂练习
课堂练习
D
选项 目的 分离或提纯方法 原理
A 分离溶于水的碘 用乙醇萃取 碘在乙醇中的溶解度较大
B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C 除去KNO3固体中混杂的NaCl 重结晶 NaCl在水中的溶解度很大
D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
4.下列实验中,所采取的分离或提纯方法与原理都正确的是( )
第2课时 有机化合物组成、结构的确定
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
导入新课
2015年,我国科学家屠呦呦因为青蒿素的相关研究,获得了诺贝尔生理学或医学奖。
请同学们阅读课本P19资料:
“科学·技术·社会”
思考:青蒿素研究过程中用到了哪些分离提纯方法和测定分子结构的方法?
1.元素的定性、定量分析是用化学方法测定有机化合物的元素组成,以及各元素的质量分数。
新知讲解
一、确定实验式
2.元素的定量分析
(1)原理
将一定量的有机化合物燃烧
转化为简单的无机化合物
定量测定
推算有机物各元素质量分数
计算有机物各元素原子最简整数比
确定实验式(最简式)
用KOH浓溶液吸收
用无水CaCl2吸收
加CuO氧化
(2)李比希的燃烧分析法
李比希及李比希元素分析仪
取一定量仅含C、H、O元素的有机化合物
H2O
CO2
测得吸收剂吸收前后的质量差
测得吸收剂吸收前后的质量差
计算碳、氢元素的质量分数
剩余的为氧元素的质量分数
有机化合物的实验式
新知讲解
例题:某种含C、H、O三种元素的未知物A,经燃烧分析实验测得其中碳的质量分数为52.2%,氢的质量分数为13.1%。试求该未知物A的实验式。
新知讲解
解:(1)计算该有机化合物中氧元素的质量分数:
w(O)=100%-52.2%-13.1%=34.7%
(2)计算该有机化合物分子内各元素原子的个数比:
N(C):N(H):N(O)=
=2:6:1
答:该未知物A的实验式为C2H6O。
新知讲解
(3)现代元素定量分析
现代元素分析仪
元素定量分析
实验式
分子式
相对分子质量
测定相对分子质量最精确快捷的方法——质谱法
用高能电子流轰击分子,使其失去电子变成带正电荷的分子离子和碎片离子,带正电荷的分子离子和碎片离子具有不同质量,它们在磁场下达到检测器的时间不同,结果被记录为质谱图。
二、确定分子式
新知讲解
由于分子离子的质荷比越大,达到检测器需要的时间最长,因此谱图中的质荷比最大的就是未知物的相对分子质量
(1)质荷比是什么?
(2)如何确定有机物的相对分子质量?
分子离子与碎片离子的相对质量与其电荷的比值
质谱仪
新知讲解
未知化合物A的质谱图
结论:A的相对分子质量为46
新知讲解
A的分子式为C2H6O
小结:确定相对分子质量的常用方法:
(1)根据标准状况下气体的密度:
M = 22.4 L/mol ×ρ g/L = 22.4ρ g/mol
(2)依据气体的相对密度:
M1 = ρD M2(D) (注: ρD 表示未知气体相对于气体D的密度)
(3)混合物的平均相对分子质量:
(4)运用质谱法测定相对分子质量
课堂小结
三、确定分子结构
例:未知物A的分子式为C2H6O,其结构可能是什么?
确定有机物结构式的一般步骤是:
(1)根据分子式写出可能的同分异构体
(2)利用该物质的性质推测可能含有的官能团,最后确定正确的结构
新知讲解
红外光谱法确定有机物结构的原理:
由于有机物中组成化学键、官能团的原子处于不断振动状态,且振动频率与红外光的振动频谱相当。所以,当用红外线照射有机物分子时,分子中的化学键、官能团可发生振动吸收,不同的化学键、官能团吸收频率不同,在红外光谱图中将处于不同位置。因此,我们就可以根据红外光谱图,推知有机物含有哪些化学键、官能团,以确定有机物的结构。
通过红外光谱法可以获取有机物分子中所含化学键和官能团的信息。
1.红外光谱
新知讲解
通过红外光谱可以获得化学键和官能团的信息
结论:A中含有O-H、C-O、C-H,所以A为CH3CH2OH
新知讲解
通过核磁共振氢谱可以获取有机物分子中有几种不同类型的氢原子及它们的相对数目等信息
对于CH3CH2OH、CH3—O—CH3这两种物质来说,除了氧原子的位置、连接方式不同外,碳原子、氢原子的连接方式也不同、所处的环境不同,即等效碳、等效氢的种数不同。
处在不同化学环境中的氢原子因产生共振时吸收电磁波的频率不同,在谱图上出现的位置也不同,这种差异叫化学位移δ。
从核磁共振氢图谱上可推知该有机物分子有几种不同类型的氢原子(波峰数)及它们的数目比(波峰面积比)。
2.核磁共振氢谱
新知讲解
CH3CH2OH的红外光谱
可以推知未知物A分子有3种不同类型的氢原子及它们的数目比为3:2:1
因此,A的结构为:
H H
H-C-C-O-H
H H
新知讲解
X射线衍射分为多晶粉末衍射和单晶衍射法,可以测定有机化合物晶体结构和分子结构。
新知讲解
3.X射线衍射
X射线晶体结构分析是利用晶体的X射线衍射现象来测定晶体及分子的结构。
通过X射线衍射可简单理解为当一束平行的X射线投射在晶体上时,大部分入射线穿过晶体沿原方向前进,而部分射线却偏离了入射方向。
1.2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的(10-9 g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+ ……,然后测定其质荷比。某有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是
A 甲醇 B 甲烷 C 丙烷 D 乙烯
课堂练习
2.下图是一种分子式为C4H8O2的有机物的红外光谱谱图,则该有机物的结构简式为:
C—O—C
C=O
不对称CH3
CH3COOCH2CH3
课堂练习
3.某有机物只含有碳、氢、氧三种元素,其相对分子质量为70,红外光谱表征到碳碳双键和C=O的存在,核磁共振氢谱如图所示:
说明:这四种峰的面积比是:1:1:1:3
②写出该有机物可能的结构简式:
①写出该有机物的分子式:
C4H6O
CH3CH=CHCHO
课堂练习
4.下列化合物的核磁共振氢谱中出现三组峰的是( )
A. 2,2,3,3-四甲基丁烷 B. 2,3,4-三甲基戊烷
C. 3,4-二甲基己烷 D. 2,5-二甲基己烷
D
课堂练习
5.在核磁共振氢谱中出现3组峰,且氢原子个数比为3:1:4的化合物是( )
A. B.
C. D.
C
6.将有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g和8.8 g ,消耗氧气6.72 L(标准状况下),则该物质的最简式为________,若要确定其分子式,_____(填“是”或“否”)需有其他条件。已知有机物A的核磁共振氢谱、质谱如图所示,则A的结构简式为______________。
C2H6O
否
CH3CH2OH
课堂练习
课堂小结
有机物结构的确定方法思路
确定实验式——元素分析
确定分子式——质谱法
基团性质
空间排列
基团位置
确定分子结构——波谱分析
具体方法
红外光谱法
核磁共振氢谱
根据价键规律推断
典型特征反应实验
第1课时 有机化合物的分离、提纯
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
导入新课
研究有机化合物的流程:
第一步:通过分离、提纯得到纯净的物质
第二步:确定有机化合物的元素组成
第三步:测定有机化合物的相对分子质量,并结合其实验式推出分子式
第四步:通过波普分析确定有机化合物的分子结构
1 .蒸馏
一、有机化合物的分离、提纯
分离和提纯是测定有机化合物分子结构和研究性质的基础。在有机化学中常用的分离和提纯方法有蒸馏、萃取、重结晶等
适用范围:用于分离和提纯热稳定性较高、沸点与杂质的沸点相差较大的液态有机化合物
如:分离酒精和水的混合物;
分离石油中的各成分;
分离甲烷和氯气发生取代反应得到的液态混合物,其中含有:二氯甲烷(沸点40℃)、三氯甲烷(沸点62℃)、四氯化碳(沸点77℃)。
——利用沸点差异
一、有机化合物的分离、提纯
注意事项
a.加热时应垫石棉网
b.烧瓶中放少量沸石或碎瓷片(防止暴沸)
c.烧瓶中所盛放液体不能超过2/3
d.温度计水银球的部位(蒸馏烧瓶支管处)
e.进出水方向(下进上出)
f.用锥形瓶收集馏分
含杂质的工业乙醇
95.6%
工业乙醇
无水乙醇(99.5%以上)
蒸馏
加吸水剂
蒸馏
蒸馏的实际应用——无水乙醇的制取
一、有机化合物的分离、提纯
通过第一次蒸馏得到的酒精仍然含有少量水,要得到无水酒精需要加入CaO等吸水剂再蒸馏。
2 .萃取
一、有机化合物的分离、提纯
① 目的:先使有机物富集,便于后续分离提纯
② 分类:液-液萃取、固-液萃取
a.液-液萃取:利用待分离组分在两种不互溶的溶剂中的溶解性不同,将其从一种溶剂转移到另一种溶剂的过程。
萃取后用分液的方法将两层液体分开,所以萃取之后一般接着进行分液操作。
常用的萃取剂有:乙醚(C2H5OC2H5)、乙酸乙酯、二氯甲烷等
b.固-液萃取:用溶剂从固体物质中溶解出待分离组分的过程,如用酒精浸泡中药材
2 .萃取
一、有机化合物的分离、提纯
选取萃取剂的原则
① 萃取剂不能和被萃取的物质(溶质)及原溶液的溶剂发生反应
② 萃取剂和原溶液中的溶剂互不相溶
③ 萃取剂对被萃取的物质(溶质)的溶解度要远大于原溶剂
液-液萃取仪器:分液漏斗、烧杯、铁架台(含铁圈)
操作过程:
振荡→
静置→
分液
一、有机化合物的分离、提纯
一、有机化合物的分离、提纯
注意事项
a.使用前先检查分液漏斗是否漏液。
b.振荡时双手托住分液漏斗,右手按住玻璃塞,平放,用力振荡(振荡后注意放气)。
c.振荡后,使玻璃塞凹槽和小孔对齐,静置分层。
d.分液时,记住下层的为密度大的液体,从下面放出。上层的为密度相对小的液体,从上面倒出。
固-液萃取:是用有机溶剂从固体物质中溶解出有机物的过程 (专用仪器设备)
简介色谱法:阅读课本P14
利用吸附剂对不同有机物吸附作用的不同,分离、提纯有机物的方法。
例如:用粉笔分离色素……
一、有机化合物的分离、提纯
3.重结晶
一、有机化合物的分离、提纯
重结晶是提纯固体有机化合物常用的方法。
① 原理:利用被提纯物质与杂质在同一溶剂中的溶解度不同,使被提纯物质从过饱和溶液中析出,让杂质全部或大部分留在溶液中或过滤除去,从而达到提纯的目的。
② 溶剂选择要求:
对于杂质,要求溶解度很大或很小。
对于被提纯的有机化合物,要求在此溶剂中的溶解度受温度的影响较大(在较高温度时溶解度大,在低温时溶解度小),这样便于进行冷却结晶。
③ 若进行一次重结晶所得晶体纯度达不到要求,可多次进行重结晶,以提高产物的纯度。
提问:粗苯甲酸中含有少量可溶性杂质(如氯化钠)和不溶性杂质(如泥沙),如何提纯?
资料:
苯甲酸可用作食品防腐剂。纯净的苯甲酸为无色结晶,其结构可表示为:
熔点122℃,沸点249 ℃
苯甲酸微溶于水,易溶于乙醇等有机溶剂。
温度 / ℃ 25 50 75 95
溶解度 / g 0.34 0.85 2.2 6.8
探究——重结晶法提纯苯甲酸
苯甲酸在水中的溶解度如下:
如何分离、提纯粗苯甲酸?有哪些步骤?选择什么溶剂?
实验步骤 加热溶解 趁热过滤 冷却结晶
实验装置
注意事项 除去不溶性杂质
除去可溶性杂质
探究——重结晶法提纯苯甲酸
趁热过滤的目的一方面是除去不溶性的杂质,另一方面是尽量减小因温度低导致过滤过程中被提纯物质析出而造成的损失
问题讨论
1.溶解粗苯甲酸时加热的作用是什么?
答:提高苯甲酸的溶解量,使其尽可能完全溶于水,同时可加快苯甲酸的溶解速率。
2.被溶解的粗苯甲酸为什么要趁热过滤?
答:防止冷却后苯甲酸提前结晶析出。
3.为什么滤液需在静置条件下缓慢结晶?
答:静置条件是为了得到均匀而较大晶体。急速冷却滤液形成的结晶小,表面积大,吸附的杂质多。
4.冷却结晶时,是不是温度越低越好?
答:不是,因为温度过低,杂质也有可能结晶出来。
5.过滤后如何洗涤苯甲酸晶体?
答:向漏斗中加入蒸馏水,至水面没过晶体,等水流完后,重复操作数次。
6.实验操作中多次使用了玻璃棒,分别起到了那些作用?
答:溶解时,搅拌,加速溶解
过滤时,引流
7.如何证明混在苯甲酸中的氯化钠已被除净?
答:用适量蒸馏水洗涤过滤器中的苯甲酸晶体,收集最后一次洗涤后的液体,滴加几滴硝酸银溶液,若无沉淀产生,则氯化钠被除尽。
问题讨论
结晶的两种方法
(1)蒸发结晶:将溶剂蒸发获取晶体,此法适用于溶解度随温度变化不大的物质,如粗盐的提纯。
(2)降温结晶:将热的饱和溶液慢慢冷却后析出晶体,此法适用于溶解度随温度变化较大的物质。如氯化钠和硝酸钾的分离。
课堂小结
常用的分离、提纯有机化合物的方法及适用范围:
方法 适用范围
分液 不互溶、密度不同的两种液体
萃取 相同温度下溶质在两种不互溶的溶剂中的溶解度相差很大
蒸馏 液态有机化合物的沸点与杂质的沸点相差较大且热稳定性较高
重结晶 固体混合物,被提纯的有机化合物在所选溶剂中的溶解度受温度的影响较大,杂质在所选溶剂中的溶解度要么很大,要么很小
课堂小结
根据给定混合物的状态、溶解性、熔沸点的差异等,选择与以上适用范围相匹配的方法即可。具体如下:
(1)
(2)
课堂小结
1.在蒸馏实验中,下列叙述不正确的是( )
A.在蒸馏烧瓶中放入几粒碎瓷片,防止液体暴沸
B.将温度计水银球放在蒸馏烧瓶支管口附近
C.冷水从冷凝管下口入,上口出
D.蒸馏烧瓶不用垫石棉网,可直接加热
D
课堂练习
2.下列说法中错误的是( )
A.用酒精萃取溴水中的溴的操作可选用分液漏斗,而后静置分液
B.进行分液时,分液漏斗中的下层液体从下口放出,上层液体则从上口倒出
C.密度不同、不互溶的液体混合物,可采用分液的方法将它们分离
D.对于热稳定性较高、沸点较高的液态有机化合物和沸点较低的杂质可用蒸馏法除杂
3.可以用分液漏斗分离的一组物质是( )
A.溴和四氯化碳 B.苯和溴苯 C.酒精和水 D.硝基苯和水
A
D
课堂练习
课堂练习
D
选项 目的 分离或提纯方法 原理
A 分离溶于水的碘 用乙醇萃取 碘在乙醇中的溶解度较大
B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C 除去KNO3固体中混杂的NaCl 重结晶 NaCl在水中的溶解度很大
D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
4.下列实验中,所采取的分离或提纯方法与原理都正确的是( )
第2课时 有机化合物组成、结构的确定
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
导入新课
2015年,我国科学家屠呦呦因为青蒿素的相关研究,获得了诺贝尔生理学或医学奖。
请同学们阅读课本P19资料:
“科学·技术·社会”
思考:青蒿素研究过程中用到了哪些分离提纯方法和测定分子结构的方法?
1.元素的定性、定量分析是用化学方法测定有机化合物的元素组成,以及各元素的质量分数。
新知讲解
一、确定实验式
2.元素的定量分析
(1)原理
将一定量的有机化合物燃烧
转化为简单的无机化合物
定量测定
推算有机物各元素质量分数
计算有机物各元素原子最简整数比
确定实验式(最简式)
用KOH浓溶液吸收
用无水CaCl2吸收
加CuO氧化
(2)李比希的燃烧分析法
李比希及李比希元素分析仪
取一定量仅含C、H、O元素的有机化合物
H2O
CO2
测得吸收剂吸收前后的质量差
测得吸收剂吸收前后的质量差
计算碳、氢元素的质量分数
剩余的为氧元素的质量分数
有机化合物的实验式
新知讲解
例题:某种含C、H、O三种元素的未知物A,经燃烧分析实验测得其中碳的质量分数为52.2%,氢的质量分数为13.1%。试求该未知物A的实验式。
新知讲解
解:(1)计算该有机化合物中氧元素的质量分数:
w(O)=100%-52.2%-13.1%=34.7%
(2)计算该有机化合物分子内各元素原子的个数比:
N(C):N(H):N(O)=
=2:6:1
答:该未知物A的实验式为C2H6O。
新知讲解
(3)现代元素定量分析
现代元素分析仪
元素定量分析
实验式
分子式
相对分子质量
测定相对分子质量最精确快捷的方法——质谱法
用高能电子流轰击分子,使其失去电子变成带正电荷的分子离子和碎片离子,带正电荷的分子离子和碎片离子具有不同质量,它们在磁场下达到检测器的时间不同,结果被记录为质谱图。
二、确定分子式
新知讲解
由于分子离子的质荷比越大,达到检测器需要的时间最长,因此谱图中的质荷比最大的就是未知物的相对分子质量
(1)质荷比是什么?
(2)如何确定有机物的相对分子质量?
分子离子与碎片离子的相对质量与其电荷的比值
质谱仪
新知讲解
未知化合物A的质谱图
结论:A的相对分子质量为46
新知讲解
A的分子式为C2H6O
小结:确定相对分子质量的常用方法:
(1)根据标准状况下气体的密度:
M = 22.4 L/mol ×ρ g/L = 22.4ρ g/mol
(2)依据气体的相对密度:
M1 = ρD M2(D) (注: ρD 表示未知气体相对于气体D的密度)
(3)混合物的平均相对分子质量:
(4)运用质谱法测定相对分子质量
课堂小结
三、确定分子结构
例:未知物A的分子式为C2H6O,其结构可能是什么?
确定有机物结构式的一般步骤是:
(1)根据分子式写出可能的同分异构体
(2)利用该物质的性质推测可能含有的官能团,最后确定正确的结构
新知讲解
红外光谱法确定有机物结构的原理:
由于有机物中组成化学键、官能团的原子处于不断振动状态,且振动频率与红外光的振动频谱相当。所以,当用红外线照射有机物分子时,分子中的化学键、官能团可发生振动吸收,不同的化学键、官能团吸收频率不同,在红外光谱图中将处于不同位置。因此,我们就可以根据红外光谱图,推知有机物含有哪些化学键、官能团,以确定有机物的结构。
通过红外光谱法可以获取有机物分子中所含化学键和官能团的信息。
1.红外光谱
新知讲解
通过红外光谱可以获得化学键和官能团的信息
结论:A中含有O-H、C-O、C-H,所以A为CH3CH2OH
新知讲解
通过核磁共振氢谱可以获取有机物分子中有几种不同类型的氢原子及它们的相对数目等信息
对于CH3CH2OH、CH3—O—CH3这两种物质来说,除了氧原子的位置、连接方式不同外,碳原子、氢原子的连接方式也不同、所处的环境不同,即等效碳、等效氢的种数不同。
处在不同化学环境中的氢原子因产生共振时吸收电磁波的频率不同,在谱图上出现的位置也不同,这种差异叫化学位移δ。
从核磁共振氢图谱上可推知该有机物分子有几种不同类型的氢原子(波峰数)及它们的数目比(波峰面积比)。
2.核磁共振氢谱
新知讲解
CH3CH2OH的红外光谱
可以推知未知物A分子有3种不同类型的氢原子及它们的数目比为3:2:1
因此,A的结构为:
H H
H-C-C-O-H
H H
新知讲解
X射线衍射分为多晶粉末衍射和单晶衍射法,可以测定有机化合物晶体结构和分子结构。
新知讲解
3.X射线衍射
X射线晶体结构分析是利用晶体的X射线衍射现象来测定晶体及分子的结构。
通过X射线衍射可简单理解为当一束平行的X射线投射在晶体上时,大部分入射线穿过晶体沿原方向前进,而部分射线却偏离了入射方向。
1.2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的(10-9 g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+ ……,然后测定其质荷比。某有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是
A 甲醇 B 甲烷 C 丙烷 D 乙烯
课堂练习
2.下图是一种分子式为C4H8O2的有机物的红外光谱谱图,则该有机物的结构简式为:
C—O—C
C=O
不对称CH3
CH3COOCH2CH3
课堂练习
3.某有机物只含有碳、氢、氧三种元素,其相对分子质量为70,红外光谱表征到碳碳双键和C=O的存在,核磁共振氢谱如图所示:
说明:这四种峰的面积比是:1:1:1:3
②写出该有机物可能的结构简式:
①写出该有机物的分子式:
C4H6O
CH3CH=CHCHO
课堂练习
4.下列化合物的核磁共振氢谱中出现三组峰的是( )
A. 2,2,3,3-四甲基丁烷 B. 2,3,4-三甲基戊烷
C. 3,4-二甲基己烷 D. 2,5-二甲基己烷
D
课堂练习
5.在核磁共振氢谱中出现3组峰,且氢原子个数比为3:1:4的化合物是( )
A. B.
C. D.
C
6.将有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g和8.8 g ,消耗氧气6.72 L(标准状况下),则该物质的最简式为________,若要确定其分子式,_____(填“是”或“否”)需有其他条件。已知有机物A的核磁共振氢谱、质谱如图所示,则A的结构简式为______________。
C2H6O
否
CH3CH2OH
课堂练习
课堂小结
有机物结构的确定方法思路
确定实验式——元素分析
确定分子式——质谱法
基团性质
空间排列
基团位置
确定分子结构——波谱分析
具体方法
红外光谱法
核磁共振氢谱
根据价键规律推断
典型特征反应实验
