专题3第二单元 离子键 离子晶体 课后练 (含解析)
文档属性
| 名称 | 专题3第二单元 离子键 离子晶体 课后练 (含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 616.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-09 19:30:53 | ||
图片预览


文档简介
第二单元 离子键 离子晶体
1. (2021·南通一中质检)下列物质中,属于离子化合物的是( )
A. NaOH B. HCl
C. O2 D. NH3
2. 具有下列电子排布的原子中,最难形成离子键的是( )
A. 1s22s22p2 B. 1s22s22p5
C. 1s22s22p63s2 D. 1s22s22p63s1
3. (2021·苏州五中质检)下列物质只含有离子键的是( )
A. H2O B. MgCl2 C. SiO2 D. NH4Cl
4. 下列说法正确的是( )
A. 固态时能导电的晶体一定是金属晶体
B. 熔融态能导电的晶体一定是离子晶体
C. 水溶液能导电的晶体一定是离子晶体
D. 固态不导电而熔融态导电的晶体一定是离子晶体
5. (2021·礼嘉中学阶段调研)锌与硫所形成化合物晶体的晶胞如图所示。下列判断正确的是( )
A. 该晶体属于分子晶体
B. 该晶胞中Zn2+和S2-数目不相等
C. 阳离子的配位数为6
D. 氧化锌的熔点高于硫化锌
6. 下列有关离子晶体的叙述中,不正确的是( )
A. 1 mol氯化钠晶体中有NA个NaCl分子
B. 氯化钠晶体中,每个Na+周围距离最近且相等的Cl-共有6个
C. 醋酸钠属于离子晶体,含共价键
D. 平均每个NaCl晶胞中有4个Na+、4个Cl-
7. 自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列实验中,一定能说明CaF2是离子晶体的是( )
A. CaF2难溶于水,其水溶液的导电性极弱
B. CaF2的熔沸点较高,硬度较大
C. CaF2固体不导电,但在熔融状态下可以导电
D. CaF2在有机溶剂(如苯)中的溶解度极小
8. (2020·吕叔湘中学诊断考试) CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法正确的是( )
A. C与N2核外电子总数相等
B. 1个Ca2+周围距离最近且等距离的C数目为6
C. CaC2晶体中,所有原子之间都以离子键相结合
D. 1个CaC2晶体的晶胞平均含有1个Ca2+和1个C
9. (2020·滕州一中月考)钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,下列有关说法不正确的是( )
A. 该晶体属于离子晶体
B. 晶体的化学式为Ba2O2
C. 该晶体晶胞结构与NaCl相似
D. 与每个Ba2+距离相等且最近的Ba2+共有12个
10. 根据下表的数据,判断下列说法正确的是( )
离子化合物 电荷数Z 晶格能/(kJ·mol-1) 熔点/℃
NaF 1 923 993
NaCl 1 786 801
MgO 2 3 791 2 852
CaO 2 3 401 2 614
A. 晶格能的大小与正负离子电荷数和距离成正比
B. 晶格能越大,即正负离子间的静电引力越强,晶体的熔点就越高,硬度越大
C. NaF晶体比NaCl晶体稳定
D. 表中物质CaO的晶体最稳定
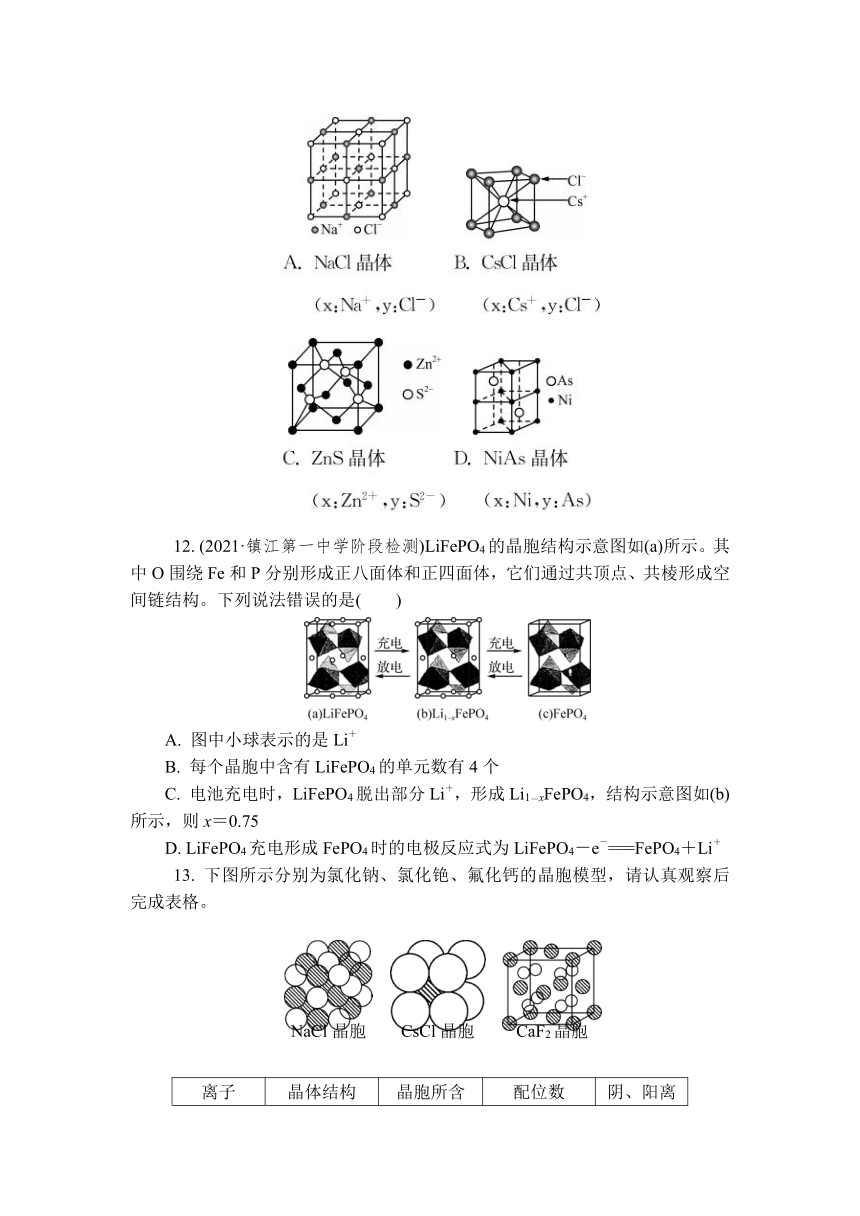
11. (2020·徐州一中期末)在某晶体中,与某一个微粒x距离最近且等距离的另一个微粒y所围成的空间结构为如图所示的正八面体。该晶体可能是( )
12. (2021·镇江第一中学阶段检测)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。下列说法错误的是( )
A. 图中小球表示的是Li+
B. 每个晶胞中含有LiFePO4的单元数有4个
C. 电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x=0.75
D. LiFePO4充电形成FePO4时的电极反应式为LiFePO4-e-===FePO4+Li+
13. 下图所示分别为氯化钠、氯化铯、氟化钙的晶胞模型,请认真观察后完成表格。
离子 晶体 晶体结构 粒子 晶胞所含 粒子数 配位数 阴、阳离 子个数 之比
阴 离子 阳 离子 阴 离子 阳 离子
氯化钠
氯化铯
氟化钙
14. NaCl晶体模型如下图所示:
(1) 在NaCl晶体中,每个Na+周围同时吸引________个Cl-,每个Cl-周围也同时吸引着________个Na+,在NaCl晶胞中含有________个Na+、________个Cl-,晶体中每个Na+周围与它距离最近且相等的Na+共有________个。
(2) 对于氯化钠晶体,下列描述正确的是________(填字母)。
A. 相邻的正、负离子核间距等于正、负离子半径之和
B. 与氯化铯晶体结构相同
C. 每个Na+与6个Cl-作为近邻
15. 前36号元素A、B、C、D、E原子序数依次增大,A与B是同一周期紧邻元素,B与D同一主族,B元素的氢化物的水溶液可用于玻璃的雕刻。C元素是同周期元素中第一电离能最小的元素,C与E的最外层电子数相同,E元素内层均排满电子。
(1) 基态原子E的电子排布式为________;依据电子排布周期表划分为5个区,该元素位于周期表的________区。
(2) 元素A、B、D电负性由大到小的顺序为______________________________________________________________________。
(3) 单质C经常用于储氢,储氢后形成晶体结构如图所示:
该晶体中与C离子近邻的氢离子有________个,这些氢离子,构成的空间结构为________;该晶体的化学式为________。
第二单元 离子键 离子晶体
1. A 解析:钠离子和氢氧根离子之间存在离子键,是离子化合物,A符合题意;氢原子和氯原子之间只存在共价键,是共价化合物,B不符合题意;氧气是单质,不是离子化合物,C不符合题意;氮原子和氢原子之间只存在共价键,是共价化合物,D不符合题意。
2. A 解析:根据电子排布式可知,该原子为C原子,化学性质比较稳定,不易形成离子键,A符合题意;根据电子排布式可知,该原子为F原子,化学性质活泼,容易得到电子变成F-,容易形成离子键,B不符合题意;根据电子排布式可知,该原子为Mg原子,化学性质活泼,容易失去电子变成Mg2+,容易形成离子键,C不符合题意;根据电子排布式可知,该原子为Na原子,化学性质活泼,容易失去电子变成Na+,容易形成离子键,D不符合题意。
3. B 解析:H2O是共价化合物,只存在共价键,不含离子键,A错误;MgCl2属于离子晶体,只含有离子键,B正确;SiO2是共价化合物,只存在共价键,不含离子键,C错误;NH4Cl中含离子键,在铵根离子内存在N—H极性共价键,D错误。
4. D 解析:离子晶体是阴、阳离子组成的,固态时阴、阳离子不能自由移动,不导电,但是石墨固态时也能导电,而石墨不是金属晶体,A错误;离子化合物在熔融状态时能电离,故能导电,但是金属晶体在熔融状态下也能导电,B错误;有些分子晶体的水溶液也能导电,C错误;离子晶体在固态时不导电而熔融态下能导电,D正确。
5. D 解析:该晶体由阴、阳离子构成,属于离子晶体,A错误;从晶胞图分析,含有Zn2+的数目为8×+6×=4,S2-位于立方体内,S2-的数目为4,所以该晶胞中Zn2+与S2-的数目相等,B错误;在ZnS晶胞中,1个S2-周围距离最近的Zn2+有4个,1个Zn2+周围距离最近的S2-有4个,则S2-的配位数为4,Zn2+的配位数也为4,C错误;ZnO和ZnS中,O2-的半径小于S2-的半径,离子所带的电荷数相等,所以ZnO中离子键强度大于ZnS中离子键强度,ZnO的熔点高于ZnS,D正确。
6. A 解析:NaCl为面心立方结构,每个晶胞中Na+的个数为12×+1=4,Cl-的个数为8×+6×=4,则1 mol氯化钠晶体中有4NA个Na+、4NA个Cl-,不存在分子,A错误、D正确;由NaCl的晶胞结构可知,Na+在棱心和体心时,顶点和面心为Cl-,则每个Na+周围距离最近且相等的Cl-共有6个,B正确;醋酸钠中存在碳碳、碳氢、碳氧共价键,C正确。
7. C 解析:难溶于水,其水溶液的导电性极弱,不能说明CaF2一定是离子晶体,A错误;熔点较高,硬度较大,也可能是共价晶体的性质,不能说明CaF2一定是离子晶体,B错误;熔融状态下可以导电,一定有自由移动的离子生成,说明CaF2一定是离子晶体,C正确;CaF2在有机溶剂(如苯)中的溶解度极小,只能说明CaF2是极性分子,不能说明CaF2一定是离子晶体,D错误。
8. A 解析:C含电子数为2×6+2=14,N2的电子数为2×7=14,二者电子数相同,A正确;依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C有4个,而不是6个,B错误;CaC2晶体中,Ca2+、C之间是离子键,C中含C≡C键,是共价键,C错误;根据晶胞示意图可以看出:处于棱上的Ca2+有12个,每个钙离子同时为4个晶胞所共有,每个晶胞占,则1个晶胞含Ca2+的个数为12×=3;处于中心的Ca2+有1个,完全属于该晶胞,则1个晶胞中含Ca2+的个数为3+1=4;含有C的个数为1+6×=4,D错误。
9. B 解析:Ba是活泼金属元素,O是活泼非金属元素,二者形成的化合物是离子化合物,A正确;根据Ba和O在晶胞中的位置,晶胞中共含有Ba的个数为8×+6×=4,O的个数为12×2×+2=8,所以Ba与O的个数比为1∶2,该氧化物为BaO2,B错误;NaCl晶胞与该结构相似,C正确;与每个Ba2+距离相等且最近的Ba2+共有8×3×=12个,D正确。
10. C 解析:根据表中的数据可知,NaF电荷数为1,MgO电荷数为2,晶格能的大小与正负离子电荷数成正比,MgO、CaO中所带电荷相同,但镁离子半径小于钙离子半径,键长MgO小于CaO,晶格能:MgO>CaO,所以晶格能的大小与距离成反比,A错误;离子键本质是阴、阳离子间的静电作用,不只是引力,还有斥力等,晶格能越大,即正负离子间的静电作用力越强,晶体的熔点就越高,硬度越大,B错误;由表中数据知NaF晶格能大于NaCl,故NaF晶体更稳定,C正确;由表中数据知晶格能MgO>CaO>NaF>NaCl,故MgO最稳定,D错误。
11. A 解析:根据题图知,与某一个微粒x距离最近且等距离的另一个微粒y所围成的空间结构为正八面体,所以x的配位数是6,只要晶体中配位数是6的就符合该图。氯化钠晶体中的离子配位数是6,A符合题意;氯化铯晶体中的离子配位数是8,B不符合题意;ZnS晶体中离子配位数是4,C不符合题意;NiAs晶体中的原子配位数是4,D不符合题意。
12. C 解析:O围绕Fe和P分别形成正八面体和正四面体,可知图中小球表示的是Li+,A正确;均摊法可知,晶胞中Li+数目为8×+4×+4× =4,故每个晶胞中含有LiFePO4的单元数有4个,B正确;由图可知,(a)→(b)充电过程中,晶胞失去1个棱心、1个面心位置的Li+,(b)晶胞中Li+数目为8×+3×+2×= ,Fe原子数目不变,有4个,故(1-x)∶1= ∶4,解得x= ,C错误;LiFePO4充电形成FePO4,失去全部的Li+,LiFePO4失去电子被氧化生成FePO4,则电极反应式为LiFePO4-e-===FePO4+Li+,D正确。
13.
离子 晶体 晶体 结构 粒子 晶胞所含 粒子数 配位数 阴、阳离子个数之比
阴 离子 阳 离子 阴 离子 阳 离子
氯化钠 Na+、Cl- 4 4 6 6 1:1
氯化铯 Cs+、Cl- 1 1 8 8 1:1
氟化钙 Ca2+、F- 8 4 4 4 2:1
14. (1) 6 6 4 4 12 (2) C
解析:(1) 在氯化钠晶体中,一个晶胞中共含有4个Na+,4个Cl-。NaCl晶体中Na+、Cl-的个数之比为1∶1。图中位于晶胞中心的Na+共有3个平面通过它,通过中心Na+的每个平面都有4个Na+位于平面的四角,这4个Na+与中心Na+距离最近且距离相等。所以在NaCl晶体中,每个Na+周围与它距离最近且距离相等的Na+共有12个,可推出每个Cl-周围与它最近且距离相等的Cl-也共有12个。(2) 相邻的正、负离子核间距不等于正、负离子半径之和,A错误;氯化铯晶体结构呈体心立方堆积,B错误;氯化钠晶体中以Na+为中心向三维方向伸展,有6个Cl-近邻,C正确。
15. (1) [Ar]3d104s1 ds (2) F>O>Cl
(3) 6 八面体 NaH
解析:B元素氢化物的水溶液可用于玻璃的雕刻,B为F元素;A与B是同一周期紧邻元素,则A为O元素,B与D同一主族,则D为Cl或Br元素;C元素是同周期元素中第一电离能最小的元素,则C为Na元素;C与E的最外层电子数相同,E元素内层均排满电子,E的价电子排布式为3d104s1,E为Cu元素,则D为Cl元素。
1. (2021·南通一中质检)下列物质中,属于离子化合物的是( )
A. NaOH B. HCl
C. O2 D. NH3
2. 具有下列电子排布的原子中,最难形成离子键的是( )
A. 1s22s22p2 B. 1s22s22p5
C. 1s22s22p63s2 D. 1s22s22p63s1
3. (2021·苏州五中质检)下列物质只含有离子键的是( )
A. H2O B. MgCl2 C. SiO2 D. NH4Cl
4. 下列说法正确的是( )
A. 固态时能导电的晶体一定是金属晶体
B. 熔融态能导电的晶体一定是离子晶体
C. 水溶液能导电的晶体一定是离子晶体
D. 固态不导电而熔融态导电的晶体一定是离子晶体
5. (2021·礼嘉中学阶段调研)锌与硫所形成化合物晶体的晶胞如图所示。下列判断正确的是( )
A. 该晶体属于分子晶体
B. 该晶胞中Zn2+和S2-数目不相等
C. 阳离子的配位数为6
D. 氧化锌的熔点高于硫化锌
6. 下列有关离子晶体的叙述中,不正确的是( )
A. 1 mol氯化钠晶体中有NA个NaCl分子
B. 氯化钠晶体中,每个Na+周围距离最近且相等的Cl-共有6个
C. 醋酸钠属于离子晶体,含共价键
D. 平均每个NaCl晶胞中有4个Na+、4个Cl-
7. 自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列实验中,一定能说明CaF2是离子晶体的是( )
A. CaF2难溶于水,其水溶液的导电性极弱
B. CaF2的熔沸点较高,硬度较大
C. CaF2固体不导电,但在熔融状态下可以导电
D. CaF2在有机溶剂(如苯)中的溶解度极小
8. (2020·吕叔湘中学诊断考试) CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法正确的是( )
A. C与N2核外电子总数相等
B. 1个Ca2+周围距离最近且等距离的C数目为6
C. CaC2晶体中,所有原子之间都以离子键相结合
D. 1个CaC2晶体的晶胞平均含有1个Ca2+和1个C
9. (2020·滕州一中月考)钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,下列有关说法不正确的是( )
A. 该晶体属于离子晶体
B. 晶体的化学式为Ba2O2
C. 该晶体晶胞结构与NaCl相似
D. 与每个Ba2+距离相等且最近的Ba2+共有12个
10. 根据下表的数据,判断下列说法正确的是( )
离子化合物 电荷数Z 晶格能/(kJ·mol-1) 熔点/℃
NaF 1 923 993
NaCl 1 786 801
MgO 2 3 791 2 852
CaO 2 3 401 2 614
A. 晶格能的大小与正负离子电荷数和距离成正比
B. 晶格能越大,即正负离子间的静电引力越强,晶体的熔点就越高,硬度越大
C. NaF晶体比NaCl晶体稳定
D. 表中物质CaO的晶体最稳定
11. (2020·徐州一中期末)在某晶体中,与某一个微粒x距离最近且等距离的另一个微粒y所围成的空间结构为如图所示的正八面体。该晶体可能是( )
12. (2021·镇江第一中学阶段检测)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。下列说法错误的是( )
A. 图中小球表示的是Li+
B. 每个晶胞中含有LiFePO4的单元数有4个
C. 电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x=0.75
D. LiFePO4充电形成FePO4时的电极反应式为LiFePO4-e-===FePO4+Li+
13. 下图所示分别为氯化钠、氯化铯、氟化钙的晶胞模型,请认真观察后完成表格。
离子 晶体 晶体结构 粒子 晶胞所含 粒子数 配位数 阴、阳离 子个数 之比
阴 离子 阳 离子 阴 离子 阳 离子
氯化钠
氯化铯
氟化钙
14. NaCl晶体模型如下图所示:
(1) 在NaCl晶体中,每个Na+周围同时吸引________个Cl-,每个Cl-周围也同时吸引着________个Na+,在NaCl晶胞中含有________个Na+、________个Cl-,晶体中每个Na+周围与它距离最近且相等的Na+共有________个。
(2) 对于氯化钠晶体,下列描述正确的是________(填字母)。
A. 相邻的正、负离子核间距等于正、负离子半径之和
B. 与氯化铯晶体结构相同
C. 每个Na+与6个Cl-作为近邻
15. 前36号元素A、B、C、D、E原子序数依次增大,A与B是同一周期紧邻元素,B与D同一主族,B元素的氢化物的水溶液可用于玻璃的雕刻。C元素是同周期元素中第一电离能最小的元素,C与E的最外层电子数相同,E元素内层均排满电子。
(1) 基态原子E的电子排布式为________;依据电子排布周期表划分为5个区,该元素位于周期表的________区。
(2) 元素A、B、D电负性由大到小的顺序为______________________________________________________________________。
(3) 单质C经常用于储氢,储氢后形成晶体结构如图所示:
该晶体中与C离子近邻的氢离子有________个,这些氢离子,构成的空间结构为________;该晶体的化学式为________。
第二单元 离子键 离子晶体
1. A 解析:钠离子和氢氧根离子之间存在离子键,是离子化合物,A符合题意;氢原子和氯原子之间只存在共价键,是共价化合物,B不符合题意;氧气是单质,不是离子化合物,C不符合题意;氮原子和氢原子之间只存在共价键,是共价化合物,D不符合题意。
2. A 解析:根据电子排布式可知,该原子为C原子,化学性质比较稳定,不易形成离子键,A符合题意;根据电子排布式可知,该原子为F原子,化学性质活泼,容易得到电子变成F-,容易形成离子键,B不符合题意;根据电子排布式可知,该原子为Mg原子,化学性质活泼,容易失去电子变成Mg2+,容易形成离子键,C不符合题意;根据电子排布式可知,该原子为Na原子,化学性质活泼,容易失去电子变成Na+,容易形成离子键,D不符合题意。
3. B 解析:H2O是共价化合物,只存在共价键,不含离子键,A错误;MgCl2属于离子晶体,只含有离子键,B正确;SiO2是共价化合物,只存在共价键,不含离子键,C错误;NH4Cl中含离子键,在铵根离子内存在N—H极性共价键,D错误。
4. D 解析:离子晶体是阴、阳离子组成的,固态时阴、阳离子不能自由移动,不导电,但是石墨固态时也能导电,而石墨不是金属晶体,A错误;离子化合物在熔融状态时能电离,故能导电,但是金属晶体在熔融状态下也能导电,B错误;有些分子晶体的水溶液也能导电,C错误;离子晶体在固态时不导电而熔融态下能导电,D正确。
5. D 解析:该晶体由阴、阳离子构成,属于离子晶体,A错误;从晶胞图分析,含有Zn2+的数目为8×+6×=4,S2-位于立方体内,S2-的数目为4,所以该晶胞中Zn2+与S2-的数目相等,B错误;在ZnS晶胞中,1个S2-周围距离最近的Zn2+有4个,1个Zn2+周围距离最近的S2-有4个,则S2-的配位数为4,Zn2+的配位数也为4,C错误;ZnO和ZnS中,O2-的半径小于S2-的半径,离子所带的电荷数相等,所以ZnO中离子键强度大于ZnS中离子键强度,ZnO的熔点高于ZnS,D正确。
6. A 解析:NaCl为面心立方结构,每个晶胞中Na+的个数为12×+1=4,Cl-的个数为8×+6×=4,则1 mol氯化钠晶体中有4NA个Na+、4NA个Cl-,不存在分子,A错误、D正确;由NaCl的晶胞结构可知,Na+在棱心和体心时,顶点和面心为Cl-,则每个Na+周围距离最近且相等的Cl-共有6个,B正确;醋酸钠中存在碳碳、碳氢、碳氧共价键,C正确。
7. C 解析:难溶于水,其水溶液的导电性极弱,不能说明CaF2一定是离子晶体,A错误;熔点较高,硬度较大,也可能是共价晶体的性质,不能说明CaF2一定是离子晶体,B错误;熔融状态下可以导电,一定有自由移动的离子生成,说明CaF2一定是离子晶体,C正确;CaF2在有机溶剂(如苯)中的溶解度极小,只能说明CaF2是极性分子,不能说明CaF2一定是离子晶体,D错误。
8. A 解析:C含电子数为2×6+2=14,N2的电子数为2×7=14,二者电子数相同,A正确;依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C有4个,而不是6个,B错误;CaC2晶体中,Ca2+、C之间是离子键,C中含C≡C键,是共价键,C错误;根据晶胞示意图可以看出:处于棱上的Ca2+有12个,每个钙离子同时为4个晶胞所共有,每个晶胞占,则1个晶胞含Ca2+的个数为12×=3;处于中心的Ca2+有1个,完全属于该晶胞,则1个晶胞中含Ca2+的个数为3+1=4;含有C的个数为1+6×=4,D错误。
9. B 解析:Ba是活泼金属元素,O是活泼非金属元素,二者形成的化合物是离子化合物,A正确;根据Ba和O在晶胞中的位置,晶胞中共含有Ba的个数为8×+6×=4,O的个数为12×2×+2=8,所以Ba与O的个数比为1∶2,该氧化物为BaO2,B错误;NaCl晶胞与该结构相似,C正确;与每个Ba2+距离相等且最近的Ba2+共有8×3×=12个,D正确。
10. C 解析:根据表中的数据可知,NaF电荷数为1,MgO电荷数为2,晶格能的大小与正负离子电荷数成正比,MgO、CaO中所带电荷相同,但镁离子半径小于钙离子半径,键长MgO小于CaO,晶格能:MgO>CaO,所以晶格能的大小与距离成反比,A错误;离子键本质是阴、阳离子间的静电作用,不只是引力,还有斥力等,晶格能越大,即正负离子间的静电作用力越强,晶体的熔点就越高,硬度越大,B错误;由表中数据知NaF晶格能大于NaCl,故NaF晶体更稳定,C正确;由表中数据知晶格能MgO>CaO>NaF>NaCl,故MgO最稳定,D错误。
11. A 解析:根据题图知,与某一个微粒x距离最近且等距离的另一个微粒y所围成的空间结构为正八面体,所以x的配位数是6,只要晶体中配位数是6的就符合该图。氯化钠晶体中的离子配位数是6,A符合题意;氯化铯晶体中的离子配位数是8,B不符合题意;ZnS晶体中离子配位数是4,C不符合题意;NiAs晶体中的原子配位数是4,D不符合题意。
12. C 解析:O围绕Fe和P分别形成正八面体和正四面体,可知图中小球表示的是Li+,A正确;均摊法可知,晶胞中Li+数目为8×+4×+4× =4,故每个晶胞中含有LiFePO4的单元数有4个,B正确;由图可知,(a)→(b)充电过程中,晶胞失去1个棱心、1个面心位置的Li+,(b)晶胞中Li+数目为8×+3×+2×= ,Fe原子数目不变,有4个,故(1-x)∶1= ∶4,解得x= ,C错误;LiFePO4充电形成FePO4,失去全部的Li+,LiFePO4失去电子被氧化生成FePO4,则电极反应式为LiFePO4-e-===FePO4+Li+,D正确。
13.
离子 晶体 晶体 结构 粒子 晶胞所含 粒子数 配位数 阴、阳离子个数之比
阴 离子 阳 离子 阴 离子 阳 离子
氯化钠 Na+、Cl- 4 4 6 6 1:1
氯化铯 Cs+、Cl- 1 1 8 8 1:1
氟化钙 Ca2+、F- 8 4 4 4 2:1
14. (1) 6 6 4 4 12 (2) C
解析:(1) 在氯化钠晶体中,一个晶胞中共含有4个Na+,4个Cl-。NaCl晶体中Na+、Cl-的个数之比为1∶1。图中位于晶胞中心的Na+共有3个平面通过它,通过中心Na+的每个平面都有4个Na+位于平面的四角,这4个Na+与中心Na+距离最近且距离相等。所以在NaCl晶体中,每个Na+周围与它距离最近且距离相等的Na+共有12个,可推出每个Cl-周围与它最近且距离相等的Cl-也共有12个。(2) 相邻的正、负离子核间距不等于正、负离子半径之和,A错误;氯化铯晶体结构呈体心立方堆积,B错误;氯化钠晶体中以Na+为中心向三维方向伸展,有6个Cl-近邻,C正确。
15. (1) [Ar]3d104s1 ds (2) F>O>Cl
(3) 6 八面体 NaH
解析:B元素氢化物的水溶液可用于玻璃的雕刻,B为F元素;A与B是同一周期紧邻元素,则A为O元素,B与D同一主族,则D为Cl或Br元素;C元素是同周期元素中第一电离能最小的元素,则C为Na元素;C与E的最外层电子数相同,E元素内层均排满电子,E的价电子排布式为3d104s1,E为Cu元素,则D为Cl元素。
