专题3第三单元 共价键 共价晶体课时2 共价键键能与化学反应的反应热 共价晶体 课后练 (含解析)
文档属性
| 名称 | 专题3第三单元 共价键 共价晶体课时2 共价键键能与化学反应的反应热 共价晶体 课后练 (含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 183.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-09 19:32:49 | ||
图片预览


文档简介
课时2 共价键键能与化学反应的反应热 共价晶体
1. 下列说法中,不正确的是( )
A. 金属元素与非金属元素也可能形成共价键
B. 成键原子间原子轨道重叠的愈多,共价键愈牢固
C. 对双原子分子来说,键能愈大,含有该键的分子愈稳定
D. 键长愈长,化学键愈牢固
2. (2021·南菁高级中学质检)下列比较不正确的是( )
A. 熔点由高到低:生铁<纯铁
B. 硬度由大到小:金刚石>碳化硅>晶体硅
C. 熔点由高到低: Na>Mg>Al
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
3. 二氧化硅晶体是立体的网状结构,其结构如图所示。关于二氧化硅的下列说法中,不正确的是( )
A. 晶体中Si、O原子个数比为1∶2
B. 晶体中最小原子环上的原子数为8
C. 晶体中最小原子环上的原子数为12
D. 晶体中Si、O原子最外层都满足8电子稳定结构
4. (2020·淄博淄川中学月考)下列说法正确的是( )
A. 金刚石晶体中的最小环由6个碳原子构成
B. AlCl3晶体属于共价晶体
C. 1 mol SiO2晶体中含2 mol Si—O键
D. 金刚石化学性质稳定,即使在高温下也不会和O2反应
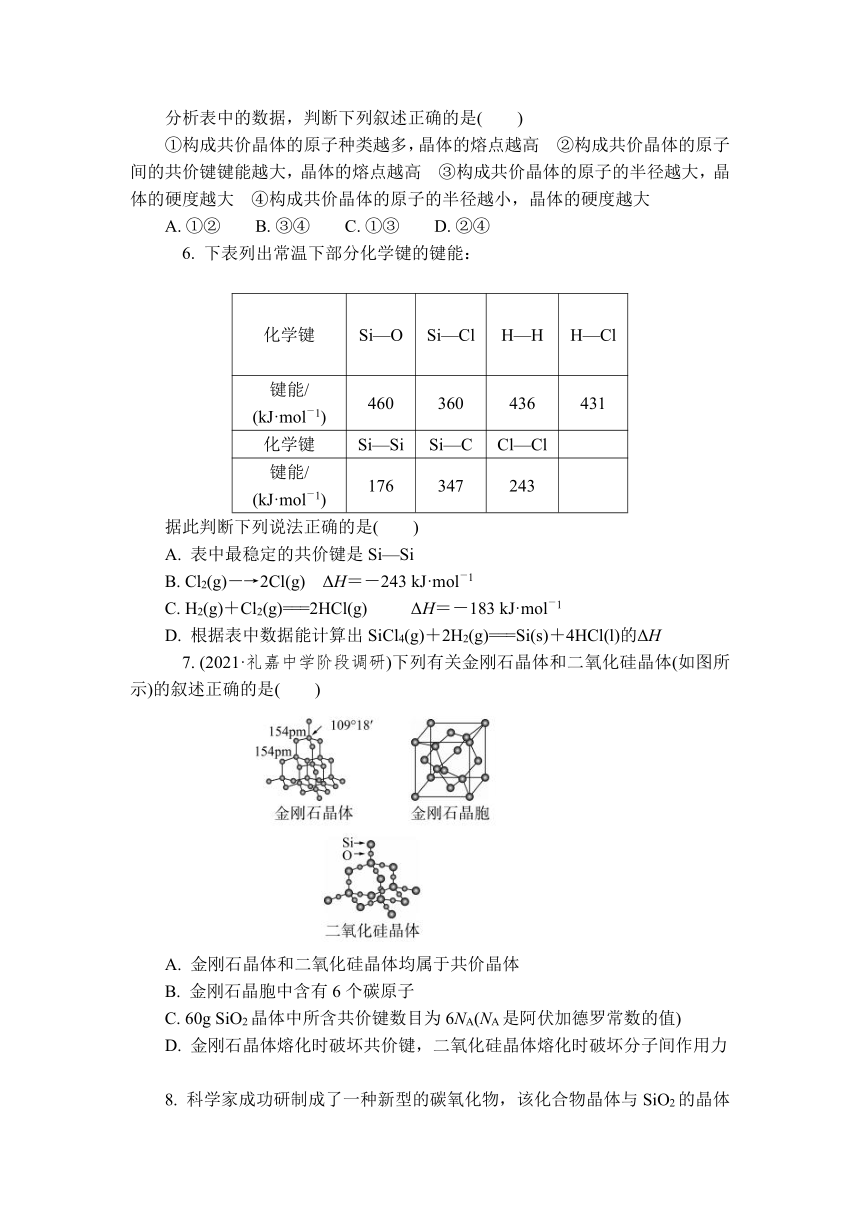
5. 下表是某些共价晶体的熔点和硬度:
共价晶体 金刚石 氮化硼 碳化硅
熔点/℃ 3 900 3 000 2 700
硬度 10 9.5 9.5
共价晶体 石英 硅 锗
熔点/℃ 1 710 1 410 1 211
硬度 7 6.5 6.0
分析表中的数据,判断下列叙述正确的是( )
①构成共价晶体的原子种类越多,晶体的熔点越高 ②构成共价晶体的原子间的共价键键能越大,晶体的熔点越高 ③构成共价晶体的原子的半径越大,晶体的硬度越大 ④构成共价晶体的原子的半径越小,晶体的硬度越大
A. ①② B. ③④ C. ①③ D. ②④
6. 下表列出常温下部分化学键的键能:
化学键 Si—O Si—Cl H—H H—Cl
键能/ (kJ·mol-1) 460 360 436 431
化学键 Si—Si Si—C Cl—Cl
键能/ (kJ·mol-1) 176 347 243
据此判断下列说法正确的是( )
A. 表中最稳定的共价键是Si—Si
B. Cl2(g)―→2Cl(g) ΔH=-243 kJ·mol-1
C. H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1
D. 根据表中数据能计算出SiCl4(g)+2H2(g)===Si(s)+4HCl(l)的ΔH
7. (2021·礼嘉中学阶段调研)下列有关金刚石晶体和二氧化硅晶体(如图所示)的叙述正确的是( )
A. 金刚石晶体和二氧化硅晶体均属于共价晶体
B. 金刚石晶胞中含有6个碳原子
C. 60g SiO2晶体中所含共价键数目为6NA(NA是阿伏加德罗常数的值)
D. 金刚石晶体熔化时破坏共价键,二氧化硅晶体熔化时破坏分子间作用力
8. 科学家成功研制成了一种新型的碳氧化物,该化合物晶体与SiO2的晶体的结构相似,晶体中每个碳原子均以4个共价单键与氧原子结合,形成一种无限伸展的空间网状结构。下列对该晶体的叙述错误的是( )
A. 该晶体是共价晶体
B. 该晶体中碳原子和氧原子的个数比为1∶2
C. 该晶体中碳原子数与C—O键数之比为1∶2
D. 该晶体中最小的环由12个原子构成
9. 氮化碳结构如图,其中β氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法中,不正确的是( )
A. 氮化碳属于共价晶体
B. 氮化碳中碳显-4价,氮显+3价
C. 氮化碳的化学式为C3N4
D. 每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
10. (2020·禄丰县一中月考)下列各项说法中,正确的是( )
A. 分子中键能越高,键长越长,则分子越稳定
B. 元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间不能形成共价键
C. 水分子可表示为H—O—H,分子中键角为180°
D. H—O的键能为463 kJ·mol-1,即18 g H2O分解成H2和O2时,消耗能量为2×463 kJ
11. 如图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
A. W、R元素单质分子内都存在非极性键
B. X、Z元素都能形成双原子分子
C. 键长:W—HW—H
D. 键长:X—H12. 已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法不正确的是( )
A. 该晶体属于共价晶体,其化学键比金刚石中的碳碳键更牢固
B. 该晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子
C. 该晶体与金刚石相似,碳原子个数与碳氮键个数之比为1∶2
D. 该晶体中碳原子和氮原子的最外层都满足8电子稳定结构
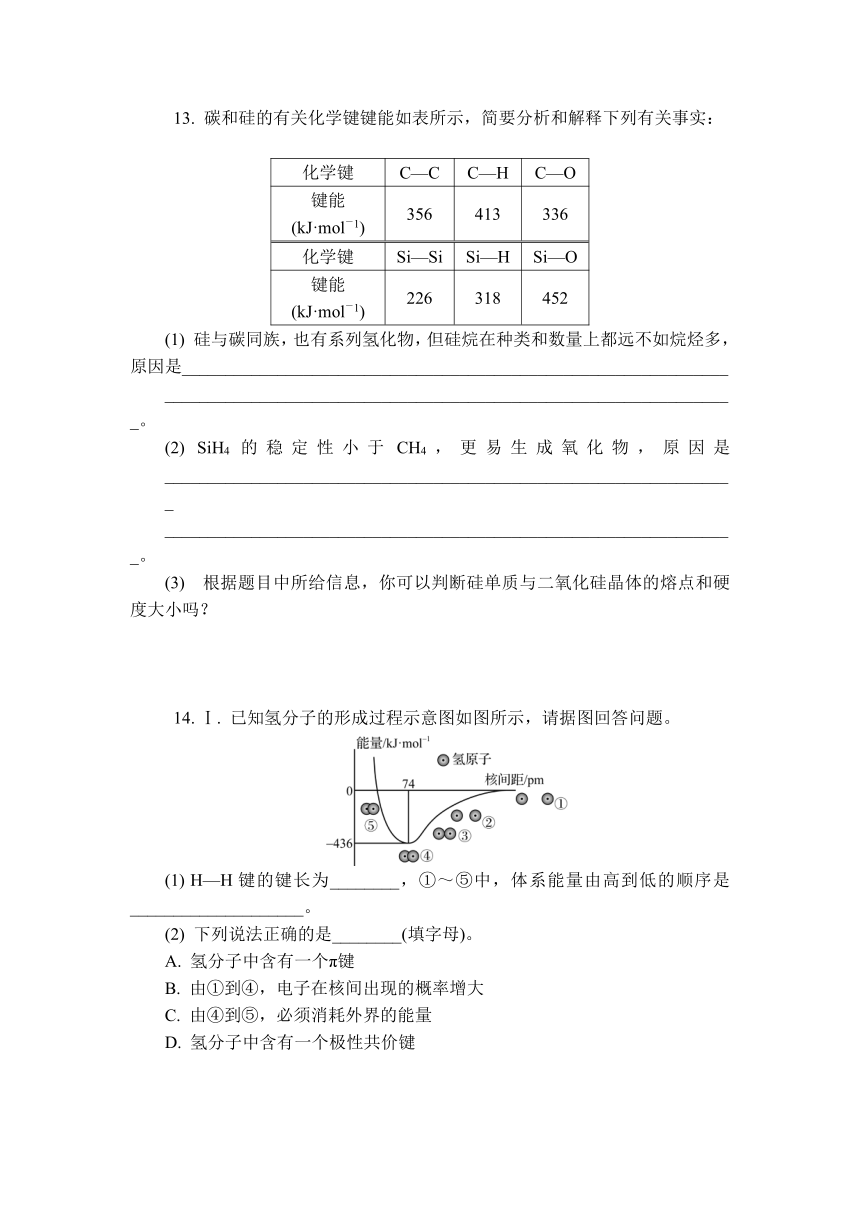
13. 碳和硅的有关化学键键能如表所示,简要分析和解释下列有关事实:
化学键 C—C C—H C—O
键能 (kJ·mol-1) 356 413 336
化学键 Si—Si Si—H Si—O
键能 (kJ·mol-1) 226 318 452
(1) 硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是_______________________________________________________________
__________________________________________________________________。
(2) SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________________________________________________________
__________________________________________________________________。
(3) 根据题目中所给信息,你可以判断硅单质与二氧化硅晶体的熔点和硬度大小吗?
14. Ⅰ. 已知氢分子的形成过程示意图如图所示,请据图回答问题。
(1) H—H键的键长为________,①~⑤中,体系能量由高到低的顺序是____________________。
(2) 下列说法正确的是________(填字母)。
A. 氢分子中含有一个π键
B. 由①到④,电子在核间出现的概率增大
C. 由④到⑤,必须消耗外界的能量
D. 氢分子中含有一个极性共价键
Ⅱ. 几种常见化学键的键能如下表所示。
化学键 Si—O H—O O===O
键能/(kJ·mol-1) 452 462.8 497.3
化学键 Si—Si Si—C
键能/(kJ·mol-1) 226 X
请回答下列问题:
(3) 试比较Si—C键与Si—Si键的键能大小:X________(填“>”“<”或“=”)226 kJ·mol-1。
(4) H2被认为是21世纪人类最理想的燃料,而又有科学家提出硅是“21世纪的能源”“未来的石油”等观点。结合Ⅰ中图像,试计算每千克H2燃烧(生成水蒸气)放出的热量约为________;每摩尔硅完全燃烧放出的热量约为________(已知1 mol Si中含有2 mol Si—Si键,1 mol SiO2中含有4 mol Si—O键)。
15. 已知某些共价键的键能如下表,试回答下列问题:
共价键 键能/(kJ·mol-1)
H—H 436
Cl—Cl 242.7
C—H 413.4
共价键 键能/(kJ·mol-1)
O—H 462.8
N≡N 946
H—Cl 431.8
(1) H—H键的键能为什么比Cl—Cl键的键能大?
__________________________________________________________________
__________________________________________________________________。
(2) 已知H2O在2 000 ℃时有5%的分子分解,而CH4在1 000 ℃时可能完全分解为C和H2,试解释其中的原因。
__________________________________________________________________
__________________________________________________________________。
(3) 试解释氮气为什么能在空气中稳定存在。
__________________________________________________________________
__________________________________________________________________。
16. 单质硼有无定形和晶体两种,参考下表数据,回答下列问题:
金刚石 晶体硅 晶体硼
熔点/K >3 823 1 683 2 573
沸点/K 5 100 2 628 2 823
硬度 10 7.0 9.5
(1) 晶体硼的晶体类型属于________晶体,理由是__________________________________________________________________
__________________________________________________________________。
(2) 已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如图),其中有20个等边三角形的面和一定数目的顶点,每个顶点上各有1个B原子。通过观察图形及推算,此晶体结构单元由________个B原子组成。
课时2 共价键键能与化学反应的反应热 共价晶体
1. D 解析:金属原子与非金属原子之间的化学键可能是离子键,如氯化钠,也可能是共价键,如氯化铝,A正确;原子轨道重叠越多,电子在核间出现的概率就越大,所形成的共价键就越牢固,B正确;键能越大,断裂时吸收的能量越多,则越难以断裂,分子越稳定,C正确;共价键的键长越短,键能越大,键越牢固,键长越长,化学键越不牢固,D错误。
2. C 解析:生铁为合金,熔点比纯铁低,A正确;共价晶体中,共价键越短,共价键越强,硬度越大,碳原子半径小于硅原子,则硬度由大到小:金刚石>碳化硅>晶体硅,B正确;金属离子的电荷越大、半径越小,其熔点越大,则熔点由高到低为Al>Mg>Na,C错误;离子晶体中离子半径越小,晶格能越大,则晶格能由大到小:NaF>NaCl>NaBr>NaI,D正确。
3. B 解析:硅原子占有与其成键的每一个氧原子的,完全占有的氧原子数为4×=2,则晶体中Si、O原子个数比为1∶2,A正确;观察结构示意图,可知晶体中最小原子环上的原子数为12,B错误,C正确;晶体中,每个Si原子形成四个共价键后达到了8电子稳定结构,每个氧原子形成2个共价键后达到了8电子稳定结构,D正确。
4. A 解析:金刚石是共价晶体,原子间以共价键相结合,形成三维的空间网状结构,最小的环上有6个碳原子,A正确;AlCl3熔、沸点较低,其晶体属于分子晶体,B错误;1个硅原子与周围4个氧原子形成4个Si—O键,而1个氧原子能形成2个Si—O键,1 mol SiO2晶体有1 mol硅原子和2 mol氧原子,含有Si—O键的物质的量为4 mol,C错误;金刚石为碳元素形成的单质,高温下与O2反应,D错误。
5. D 解析:共价晶体的熔点和硬度与构成共价晶体的原子间的共价键键能有关,而原子间的共价键键能与原子半径的大小有关,共价晶体的熔点与原子种类多少无关,①错误;共价晶体的熔点与构成共价晶体的原子间的共价键键能有关,构成共价晶体的原子间的共价键键能越大,晶体的熔点越高,②正确;构成共价晶体的原子的半径越大,键长越长,共价键键能越小,晶体的硬度越小,③错误,④正确;故选D。
6. C 解析:键能越大形成的化学键越稳定,表中键能最大的是Si—O键,最稳定的共价键是Si—O键,A错误;氯气变化为氯原子吸热等于氯气中断裂化学键需要的能量,Cl2(g)―→2Cl(g) ΔH=243 kJ·mol-1 ,B错误;依据键能计算,反应焓变=反应物键能总和-生成物键能总和,ΔH=436 kJ·mol-1+243 kJ·mol-1-2×431 kJ·mol-1=-183 kJ·mol-1,H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1,C正确;HCl(g)===HCl(l)的ΔH未告知,故无法计算SiCl4(g)+2H2(g)===Si(s)+4HCl(l)的ΔH,D错误。
7. A 解析:金刚石晶体和二氧化硅晶体均属于共价晶体,A正确;金刚石的晶胞中含有碳原子数为8×+6×+4=8个,B错误;60 g SiO2晶体的物质的量为1 mol,1 mol Si原子与4 mol O 原子形成4 mol硅氧键,1 mol O原子与2 mol Si原子形成2 mol硅氧键,故1 mol SiO2中含4 mol硅氧键,即共价键数为4NA,C错误;二氧化硅晶体属于共价晶体,熔化时破坏共价键,D错误。
8. C 解析:该化合物晶体中每个碳原子均以4个共价单键与氧原子结合,形成一种无限伸展的空间网状结构,则该化合物晶体中不存在分子,属于共价晶体,A正确;晶体中每个碳原子均以4个共价单键与氧原子结合,每个氧原子和2个碳原子以共价单键相结合,所以碳、氧原子个数比为1∶2,B正确;该晶体中每个碳原子形成4个C—O共价键,所以C原子与C—O键数目之比为1∶4,C错误;该晶体中最小的环由6个碳原子和6个氧原子构成,D正确。
9. B 解析:根据β氮化碳硬度超过金刚石晶体判断,氮化碳属于共价晶体,A正确;氮的非金属性大于碳的非金属性,氮化碳中碳显+4价,氮显-3价,B错误;氮化碳的化学式为C3N4,每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连,C、D正确。
10. B 解析:分子中键长越短,键能越高,则分子越稳定,键长越长,键能越低,则分子越不稳定,A错误;元素周期表中的ⅠA族(除H外)和ⅦA族元素都是典型的金属和非金属元素,所以形成的化学键是离子键,B正确;水分子的结构是V形,键角是105°,C错误;H—O的键能为463 kJ·mol-1,18 g H2O即1 mol H2O分解成2 mol H和1 mol O时消耗的能量为2×463 kJ,D错误。
11. B 解析:由元素在周期表中的位置可知,X为N、W为P、Y为S、R为Ar、Z为Br。白磷分子中存在非极性键,但稀有气体分子为单原子分子,分子中没有化学键,A错误;氮气、溴单质都是双原子分子,B正确;原子半径:W>Y,故键长:W—H>Y—H,电负性:WW—H,C错误;原子半径:W>X,故键长:W—H>X—H,键长越短,键能越大,故键能:W—H12. C 解析:C3N4晶体具有比金刚石还大的硬度,则该晶体属于共价晶体,其化学键比金刚石更牢固,A正确;C的最外层有4个电子,因此一个碳原子连接4个N原子,N的最外层有5个电子,因此一个N原子连接3个C原子,B正确;根据以上分析可知该晶体中碳原子个数与碳氮键个数之比为1∶4,C错误;构成该晶体的微粒间只以单键结合,每个碳原子连接4个氮原子,每个氮原子连接3个碳原子,则晶体中碳原子和氮原子的最外层都满足8电子稳定结构,D正确。
13. (1) C—C键和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成
(2) C—H键的键能大于C—O键,C—H键比C—O键稳定。而Si—H键的键能却小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键
(3) 硅单质的硬度和熔点小于二氧化硅晶体。
14. (1) 74 pm ①⑤②③④ (2) BC
(3) > (4) 120 475 kJ 858.7 kJ
解析:(1) 可以直接从题中读出有关数据,H—H键的键长为74 pm;体系能量由高到低的顺序是①⑤②③④。(2) 氢分子中含有一个σ键,A错误;核间距逐渐减小时,两个氢原子的原子轨道会相互重叠,导致电子在核间出现的概率增大,B正确;④已经达到稳定状态,当改变构成氢分子的两个氢原子的核间距时,必须消耗外界的能量,C正确;氢分子中含有一个非极性共价键,D错误。(3) Si—Si键的键长比Si—C键的键长长,Si—Si键的键能比Si—C键的键能小。(4) H—H键的键能为436 kJ·mol-1,每千克H2燃烧(生成水蒸气)放出的热量约为1 000 g÷2 g·mol-1×(462.8 kJ·mol-1×2-436 kJ·mol-1-497.3 kJ·mol-1×)=120 475 kJ;每摩尔硅完全燃烧放出的热量约为452 kJ·mol-1×4 mol-497.3 kJ·mol-1×1 mol-226 kJ·mol-1×2 mol=858.7 kJ。
15. (1) H原子的半径比Cl原子的半径小,故H—H键的键长比Cl—Cl键的键长短,H—H键的键能比Cl—Cl键的键能大
(2) H—O键的键能比H—C键的键能大,故H2O比CH4稳定
(3) N2分子中存在氮氮三键,键能大,结构稳定,故氮气能在空气中稳定存在
16. (1) 共价 晶体硼的熔、沸点和硬度都介于晶体硅和金刚石之间,而金刚石和晶体硅均为共价晶体,B与C相邻且与Si处于对角线位置,也应为共价晶体 (2) 12
解析:(2) 每个三角形的顶点被5个三角形所共有,所以,此顶点完全属于一个三角形的只占到,每个三角形中有3个这样的点,且晶体B中有20个这样的三角形,因此,晶体B中这样的顶点(B原子)有×20=12个。
1. 下列说法中,不正确的是( )
A. 金属元素与非金属元素也可能形成共价键
B. 成键原子间原子轨道重叠的愈多,共价键愈牢固
C. 对双原子分子来说,键能愈大,含有该键的分子愈稳定
D. 键长愈长,化学键愈牢固
2. (2021·南菁高级中学质检)下列比较不正确的是( )
A. 熔点由高到低:生铁<纯铁
B. 硬度由大到小:金刚石>碳化硅>晶体硅
C. 熔点由高到低: Na>Mg>Al
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
3. 二氧化硅晶体是立体的网状结构,其结构如图所示。关于二氧化硅的下列说法中,不正确的是( )
A. 晶体中Si、O原子个数比为1∶2
B. 晶体中最小原子环上的原子数为8
C. 晶体中最小原子环上的原子数为12
D. 晶体中Si、O原子最外层都满足8电子稳定结构
4. (2020·淄博淄川中学月考)下列说法正确的是( )
A. 金刚石晶体中的最小环由6个碳原子构成
B. AlCl3晶体属于共价晶体
C. 1 mol SiO2晶体中含2 mol Si—O键
D. 金刚石化学性质稳定,即使在高温下也不会和O2反应
5. 下表是某些共价晶体的熔点和硬度:
共价晶体 金刚石 氮化硼 碳化硅
熔点/℃ 3 900 3 000 2 700
硬度 10 9.5 9.5
共价晶体 石英 硅 锗
熔点/℃ 1 710 1 410 1 211
硬度 7 6.5 6.0
分析表中的数据,判断下列叙述正确的是( )
①构成共价晶体的原子种类越多,晶体的熔点越高 ②构成共价晶体的原子间的共价键键能越大,晶体的熔点越高 ③构成共价晶体的原子的半径越大,晶体的硬度越大 ④构成共价晶体的原子的半径越小,晶体的硬度越大
A. ①② B. ③④ C. ①③ D. ②④
6. 下表列出常温下部分化学键的键能:
化学键 Si—O Si—Cl H—H H—Cl
键能/ (kJ·mol-1) 460 360 436 431
化学键 Si—Si Si—C Cl—Cl
键能/ (kJ·mol-1) 176 347 243
据此判断下列说法正确的是( )
A. 表中最稳定的共价键是Si—Si
B. Cl2(g)―→2Cl(g) ΔH=-243 kJ·mol-1
C. H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1
D. 根据表中数据能计算出SiCl4(g)+2H2(g)===Si(s)+4HCl(l)的ΔH
7. (2021·礼嘉中学阶段调研)下列有关金刚石晶体和二氧化硅晶体(如图所示)的叙述正确的是( )
A. 金刚石晶体和二氧化硅晶体均属于共价晶体
B. 金刚石晶胞中含有6个碳原子
C. 60g SiO2晶体中所含共价键数目为6NA(NA是阿伏加德罗常数的值)
D. 金刚石晶体熔化时破坏共价键,二氧化硅晶体熔化时破坏分子间作用力
8. 科学家成功研制成了一种新型的碳氧化物,该化合物晶体与SiO2的晶体的结构相似,晶体中每个碳原子均以4个共价单键与氧原子结合,形成一种无限伸展的空间网状结构。下列对该晶体的叙述错误的是( )
A. 该晶体是共价晶体
B. 该晶体中碳原子和氧原子的个数比为1∶2
C. 该晶体中碳原子数与C—O键数之比为1∶2
D. 该晶体中最小的环由12个原子构成
9. 氮化碳结构如图,其中β氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法中,不正确的是( )
A. 氮化碳属于共价晶体
B. 氮化碳中碳显-4价,氮显+3价
C. 氮化碳的化学式为C3N4
D. 每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
10. (2020·禄丰县一中月考)下列各项说法中,正确的是( )
A. 分子中键能越高,键长越长,则分子越稳定
B. 元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间不能形成共价键
C. 水分子可表示为H—O—H,分子中键角为180°
D. H—O的键能为463 kJ·mol-1,即18 g H2O分解成H2和O2时,消耗能量为2×463 kJ
11. 如图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
A. W、R元素单质分子内都存在非极性键
B. X、Z元素都能形成双原子分子
C. 键长:W—H
D. 键长:X—H
A. 该晶体属于共价晶体,其化学键比金刚石中的碳碳键更牢固
B. 该晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子
C. 该晶体与金刚石相似,碳原子个数与碳氮键个数之比为1∶2
D. 该晶体中碳原子和氮原子的最外层都满足8电子稳定结构
13. 碳和硅的有关化学键键能如表所示,简要分析和解释下列有关事实:
化学键 C—C C—H C—O
键能 (kJ·mol-1) 356 413 336
化学键 Si—Si Si—H Si—O
键能 (kJ·mol-1) 226 318 452
(1) 硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是_______________________________________________________________
__________________________________________________________________。
(2) SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________________________________________________________
__________________________________________________________________。
(3) 根据题目中所给信息,你可以判断硅单质与二氧化硅晶体的熔点和硬度大小吗?
14. Ⅰ. 已知氢分子的形成过程示意图如图所示,请据图回答问题。
(1) H—H键的键长为________,①~⑤中,体系能量由高到低的顺序是____________________。
(2) 下列说法正确的是________(填字母)。
A. 氢分子中含有一个π键
B. 由①到④,电子在核间出现的概率增大
C. 由④到⑤,必须消耗外界的能量
D. 氢分子中含有一个极性共价键
Ⅱ. 几种常见化学键的键能如下表所示。
化学键 Si—O H—O O===O
键能/(kJ·mol-1) 452 462.8 497.3
化学键 Si—Si Si—C
键能/(kJ·mol-1) 226 X
请回答下列问题:
(3) 试比较Si—C键与Si—Si键的键能大小:X________(填“>”“<”或“=”)226 kJ·mol-1。
(4) H2被认为是21世纪人类最理想的燃料,而又有科学家提出硅是“21世纪的能源”“未来的石油”等观点。结合Ⅰ中图像,试计算每千克H2燃烧(生成水蒸气)放出的热量约为________;每摩尔硅完全燃烧放出的热量约为________(已知1 mol Si中含有2 mol Si—Si键,1 mol SiO2中含有4 mol Si—O键)。
15. 已知某些共价键的键能如下表,试回答下列问题:
共价键 键能/(kJ·mol-1)
H—H 436
Cl—Cl 242.7
C—H 413.4
共价键 键能/(kJ·mol-1)
O—H 462.8
N≡N 946
H—Cl 431.8
(1) H—H键的键能为什么比Cl—Cl键的键能大?
__________________________________________________________________
__________________________________________________________________。
(2) 已知H2O在2 000 ℃时有5%的分子分解,而CH4在1 000 ℃时可能完全分解为C和H2,试解释其中的原因。
__________________________________________________________________
__________________________________________________________________。
(3) 试解释氮气为什么能在空气中稳定存在。
__________________________________________________________________
__________________________________________________________________。
16. 单质硼有无定形和晶体两种,参考下表数据,回答下列问题:
金刚石 晶体硅 晶体硼
熔点/K >3 823 1 683 2 573
沸点/K 5 100 2 628 2 823
硬度 10 7.0 9.5
(1) 晶体硼的晶体类型属于________晶体,理由是__________________________________________________________________
__________________________________________________________________。
(2) 已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如图),其中有20个等边三角形的面和一定数目的顶点,每个顶点上各有1个B原子。通过观察图形及推算,此晶体结构单元由________个B原子组成。
课时2 共价键键能与化学反应的反应热 共价晶体
1. D 解析:金属原子与非金属原子之间的化学键可能是离子键,如氯化钠,也可能是共价键,如氯化铝,A正确;原子轨道重叠越多,电子在核间出现的概率就越大,所形成的共价键就越牢固,B正确;键能越大,断裂时吸收的能量越多,则越难以断裂,分子越稳定,C正确;共价键的键长越短,键能越大,键越牢固,键长越长,化学键越不牢固,D错误。
2. C 解析:生铁为合金,熔点比纯铁低,A正确;共价晶体中,共价键越短,共价键越强,硬度越大,碳原子半径小于硅原子,则硬度由大到小:金刚石>碳化硅>晶体硅,B正确;金属离子的电荷越大、半径越小,其熔点越大,则熔点由高到低为Al>Mg>Na,C错误;离子晶体中离子半径越小,晶格能越大,则晶格能由大到小:NaF>NaCl>NaBr>NaI,D正确。
3. B 解析:硅原子占有与其成键的每一个氧原子的,完全占有的氧原子数为4×=2,则晶体中Si、O原子个数比为1∶2,A正确;观察结构示意图,可知晶体中最小原子环上的原子数为12,B错误,C正确;晶体中,每个Si原子形成四个共价键后达到了8电子稳定结构,每个氧原子形成2个共价键后达到了8电子稳定结构,D正确。
4. A 解析:金刚石是共价晶体,原子间以共价键相结合,形成三维的空间网状结构,最小的环上有6个碳原子,A正确;AlCl3熔、沸点较低,其晶体属于分子晶体,B错误;1个硅原子与周围4个氧原子形成4个Si—O键,而1个氧原子能形成2个Si—O键,1 mol SiO2晶体有1 mol硅原子和2 mol氧原子,含有Si—O键的物质的量为4 mol,C错误;金刚石为碳元素形成的单质,高温下与O2反应,D错误。
5. D 解析:共价晶体的熔点和硬度与构成共价晶体的原子间的共价键键能有关,而原子间的共价键键能与原子半径的大小有关,共价晶体的熔点与原子种类多少无关,①错误;共价晶体的熔点与构成共价晶体的原子间的共价键键能有关,构成共价晶体的原子间的共价键键能越大,晶体的熔点越高,②正确;构成共价晶体的原子的半径越大,键长越长,共价键键能越小,晶体的硬度越小,③错误,④正确;故选D。
6. C 解析:键能越大形成的化学键越稳定,表中键能最大的是Si—O键,最稳定的共价键是Si—O键,A错误;氯气变化为氯原子吸热等于氯气中断裂化学键需要的能量,Cl2(g)―→2Cl(g) ΔH=243 kJ·mol-1 ,B错误;依据键能计算,反应焓变=反应物键能总和-生成物键能总和,ΔH=436 kJ·mol-1+243 kJ·mol-1-2×431 kJ·mol-1=-183 kJ·mol-1,H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1,C正确;HCl(g)===HCl(l)的ΔH未告知,故无法计算SiCl4(g)+2H2(g)===Si(s)+4HCl(l)的ΔH,D错误。
7. A 解析:金刚石晶体和二氧化硅晶体均属于共价晶体,A正确;金刚石的晶胞中含有碳原子数为8×+6×+4=8个,B错误;60 g SiO2晶体的物质的量为1 mol,1 mol Si原子与4 mol O 原子形成4 mol硅氧键,1 mol O原子与2 mol Si原子形成2 mol硅氧键,故1 mol SiO2中含4 mol硅氧键,即共价键数为4NA,C错误;二氧化硅晶体属于共价晶体,熔化时破坏共价键,D错误。
8. C 解析:该化合物晶体中每个碳原子均以4个共价单键与氧原子结合,形成一种无限伸展的空间网状结构,则该化合物晶体中不存在分子,属于共价晶体,A正确;晶体中每个碳原子均以4个共价单键与氧原子结合,每个氧原子和2个碳原子以共价单键相结合,所以碳、氧原子个数比为1∶2,B正确;该晶体中每个碳原子形成4个C—O共价键,所以C原子与C—O键数目之比为1∶4,C错误;该晶体中最小的环由6个碳原子和6个氧原子构成,D正确。
9. B 解析:根据β氮化碳硬度超过金刚石晶体判断,氮化碳属于共价晶体,A正确;氮的非金属性大于碳的非金属性,氮化碳中碳显+4价,氮显-3价,B错误;氮化碳的化学式为C3N4,每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连,C、D正确。
10. B 解析:分子中键长越短,键能越高,则分子越稳定,键长越长,键能越低,则分子越不稳定,A错误;元素周期表中的ⅠA族(除H外)和ⅦA族元素都是典型的金属和非金属元素,所以形成的化学键是离子键,B正确;水分子的结构是V形,键角是105°,C错误;H—O的键能为463 kJ·mol-1,18 g H2O即1 mol H2O分解成2 mol H和1 mol O时消耗的能量为2×463 kJ,D错误。
11. B 解析:由元素在周期表中的位置可知,X为N、W为P、Y为S、R为Ar、Z为Br。白磷分子中存在非极性键,但稀有气体分子为单原子分子,分子中没有化学键,A错误;氮气、溴单质都是双原子分子,B正确;原子半径:W>Y,故键长:W—H>Y—H,电负性:W
13. (1) C—C键和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成
(2) C—H键的键能大于C—O键,C—H键比C—O键稳定。而Si—H键的键能却小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键
(3) 硅单质的硬度和熔点小于二氧化硅晶体。
14. (1) 74 pm ①⑤②③④ (2) BC
(3) > (4) 120 475 kJ 858.7 kJ
解析:(1) 可以直接从题中读出有关数据,H—H键的键长为74 pm;体系能量由高到低的顺序是①⑤②③④。(2) 氢分子中含有一个σ键,A错误;核间距逐渐减小时,两个氢原子的原子轨道会相互重叠,导致电子在核间出现的概率增大,B正确;④已经达到稳定状态,当改变构成氢分子的两个氢原子的核间距时,必须消耗外界的能量,C正确;氢分子中含有一个非极性共价键,D错误。(3) Si—Si键的键长比Si—C键的键长长,Si—Si键的键能比Si—C键的键能小。(4) H—H键的键能为436 kJ·mol-1,每千克H2燃烧(生成水蒸气)放出的热量约为1 000 g÷2 g·mol-1×(462.8 kJ·mol-1×2-436 kJ·mol-1-497.3 kJ·mol-1×)=120 475 kJ;每摩尔硅完全燃烧放出的热量约为452 kJ·mol-1×4 mol-497.3 kJ·mol-1×1 mol-226 kJ·mol-1×2 mol=858.7 kJ。
15. (1) H原子的半径比Cl原子的半径小,故H—H键的键长比Cl—Cl键的键长短,H—H键的键能比Cl—Cl键的键能大
(2) H—O键的键能比H—C键的键能大,故H2O比CH4稳定
(3) N2分子中存在氮氮三键,键能大,结构稳定,故氮气能在空气中稳定存在
16. (1) 共价 晶体硼的熔、沸点和硬度都介于晶体硅和金刚石之间,而金刚石和晶体硅均为共价晶体,B与C相邻且与Si处于对角线位置,也应为共价晶体 (2) 12
解析:(2) 每个三角形的顶点被5个三角形所共有,所以,此顶点完全属于一个三角形的只占到,每个三角形中有3个这样的点,且晶体B中有20个这样的三角形,因此,晶体B中这样的顶点(B原子)有×20=12个。
