专题3第四单元 分子间作用力 分子晶体 课时2 分子晶体 课后练 (含解析)
文档属性
| 名称 | 专题3第四单元 分子间作用力 分子晶体 课时2 分子晶体 课后练 (含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 176.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-09 00:00:00 | ||
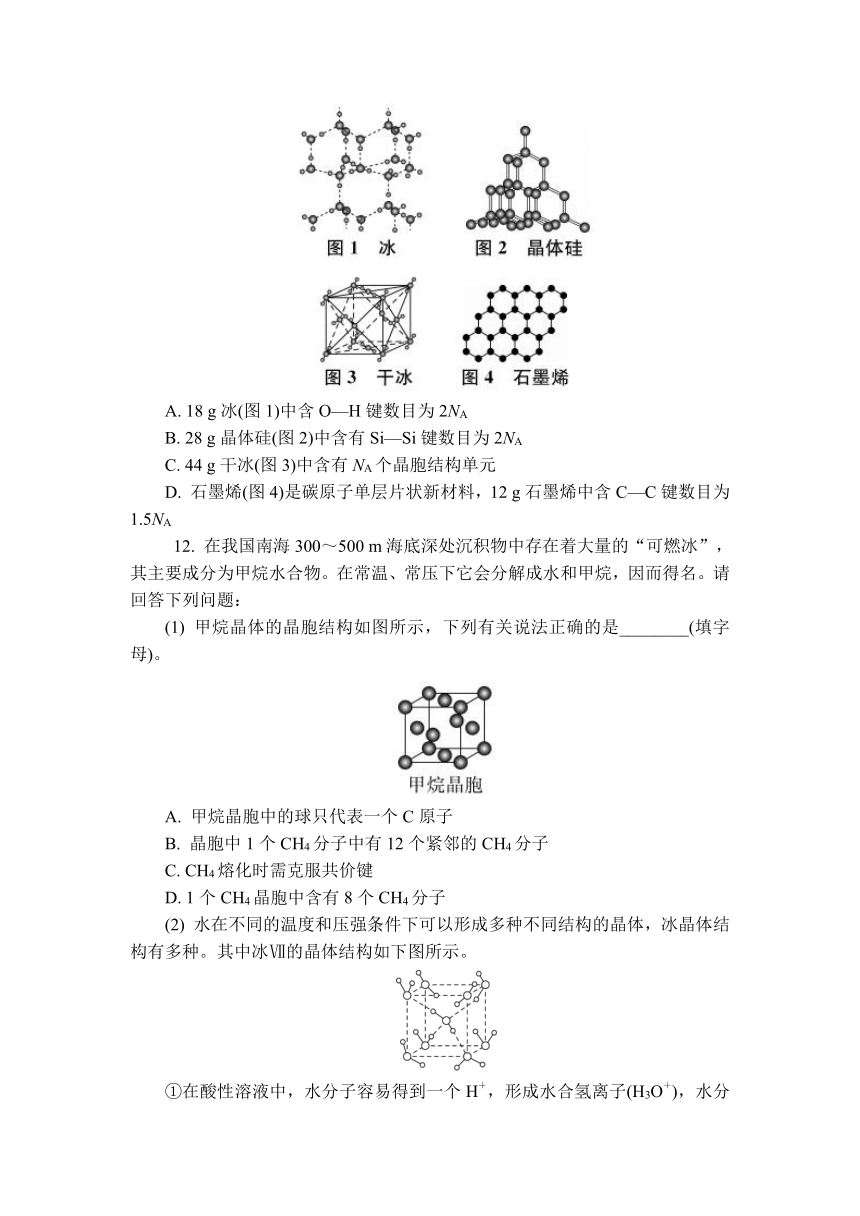
图片预览


文档简介
课时2 分子晶体
1. (2022·高邮第一中学期末) 氮氧化铝(AlON)是新型透明高硬度防弹铝材料,硬度是石英玻璃的4倍。一种制备AlON的反应为CO2+AlCl3+NH3AlON+CO+3HCl。下列说法正确的是( )
2. 下列属于分子晶体性质的是( )
A. 组成晶体的微粒是离子
B. 能溶于CS2,熔点为112.8 ℃,沸点为444.6 ℃
C. 熔点为1 400 ℃,可作半导体材料,难溶于水
D. 熔点高,硬度大
3. (2020·吕叔湘中学诊断考试)下列各物质中,按熔点由高到低的顺序排列正确的是( )
A. CH4>SiH4>GeH4>SnH4
B. KCl>NaCl>MgCl2>MgO
C. Rb>K>Na>Li
D. 金刚石>Si>钠
4. 某研究所合成了一种球形分子,其分子式为C60Si60,结构中含有C60和Si60。下列对该分子的叙述正确的是( )
A. 形成的晶体属于分子晶体
B. 分子中Si60被包裹在C60里面
C. 其摩尔质量为2 400
D. 熔点高、硬度大
5. (2021·吉林白山质检)下列化学式能真实表示物质分子组成的是( )
A. NaOH B. SO3
C. CsCl D. SiO2
6. 下列有关分子晶体的说法正确的是( )
A. 分子内均存在共价键
B. 分子间一定存在范德华力
C. 分子间一定存在氢键
D. 其结构一定为分子密堆积
7. (2021·礼嘉中学阶段调研)下列关于晶体的说法正确的组合是( )
①所有分子晶体中都存在共价键 ②在晶体中只要有阳离子就一定有阴离子 ③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低 ④离子晶体中只有离子键 ⑤SiO2晶体中每个硅原子与4个氧原子以共价键相结合 ⑥晶体中分子间作用力越大,分子越稳定 ⑦氯化钠熔化时离子键被破坏 ⑧含有共价键的晶体熔、沸点都比较高,因为熔化时需要破坏共价键
A. ①②⑤ B. ③⑤⑦
C. ⑤⑥⑧ D. ④⑦⑧
8. (2021·苏大附中月考)下列事实与氢键无关的是( )
A. H2O比H2S稳定
B. 冰的密度比液态水的密度小
C. 乙醇能与水以任意比混溶而甲醚(CH3-O—CH3)难溶于水
D. 液态氟化氢中有三聚氟化氢(HF)3分子存在
9. 下列叙述正确的是( )
A. 熔、沸点由高到低的顺序:AsH3>PH3>NH3
B. 熔、沸点由高到低的顺序:硅>金刚石>NaCl>I2
C. 某物质熔点 1 067 ℃,易溶于水,其水溶液和熔融态均能导电,其晶体一定为离子晶体
D. 硫黄与金刚石晶体熔化时,所克服的微粒间相互作用力相同
10. 某化学兴趣小组在学习分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
NaCl MgCl2 AlCl3 SiCl4 CaCl2
熔点/℃ 801 712 190 -68 782
沸点/℃ 1 465 1 418 230 57 1 600
根据这些数据分析,他们认为属于分子晶体的是( )
A. NaCl、MgCl2、CaCl2
B. AlCl3、SiCl4
C. NaCl、CaCl2
D. 全部
11. 以NA表示阿伏加德罗常数的值,下列说法错误的是( )
A. 18 g冰(图1)中含O—H键数目为2NA
B. 28 g晶体硅(图2)中含有Si—Si键数目为2NA
C. 44 g干冰(图3)中含有NA个晶胞结构单元
D. 石墨烯(图4)是碳原子单层片状新材料,12 g石墨烯中含C—C键数目为1.5NA
12. 在我国南海300~500 m海底深处沉积物中存在着大量的“可燃冰”,其主要成分为甲烷水合物。在常温、常压下它会分解成水和甲烷,因而得名。请回答下列问题:
(1) 甲烷晶体的晶胞结构如图所示,下列有关说法正确的是________(填字母)。
A. 甲烷晶胞中的球只代表一个C原子
B. 晶胞中1个CH4分子中有12个紧邻的CH4分子
C. CH4熔化时需克服共价键
D. 1个CH4晶胞中含有8个CH4分子
(2) 水在不同的温度和压强条件下可以形成多种不同结构的晶体,冰晶体结构有多种。其中冰Ⅶ的晶体结构如下图所示。
①在酸性溶液中,水分子容易得到一个H+,形成水合氢离子(H3O+),水分子能与H+形成配位键,其原因是在氧原子上有____________。
②上述冰晶体中每个水分子与周围________个水分子以氢键结合,该晶体中1 mol水形成________mol氢键。
③实验测得冰中氢键的作用力为18.5 kJ·mol-1,而冰的熔化热为5.0 kJ·mol-1,这说明________________________________________________________________
__________________________________________________________________。
(3) 氨气极易溶于水的原因之一是与氢键有关。请判断:NH3溶于水后,形成的NH3·H2O的合理结构是________(填字母)。
(4) 用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小关系是____________,其判断依据是____________________________________
__________________________________________________________________。
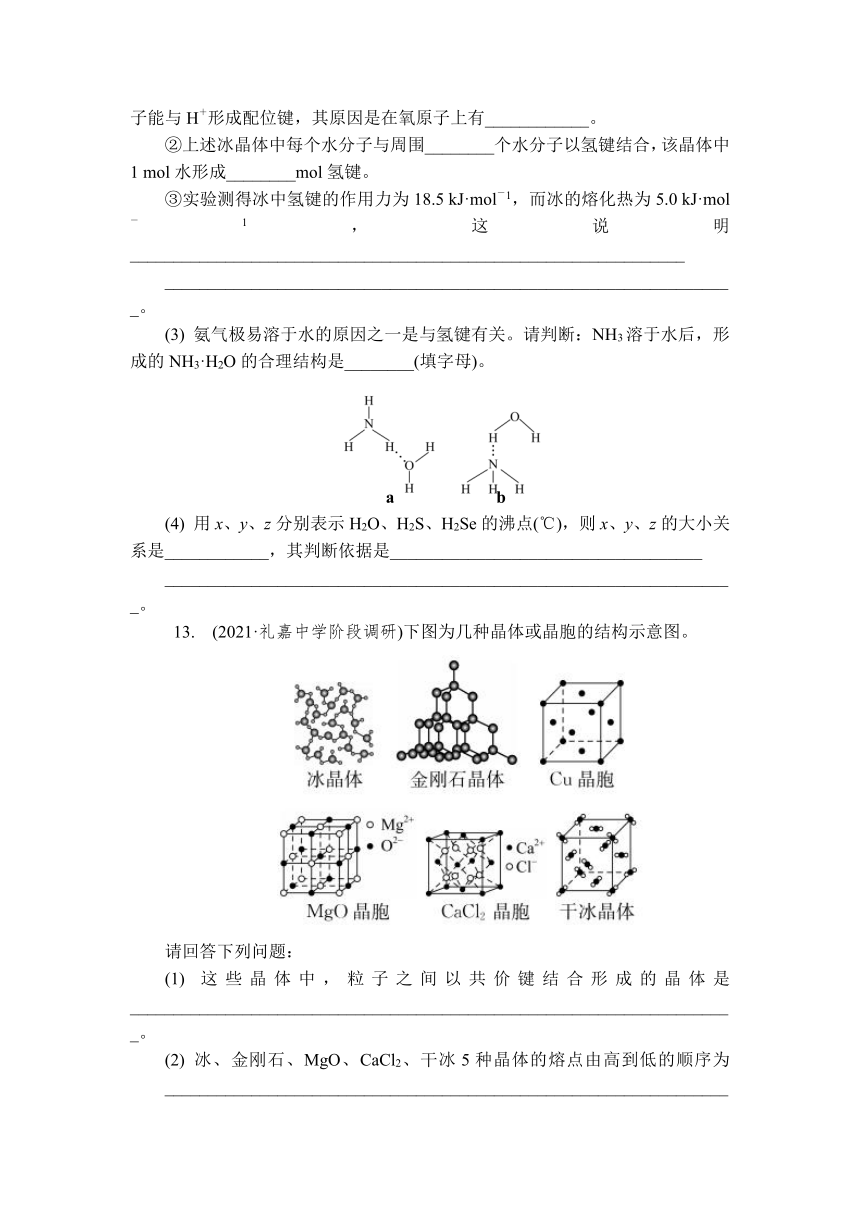
13. (2021·礼嘉中学阶段调研)下图为几种晶体或晶胞的结构示意图。
请回答下列问题:
(1) 这些晶体中,粒子之间以共价键结合形成的晶体是______________________________________________________________________。
(2) 冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为__________________________________________________________________
__________________________________________________________________。
(3) NaCl晶胞与MgO晶胞结构相同,NaCl晶体的硬度________ (填“大于”或“小于”)MgO晶体的硬度,原因是 _______________________________________________________________
__________________________________________________________________。
(4) 每个Cu晶胞中实际占有________个Cu原子,CaCl2晶胞中每个Ca2+周围距离最近且相等的Cl-有________个。
课时2 分子晶体
1. A 解析:CO2的结构式为O===C===O,每个双键中有1个σ键与1个π键,则CO2分子中σ键与π键之比为1∶1,A正确;氮氧化铝(AlON)高硬度,硬度是石英玻璃的4倍,则AlON为共价晶体,B错误;NH3极易溶于水是因为氨气分子与水分子之间存在氢键,C错误; HCl为共价化合物,电子式为H,D错误。
2. B 解析:分子晶体的组成微粒是分子,A错误;分子晶体的熔、沸点低,极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂,B正确;分子晶体的熔、沸点低,晶体在固态和熔融状态时均不导电,C错误;分子晶体的熔、沸点低,硬度小,D错误。
3. D 解析:分子结构相似,且都为分子晶体,分子的相对分子质量越大,分子之间作用力越大,熔点越高,则CH4<SiH4<GeH4< SnH4,A错误;离子晶体的晶格能大小取决于离子半径的大小和电荷的因素,离子半径越小,电荷越多,晶格能越大,离子晶体的熔点越高,则KCl<NaCl<MgCl2<MgO,B错误;碱金属从上到下,原子半径逐渐增大,金属键键能逐渐减小,金属晶体的熔点逐渐降低,则Rb<K<Na<Li,C错误;金刚石和晶体硅均为共价晶体,共价晶体的熔点取决于共价键的键能,而共价键的键能与键长成反比,晶体硅中的Si—Si键的键长比金刚石中C—C键键长长,所以熔点金刚石>Si,Na的熔点较低,则熔点:金刚石>Si>钠,D正确。
4. A 解析:球形分子的分子式为C60Si60,其结构中含有C60和Si60,该物质的晶体是由C60分子和Si60分子构成的,属于分子晶体,A正确;Si原子的半径大于C原子,所以Si—Si键的键长比C—C键长,分子中Si60包裹着C60,B错误;摩尔质量的单位为g·mol-1,C错误;C60Si60属于分子晶体,熔点低、硬度小,D错误。
5. B 解析:化学式能真实表示物质分子组成,说明该物质形成的晶体类型应该是分子晶体,A、C是离子晶体,D是共价晶体,不存在分子,故选B。
6. B 解析:稀有气体组成的晶体中,其分子内不存在任何化学键,A错误;分子间作用力包括范德华力和氢键,所有的分子晶体中都存在范德华力,但只有部分分子晶体的分子间存在氢键,B正确,C错误;存在氢键的分子晶体不采取分子密堆积的方式,D错误。
7. B 解析:稀有气体形成的分子晶体中不存在共价键,①错误;金属晶体中有阳离子,但没有阴离子,②错误;金刚石、SiC形成共价晶体,NaF、NaCl形成离子晶体,H2O、H2S形成分子晶体,金刚石的熔点比SiC高,NaF的熔点比NaCl高,H2O分子间能形成氢键,熔点比H2S高,所以晶体的熔点依次降低,③正确;离子晶体中一定有离子键,可能有共价键,④错误;Si的最外层电子数为4,能形成4个共价键,所以SiO2晶体中每个硅原子与4个氧原子以共价键相结合,⑤正确;晶体中分子间作用力越大,熔、沸点越高,但不影响分子的稳定性,⑥错误;氯化钠熔化时,离子键被破坏,转化为自由移动的Na+、Cl-,⑦正确;离子晶体熔化时不需要破坏共价键,所以含有共价键的晶体熔、沸点不一定高,⑧错误;③⑤⑦正确,答案选B。
8. A 解析:H2O比H2S稳定是由于H2O中的O—H键比H2S中的S—H键的键能更大,与氢键无关,A符合题意;由于水结冰的过程中形成的分子间氢键数目增多,且氢键有方向性,导致空间利用率减小,故冰的密度比液态水的密度小,与氢键有关,B不符合题意;乙醇能与水以任意比混溶而甲醚(CH3—O—CH3)难溶于水,是由于乙醇能与水分子形成分子间氢键,而甲醚(CH3—O—CH3)不能,与氢键有关,C不符合题意;由于液态氟化氢中存在分子间氢键,故液态氢氟酸能够形成三聚氟化氢(HF)3分子,与氢键有关,D不符合题意。
9. C 解析:NH3分子间有氢键,AsH3、PH3的组成和结构相似,由于AsH3的相对分子质量高于PH3,AsH3的熔沸点高于PH3,熔、沸点由高到低的顺序:NH3>AsH3>PH3,A错误;熔、沸点:共价晶体>离子晶体>分子晶体,共价晶体中共价键的键长越短,键能越大,熔、沸点越大,所以熔、沸点由高到低的顺序:金刚石>硅> NaCl>I2,B错误;熔融态能导电,则可能是离子晶体或金属晶体,该物质熔点 1 067 ℃,易溶于水,其水溶液能导电,则不可能为金属晶体,故其晶体一定为离子晶体,C正确;硫黄属于分子晶体,金刚石属于共价晶体,故晶体熔化时,前者克服的是分子间作用力,后者克服的是共价键,D错误。
10. B 解析:由分子构成的晶体,分子与分子之间靠分子间作用力聚集在一起,而分子间作用力较小,克服分子间作用力所需能量较低,故分子晶体的熔、沸点较低,表中的MgCl2、NaCl、CaCl2熔、沸点很高,不属于分子晶体,AlCl3、SiCl4熔、沸点较低,应为分子晶体,B正确,A、C、D错误。
11. C 解析:一个水分子中有2个H—O,则18 g即1 mol冰中含O—H键数目为2NA,A正确;28 g晶体硅中含有1 mol硅原子,晶体硅中每个硅原子形成的共价键为×4=2,则1 mol晶体硅中含有Si—Si键数目为2NA,B正确;一个晶胞结构单元含有4个二氧化碳分子,44 g干冰即1 mol中晶胞结构单元数小于NA个,C错误;石墨烯中每个碳原子周围有3个C—C键,所以每个碳原子实际拥有1.5个C—C键,则12 g石墨烯即1 mol中含C—C键数目为1.5NA,D正确。
12. (1) B
(2) ①孤电子对 ②4 2 ③冰融化为液态水时只破坏了一部分氢键,液态水中仍存在氢键
(3) b
(4) x>z>y 水分子间可以形成氢键,H2Se的相对分子质量大于H2S,故沸点:H2O>H2Se>H2S
解析:(1) CH4是分子晶体,熔化时克服范德华力。晶胞中的球体代表的是一个甲烷分子,并不是一个C原子。以该甲烷晶胞分析,位于顶点的某一个甲烷分子与其距离最近的甲烷分子有3个,而这3个甲烷分子在面上,故与1个甲烷分子紧邻的甲烷分子有3×8×=12(个)。甲烷晶胞属于面心立方晶胞,该晶胞中甲烷分子的个数为8×+6×=4(个)。(2) ①H2O分子能与H+形成配位键,其原因是在O原子上有孤电子对,H+有空轨道。②观察图示晶体结构可知,该水分子与周围4个水分子以氢键结合,每2个水分子间形成1个氢键,故1 mol水可形成4 mol×=2 mol 氢键。③冰中氢键的作用力为18.5 kJ·mol-1,而冰的熔化热为5.0 kJ·mol-1,说明冰融化为液态水时只是破坏了一部分氢键,并且液态水中仍存在氢键。(3) 由电离方程式NH3·H2O NH+OH-,可知b图符合NH3·H2O的结构。
(4) 水分子间存在氢键,H2Se与H2S分子间不存在氢键,但H2Se的相对分子质量大于H2S相对分子质量,H2Se分子间范德华力大于H2S分子间范德华力。
13. (1) 金刚石晶体
(2) 金刚石、MgO、CaCl2、冰、干冰
(3) 小于 在MgO、NaCl晶体中,离子半径:r(Mg2+)(4) 4 8
解析:(1) 冰、干冰属于分子晶体,分子间以分子间作用力结合;金刚石为共价晶体,原子间通过共价键结合;Cu属于金属晶体,金属阳离子与自由电子间以金属键结合;MgO、CaCl2属于离子晶体,阴阳离子间通过离子键结合,所以这些晶体中只有金刚石的微粒间时通过共价键结合的。(2) 一般情况下,微粒间的作用力:共价晶体>离子晶体>分子晶体,在上述物质中,金刚石为共价晶体,则其熔点最高;MgO、CaCl2为离子晶体,则其熔点低于金刚石,由于离子半径:镁离子小于钙离子,氧离子小于氯离子,离子半径越小,离子所带电荷越多,则离子键越强,断键所需的能量越大,物质熔点越高,所以熔点:MgO>CaCl2;冰、干冰均属于分子晶体,分子间以分子间作用力相结合,由于水分子中含有氢键,二氧化碳中只含分子间作用力,所以熔点:冰>干冰,综上所述,以上五种物质的熔点高低:金刚石>MgO>CaCl2>冰>干冰。(3) NaCl、MgO晶体中,离子半径:镁离子<钠离子,氧离子<氯离子;且NaCl晶体中所带电荷数小于MgO晶体中所带电荷数,所以NaCl晶体的硬度小于MgO晶体。(4) 每个Cu晶胞中所含由的Cu原子个数为8×+6×=4;CaCl2晶体中,每个钙离子周围距离最近且相等的氯离子构成正方体形结构,所以每个钙离子周围距离最近且相等的氯离子有8个。
1. (2022·高邮第一中学期末) 氮氧化铝(AlON)是新型透明高硬度防弹铝材料,硬度是石英玻璃的4倍。一种制备AlON的反应为CO2+AlCl3+NH3AlON+CO+3HCl。下列说法正确的是( )
2. 下列属于分子晶体性质的是( )
A. 组成晶体的微粒是离子
B. 能溶于CS2,熔点为112.8 ℃,沸点为444.6 ℃
C. 熔点为1 400 ℃,可作半导体材料,难溶于水
D. 熔点高,硬度大
3. (2020·吕叔湘中学诊断考试)下列各物质中,按熔点由高到低的顺序排列正确的是( )
A. CH4>SiH4>GeH4>SnH4
B. KCl>NaCl>MgCl2>MgO
C. Rb>K>Na>Li
D. 金刚石>Si>钠
4. 某研究所合成了一种球形分子,其分子式为C60Si60,结构中含有C60和Si60。下列对该分子的叙述正确的是( )
A. 形成的晶体属于分子晶体
B. 分子中Si60被包裹在C60里面
C. 其摩尔质量为2 400
D. 熔点高、硬度大
5. (2021·吉林白山质检)下列化学式能真实表示物质分子组成的是( )
A. NaOH B. SO3
C. CsCl D. SiO2
6. 下列有关分子晶体的说法正确的是( )
A. 分子内均存在共价键
B. 分子间一定存在范德华力
C. 分子间一定存在氢键
D. 其结构一定为分子密堆积
7. (2021·礼嘉中学阶段调研)下列关于晶体的说法正确的组合是( )
①所有分子晶体中都存在共价键 ②在晶体中只要有阳离子就一定有阴离子 ③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低 ④离子晶体中只有离子键 ⑤SiO2晶体中每个硅原子与4个氧原子以共价键相结合 ⑥晶体中分子间作用力越大,分子越稳定 ⑦氯化钠熔化时离子键被破坏 ⑧含有共价键的晶体熔、沸点都比较高,因为熔化时需要破坏共价键
A. ①②⑤ B. ③⑤⑦
C. ⑤⑥⑧ D. ④⑦⑧
8. (2021·苏大附中月考)下列事实与氢键无关的是( )
A. H2O比H2S稳定
B. 冰的密度比液态水的密度小
C. 乙醇能与水以任意比混溶而甲醚(CH3-O—CH3)难溶于水
D. 液态氟化氢中有三聚氟化氢(HF)3分子存在
9. 下列叙述正确的是( )
A. 熔、沸点由高到低的顺序:AsH3>PH3>NH3
B. 熔、沸点由高到低的顺序:硅>金刚石>NaCl>I2
C. 某物质熔点 1 067 ℃,易溶于水,其水溶液和熔融态均能导电,其晶体一定为离子晶体
D. 硫黄与金刚石晶体熔化时,所克服的微粒间相互作用力相同
10. 某化学兴趣小组在学习分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
NaCl MgCl2 AlCl3 SiCl4 CaCl2
熔点/℃ 801 712 190 -68 782
沸点/℃ 1 465 1 418 230 57 1 600
根据这些数据分析,他们认为属于分子晶体的是( )
A. NaCl、MgCl2、CaCl2
B. AlCl3、SiCl4
C. NaCl、CaCl2
D. 全部
11. 以NA表示阿伏加德罗常数的值,下列说法错误的是( )
A. 18 g冰(图1)中含O—H键数目为2NA
B. 28 g晶体硅(图2)中含有Si—Si键数目为2NA
C. 44 g干冰(图3)中含有NA个晶胞结构单元
D. 石墨烯(图4)是碳原子单层片状新材料,12 g石墨烯中含C—C键数目为1.5NA
12. 在我国南海300~500 m海底深处沉积物中存在着大量的“可燃冰”,其主要成分为甲烷水合物。在常温、常压下它会分解成水和甲烷,因而得名。请回答下列问题:
(1) 甲烷晶体的晶胞结构如图所示,下列有关说法正确的是________(填字母)。
A. 甲烷晶胞中的球只代表一个C原子
B. 晶胞中1个CH4分子中有12个紧邻的CH4分子
C. CH4熔化时需克服共价键
D. 1个CH4晶胞中含有8个CH4分子
(2) 水在不同的温度和压强条件下可以形成多种不同结构的晶体,冰晶体结构有多种。其中冰Ⅶ的晶体结构如下图所示。
①在酸性溶液中,水分子容易得到一个H+,形成水合氢离子(H3O+),水分子能与H+形成配位键,其原因是在氧原子上有____________。
②上述冰晶体中每个水分子与周围________个水分子以氢键结合,该晶体中1 mol水形成________mol氢键。
③实验测得冰中氢键的作用力为18.5 kJ·mol-1,而冰的熔化热为5.0 kJ·mol-1,这说明________________________________________________________________
__________________________________________________________________。
(3) 氨气极易溶于水的原因之一是与氢键有关。请判断:NH3溶于水后,形成的NH3·H2O的合理结构是________(填字母)。
(4) 用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小关系是____________,其判断依据是____________________________________
__________________________________________________________________。
13. (2021·礼嘉中学阶段调研)下图为几种晶体或晶胞的结构示意图。
请回答下列问题:
(1) 这些晶体中,粒子之间以共价键结合形成的晶体是______________________________________________________________________。
(2) 冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为__________________________________________________________________
__________________________________________________________________。
(3) NaCl晶胞与MgO晶胞结构相同,NaCl晶体的硬度________ (填“大于”或“小于”)MgO晶体的硬度,原因是 _______________________________________________________________
__________________________________________________________________。
(4) 每个Cu晶胞中实际占有________个Cu原子,CaCl2晶胞中每个Ca2+周围距离最近且相等的Cl-有________个。
课时2 分子晶体
1. A 解析:CO2的结构式为O===C===O,每个双键中有1个σ键与1个π键,则CO2分子中σ键与π键之比为1∶1,A正确;氮氧化铝(AlON)高硬度,硬度是石英玻璃的4倍,则AlON为共价晶体,B错误;NH3极易溶于水是因为氨气分子与水分子之间存在氢键,C错误; HCl为共价化合物,电子式为H,D错误。
2. B 解析:分子晶体的组成微粒是分子,A错误;分子晶体的熔、沸点低,极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂,B正确;分子晶体的熔、沸点低,晶体在固态和熔融状态时均不导电,C错误;分子晶体的熔、沸点低,硬度小,D错误。
3. D 解析:分子结构相似,且都为分子晶体,分子的相对分子质量越大,分子之间作用力越大,熔点越高,则CH4<SiH4<GeH4< SnH4,A错误;离子晶体的晶格能大小取决于离子半径的大小和电荷的因素,离子半径越小,电荷越多,晶格能越大,离子晶体的熔点越高,则KCl<NaCl<MgCl2<MgO,B错误;碱金属从上到下,原子半径逐渐增大,金属键键能逐渐减小,金属晶体的熔点逐渐降低,则Rb<K<Na<Li,C错误;金刚石和晶体硅均为共价晶体,共价晶体的熔点取决于共价键的键能,而共价键的键能与键长成反比,晶体硅中的Si—Si键的键长比金刚石中C—C键键长长,所以熔点金刚石>Si,Na的熔点较低,则熔点:金刚石>Si>钠,D正确。
4. A 解析:球形分子的分子式为C60Si60,其结构中含有C60和Si60,该物质的晶体是由C60分子和Si60分子构成的,属于分子晶体,A正确;Si原子的半径大于C原子,所以Si—Si键的键长比C—C键长,分子中Si60包裹着C60,B错误;摩尔质量的单位为g·mol-1,C错误;C60Si60属于分子晶体,熔点低、硬度小,D错误。
5. B 解析:化学式能真实表示物质分子组成,说明该物质形成的晶体类型应该是分子晶体,A、C是离子晶体,D是共价晶体,不存在分子,故选B。
6. B 解析:稀有气体组成的晶体中,其分子内不存在任何化学键,A错误;分子间作用力包括范德华力和氢键,所有的分子晶体中都存在范德华力,但只有部分分子晶体的分子间存在氢键,B正确,C错误;存在氢键的分子晶体不采取分子密堆积的方式,D错误。
7. B 解析:稀有气体形成的分子晶体中不存在共价键,①错误;金属晶体中有阳离子,但没有阴离子,②错误;金刚石、SiC形成共价晶体,NaF、NaCl形成离子晶体,H2O、H2S形成分子晶体,金刚石的熔点比SiC高,NaF的熔点比NaCl高,H2O分子间能形成氢键,熔点比H2S高,所以晶体的熔点依次降低,③正确;离子晶体中一定有离子键,可能有共价键,④错误;Si的最外层电子数为4,能形成4个共价键,所以SiO2晶体中每个硅原子与4个氧原子以共价键相结合,⑤正确;晶体中分子间作用力越大,熔、沸点越高,但不影响分子的稳定性,⑥错误;氯化钠熔化时,离子键被破坏,转化为自由移动的Na+、Cl-,⑦正确;离子晶体熔化时不需要破坏共价键,所以含有共价键的晶体熔、沸点不一定高,⑧错误;③⑤⑦正确,答案选B。
8. A 解析:H2O比H2S稳定是由于H2O中的O—H键比H2S中的S—H键的键能更大,与氢键无关,A符合题意;由于水结冰的过程中形成的分子间氢键数目增多,且氢键有方向性,导致空间利用率减小,故冰的密度比液态水的密度小,与氢键有关,B不符合题意;乙醇能与水以任意比混溶而甲醚(CH3—O—CH3)难溶于水,是由于乙醇能与水分子形成分子间氢键,而甲醚(CH3—O—CH3)不能,与氢键有关,C不符合题意;由于液态氟化氢中存在分子间氢键,故液态氢氟酸能够形成三聚氟化氢(HF)3分子,与氢键有关,D不符合题意。
9. C 解析:NH3分子间有氢键,AsH3、PH3的组成和结构相似,由于AsH3的相对分子质量高于PH3,AsH3的熔沸点高于PH3,熔、沸点由高到低的顺序:NH3>AsH3>PH3,A错误;熔、沸点:共价晶体>离子晶体>分子晶体,共价晶体中共价键的键长越短,键能越大,熔、沸点越大,所以熔、沸点由高到低的顺序:金刚石>硅> NaCl>I2,B错误;熔融态能导电,则可能是离子晶体或金属晶体,该物质熔点 1 067 ℃,易溶于水,其水溶液能导电,则不可能为金属晶体,故其晶体一定为离子晶体,C正确;硫黄属于分子晶体,金刚石属于共价晶体,故晶体熔化时,前者克服的是分子间作用力,后者克服的是共价键,D错误。
10. B 解析:由分子构成的晶体,分子与分子之间靠分子间作用力聚集在一起,而分子间作用力较小,克服分子间作用力所需能量较低,故分子晶体的熔、沸点较低,表中的MgCl2、NaCl、CaCl2熔、沸点很高,不属于分子晶体,AlCl3、SiCl4熔、沸点较低,应为分子晶体,B正确,A、C、D错误。
11. C 解析:一个水分子中有2个H—O,则18 g即1 mol冰中含O—H键数目为2NA,A正确;28 g晶体硅中含有1 mol硅原子,晶体硅中每个硅原子形成的共价键为×4=2,则1 mol晶体硅中含有Si—Si键数目为2NA,B正确;一个晶胞结构单元含有4个二氧化碳分子,44 g干冰即1 mol中晶胞结构单元数小于NA个,C错误;石墨烯中每个碳原子周围有3个C—C键,所以每个碳原子实际拥有1.5个C—C键,则12 g石墨烯即1 mol中含C—C键数目为1.5NA,D正确。
12. (1) B
(2) ①孤电子对 ②4 2 ③冰融化为液态水时只破坏了一部分氢键,液态水中仍存在氢键
(3) b
(4) x>z>y 水分子间可以形成氢键,H2Se的相对分子质量大于H2S,故沸点:H2O>H2Se>H2S
解析:(1) CH4是分子晶体,熔化时克服范德华力。晶胞中的球体代表的是一个甲烷分子,并不是一个C原子。以该甲烷晶胞分析,位于顶点的某一个甲烷分子与其距离最近的甲烷分子有3个,而这3个甲烷分子在面上,故与1个甲烷分子紧邻的甲烷分子有3×8×=12(个)。甲烷晶胞属于面心立方晶胞,该晶胞中甲烷分子的个数为8×+6×=4(个)。(2) ①H2O分子能与H+形成配位键,其原因是在O原子上有孤电子对,H+有空轨道。②观察图示晶体结构可知,该水分子与周围4个水分子以氢键结合,每2个水分子间形成1个氢键,故1 mol水可形成4 mol×=2 mol 氢键。③冰中氢键的作用力为18.5 kJ·mol-1,而冰的熔化热为5.0 kJ·mol-1,说明冰融化为液态水时只是破坏了一部分氢键,并且液态水中仍存在氢键。(3) 由电离方程式NH3·H2O NH+OH-,可知b图符合NH3·H2O的结构。
(4) 水分子间存在氢键,H2Se与H2S分子间不存在氢键,但H2Se的相对分子质量大于H2S相对分子质量,H2Se分子间范德华力大于H2S分子间范德华力。
13. (1) 金刚石晶体
(2) 金刚石、MgO、CaCl2、冰、干冰
(3) 小于 在MgO、NaCl晶体中,离子半径:r(Mg2+)
解析:(1) 冰、干冰属于分子晶体,分子间以分子间作用力结合;金刚石为共价晶体,原子间通过共价键结合;Cu属于金属晶体,金属阳离子与自由电子间以金属键结合;MgO、CaCl2属于离子晶体,阴阳离子间通过离子键结合,所以这些晶体中只有金刚石的微粒间时通过共价键结合的。(2) 一般情况下,微粒间的作用力:共价晶体>离子晶体>分子晶体,在上述物质中,金刚石为共价晶体,则其熔点最高;MgO、CaCl2为离子晶体,则其熔点低于金刚石,由于离子半径:镁离子小于钙离子,氧离子小于氯离子,离子半径越小,离子所带电荷越多,则离子键越强,断键所需的能量越大,物质熔点越高,所以熔点:MgO>CaCl2;冰、干冰均属于分子晶体,分子间以分子间作用力相结合,由于水分子中含有氢键,二氧化碳中只含分子间作用力,所以熔点:冰>干冰,综上所述,以上五种物质的熔点高低:金刚石>MgO>CaCl2>冰>干冰。(3) NaCl、MgO晶体中,离子半径:镁离子<钠离子,氧离子<氯离子;且NaCl晶体中所带电荷数小于MgO晶体中所带电荷数,所以NaCl晶体的硬度小于MgO晶体。(4) 每个Cu晶胞中所含由的Cu原子个数为8×+6×=4;CaCl2晶体中,每个钙离子周围距离最近且相等的氯离子构成正方体形结构,所以每个钙离子周围距离最近且相等的氯离子有8个。
