专题3第一单元 金属键 金属晶体 课后练 (含解析)
文档属性
| 名称 | 专题3第一单元 金属键 金属晶体 课后练 (含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 282.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-09 19:36:12 | ||
图片预览



文档简介
专题3 微粒间作用力与物质性质
第一单元 金属键 金属晶体
1. 下列有关金属元素特性的叙述中,正确的是( )
A. 金属元素的原子具有还原性,离子只具有氧化性
B. 金属元素在化合物中一般显正价
C. 金属元素在不同化合物中的化合价均不同
D. 金属元素的单质在常温下均为金属晶体
2. (2020·徐州一中月考)已知某晶体由X、Y、Z三种元素组成,其晶胞如图所示,则X、Y、Z三种元素的原子个数之比正确的是( )
A. 1∶3∶1
B. 2∶6∶1
C. 4∶8∶1
D. 8∶1∶1
3. (2020·昭通第四中学期末)下列叙述正确的是( )
A. 金属受外力作用时常常发生形变而不易折断是由于金属原子之间有较强的作用
B. 通常情况下,金属里的自由电子会发生定向移动而形成电流
C. 金属借助自由电子的运动,把能量从温度高的部分传到温度低的部分
D. 金属的导电性随温度的升高而减弱
4. (2022·四川岳池期中)“神舟十三号”载人飞船于2021年10月16日凌晨发射升空,飞船上使用了锂镁合金和锂铝合金等合金材料,下列有关叙述不正确的是( )
A. 飞船使用的合金材料,一般具有质量轻、强度高的特点
B. 钠的金属性强于锂铝合金中铝、锂
C. 锂镁合金和锂铝合金性质相当稳定,不会与酸发生化学反应
D. 锂镁合金是一种具有金属特性的物质,易导热、导电
5. (2021·南菁高级中学高二阶段性检测)铁有δ、γ、α三种晶体结构,以下依次是δ、γ、α三种晶体在不同温度下转化的图示。
已知:δFeγFeαFe,下列有关说法正确的是( )
A. δ、γ、α三种晶体互为同分异构体
B. γ-Fe晶体体心立方体紧密堆积
C. α-Fe晶体中,与每个Fe原子距离相等且最近的Fe原子有6个
D. δ-Fe晶体中,与每个Fe原子距离相等且最近的Fe原子有6个
6. 下列有关金属晶体的说法错误的是( )
A. 金属晶体是一种“巨型分子”
B. “电子气”为所有原子所共有
C. 简单立方堆积的空间利用率最低
D. 体心立方堆积的空间利用率最高
7. (2021·东台创新中学质检)已知X、Y、Z三种元素组成的化合物,其晶胞如图所示,则下面表示该化合物的化学式正确的( )
A. ZXY3
B. ZX2Y6
C. ZX4Y8
D. ZX8Y12
8. 下列关于金属性质和原因的描述不正确的是( )
A. 金属一般具有银白色光泽,是物理性质,与金属键没有关系
B. 金属具有良好的导电性,是因为在外电场的作用下自由电子在金属内部定向移动便形成了电流
C. 金属具有良好的导热性能,是因为自由电子通过与金属离子发生碰撞,传递了能量
D. 金属晶体具有良好的延展性,是因为金属受到外力作用时,金属原子层可以滑动而不破坏金属键
9. (2022·海门中学高三入学考试)某小组设计下列实验验证Ag+ 和Fe2+的反应为可逆反应。
实验1:将0.010 0 mol·L-1 Ag2SO4溶液与0.040 0 mol·L-1 FeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验2:取实验1中沉淀,加入浓硝酸,灰黑色固体溶解,产生红棕色气体。
实验3:向少量Ag粉中加入0.010 0 mol·L-1 Fe2(SO4)3溶液(pH=1),固体完全溶解。
下列说法正确的是( )
A. 实验1中发生反应的离子方程式为Ag2SO4+2Fe2+===2Fe3++2Ag↓+SO
B. 实验2可证明实验1中灰黑色沉淀为Ag,产生气体为NO
C. 实验3中Fe2(SO4)3溶液不可以用Fe(NO3)3溶液代替
D. 银的晶胞结构如图,Ag的配位数为8
10. (2022·开鲁第一中学期中)下列能够表示出每个晶胞中所含实际微粒个数的面心立方晶胞的是( )
11. (2020·扬中高级中学月考)金属钾、铜的部分结构和性质的数据如表所示,则下列说法错误的是( )
金属 K Cu
原子外围电子排布 4s1 3d104s1
原子半径/pm 255 128
原子化热/(kJ·mol-1) 90.0 339.3
熔点/℃ 63.4 1 083
A. 单位体积内自由电子数目:KB. 金属键强弱顺序为KC. 金属的硬度大小顺序为KD. 两者最外层电子数目相等,因此其金属键的强弱取决于原子半径大小
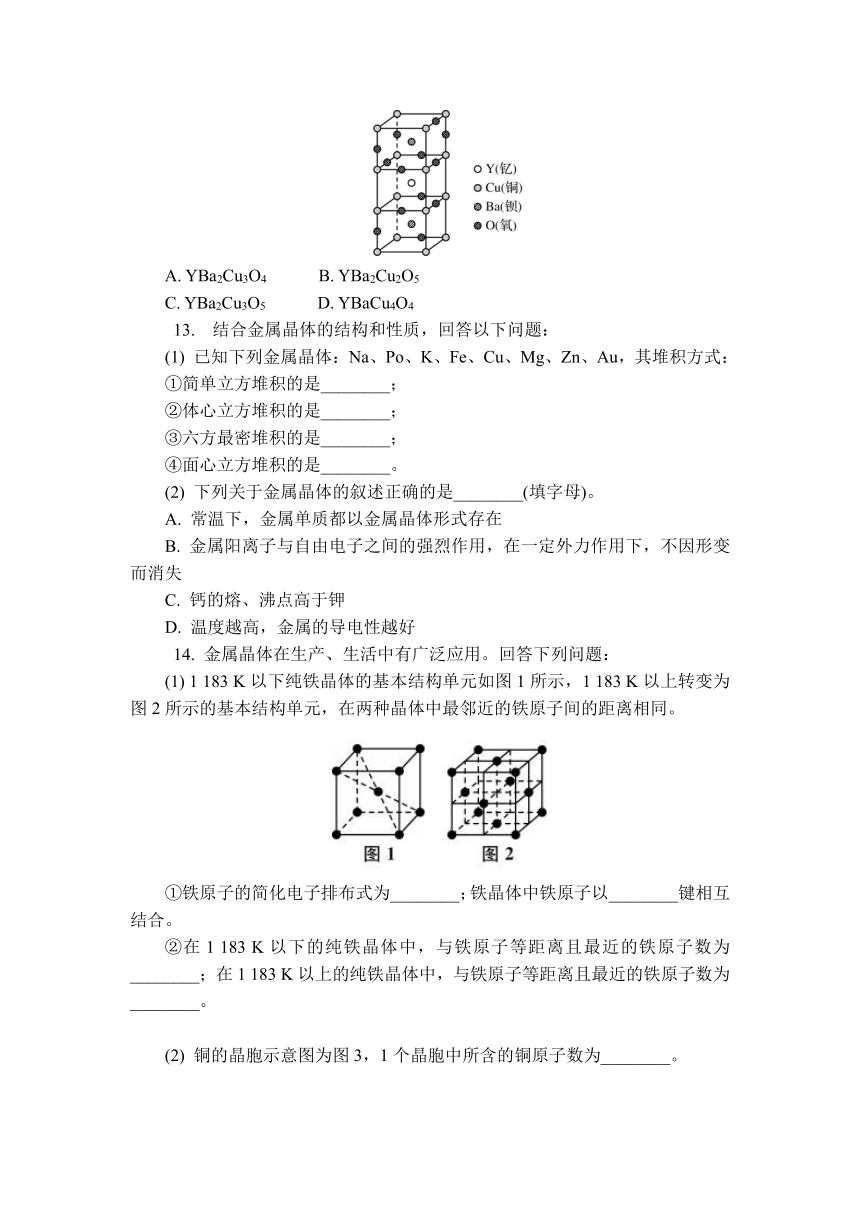
12. (2022·建平实验中学月考)钇钡铜氧化合物晶胞的结构如图所示,则该化合物的化学式可能是( )
A. YBa2Cu3O4 B. YBa2Cu2O5
C. YBa2Cu3O5 D. YBaCu4O4
13. 结合金属晶体的结构和性质,回答以下问题:
(1) 已知下列金属晶体:Na、Po、K、Fe、Cu、Mg、Zn、Au,其堆积方式:
①简单立方堆积的是________;
②体心立方堆积的是________;
③六方最密堆积的是________;
④面心立方堆积的是________。
(2) 下列关于金属晶体的叙述正确的是________(填字母)。
A. 常温下,金属单质都以金属晶体形式存在
B. 金属阳离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
C. 钙的熔、沸点高于钾
D. 温度越高,金属的导电性越好
14. 金属晶体在生产、生活中有广泛应用。回答下列问题:
(1) 1 183 K以下纯铁晶体的基本结构单元如图1所示,1 183 K以上转变为图2所示的基本结构单元,在两种晶体中最邻近的铁原子间的距离相同。
①铁原子的简化电子排布式为________;铁晶体中铁原子以________键相互结合。
②在1 183 K以下的纯铁晶体中,与铁原子等距离且最近的铁原子数为________;在1 183 K以上的纯铁晶体中,与铁原子等距离且最近的铁原子数为________。
(2) 铜的晶胞示意图为图3,1个晶胞中所含的铜原子数为________。
15. 铜及其化合物在生产、生活中应用广泛。回答下列问题:
(1) Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有____个铜原子。
(2) 利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为________,该功能陶瓷的化学式为________。
16. (1) 元素铜的一种氯化物晶体的晶胞结构如下图所示,该氯化物的化学式是________。
(2) 某晶体结构模型如下图所示。该晶体的化学式是______________,在晶体中1个Ti原子、1个Co原子周围距离最近的O原子数目分别为________个、________个。
(3) 有一种钛原子和碳原子构成的气态团簇分子,如下图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为________(填字母)。
A. Ti14C13
B. TiC
C. Ti14C4
D. Ti4C3
专题3 微粒间作用力与物质性质
第一单元 金属键 金属晶体
1. B 解析:变价金属的中间价态离子既有还原性又有氧化性,A错误;金属元素在化合物中一般显正价,B正确;同种金属元素在不同化合物中的化合价可以相同,也可以不同,C错误;汞在常温下为液体,此时不属于晶体,D错误。
2. A 解析:根据均摊法可知,晶胞中含有Z原子的数目为1,含有X原子的数目为8×=1,含有Y原子的数目为12×=3,所以X、Y、Z的原子个数比是1∶3∶1。
3. D 解析:金属受外力作用时常常发生形变而不易折断是因为金属晶体中各原子层会发生相对滑动,但不会改变原来的排列方式,A错误;金属里的自由电子要在外加电场作用下才能发生定向移动产生电流,B错误;金属的导热性是由于自由电子碰撞金属原子将能量进行传递,C错误;当温度升高时,阳离子的振动加剧,对自由电子的定向移动产生了阻碍作用,故导电能力下降,D正确。
4. C 解析:锂、镁按一定比例熔合而得到锂镁合金,具有活泼金属的性质,能与酸反应,C错误。
5. C 解析:同分异构体是分子式相同而结构式不同的化合物的互称,而铁的三种不同晶体结构中都只含有一种铁元素,均为单质,A错误;结合γFe晶体的晶胞结构可知其为面心立方体紧密堆积,B错误;αFe晶体的堆积为简单立方堆积,与每个Fe原子距离相等且最近的Fe原子有6个,C正确;δFe晶体中,以体心的Fe原子为标准,则位于顶点的8个Fe原子到体心的Fe原子的距离相等且最近,D错误。
6. D 解析:金属晶体的堆积方式中空间利用率分别是:简单立方52%,体心立方68%,面心立方为74%,因此简单立方的空间利用率最低,面心立方空间利用率最高,D错误。
7. A 解析:根据晶体结构的计算方法可知,一个晶胞中含1个Z原子,X原子数为8×=1,Y原子数为12×=3。所以化学式为ZXY3 ,故选A。
8. A 解析:金属一般具有银白色光泽是由于金属键中的自由电子在吸收可见光以后,发生跃迁,成为高能态,然后又会回到低能态,把多余的能量以可见光的形式释放出来的缘故,所以金属一般具有银白色光泽与金属键有关系,A错误。
9. C 解析:实验1中为0.010 0 mol·L-1 Ag2SO4溶液与0.040 0 mol·L-1 FeSO4溶液(pH=1)产生灰黑色沉淀,溶液呈黄色,则发生反应生成银单质和铁离子,离子方程式为Ag++Fe2+===Fe3++Ag↓,A错误;一氧化氮气体为无色气体,二氧化氮气体为红棕色,B错误;Fe(NO3)3溶液中硝酸根离子具有强氧化性,会干扰实验,故实验3中Fe2(SO4)3溶液不可以用Fe(NO3)3溶液代替,C正确; 由图可知,晶胞为面心立方,Ag的配位数为12,D错误。
10. B 解析:A和B是面心立方晶胞,其中B是经过切割后的面心立方晶胞,它能表示出此晶胞中所含微粒的实际数目,C和D是体心立方晶胞。
11. D 解析:决定金属键强弱的因素是单位体积内自由电子数目和原子半径的大小,金属键越强,金属的熔、沸点越高,硬度越大;金属单位体积内自由电子的数目则取决于金属的外围电子数目,D错误。
12. C 解析:位于顶点的铜原子(最上层平面和最下层平面)共8个,这个晶胞只分摊到8×=1个;位于棱上(中间两个平面)的也是8个,这个晶胞分摊到的是8×=2个,所以,每个晶胞单独含有的铜原子数为3个。氧原子共13个,位于晶胞面上(不含棱)的是7个,位于晶胞棱上的是6个,所以,每个晶胞单独含有的氧原子数为7×+6×=5个。2个钡原子和1个钇原子都在晶胞内,所以该晶体每个晶胞平均分摊到(即单独含有)的钇原子、钡原子、铜原子和氧原子个数分别为1、2、3、5,化学式为YBa2Cu3O5,故选C。
13. (1) ①Po ②Na、K、Fe ③Mg、Zn ④Cu、Au
(2) BC
解析:(1) 简单立方堆积的空间利用率太低,只有金属Po采取这种方式。体心立方堆积是上层金属原子填入下层的金属原子形成的凹穴中,这种堆积方式的空间利用率比简单立方堆积的高,多数金属是这种堆积方式。六方最密堆积常见金属为Mg、Zn、Ti,面心立方最密堆积常见金属为Cu、Ag、Au。(2) 常温下,Hg为液态,A错误;因为金属键无方向性,金属键在一定范围内不因形变而消失,B正确;钙的金属键强于钾,熔、沸点高于钾,C正确;温度升高,金属的导电性减弱,D错误。
14. (1) ①[Ar]3d64s2 金属 ②8 12 (2) 4
15. (1) 16 (2) 2 BN
解析:(1) 晶胞中氧原子个数=×8+×6+4=8,则该晶胞中铜原子数目是氧原子的2倍,即16个。(2) 每个氮化硼晶胞中含有白球的个数为8×+1=2,灰球的个数为1+4×=2,所以每个晶胞中含有N原子和B原子各2个;N的电负性大于B,所以该功能陶瓷的化学式为BN。
16. (1) CuCl (2) CoTiO3 6 12 (3) A
解析:(1) 晶胞中灰球代表的微粒有4个,白球代表的微粒有6×+8×=4个,所以化学式为CuCl。(2) 晶胞中含有O:6×=3个,含Co:8×=1个,含Ti:1个,故化学式为CoTiO3。Ti原子位于晶胞的中心,其周围距离最近的O原子位于6个面的中心,所以周围距离最近的O原子数目为6个;Co原子位于晶胞的顶点,O原子位于晶胞的面心,所以Co原子周围距离最近的O原子数目为12个。(3) 由题意知该物质是气态团簇分子,故题目中图示应是该物质的一个完整的分子,由14个Ti原子和13个C原子构成,故选A。
第一单元 金属键 金属晶体
1. 下列有关金属元素特性的叙述中,正确的是( )
A. 金属元素的原子具有还原性,离子只具有氧化性
B. 金属元素在化合物中一般显正价
C. 金属元素在不同化合物中的化合价均不同
D. 金属元素的单质在常温下均为金属晶体
2. (2020·徐州一中月考)已知某晶体由X、Y、Z三种元素组成,其晶胞如图所示,则X、Y、Z三种元素的原子个数之比正确的是( )
A. 1∶3∶1
B. 2∶6∶1
C. 4∶8∶1
D. 8∶1∶1
3. (2020·昭通第四中学期末)下列叙述正确的是( )
A. 金属受外力作用时常常发生形变而不易折断是由于金属原子之间有较强的作用
B. 通常情况下,金属里的自由电子会发生定向移动而形成电流
C. 金属借助自由电子的运动,把能量从温度高的部分传到温度低的部分
D. 金属的导电性随温度的升高而减弱
4. (2022·四川岳池期中)“神舟十三号”载人飞船于2021年10月16日凌晨发射升空,飞船上使用了锂镁合金和锂铝合金等合金材料,下列有关叙述不正确的是( )
A. 飞船使用的合金材料,一般具有质量轻、强度高的特点
B. 钠的金属性强于锂铝合金中铝、锂
C. 锂镁合金和锂铝合金性质相当稳定,不会与酸发生化学反应
D. 锂镁合金是一种具有金属特性的物质,易导热、导电
5. (2021·南菁高级中学高二阶段性检测)铁有δ、γ、α三种晶体结构,以下依次是δ、γ、α三种晶体在不同温度下转化的图示。
已知:δFeγFeαFe,下列有关说法正确的是( )
A. δ、γ、α三种晶体互为同分异构体
B. γ-Fe晶体体心立方体紧密堆积
C. α-Fe晶体中,与每个Fe原子距离相等且最近的Fe原子有6个
D. δ-Fe晶体中,与每个Fe原子距离相等且最近的Fe原子有6个
6. 下列有关金属晶体的说法错误的是( )
A. 金属晶体是一种“巨型分子”
B. “电子气”为所有原子所共有
C. 简单立方堆积的空间利用率最低
D. 体心立方堆积的空间利用率最高
7. (2021·东台创新中学质检)已知X、Y、Z三种元素组成的化合物,其晶胞如图所示,则下面表示该化合物的化学式正确的( )
A. ZXY3
B. ZX2Y6
C. ZX4Y8
D. ZX8Y12
8. 下列关于金属性质和原因的描述不正确的是( )
A. 金属一般具有银白色光泽,是物理性质,与金属键没有关系
B. 金属具有良好的导电性,是因为在外电场的作用下自由电子在金属内部定向移动便形成了电流
C. 金属具有良好的导热性能,是因为自由电子通过与金属离子发生碰撞,传递了能量
D. 金属晶体具有良好的延展性,是因为金属受到外力作用时,金属原子层可以滑动而不破坏金属键
9. (2022·海门中学高三入学考试)某小组设计下列实验验证Ag+ 和Fe2+的反应为可逆反应。
实验1:将0.010 0 mol·L-1 Ag2SO4溶液与0.040 0 mol·L-1 FeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验2:取实验1中沉淀,加入浓硝酸,灰黑色固体溶解,产生红棕色气体。
实验3:向少量Ag粉中加入0.010 0 mol·L-1 Fe2(SO4)3溶液(pH=1),固体完全溶解。
下列说法正确的是( )
A. 实验1中发生反应的离子方程式为Ag2SO4+2Fe2+===2Fe3++2Ag↓+SO
B. 实验2可证明实验1中灰黑色沉淀为Ag,产生气体为NO
C. 实验3中Fe2(SO4)3溶液不可以用Fe(NO3)3溶液代替
D. 银的晶胞结构如图,Ag的配位数为8
10. (2022·开鲁第一中学期中)下列能够表示出每个晶胞中所含实际微粒个数的面心立方晶胞的是( )
11. (2020·扬中高级中学月考)金属钾、铜的部分结构和性质的数据如表所示,则下列说法错误的是( )
金属 K Cu
原子外围电子排布 4s1 3d104s1
原子半径/pm 255 128
原子化热/(kJ·mol-1) 90.0 339.3
熔点/℃ 63.4 1 083
A. 单位体积内自由电子数目:K
12. (2022·建平实验中学月考)钇钡铜氧化合物晶胞的结构如图所示,则该化合物的化学式可能是( )
A. YBa2Cu3O4 B. YBa2Cu2O5
C. YBa2Cu3O5 D. YBaCu4O4
13. 结合金属晶体的结构和性质,回答以下问题:
(1) 已知下列金属晶体:Na、Po、K、Fe、Cu、Mg、Zn、Au,其堆积方式:
①简单立方堆积的是________;
②体心立方堆积的是________;
③六方最密堆积的是________;
④面心立方堆积的是________。
(2) 下列关于金属晶体的叙述正确的是________(填字母)。
A. 常温下,金属单质都以金属晶体形式存在
B. 金属阳离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
C. 钙的熔、沸点高于钾
D. 温度越高,金属的导电性越好
14. 金属晶体在生产、生活中有广泛应用。回答下列问题:
(1) 1 183 K以下纯铁晶体的基本结构单元如图1所示,1 183 K以上转变为图2所示的基本结构单元,在两种晶体中最邻近的铁原子间的距离相同。
①铁原子的简化电子排布式为________;铁晶体中铁原子以________键相互结合。
②在1 183 K以下的纯铁晶体中,与铁原子等距离且最近的铁原子数为________;在1 183 K以上的纯铁晶体中,与铁原子等距离且最近的铁原子数为________。
(2) 铜的晶胞示意图为图3,1个晶胞中所含的铜原子数为________。
15. 铜及其化合物在生产、生活中应用广泛。回答下列问题:
(1) Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有____个铜原子。
(2) 利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为________,该功能陶瓷的化学式为________。
16. (1) 元素铜的一种氯化物晶体的晶胞结构如下图所示,该氯化物的化学式是________。
(2) 某晶体结构模型如下图所示。该晶体的化学式是______________,在晶体中1个Ti原子、1个Co原子周围距离最近的O原子数目分别为________个、________个。
(3) 有一种钛原子和碳原子构成的气态团簇分子,如下图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为________(填字母)。
A. Ti14C13
B. TiC
C. Ti14C4
D. Ti4C3
专题3 微粒间作用力与物质性质
第一单元 金属键 金属晶体
1. B 解析:变价金属的中间价态离子既有还原性又有氧化性,A错误;金属元素在化合物中一般显正价,B正确;同种金属元素在不同化合物中的化合价可以相同,也可以不同,C错误;汞在常温下为液体,此时不属于晶体,D错误。
2. A 解析:根据均摊法可知,晶胞中含有Z原子的数目为1,含有X原子的数目为8×=1,含有Y原子的数目为12×=3,所以X、Y、Z的原子个数比是1∶3∶1。
3. D 解析:金属受外力作用时常常发生形变而不易折断是因为金属晶体中各原子层会发生相对滑动,但不会改变原来的排列方式,A错误;金属里的自由电子要在外加电场作用下才能发生定向移动产生电流,B错误;金属的导热性是由于自由电子碰撞金属原子将能量进行传递,C错误;当温度升高时,阳离子的振动加剧,对自由电子的定向移动产生了阻碍作用,故导电能力下降,D正确。
4. C 解析:锂、镁按一定比例熔合而得到锂镁合金,具有活泼金属的性质,能与酸反应,C错误。
5. C 解析:同分异构体是分子式相同而结构式不同的化合物的互称,而铁的三种不同晶体结构中都只含有一种铁元素,均为单质,A错误;结合γFe晶体的晶胞结构可知其为面心立方体紧密堆积,B错误;αFe晶体的堆积为简单立方堆积,与每个Fe原子距离相等且最近的Fe原子有6个,C正确;δFe晶体中,以体心的Fe原子为标准,则位于顶点的8个Fe原子到体心的Fe原子的距离相等且最近,D错误。
6. D 解析:金属晶体的堆积方式中空间利用率分别是:简单立方52%,体心立方68%,面心立方为74%,因此简单立方的空间利用率最低,面心立方空间利用率最高,D错误。
7. A 解析:根据晶体结构的计算方法可知,一个晶胞中含1个Z原子,X原子数为8×=1,Y原子数为12×=3。所以化学式为ZXY3 ,故选A。
8. A 解析:金属一般具有银白色光泽是由于金属键中的自由电子在吸收可见光以后,发生跃迁,成为高能态,然后又会回到低能态,把多余的能量以可见光的形式释放出来的缘故,所以金属一般具有银白色光泽与金属键有关系,A错误。
9. C 解析:实验1中为0.010 0 mol·L-1 Ag2SO4溶液与0.040 0 mol·L-1 FeSO4溶液(pH=1)产生灰黑色沉淀,溶液呈黄色,则发生反应生成银单质和铁离子,离子方程式为Ag++Fe2+===Fe3++Ag↓,A错误;一氧化氮气体为无色气体,二氧化氮气体为红棕色,B错误;Fe(NO3)3溶液中硝酸根离子具有强氧化性,会干扰实验,故实验3中Fe2(SO4)3溶液不可以用Fe(NO3)3溶液代替,C正确; 由图可知,晶胞为面心立方,Ag的配位数为12,D错误。
10. B 解析:A和B是面心立方晶胞,其中B是经过切割后的面心立方晶胞,它能表示出此晶胞中所含微粒的实际数目,C和D是体心立方晶胞。
11. D 解析:决定金属键强弱的因素是单位体积内自由电子数目和原子半径的大小,金属键越强,金属的熔、沸点越高,硬度越大;金属单位体积内自由电子的数目则取决于金属的外围电子数目,D错误。
12. C 解析:位于顶点的铜原子(最上层平面和最下层平面)共8个,这个晶胞只分摊到8×=1个;位于棱上(中间两个平面)的也是8个,这个晶胞分摊到的是8×=2个,所以,每个晶胞单独含有的铜原子数为3个。氧原子共13个,位于晶胞面上(不含棱)的是7个,位于晶胞棱上的是6个,所以,每个晶胞单独含有的氧原子数为7×+6×=5个。2个钡原子和1个钇原子都在晶胞内,所以该晶体每个晶胞平均分摊到(即单独含有)的钇原子、钡原子、铜原子和氧原子个数分别为1、2、3、5,化学式为YBa2Cu3O5,故选C。
13. (1) ①Po ②Na、K、Fe ③Mg、Zn ④Cu、Au
(2) BC
解析:(1) 简单立方堆积的空间利用率太低,只有金属Po采取这种方式。体心立方堆积是上层金属原子填入下层的金属原子形成的凹穴中,这种堆积方式的空间利用率比简单立方堆积的高,多数金属是这种堆积方式。六方最密堆积常见金属为Mg、Zn、Ti,面心立方最密堆积常见金属为Cu、Ag、Au。(2) 常温下,Hg为液态,A错误;因为金属键无方向性,金属键在一定范围内不因形变而消失,B正确;钙的金属键强于钾,熔、沸点高于钾,C正确;温度升高,金属的导电性减弱,D错误。
14. (1) ①[Ar]3d64s2 金属 ②8 12 (2) 4
15. (1) 16 (2) 2 BN
解析:(1) 晶胞中氧原子个数=×8+×6+4=8,则该晶胞中铜原子数目是氧原子的2倍,即16个。(2) 每个氮化硼晶胞中含有白球的个数为8×+1=2,灰球的个数为1+4×=2,所以每个晶胞中含有N原子和B原子各2个;N的电负性大于B,所以该功能陶瓷的化学式为BN。
16. (1) CuCl (2) CoTiO3 6 12 (3) A
解析:(1) 晶胞中灰球代表的微粒有4个,白球代表的微粒有6×+8×=4个,所以化学式为CuCl。(2) 晶胞中含有O:6×=3个,含Co:8×=1个,含Ti:1个,故化学式为CoTiO3。Ti原子位于晶胞的中心,其周围距离最近的O原子位于6个面的中心,所以周围距离最近的O原子数目为6个;Co原子位于晶胞的顶点,O原子位于晶胞的面心,所以Co原子周围距离最近的O原子数目为12个。(3) 由题意知该物质是气态团簇分子,故题目中图示应是该物质的一个完整的分子,由14个Ti原子和13个C原子构成,故选A。
