专题4 分子空间结构与物质性质 综合评价 (含解析)
文档属性
| 名称 | 专题4 分子空间结构与物质性质 综合评价 (含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 210.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-09 19:45:03 | ||
图片预览


文档简介
专题4 分子空间结构与物质性质 综合评价
一、 单项选择题(本题共14小题,每小题3分,共42分)
1. (2021·日照期中)下列说法正确的是( )
A. 离子化合物中只有离子键
B. 非极性分子中肯定没有极性键
C. 1个氮气分子中有1个σ键和2个π键
D. 水分子间可以形成氢键,所以水比硫化氢更稳定
2. (2020·徐州一中期末调研)下列化合物中,含有3个手性碳原子的是( )
A. B. C. D.
3. 下列各组微粒中,都互为等电子体的是( )
A. CO、NO、NaH、N2 B. SO2、NO、N、CNO-
C. CO、NO、BeCl2 D. SiF4、SiO、SO、PO
4. (2020·吕叔湘中学诊断考试) 氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2),反应为2CHCl3+O2―→2HCl+2COCl2,光气的结构式为CClOCl。下列说法正确的是( )
A. 使用前不能用硝酸银稀溶液检验氯仿是否变质
B. CHCl3分子为含极性键的非极性分子
C. COCl2分子中所有原子的最外层电子都满足8电子结构
D. COCl2分子中含有3个σ键、1个π键,中心碳原子采用sp杂化
5. (2022·江苏高三百校第四次大联考 )用氨水吸收硫酸工厂尾气中的SO2发生反应:2NH3·H2O+SO2===(NH4)2SO3+H2O。下列说法正确的是( )
A. NH3的电子式为HN··,HH B. SO2是非极性分子
C. NH的结构式为(NHHHH)+ D. H2O的空间结构为直线形
6. (2021·葫芦岛期末)下列说法正确的是( )
A. NH3分子为三角锥形,N采取sp2杂化
B. 杂化轨道只适用于形成共价键
C. SCl2属于AB2型共价化合物,中心原子S采取sp杂化轨道成键
D. 价层电子对互斥模型中,π键电子对数也要计入中心原子的价层电子对数
7. (2022·南通高三调研)反应(NH4)2SiF6+4NH3·H2O===SiO2↓+6NH4F+2H2O可制纳米SiO2。下列说法正确的是( )
A. NH3是非极性分子
B. NH4F既含离子键又含共价键
C. H2O的电子式为H+[]2-H+
D. 基态Si原子的电子排布式为[Ne]3s13p3
8. (2022·如皋高三适应性考试) 配合物[Cu(NH3)4]Cl2可用于蚀刻铜,蚀刻后的产物[Cu(NH3)4]Cl2可在氧气中再生,再生反应为4[Cu(NH3)4]Cl+4NH4Cl+O2===4[Cu(NH3)4]Cl2+2H2O+4NH3。下列说法正确的是 ( )
A. 基态Cu的电子排布式为[Ar]3d94s2
B. NH4Cl属于共价化合物
C. NH3的晶体类型为共价晶体
D. [Cu(NH3)4]2+中与Cu2+形成配位键的原子是N
9. (2020·广饶一中月考)下列分子中,中心原子的杂化轨道类型和分子空间结构不正确的是 ( )
A. CCl4中C原子为sp3杂化;正四面体形 B. H2S分子中S原子为sp2杂化;直线形
C. CS2中C原子为sp杂化;直线形 D. BF3中B原子为sp2杂化;平面三角形
10. (2021·苏大附中检测)镍能形成多种不同的化合物。图1是镍的一种配合物的结构,图2是一种镍的氧合物的晶胞(图中白球为氧)。判断下列说法正确的是( )
A. 图1分子中存在的化学键有共价键、配位键、氢键
B. 图1中C、N、O的第一电离能C>N>O
C. 图2中离镍原子最近的镍原子数共为8个
D. 图2可能表示的是氧化镍(NiO)的晶胞
11. (2021·天津武清高三一模)短周期元素X、Y、Z原子序数依次增大,X元素基态原子有2个未成对电子,Y元素基态原子的核外p电子数比s电子数少1个,Z的一种“超原子”(Z)具有40个价电子,下列说法错误的是( )
A. 简单离子半径:YC. YO中心原子的杂化方式为sp2杂化 D. X、Y、Z的电负性:Y>X>Z
12. (2022·南通海门区高三阶段检测 )下列有关含硫微粒说法正确的是( )
A. SO3 的空间结构为三角锥形
B. 硫酸铵中存在离子键、共价键、配位键
C. H2S 分子间能形成氢键
D. SO2中O—S—O键角大于SO3中的O—S—O键角
13. (2021·沧州高三期中)向盛有硝酸银溶液的试管中加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到无色透明溶液,下列说法正确的是( )
A. 反应前后Ag+的浓度不变
B. 沉淀溶解后,生成的[Ag(NH3)2]OH难电离
C. 上述现象说明[Ag(NH3)2]+不如AgOH稳定
D. 配合离子[Ag(NH3)2]+中,Ag+提供空轨道,NH3给出孤电子对
14. (2022·盐城中学、南通中学高三联考) 铜是生命必需的元素,也是人类最早使用的金属之一,铜及其重要化合物在生产中有着重要的应用。辉铜矿(主要成分Cu2S)可以用于制铜,反应方程式为Cu2S+O22Cu+SO2,制得的粗铜通过电解法进行精炼。关于用辉铜矿制备粗铜反应的相关说法正确的是( )
A. Cu+转化为基态Cu,得到的电子填充在3d轨道上
B. O2和SO2都是非极性分子
C. Cu2S晶胞中S2-位置如图所示,则一个晶胞中含有8个Cu+
D. 标准状况下,每有22.4 L O2参与反应,转移电子4 mol
二、 非选择题(本题共4题,共58分)
15. (14分)(2021·泰州中学质检)作为新型高能含能材料,AgN5在炸药、推进剂和发射药等领域具有较高的应用价值。
(1) N为平面结构,结构为,其中N原子的杂化方式是________________________。
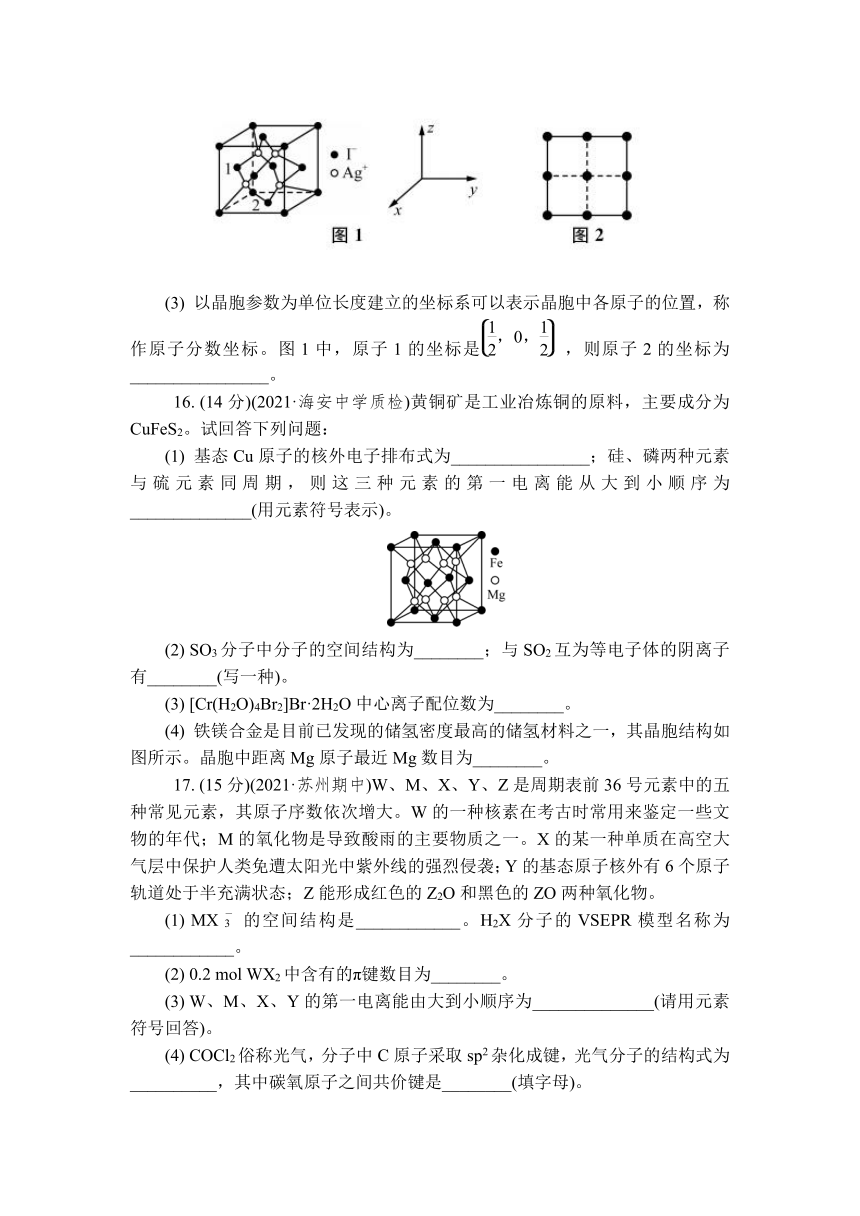
(2) AgN5的晶体结构与AgI相似。AgI的结构分为αAgI和γAgI,γAgI立方晶胞的示意图见图1、图2是晶胞正上方的俯视投影图,图中黑球(实心球)表示I-,请在图2中用白球(空心球)表示出Ag+的位置。
(3) 以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图1中,原子1的坐标是,则原子2的坐标为________________。
16. (14分)(2021·海安中学质检)黄铜矿是工业冶炼铜的原料,主要成分为CuFeS2。试回答下列问题:
(1) 基态Cu原子的核外电子排布式为________________;硅、磷两种元素与硫元素同周期,则这三种元素的第一电离能从大到小顺序为______________(用元素符号表示)。
(2) SO3分子中分子的空间结构为________;与SO2互为等电子体的阴离子有________(写一种)。
(3) [Cr(H2O)4Br2]Br·2H2O中心离子配位数为________。
(4) 铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。晶胞中距离Mg原子最近Mg数目为________。
17. (15分)(2021·苏州期中)W、M、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1) MX的空间结构是____________。H2X分子的VSEPR模型名称为____________。
(2) 0.2 mol WX2中含有的π键数目为________。
(3) W、M、X、Y的第一电离能由大到小顺序为______________(请用元素符号回答)。
(4) COCl2俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为__________,其中碳氧原子之间共价键是________(填字母)。
a. 2个σ键 b. 2个π键 c. 1个σ键,1个π键
(5) Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是______________________________________________________________________。
18. (15分)(2021·云南曲靖中学月考)Ⅰ. 艾姆斯实验室已制造出包含钙、钾、铁和砷以及少量镍的CaK(Fe1-xNix)4As4新型化合物材料。回答下列问题:
(1) 基态镍原子的外围电子排布式为____________________。
(2) 在稀氨水介质中,Ni2+与丁二酮肟(分子式为C4H8N2O2)反应可生成鲜红色沉淀,其分子结构如图所示,该结构中碳原子的杂化方式为________;其中碳、氮、氧三种元素第一电离能由大到小的顺序为________________(用元素符号表示)。
(3) NCl3的立体构型为________,其中心原子的杂化轨道类型为________。
Ⅱ. 叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H—N===N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2===2H2O+HN3。HN3的酸性和醋酸相近,可微弱电离出H+和N。试回答下列问题:
(4) 下列有关说法正确的是________(填字母)。
A. 1个HN3分子中含有5个σ键
B. HN3中的三个氮原子均采用sp2杂化
C. HN3、HNO2、H2O、N2H4都是极性分子
D. 肼(N2H4)的沸点高达113.5 ℃,说明肼分子间可形成氢键
(5) 叠氮酸根能与许多金属离子形成配合物,如[Co(N3)(NH3)5]SO4,根据价层电子对互斥模型判断SO的空间结构为____________。
专题4 综合评价
1. C 解析:离子化合物中一定含有离子键,也可能含有共价键,A错误;甲烷分子中含有C—H极性键,属于非极性分子,B错误;1个氮气分子中有1个氮氮三键,其中有1个σ键和2个π键,C正确;氢键影响物质的物理性质,而稳定性是化学性质,由共价键强弱决定,与氢键无关,D错误。
2. A 解析:含有3个手性碳原子,A符合题意;含有1个手性碳原子,B不符合题意;含有2个手性碳原子,C不符合题意;含有1个手性碳原子,D不符合题意。
3. D 解析:CO的价电子数为4+6=10,NO的价电子数为5+6=11, NaH是离子化合物,不存在分子,N2的价电子数为5+5=10,A不符合题意;SO2的价电子数为6+6×2=18,NO的价电子数为5+6×2-1=16,N的价电子数为5×3+1=16,CNO-的价电子数为4+5+6+1=16,B不符合题意;CO的价电子数为4+6×3+2=24,NO的价电子数为5+6×3+1=24,BeCl2的价电子数为2+7×2=16,C不符合题意;SiF4的价电子数为4+7×4=32,SiO的价电子数为4+6×4+4=32,SO的价电子数为6+6×4+2=32,PO的价电子数为5+6×4+3=32,D符合题意。
4. C 解析:若变质混有HCl,HCl与硝酸银反应,氯仿与硝酸银不反应,则使用前可用硝酸银稀溶液检验氯仿是否变质,A错误;由结构可知,含3个C—Cl、1个C—H,结构不对称,则为含极性键的极性分子,B错误;Cl最外层有7个电子,O最外层有6个电子,C最外层有4个电子,由结构可知,含2个C—Cl、1个C===O,所有原子都满足最外层8电子稳定结构,C正确;单键为σ键,双键中含1个σ键、1个π键,共有3个σ键、一个π键,中心C原子上无孤电子对,C形成3个σ键,则C原子采用sp2杂化,D错误。
5. C 解析:氮原子要达到8电子稳定结构,NH3的电子式为HN··,H ,A错误;SO2的中心原子价层电子对数是2+(6-2×2)=2+1,空间结构是V形,正负电荷重心不重合,是极性分子,B错误;由NH的电子式[HN,H]+ 可得其结构式为 ,C正确;H2O的中心原子价层电子对是2+(6-2×1)=2+2,空间结构为V形,D错误。
6. B 解析:NH3分子为三角锥形,N采取sp3杂化,A错误;杂化轨道只适用于形成共价键,原子间需形成共用电子对,B正确;SCl2属于AB2型共价化合物,中心原子S采取sp3杂化,分子空间结构为V形,C错误;价层电子对互斥模型中,σ键数和孤电子对数计入中心原子的价层电子对数,而π键不计入,D错误。
7. B 解析:NH3的空间结构是三角锥形,是极性分子,A错误;NH4F由铵根和氟离子构成,则既含离子键又含共价键,B正确;H2O为共价化合物,则其电子式为HH,C错误;Si为14号元素,原子核外有14个电子,则Si原子的电子排布式为[Ne]3s23p2,D错误。
8. D 解析:根据洪特规则,基态Cu的电子排布式为[Ar]3d104s1,A错误;NH4Cl含有离子键,属于离子化合物,B错误;构成NH3晶体的微粒为氨分子,微粒间为分子间作用力,晶体类型为分子晶体,C错误;氨分子中N原子含有孤电子对,[Cu(NH3)4]2+中与Cu2+形成配位键的原子是N,D正确。
9. B 解析:CCl4中C原子形成4个σ键,孤电子对数为0,则C原子为sp3杂化,空间结构为正四面体形,A正确;H2S分子中,S原子形成2个σ键,孤电子对数为×(6-2×1)=2,则S原子为sp3杂化,H2S的空间结构为V形,B错误;CS2中C原子形成2个σ键,孤电子对数为×(4-2×2)=0,则C原子为sp杂化,CS2空间结构为直线形,C正确;BF3中B原子形成3个σ键,孤电子对数为×(3-3×1)=0,则B原子为sp2杂化,BF3空间结构为平面三角形,D正确。
10. D 解析:氢键不是化学键,故图1分子中存在的化学键有共价键、配位键,A错误;根据第一电离能同一周期从左往右呈增大趋势,其中ⅡA与ⅢA、ⅤA与ⅥA反常,故图1中C、N、O的第一电离能N > O >C,B错误;根据图2所示晶胞图可知,晶胞中离镍原子最近的镍原子数共为12个,C错误;图2中O原子位于8个顶点和6个面心上,故一个晶胞含有的O原子数为8×+6×=4,而Ni原子位于12条棱心和体心上,故一个晶胞含有的Ni原子个数为12×+1=4,故Ni和O的个数比为1∶1,故可能表示的是氧化镍(NiO)的晶胞,D正确。
11. A 解析:短周期元素X、Y、Z原子序数依次增大,Z的一种超原子Z具有40个价电子,则Z的价电子数为=3,Z为Al元素;Y元素基态原子的核外p电子数比s电子数少1个,Y为N元素;X元素基态原子有2个未成对电子,X为C元素。N3-和Al3+的核外电子层数相同,而N的核电荷数小于Al,则离子半径:N3->Al3+,A错误;CO的中心原子的价层电子对数为=3,不含孤电子对,采取sp2杂化,空间结构为平面三角形,B正确;NO的中心原子的价层电子对数为=3,不含孤电子对,采取sp2杂化,C正确;元素的非金属性越强,电负性越大,故电负性:N>C>Al,D正确。
12. B 解析:三氧化硫分子中硫原子的价层电子对数为3,孤对电子对数为0,分子的空间结构为平面三角形,A错误;硫酸铵是含有离子键、共价键、配位键的离子化合物,B正确;原子半径小、非金属性强的氮、氧、氟的氢化物能形成分子间氢键,硫化氢分子不能形成分子间氢键,C错误;二氧化硫分子中含有1对孤电子对,三氧化硫分子中不含有孤电子对,孤电子对对成键电子对的斥力大,分子中的键角小,所以二氧化硫分子中O—S—O键角小于三氧化硫中的O—S—O键角,D错误。
13. D 解析:反应后形成的配合离子是[Ag(NH3)2]+,该离子较稳定,难电离,所以Ag+的浓度减小,A错误;[Ag(NH3)2]OH是强电解质,完全电离,B错误;氨水呈碱性,向盛有硝酸银水溶液的试管中加入氨水,先形成难溶物氢氧化银,继续滴加氨水,难溶物溶解得到无色的透明溶液[Ag(NH3)2]+,氢氧化银沉淀能转化成为[Ag(NH3)2]+,说明了[Ag(NH3)2]+比AgOH稳定,C错误;配合离子[Ag(NH3)2]+中,金属阳离子为中心原子,有空轨道,故该配合离子中Ag+提供空轨道,NH3中N原子有孤电子对,NH3作为配体,故N给出孤电子对,D正确。
14. C 解析:Cu+核外电子排布式是1s22s22p63s23p63d10,Cu+转化为基态Cu,得到的电子填充在4s轨道上,A错误;SO2是由极性键构成的非极性分子,B错误;Cu2S晶胞中S2-位置如图所示,则一个晶胞中含有S2-数目为8×+6×=4,则其中所含Cu+ 数目为8个,C正确;在该反应中Cu元素化合价由+1价变为0价,O元素化合价由0价变为-2价,化合价共降低1×2+2×2=6,S元素化合价由-2价变为+4价,化合价升高6价,标准状况下,每有22.4 L O2参与反应,反应的O2的物质的量是1 mol,转移电子是物质的量是6 mol,D错误。
15. (1) sp2
(2) (3)
16. (1) 1s22s22p63s23p63d104s1或[Ar]3d104s1
P>S>Si
(2) 平面三角形 NO (3) 6 (4) 6
17. (1) 平面正三角形 四面体形 (2) 0.4NA
(3) N>O>C>Cr (4) CClOCl c
(5) Ge的原子半径大,难以形成π键
解析:根据W的一种核素在考古时常用来鉴定一些文物年代,可知W为C元素;由X的某一种单质能吸收紫外线,可知X为O元素;M的原子序数在C和O之间,为N元素;根据Y的基态原子核外有6个原子轨道处于半充满状态,可知其外围电子排布式为3d54s1,即为Cr元素;结合Z形成氧化物的颜色,可判断Z为Cu。(1) NO的中心N原子价层电子对数为3+=3,不含孤电子对,空间结构为平面正三角形;H2O的中心O原子价层电子对数为2+=4,VSEPR模型为四面体形。(2) CO2的结构式为O===C===O,双键中含1个σ键和1个π键,则0.2 mol CO2中含0.4 mol π键,π键数目为0.4NA。(3) 根据同周期和同主族元素第一电离能的递变规律,以及ⅡA、ⅤA族元素第一电离能比同周期相邻元素大,可知第一电离能:N>O>C>Cr。(4) 根据C原子采取sp2杂化,可判断存在C—Cl键和C===O键,故COCl2的结构式为CClOCl。其中C===O键中含有1个σ键和1个π键,c正确。(5) Ge的原子半径大,原子间形成的σ键较长,pp轨道“肩并肩”程度很小或几乎不能重叠,故Ge原子间难以形成双键或三键。
18. (1) 3d84s2 (2) sp3、sp2 N>O>C
(3) 三角锥形 sp3
(4) CD (5) 正四面体形
一、 单项选择题(本题共14小题,每小题3分,共42分)
1. (2021·日照期中)下列说法正确的是( )
A. 离子化合物中只有离子键
B. 非极性分子中肯定没有极性键
C. 1个氮气分子中有1个σ键和2个π键
D. 水分子间可以形成氢键,所以水比硫化氢更稳定
2. (2020·徐州一中期末调研)下列化合物中,含有3个手性碳原子的是( )
A. B. C. D.
3. 下列各组微粒中,都互为等电子体的是( )
A. CO、NO、NaH、N2 B. SO2、NO、N、CNO-
C. CO、NO、BeCl2 D. SiF4、SiO、SO、PO
4. (2020·吕叔湘中学诊断考试) 氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2),反应为2CHCl3+O2―→2HCl+2COCl2,光气的结构式为CClOCl。下列说法正确的是( )
A. 使用前不能用硝酸银稀溶液检验氯仿是否变质
B. CHCl3分子为含极性键的非极性分子
C. COCl2分子中所有原子的最外层电子都满足8电子结构
D. COCl2分子中含有3个σ键、1个π键,中心碳原子采用sp杂化
5. (2022·江苏高三百校第四次大联考 )用氨水吸收硫酸工厂尾气中的SO2发生反应:2NH3·H2O+SO2===(NH4)2SO3+H2O。下列说法正确的是( )
A. NH3的电子式为HN··,HH B. SO2是非极性分子
C. NH的结构式为(NHHHH)+ D. H2O的空间结构为直线形
6. (2021·葫芦岛期末)下列说法正确的是( )
A. NH3分子为三角锥形,N采取sp2杂化
B. 杂化轨道只适用于形成共价键
C. SCl2属于AB2型共价化合物,中心原子S采取sp杂化轨道成键
D. 价层电子对互斥模型中,π键电子对数也要计入中心原子的价层电子对数
7. (2022·南通高三调研)反应(NH4)2SiF6+4NH3·H2O===SiO2↓+6NH4F+2H2O可制纳米SiO2。下列说法正确的是( )
A. NH3是非极性分子
B. NH4F既含离子键又含共价键
C. H2O的电子式为H+[]2-H+
D. 基态Si原子的电子排布式为[Ne]3s13p3
8. (2022·如皋高三适应性考试) 配合物[Cu(NH3)4]Cl2可用于蚀刻铜,蚀刻后的产物[Cu(NH3)4]Cl2可在氧气中再生,再生反应为4[Cu(NH3)4]Cl+4NH4Cl+O2===4[Cu(NH3)4]Cl2+2H2O+4NH3。下列说法正确的是 ( )
A. 基态Cu的电子排布式为[Ar]3d94s2
B. NH4Cl属于共价化合物
C. NH3的晶体类型为共价晶体
D. [Cu(NH3)4]2+中与Cu2+形成配位键的原子是N
9. (2020·广饶一中月考)下列分子中,中心原子的杂化轨道类型和分子空间结构不正确的是 ( )
A. CCl4中C原子为sp3杂化;正四面体形 B. H2S分子中S原子为sp2杂化;直线形
C. CS2中C原子为sp杂化;直线形 D. BF3中B原子为sp2杂化;平面三角形
10. (2021·苏大附中检测)镍能形成多种不同的化合物。图1是镍的一种配合物的结构,图2是一种镍的氧合物的晶胞(图中白球为氧)。判断下列说法正确的是( )
A. 图1分子中存在的化学键有共价键、配位键、氢键
B. 图1中C、N、O的第一电离能C>N>O
C. 图2中离镍原子最近的镍原子数共为8个
D. 图2可能表示的是氧化镍(NiO)的晶胞
11. (2021·天津武清高三一模)短周期元素X、Y、Z原子序数依次增大,X元素基态原子有2个未成对电子,Y元素基态原子的核外p电子数比s电子数少1个,Z的一种“超原子”(Z)具有40个价电子,下列说法错误的是( )
A. 简单离子半径:Y
12. (2022·南通海门区高三阶段检测 )下列有关含硫微粒说法正确的是( )
A. SO3 的空间结构为三角锥形
B. 硫酸铵中存在离子键、共价键、配位键
C. H2S 分子间能形成氢键
D. SO2中O—S—O键角大于SO3中的O—S—O键角
13. (2021·沧州高三期中)向盛有硝酸银溶液的试管中加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到无色透明溶液,下列说法正确的是( )
A. 反应前后Ag+的浓度不变
B. 沉淀溶解后,生成的[Ag(NH3)2]OH难电离
C. 上述现象说明[Ag(NH3)2]+不如AgOH稳定
D. 配合离子[Ag(NH3)2]+中,Ag+提供空轨道,NH3给出孤电子对
14. (2022·盐城中学、南通中学高三联考) 铜是生命必需的元素,也是人类最早使用的金属之一,铜及其重要化合物在生产中有着重要的应用。辉铜矿(主要成分Cu2S)可以用于制铜,反应方程式为Cu2S+O22Cu+SO2,制得的粗铜通过电解法进行精炼。关于用辉铜矿制备粗铜反应的相关说法正确的是( )
A. Cu+转化为基态Cu,得到的电子填充在3d轨道上
B. O2和SO2都是非极性分子
C. Cu2S晶胞中S2-位置如图所示,则一个晶胞中含有8个Cu+
D. 标准状况下,每有22.4 L O2参与反应,转移电子4 mol
二、 非选择题(本题共4题,共58分)
15. (14分)(2021·泰州中学质检)作为新型高能含能材料,AgN5在炸药、推进剂和发射药等领域具有较高的应用价值。
(1) N为平面结构,结构为,其中N原子的杂化方式是________________________。
(2) AgN5的晶体结构与AgI相似。AgI的结构分为αAgI和γAgI,γAgI立方晶胞的示意图见图1、图2是晶胞正上方的俯视投影图,图中黑球(实心球)表示I-,请在图2中用白球(空心球)表示出Ag+的位置。
(3) 以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图1中,原子1的坐标是,则原子2的坐标为________________。
16. (14分)(2021·海安中学质检)黄铜矿是工业冶炼铜的原料,主要成分为CuFeS2。试回答下列问题:
(1) 基态Cu原子的核外电子排布式为________________;硅、磷两种元素与硫元素同周期,则这三种元素的第一电离能从大到小顺序为______________(用元素符号表示)。
(2) SO3分子中分子的空间结构为________;与SO2互为等电子体的阴离子有________(写一种)。
(3) [Cr(H2O)4Br2]Br·2H2O中心离子配位数为________。
(4) 铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。晶胞中距离Mg原子最近Mg数目为________。
17. (15分)(2021·苏州期中)W、M、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1) MX的空间结构是____________。H2X分子的VSEPR模型名称为____________。
(2) 0.2 mol WX2中含有的π键数目为________。
(3) W、M、X、Y的第一电离能由大到小顺序为______________(请用元素符号回答)。
(4) COCl2俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为__________,其中碳氧原子之间共价键是________(填字母)。
a. 2个σ键 b. 2个π键 c. 1个σ键,1个π键
(5) Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是______________________________________________________________________。
18. (15分)(2021·云南曲靖中学月考)Ⅰ. 艾姆斯实验室已制造出包含钙、钾、铁和砷以及少量镍的CaK(Fe1-xNix)4As4新型化合物材料。回答下列问题:
(1) 基态镍原子的外围电子排布式为____________________。
(2) 在稀氨水介质中,Ni2+与丁二酮肟(分子式为C4H8N2O2)反应可生成鲜红色沉淀,其分子结构如图所示,该结构中碳原子的杂化方式为________;其中碳、氮、氧三种元素第一电离能由大到小的顺序为________________(用元素符号表示)。
(3) NCl3的立体构型为________,其中心原子的杂化轨道类型为________。
Ⅱ. 叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H—N===N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2===2H2O+HN3。HN3的酸性和醋酸相近,可微弱电离出H+和N。试回答下列问题:
(4) 下列有关说法正确的是________(填字母)。
A. 1个HN3分子中含有5个σ键
B. HN3中的三个氮原子均采用sp2杂化
C. HN3、HNO2、H2O、N2H4都是极性分子
D. 肼(N2H4)的沸点高达113.5 ℃,说明肼分子间可形成氢键
(5) 叠氮酸根能与许多金属离子形成配合物,如[Co(N3)(NH3)5]SO4,根据价层电子对互斥模型判断SO的空间结构为____________。
专题4 综合评价
1. C 解析:离子化合物中一定含有离子键,也可能含有共价键,A错误;甲烷分子中含有C—H极性键,属于非极性分子,B错误;1个氮气分子中有1个氮氮三键,其中有1个σ键和2个π键,C正确;氢键影响物质的物理性质,而稳定性是化学性质,由共价键强弱决定,与氢键无关,D错误。
2. A 解析:含有3个手性碳原子,A符合题意;含有1个手性碳原子,B不符合题意;含有2个手性碳原子,C不符合题意;含有1个手性碳原子,D不符合题意。
3. D 解析:CO的价电子数为4+6=10,NO的价电子数为5+6=11, NaH是离子化合物,不存在分子,N2的价电子数为5+5=10,A不符合题意;SO2的价电子数为6+6×2=18,NO的价电子数为5+6×2-1=16,N的价电子数为5×3+1=16,CNO-的价电子数为4+5+6+1=16,B不符合题意;CO的价电子数为4+6×3+2=24,NO的价电子数为5+6×3+1=24,BeCl2的价电子数为2+7×2=16,C不符合题意;SiF4的价电子数为4+7×4=32,SiO的价电子数为4+6×4+4=32,SO的价电子数为6+6×4+2=32,PO的价电子数为5+6×4+3=32,D符合题意。
4. C 解析:若变质混有HCl,HCl与硝酸银反应,氯仿与硝酸银不反应,则使用前可用硝酸银稀溶液检验氯仿是否变质,A错误;由结构可知,含3个C—Cl、1个C—H,结构不对称,则为含极性键的极性分子,B错误;Cl最外层有7个电子,O最外层有6个电子,C最外层有4个电子,由结构可知,含2个C—Cl、1个C===O,所有原子都满足最外层8电子稳定结构,C正确;单键为σ键,双键中含1个σ键、1个π键,共有3个σ键、一个π键,中心C原子上无孤电子对,C形成3个σ键,则C原子采用sp2杂化,D错误。
5. C 解析:氮原子要达到8电子稳定结构,NH3的电子式为HN··,H ,A错误;SO2的中心原子价层电子对数是2+(6-2×2)=2+1,空间结构是V形,正负电荷重心不重合,是极性分子,B错误;由NH的电子式[HN,H]+ 可得其结构式为 ,C正确;H2O的中心原子价层电子对是2+(6-2×1)=2+2,空间结构为V形,D错误。
6. B 解析:NH3分子为三角锥形,N采取sp3杂化,A错误;杂化轨道只适用于形成共价键,原子间需形成共用电子对,B正确;SCl2属于AB2型共价化合物,中心原子S采取sp3杂化,分子空间结构为V形,C错误;价层电子对互斥模型中,σ键数和孤电子对数计入中心原子的价层电子对数,而π键不计入,D错误。
7. B 解析:NH3的空间结构是三角锥形,是极性分子,A错误;NH4F由铵根和氟离子构成,则既含离子键又含共价键,B正确;H2O为共价化合物,则其电子式为HH,C错误;Si为14号元素,原子核外有14个电子,则Si原子的电子排布式为[Ne]3s23p2,D错误。
8. D 解析:根据洪特规则,基态Cu的电子排布式为[Ar]3d104s1,A错误;NH4Cl含有离子键,属于离子化合物,B错误;构成NH3晶体的微粒为氨分子,微粒间为分子间作用力,晶体类型为分子晶体,C错误;氨分子中N原子含有孤电子对,[Cu(NH3)4]2+中与Cu2+形成配位键的原子是N,D正确。
9. B 解析:CCl4中C原子形成4个σ键,孤电子对数为0,则C原子为sp3杂化,空间结构为正四面体形,A正确;H2S分子中,S原子形成2个σ键,孤电子对数为×(6-2×1)=2,则S原子为sp3杂化,H2S的空间结构为V形,B错误;CS2中C原子形成2个σ键,孤电子对数为×(4-2×2)=0,则C原子为sp杂化,CS2空间结构为直线形,C正确;BF3中B原子形成3个σ键,孤电子对数为×(3-3×1)=0,则B原子为sp2杂化,BF3空间结构为平面三角形,D正确。
10. D 解析:氢键不是化学键,故图1分子中存在的化学键有共价键、配位键,A错误;根据第一电离能同一周期从左往右呈增大趋势,其中ⅡA与ⅢA、ⅤA与ⅥA反常,故图1中C、N、O的第一电离能N > O >C,B错误;根据图2所示晶胞图可知,晶胞中离镍原子最近的镍原子数共为12个,C错误;图2中O原子位于8个顶点和6个面心上,故一个晶胞含有的O原子数为8×+6×=4,而Ni原子位于12条棱心和体心上,故一个晶胞含有的Ni原子个数为12×+1=4,故Ni和O的个数比为1∶1,故可能表示的是氧化镍(NiO)的晶胞,D正确。
11. A 解析:短周期元素X、Y、Z原子序数依次增大,Z的一种超原子Z具有40个价电子,则Z的价电子数为=3,Z为Al元素;Y元素基态原子的核外p电子数比s电子数少1个,Y为N元素;X元素基态原子有2个未成对电子,X为C元素。N3-和Al3+的核外电子层数相同,而N的核电荷数小于Al,则离子半径:N3->Al3+,A错误;CO的中心原子的价层电子对数为=3,不含孤电子对,采取sp2杂化,空间结构为平面三角形,B正确;NO的中心原子的价层电子对数为=3,不含孤电子对,采取sp2杂化,C正确;元素的非金属性越强,电负性越大,故电负性:N>C>Al,D正确。
12. B 解析:三氧化硫分子中硫原子的价层电子对数为3,孤对电子对数为0,分子的空间结构为平面三角形,A错误;硫酸铵是含有离子键、共价键、配位键的离子化合物,B正确;原子半径小、非金属性强的氮、氧、氟的氢化物能形成分子间氢键,硫化氢分子不能形成分子间氢键,C错误;二氧化硫分子中含有1对孤电子对,三氧化硫分子中不含有孤电子对,孤电子对对成键电子对的斥力大,分子中的键角小,所以二氧化硫分子中O—S—O键角小于三氧化硫中的O—S—O键角,D错误。
13. D 解析:反应后形成的配合离子是[Ag(NH3)2]+,该离子较稳定,难电离,所以Ag+的浓度减小,A错误;[Ag(NH3)2]OH是强电解质,完全电离,B错误;氨水呈碱性,向盛有硝酸银水溶液的试管中加入氨水,先形成难溶物氢氧化银,继续滴加氨水,难溶物溶解得到无色的透明溶液[Ag(NH3)2]+,氢氧化银沉淀能转化成为[Ag(NH3)2]+,说明了[Ag(NH3)2]+比AgOH稳定,C错误;配合离子[Ag(NH3)2]+中,金属阳离子为中心原子,有空轨道,故该配合离子中Ag+提供空轨道,NH3中N原子有孤电子对,NH3作为配体,故N给出孤电子对,D正确。
14. C 解析:Cu+核外电子排布式是1s22s22p63s23p63d10,Cu+转化为基态Cu,得到的电子填充在4s轨道上,A错误;SO2是由极性键构成的非极性分子,B错误;Cu2S晶胞中S2-位置如图所示,则一个晶胞中含有S2-数目为8×+6×=4,则其中所含Cu+ 数目为8个,C正确;在该反应中Cu元素化合价由+1价变为0价,O元素化合价由0价变为-2价,化合价共降低1×2+2×2=6,S元素化合价由-2价变为+4价,化合价升高6价,标准状况下,每有22.4 L O2参与反应,反应的O2的物质的量是1 mol,转移电子是物质的量是6 mol,D错误。
15. (1) sp2
(2) (3)
16. (1) 1s22s22p63s23p63d104s1或[Ar]3d104s1
P>S>Si
(2) 平面三角形 NO (3) 6 (4) 6
17. (1) 平面正三角形 四面体形 (2) 0.4NA
(3) N>O>C>Cr (4) CClOCl c
(5) Ge的原子半径大,难以形成π键
解析:根据W的一种核素在考古时常用来鉴定一些文物年代,可知W为C元素;由X的某一种单质能吸收紫外线,可知X为O元素;M的原子序数在C和O之间,为N元素;根据Y的基态原子核外有6个原子轨道处于半充满状态,可知其外围电子排布式为3d54s1,即为Cr元素;结合Z形成氧化物的颜色,可判断Z为Cu。(1) NO的中心N原子价层电子对数为3+=3,不含孤电子对,空间结构为平面正三角形;H2O的中心O原子价层电子对数为2+=4,VSEPR模型为四面体形。(2) CO2的结构式为O===C===O,双键中含1个σ键和1个π键,则0.2 mol CO2中含0.4 mol π键,π键数目为0.4NA。(3) 根据同周期和同主族元素第一电离能的递变规律,以及ⅡA、ⅤA族元素第一电离能比同周期相邻元素大,可知第一电离能:N>O>C>Cr。(4) 根据C原子采取sp2杂化,可判断存在C—Cl键和C===O键,故COCl2的结构式为CClOCl。其中C===O键中含有1个σ键和1个π键,c正确。(5) Ge的原子半径大,原子间形成的σ键较长,pp轨道“肩并肩”程度很小或几乎不能重叠,故Ge原子间难以形成双键或三键。
18. (1) 3d84s2 (2) sp3、sp2 N>O>C
(3) 三角锥形 sp3
(4) CD (5) 正四面体形
